Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista Colombiana de Reumatología
Print version ISSN 0121-8123
Rev.Colomb.Reumatol. vol.17 no.1 Bogotá Jan./Mar. 2010
ARTÍCULO DE REVISIÓN
Laboratory evaluation of inflammation
Luis Alonso González Naranjo1, José Fernando Molina Restrepo2
1 Médico especialista en Medicina Interna y Reumatología. Profesor asistente, sección de Reumatología, Hospital Universitario San Vicente de Paúl, Universidad de Antioquia. Medellín, Colombia.
2 Médico especialista en Medicina Interna y Reumatología. Profesor asociado de Reumatología, CES. Clínica Las Américas, Medellín, Colombia.
Recibido: Enero 8 de 2010 Aceptado: Febrero 26 de 2010
Resumen
La respuesta de fase aguda refleja la inflamación tanto aguda como crónica en curso y se presenta en una amplia variedad de condiciones inflamatorias como infecciones, trauma, cirugías, quemaduras, neoplasias, enfermedades reumáticas inflamatorias y ciertas reacciones inmunes a drogas. La velocidad de sedimentación globular (VSG) y la presencia de leucocitosis con desviación a la izquierda son marcadores diagnósticos de enfermedades inflamatorias e infecciosas. Además, la medición de los niveles séricos de las proteínas de fase aguda, particularmente la proteína C reactiva (PCR), es útil en tres situaciones patológicas: infección, inflamación aguda o crónica y en la evaluación del riesgo metabólico. Procalcitonina es un marcador útil de sepsis e infecciones graves. Los niveles elevados de ferritina son característicos de la enfermedad de Still del adulto y el síndrome hemofagocítico, ambos asociados con la inflamación. Aunque los niveles séricos de citoquinas son cruciales para la generación de la inflamación, su utilidad en la clínica está aún bajo investigación. Las concentraciones séricas de los inhibidores de citocinas o receptores solubles de citoquinas, podría aportar información importante para el seguimiento de las enfermedades autoinflamatorias.
Palabras clave: inflamación, proteínas de fase aguda, enfermedades reumáticas, citoquinas, proteína C reactiva, velocidad de sedimentación globular.
Summary
The acute phase response reflects of inflammation both acute and ongoing chronic inflammation and occurs in a wide variety of inflammatory conditions such as infections, trauma, surgery, burns, malignancies, inflammatory rheumatic and certain immune reactions drug. The erythrocyte sedimentation rate and leukocytosis with left shift are diagnostic markers for inflammatory and infectious diseases. The levels of acute-phase proteins, especially C-reactive protein, are used to assess both the presence of inflammation and any response to treatment. The measurement of C-reactive protein levels is useful in three types of pathological situation: infection, acute or chronic inflammation, and evaluation of metabolic risk. Procalcitonin is an useful marker of sepsis and severe infection. High levels of ferritin are characteristic of adult-onset Still's disease and hemophagocytic syndrome, both associated with inflammation. Although serum levels of cytokines are crucial for the generation of inflammation, their usefulness in the clinic is still under investigation. Serum concentrations of cytokine inhibitors or soluble cytokine receptors could provide important information for monitoring autoinflammatory diseases.
Key words: inflammation, acute-phase proteins, rheumatic diseases, cytokines, C-reactive protein, erythrocyte sedimentation rate.
Introducción
La evaluación de la inflamación sistémica mediante las pruebas de laboratorio mejora los resultados obtenidos en el examen clínico. Tradicionalmente, la velocidad de sedimentación globular (VSG) y la presencia de leucocitosis con desviación a la izquierda son marcadores diagnósticos de enfermedades inflamatorias e infecciosas. Además, la determinación de los niveles séricos de las proteínas de fase aguda, particularmente la proteína C reactiva (PCR), se utilizan para evaluar tanto la presencia de inflamación y la respuesta al tratamiento. En la presente revisión, nos referiremos a la respuesta de fase aguda y la utilidad de los reactantes de fase aguda en la evaluación de la inflamación en las enfermedades reumáticas.
Respuesta de fase aguda de la inflamación
La respuesta de fase aguda es un reflejo de tanto la inflamación aguda como de la inflamación crónica en curso y ocurre en una amplia variedad de condiciones inflamatorias como infecciones, trauma, cirugías, quemaduras, infartos tisulares, neoplasias, trastornos reumáticos inflamatorios y ciertas reacciones inmunes a drogas1.
Los cambios de fase aguda se dividen en cambios en las concentraciones de proteínas plasmáticas, conocidas como proteínas de fase aguda (Tabla 1) y cambios metabólicos, fisiológicos y nutricionales que se presentan dentro de horas luego del estímulo inflamatorio (Tabla 2). Las proteínas de fase aguda son aquellas cuya concentración plasmática aumenta o disminuye al menos un 25% durante la inflamación y, no obstante su nombre, también se asocian con procesos inflamatorios crónicos (Figura 1)2, 3. Las que se incrementan se conocen como proteínas de fase aguda positivas o "reactantes positivos" y son producidas por los hepatocitos bajo el estímulo de citoquinas [interleuquina (IL) 1β, IL-6, IL-18 el factor de necrosis tumoral (TNF)] secretadas por monocitos activados, macrófagos o las células endoteliales; estas citoquinas proinflamatorias son inductoras de una reacción multiorgánica que involucra el hígado, el sistema nervioso central, el sistema vascular, la médula ósea y el sistema inmune (Tabla 2).


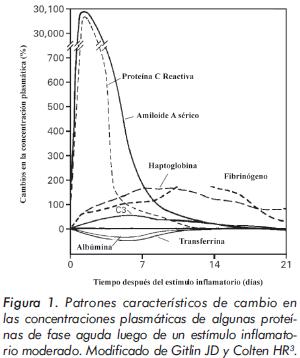
Las principales proteínas de fase aguda son: la PCR, algunos componentes del complemento sérico (especialmente C3), el fibrinógeno, el amiloide A sérico (AAS), la alfa 1 antitripsina, la ceruloplasmina y la haptoglobina. Sólo unas horas después del estímulo inicial (~4-6 h), los niveles séricos de PCR y AAS aumentan más de 1000 veces en estados inflamatorios severos e infecciones. La cinética de los cambios en las concentraciones de PCR y AAS es similar; sin embargo, los niveles de AAS sérico disminuyen más lentamente luego de la respuesta inicial (Figura 1). Las concentraciones séricas de algunos componentes del complemento, haptoglobina y fibrinógeno aumentan 2 a 5 veces con la inflamación, alcanzando un pico luego de 10 a 20 horas. Las altas concentraciones plasmáticas de fibrinógeno dan lugar a un aumento en la velocidad de sedimentación globular (VSG) 2-4. Por el contrario, las concentraciones de las proteínas de fase aguda negativas o "reactantes negativos" como la prealbúmina, albúmina, apolipoproteína-A (apoA-I), antitrombina III, proteína S y la transferrina disminuyen con la inflamación2,3,5.
Estas proteínas se clasifican en tres grupos funcionales: las que participan en las defensas del huésped, las inhibidoras de proteinasas de serina y las transportadoras con actividad antioxidante. Sus funciones son: reconocimiento y eliminación de patógenos, limitar el daño de los tejidos del huésped por enzimas proteolíticas y metabolitos de oxígeno producidos durante la inflamación aguda y reducir la reacción inflamatoria6.
Aunque los reactantes de fase aguda reflejan la presencia y el grado de inflamación, a veces hay discrepancia entre la intensidad y la magnitud de la respuesta, por diferencias en la producción de citoquinas específicas o sus moduladores, en diferentes entidades. Por ejemplo, discrepancias entre los niveles de PCR y VSG son comunes en el síndrome de Sjögren, el lupus eritematoso sistémico (LES) y especialmente en la púrpura hipergamaglobulinémica o en la macroglobulinemia de Waldeström, donde la PCR puede ser normal y la VSG muy elevada. En estas entidades, el aumento en la VSG se debe a las propiedades aglutinantes de la IgG e IgM, especialmente cuando éstas se encuentran en altas concentraciones en el plasma o hacen parte de complejos inmunes circulantes. Las razones por las cuales la PCR es baja en estas circunstancias se desconocen7.
Actualmente, las pruebas más utilizadas en la práctica clínica para la valoración de la inflamación son la PCR y la VSG.
Proteína C Reactiva
La PCR, llamada así por su capacidad de precipitar el polisacárido C del Streptococcus pneumaniae en presencia de calcio, fue la primera proteína de fase aguda descrita y es un marcador muy sensible de inflamación y daño tisular8. Es sintetizada principalmente en el hígado en respuesta a la IL-6 y esta síntesis es incrementada por la IL-1β9, 10. Aunque su función exacta se desconoce, juega un papel importante en la regulación de la intensidad y extensión de la reacción inflamatoria aguda11. La PCR se une a diferentes ligandos (fosforilcolina, fosfolípidos, fibronectina, cromatina y pequeñas ribonucleoproteínas) y tiene importantes capacidades de reconocimiento y activación. Las principales funciones de activación de la PCR son la activación de la vía clásica del complemento luego de interactuar con algunos de sus ligandos biológicos y la interacción con células del sistema inmune al unirse a los receptores Fc gamma12. La PCR se une a células apoptóticas y es importante en la depuración de restos nucleares13.
La PCR participa activamente en el desarrollo de la aterosclerosis. La PCR interactúa con las células endoteliales y estimula la producción de IL-6 y endotelina-1. La IL-6, una citoquina inflamatoria implicada en la patogénesis y curso clínico de la enfermedad vascular aterosclerótica, se une a su receptor soluble (sIL-6R) formando el complejo IL- 6/sIL-6R, el cual estimula el reclutamiento de leucocitos y promueve la respuesta inflamatoria de la célula endotelial. La endotelina-1, un potente vasoconstrictor endógeno, media una serie de respuestas como la disfunción endotelial, contracción vasomotora, activación de leucocitos y plaquetas y proliferación celular. La PCR también promueve la captación de LDL por los macrófagos y facilita la adhesión y transmigración de los leucocitos al estimular la expresión de moléculas de adhesión y la secreción de proteína-1 quimoatrayente para monocitos (MCP-1)14-16.
La PCR se encuentra en pequeñas cantidades en el plasma sanguíneo (~1 mg/L ó 0.1 mg/dl), pero se incrementa en procesos infecciosos, inflamatorios, traumáticos y neoplásicos. A pesar de su baja especificidad diagnóstica, es el marcador inflamatorio con más ventajas en la clínica, tales como su disponibilidad, reproducibilidad y fiabilidad. La PCR se utiliza en tres escenarios clínicos: infección, inflamación crónica y riesgo metabólico. La cinética de los niveles séricos de la PCR se correlaciona bien con el estímulo inflamatorio. Luego de un estímulo inflamatorio agudo, la concentración de PCR aumenta rápidamente por encima de 0.5 mg/dl en las primeras 6 horas y alcanza un pico en 48 horas, el cual refleja la extensión de la lesión15,17. Una vez el estímulo desaparece, sus niveles disminuyen rápidamente a su estado basal, con una vida media de unas 18 horas17; sin embargo, permanece elevada en procesos inflamatorios crónicos como la AR, tuberculosis pulmonar o neoplasias extensas. Por lo general, es más sensible que la VSG y a diferencia de ésta no varía con la edad, la morfología de los eritrocitos ni las variaciones de otras proteínas.
Por el método de turbidimetría, se consideran normales valores menores de 0.6 mg/dl, aunque concentraciones hasta 1 mg/dl no son inusuales, posiblemente en relación con pequeños traumas, gingivitis, diabetes, obesidad, pobre acondicionamiento físico, hipertensión arterial, bajos niveles de HDL, altos niveles de triglicéridos, entre otros; las cifras de 1 a 10 mg/dl se consideran como moderadamente elevadas y como muy altas las mayores de 10 mg/dl. (Tabla 3)18,19. A veces los resultados se informan en mg/L o mg/dl y esto hay que tenerlo en cuenta para evitar errores de interpretación. Los métodos nefelométricos son más costosos pero más sensibles. La mayoría de los pacientes (80%-85%) con niveles mayores de 15 a 20 mg/dl, tienen infección bacteriana19.
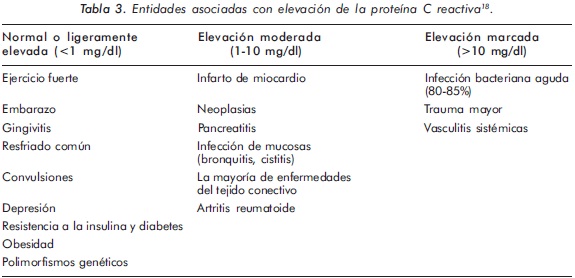
Los métodos usuales para la determinación de las concentraciones de PCR son menos precisos cuando éstas son menores de 1 mg/dl, así que el uso de métodos de alta sensibilidad, PCR ultrasensible, son de gran utilidad para distinguir los niveles basales de PCR de niveles mayores que se presentan durante la inflamación aguda, o incrementos moderados durante la inflamación crónica y en la evaluación del riesgo cardiovascular17. De los marcadores inflamatorios actuales, la PCR ultrasensible proporciona la información más concreta en la práctica clínica con respecto al riesgo cardiovascular; según sus niveles séricos, los pacientes pueden dividirse en tres categorías de riesgo cardiovascular: bajo riesgo (<1 mg/L), riesgo medio (1-3 mg/L) y alto riesgo (>3 mg/L)5, 20. En un estudio prospectivo realizado en una cohorte multiétnica de pacientes con LES, altos niveles de PCR ultrasensible (>16.5 mg/ L) se asociaron significativamente con la ocurrencia de eventos vasculares21.
En varias enfermedades reumáticas hay una buena correlación entre la actividad clínica y la elevación de la PCR (Tabla 4). También, hay un grupo de enfermedades que no obstante su actividad y severidad, presentan una modesta respuesta de fase aguda como LES, escleroderma, dermatomiositis, enfermedad mixta del tejido conectivo y colitis ulcerativa15.
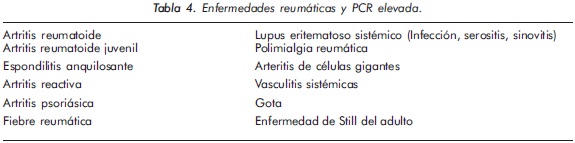
Tanto la PCR como la VSG tienen valor como indicadores de mal pronóstico en la AR, aunque los niveles de PCR se correlacionan mejor con la actividad de la enfermedad en AR. Sus niveles elevados se asocian con sinovitis precoz y erosiones que se detectan tempranamente mediante imágenes de resonancia magnética, con activación osteoclástica y baja densidad mineral ósea. Además, los niveles de reactantes de fase aguda se correlacionan con discapacidad laboral a largo plazo y similar a lo informado en la población general, con muerte por enfermedad cardiovascular. Al igual que la VSG, la PCR también predice la progresión radiográfica; sin embargo, la progresión del daño articular se puede presentar a pesar de una disminución en los valores de VSG y PCR18, 22-24.
En pacientes con LES y valores de PCR >6 mg/ dl es necesario descartar un proceso infeccioso25. Sin embargo, tales niveles no deben ser considerados como prueba de infección; niveles elevados de PCR, >6-8 mg/dl, pueden observarse en pacientes lúpicos con serositis aguda25 y sinovitis crónica26, aún en ausencia de infección. Los pacientes con espondilitis anquilosante por lo general no presentan un incremento sustancial en la PCR o la VSG. Pacientes con compromiso vertebral presentan niveles promedio de PCR de 1.6 mg/dl, mientras que pacientes con compromiso periférico o enfermedad intestinal inflamatoria asociada presentan niveles promedio de 2.5 mg/dl27. En pacientes con osteoartritis de rodilla, se han informado pequeñas elevaciones de la PCR (0.2-1 mg/ dl) especialmente quienes presentan daño articular progresivo18. Sin embargo, la utilidad clínica de esta asociación es puesta en duda por algunos autores, ya que bajas concentraciones de PCR se presentan en pacientes con obesidad, un factor de riesgo de la osteoartritis de rodilla18,28.
Velocidad de Sedimentación Globular
Por años, la VSG ha sido utilizada como el método que refleja la respuesta de fase aguda. Se define como la velocidad, expresada en milímetros, con la que los eritrocitos se precipitan en una hora en una muestra de sangre no coagulada. En la actualidad, por su bajo costo y fácil determinación, es la prueba más utilizada. Tiene una alta sensibilidad detectar inflamación sistémica a expensas de una baja especificidad. En esta prueba, la sangre anticoagulada se coloca en un tubo vertical y posteriormente se mide la velocidad de caída de los eritrocitos, usualmente en milímetros por hora.
La VSG es una medida indirecta de la concentración de proteínas de fase aguda; se modifica por variables como la viscosidad plasmática, el tamaño, forma y número de eritrocitos y las fuerzas de repulsión entre ellos, determinadas por el ácido siálico en su superficie, cuya carga negativa actúa repeliendo las otras células rojas29. El incremento de las proteínas de fase aguda, como el fibrinógeno, las α2 y γ globulinas, se traduce en un aumento de la agregación de los eritrocitos (formación de pilas de monedas o Fenómeno de Rouleaux) y en una caída más rápida de éstos18.
La VSG varía con el sexo y la edad y el método más sensible para su determinación es el de Westergren30. Los valores normales en adultos menores de 50 años son de 0 a 15 mm/hora en hombres y de 0 a 20 mm/hora en mujeres. La VSG se eleva 48 horas luego de iniciarse el proceso inflamatorio y se normaliza 10 días después de haberse terminado. También aumenta con la edad y en mayores de 50 años, el valor normal se obtiene dividiendo la edad en años por dos31.
Se considera como la prueba tamiz en diferentes entidades inflamatorias y es útil para diferenciar los procesos inflamatorios de los no inflamatorios. Las determinaciones seriadas de la VSG son de utilidad en el seguimiento de la artritis reumatoide, la arteritis temporal y la polimialgia reumática, así como infecciones u otras condiciones inflamatorias32. Además, si se determina conjuntamente con la PCR, sirve para evaluar la extensión y gravedad de la inflamación, hacer el seguimiento y determinar el pronóstico de los pacientes con artritis reumatoide. En cambio, no se le ha encontrado utilidad para el diagnóstico y seguimiento de los pacientes con LES o miopatías inflamatorias32.
La VSG se encuentra elevada en diversas enfermedades reumáticas, por lo general en relación con la actividad de la enfermedad, como por ejemplo, polimialgia reumática, artritis reumatoide, artritis reactiva, entre otras. Sin embargo, debido a la baja especificidad de la prueba, se utiliza como criterio diagnóstico sólo para la arteritis temporal y la polimialgia reumática, donde característicamente se presentan unos valores altos, considerándose como criterio valores mayores de 40 mm/hora en polimialgia reumática33, 34 y mayores o iguales a 50 mm/hora en arteritis temporal35. Contrariamente, unos valores normales no descartan el diagnóstico de AR, LES, vasculitis u otra enfermedad reumática. También, al igual que la PCR, la VSG puede elevarse en la obesidad debido a la secreción de IL-6 por los adipositos36. Los valores extremadamente altos (≥100 mm/hora) se presentan en infección, neoplasias o en enfermedad renal37.
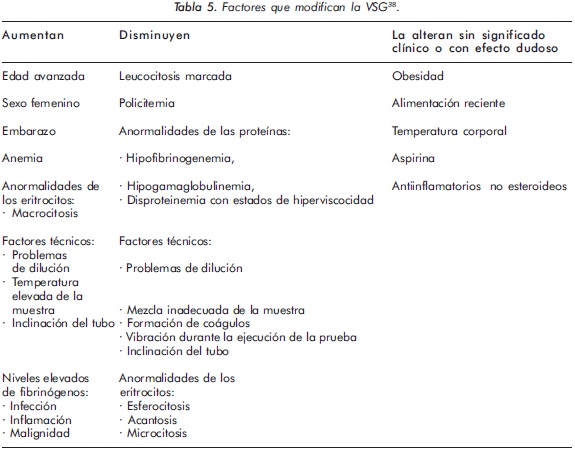
La VSG baja se debe a cambios morfológicos de los eritrocitos, como ocurre en la anemia de células falciformes, la esferocitosis hereditaria y las hemoglobinopatías; también se encuentra baja por alteraciones en las proteínas plasmáticas o en enfermedades que se caracterizan por aumento en la viscosidad plasmática como la policitemia vera18. En la tabla 5 se resumen los diversos factores que pueden modificar la VSG38.
Ferritina
Los niveles séricos de ferritina, un reactante de fase aguda moderado, se elevan entre 2 a 5 veces en estados inflamatorios. Ésta es liberada principalmente por macrófagos e histiocitos bajo el estímulo de citoquinas inflamatorias, especialmente IL-1, IL-6, IL-18 y TNF. En pacientes con enfermedad de Still del adulto activa, sus niveles son extremadamente altos, y se normalizan cuando la enfermedad entra en remisión; sin embargo, la utilidad de la ferritina como herramienta diagnóstica es limitada (sensibilidad del 80%, especificidad del 40%)39. Valores > 4000 ng/ml se presentan en menos del 50% de los pacientes con esta patología. La ferritina glicosilada es un marcador inflamatorio más específico de enfermedad de Still del adulto. Sólo un bajo porcentaje de la ferritina (≤20%) se encuentra glicosilada en pacientes con enfermedad de Still del adulto, mientras que en individuos normales el 50%-80% de la ferritina se encuentra glicosilada39,40. Cuando se combinan, un nivel de ferritina sérica mayor de 5 veces el valor normal con un nivel de ferritina glicosilada ≤20%, su especificidad en enfermedad de Still del adulto, alcanza un 93%39. A diferencia de los niveles séricos de ferritina total que se encuentran elevados durante la actividad de la enfermedad, el porcentaje de ferritina glicosilada es bajo durante la actividad de la enfermedad y durante la remisión de ésta41.
Niveles considerablemente altos de ferritina también han sido encontrados en el síndrome de activación del macrófago42, una entidad donde hasta el 40% de los pacientes cumplen con los criterios de enfermedad de Still del adulto, lo cual sugiere para algunos autores que el síndrome de activación del macrófago y la enfermedad de Still del adulto no son entidades diferentes43. Otras condiciones como la hemocromatosis, neoplasias (leucemia, linfomas), necrosis hepatocelular e historia de múltiples transfusiones, pueden tener valores séricos de ferritina considerablemente altos (>4000 ng/ml), pero por lo general tienen hallazgos típicos de laboratorio y clínicos que ayudan al diagnóstico44. En pacientes con LES, los niveles séricos de ferritina también pueden reflejar la actividad de la enfermedad en el LES45.
Pacientes con enfermedad de Still del adulto activa también presentan concentraciones extremadamente elevadas de IL-18, las cuales se correlacionan con los valores de ferritina sérica y gravedad de la enfermedad46,47.
Complemento
Los parámetros clínicos utilizados con más frecuencia para evaluar la activación del complemento son los niveles séricos de las proteínas C3 y C4, aunque sus valores son de uso limitado, ya que representan una alta producción durante la inflamación (actúan como reactantes de fase aguda positivos); sin embargo, también pueden ser consumidas por complejos inmunes. El complemento hemolítico total (CH50) es una prueba funcional utilizada para medir el consumo de toda la vía clásica7.
Bajos niveles del complemento rara vez se encuentran en la mayoría de enfermedades reumatológicas. Sin embargo, en el LES, las crioglobulinemias y la nefritis post-estreptocócica pueden encontrarse disminuidos durante la enfermedad activa debido a la formación y depósitos de complejos inmunes. La activación de la vía clásica del complemento se caracteriza por niveles bajos de C3 y C4 y niveles normales de factor B. La activación de la vía alterna del complemento se caracteriza por la presencia de bajos niveles de factor B y de C3 y concentraciones normales de C4. La activación de ambas vías lleva a bajos niveles de C3, C4 y factor B. Bajos niveles de C1q se encuentran en pacientes con vasculitis urticarial y en pacientes con nefritis lúpica que desarrollan anticuerpos anti- C1q7.
La prueba de CH50 se basa en la capacidad que tiene una muestra de suero del paciente de lisar los eritrocitos de cordero óptimamente sensibilizados con anticuerpos anti-eritrocitarios de conejo. Para obtener valores normales, es necesario que los nueve componentes de la vía clásica, de C1 a C9 estén presentes y funcionalmente intactos. El CH50 es una prueba útil para detectar deficiencias en la vía clásica, con valores cercanos a 0 unidades/ml en deficiencias homocigóticas. En circunstancias en las que el complemento es consumido por complejos inmunes, los valores rara vez son menores de 10 unidades/ml48.
Amiloide A Sérico (AAS)
El AAS es el precursor circulante de la proteína A amiloide, el componente fibrilar de los depósitos de amiloide en la amiloidosis secundaria. El AAS es una apolipoproteína de fase aguda que está estrechamente asociada con las lipoproteínas de alta densidad (HDL). El AAS promueve la exportación del colesterol de las células inflamatorias49, es un potente agente quimiotáctico para los leucocitos50, induce la secreción de IL-1851, y estimula la angiogénesis y la expresión de metaloproteinasas de matriz52.
Al igual que la PCR, los niveles de AAS aumentan a las pocas horas luego del estímulo y la magnitud de tal incremento puede ser mayor que el de la PCR. Los niveles de AAS se correlacionan con la actividad de la enfermedad en diversas condiciones inflamatorias y en infarto de miocardio53. En artritis inflamatoria temprana, los niveles de AAS se correlacionan mejor con la actividad de la enfermedad que la VSG y la PCR54. Los niveles séricos de AAS también se asocian con el desarrollo de amiloidosis (AA) secundaria. El nivel normal de AAS en adultos sanos es inferior a 1 mg/dl. Pruebas confiables para la determinación de AAS de fase aguda no están todavía disponibles, y los datos sobre los niveles en la enfermedad son limitados18.
Procalcitonina
La prohormona procalcitonina (PCT), se produce en las primeras 3 horas luego del estímulo inflamatorio. La síntesis tisular basal de PCT se restringe a órganos neuroendocrinos y a la glándula tiroides. Durante infecciones severas, la PCT puede ser producida por un período prolongado de tiempo por diversos tipos de células y sus niveles pueden elevarse más de 1000 veces55. En individuos normales, los niveles plasmáticos son muy bajos (<0.1 ng/ml), pero en pacientes con sepsis se observa un aumento significativo. Los niveles de PCT se correlacionan con la severidad de la infección y con la mortalidad. Diversos estudios han demostrado la utilidad de la PCT como un marcador diagnóstico de sepsis en unidades de cuidado intensivo, en comparación con otros marcadores de inflamación56,57. También es un marcador útil para otras condiciones inflamatorias como quemaduras severas, pancreatitis, neumonitis, injuria por inhalación, meningitis y algunas infecciones no bacterianas (por ejemplo, malaria severa y micosis sistémicas). En injurias no infecciosas, los niveles no son tan elevados como en sepsis o shock séptico (niveles mayores de 10 ng/ml, y a veces superiores a 100 ng/ml)58.
En el caso de exacerbaciones clínicas y fiebre en pacientes con enfermedades autoinmunes, los niveles normales de PCT sugieren que la causa es la actividad de la enfermedad y no la presencia de infección. La medición de los niveles de PCT puede ayudar a distinguir entre infección bacteriana, otros tipos de procesos inflamatorios y síndromes de respuesta inflamatoria sistémica59,60. En un estudio prospectivo a 2 años de 173 pacientes con fiebre y/o síndrome inflamatorio, valores >0.5 ng/ml fueron considerados como un marcador de infección bacteriana (sensibilidad del 65% y especificidad del 96%)59. Niveles de PCT falsos negativos han sido informados en infecciones bacterianas localizadas y están directamente relacionados con la carga de endotoxinas. Niveles falsos positivos de PCT han sido también informados en algunas enfermedades autoinmunes. En pacientes con vasculitis-ANCA positivo, niveles de PCT >1 ng/ml ayudan a distinguir entre infección y enfermedad activa61; en pacientes con enfermedad de Still del adulto, se han informado niveles elevados de PCT aún en ausencia de infección62.
Apolipoproteína A-1
Los niveles de apoA-1 disminuyen al menos un 25% durante la inflamación, ya que la IL-6, IL-1 y el TNF inhiben su síntesis por los hepatocitos63. La apoA-1 es el principal constituyente proteico de la HDL; las HDLs tienen propiedades anti-oxidantes, anti-inflamatorias y anti-trombóticas. La HDL inhibe la quimiotaxis de los monocitos, la adhesión de los leucocitos al endotelio, la oxidación de la LDL, la activación del complemento y de las plaquetas, pero estimula la proliferación de las células endoteliales y del músculo liso, la síntesis de prostaciclina en las células endoteliales y la activación de las proteínas C y S64. La apoA-1 asociada a la HDL también disminuye la producción de citoquinas inflamatorias65.
La respuesta de fase aguda induce cambios marcados en la composición proteica y lipídica de las HDLs. La inflamación disminuye los niveles de HDLs al aumentar la actividad de la lipasa endotelial y de la fosfolipasa A2. La concentración de colesterol HDL disminuye hasta en un 50% en pacientes con sepsis o influenza66. En inflamación crónica, la disminución de la apoA-1 contribuye a un aumento en la producción de las LDLs oxidadas, lo cual contribuye al desarrollo de aterosclerosis. En pacientes con AR, LES y síndrome antifosfolípido se ha informado bajos niveles de apoA-1 y HDL67,68.
Citoquinas
Las concentraciones plasmáticas de citoquinas y receptores de citoquinas son útiles en la clínica; sin embargo, su cuantificación presenta diversas dificultades relacionadas con su corta vida media, la presencia de factores bloqueadores y de inhibidores naturales, así como las dificultades derivadas de la técnica para su medición18.
TNF y receptores solubles del TNF
El TNF tiene un papel importante en enfermedades inflamatorias como la AR, la enfermedad intestinal inflamatoria y la psoriasis, de ahí el uso exitoso de terapia anti-TNF en estas enfermedades. En la mayoría de estudios, los niveles de TNF se encontraron ligeramente elevados mientras que los niveles del receptor soluble del TNF (TNFsR), el cual contrarresta la activación del TNF, se encontraron muy elevados en el suero y en el líquido sinovial de los pacientes con AR. Niveles altos circulantes de TNF rara vez se encuentran en diversas condiciones clínicas; sin embargo, pudieran reflejarse por los niveles del TNF-sR; debido a que el TNF-sR inhibe el TNF, la relación TNF: TNFsR sería un parámetro más confiable69,70.
El síndrome periódico asociado al receptor de TNF, es un síndrome autoinflamatorio caracterizado por fiebre en picos, artritis, manifestaciones cutáneas, marcadores inflamatorios elevados y actividad elevada del TNF. Este síndrome se debe a mutaciones en el dominio extracelular del receptor tipo I del TNF. Las concentraciones del TNF-sR usualmente se encuentran disminuidas durante las exacerbaciones71.
IL-1 y antagonistas del receptor de la IL-1 (IL-1Ra)
Existe una serie de síndromes autoinflamatorios crónicos, hereditarios [síndrome crónico, infantil, neurológico, cutáneo y articular (CINCA), fiebre mediterránea familiar, síndrome de Muckle-Wells (MWS), urticaria familiar por frío, síndrome de hiper-IgD o hiperinmunoglobulinemia D y el síndrome de artritis piógena estéril, pioderma gangrenoso y acné (PAPA)] que responden al tratamiento con IL-1Ra, el cual se une sin señalización al receptor de la IL-172. En estos síndromes, una alta secreción de IL-1β es causada por mutaciones en el gen CIAS1, también conocido como NALP3, el cual controla la activación de la caspasa-1 dentro del inflamasoma, un complejo multiproteico responsable del procesamiento y secreción de la IL-1 y la IL-1873. Las mutaciones empeoran el control estricto del procesamiento de la IL-1β, de modo que un estrés o injuria física de baja magnitud puede generar una alta secreción de IL-1β con episodios inflamatorios sistémicos. Los niveles circulantes de IL-1β, sin embargo, no reflejan fielmente el papel de la IL-1β en estos síndromes autoinflamatorios, contrario a los niveles de IL-18, los cuales son muy elevados.
La determinación de los niveles sistémicos de IL- 1β es difícil ya que sus niveles circulantes son bajos, su producción es principalmente local y su vida media es corta. Por lo tanto, la determinación de los niveles del IL-1Ra puede ser de mayor utilidad. Por ejemplo, en pacientes con LES, la elevación de los niveles de IL-1Ra se correlaciona con exacerbaciones de la enfermedad que comprometen órganos diferentes a los riñones, mientras que en compromiso renal los niveles de IL-1Ra son bajos74.
IL-6
La IL-6 tiene un marcado efecto estimulante en la síntesis hepática de reactantes de fase aguda. Su respuesta a la lesión tisular es dramática con cambios más rápidos y mayores que los de la PCR y VSG. El trauma, la inflamación aguda y crónica se asocian con aumento en los niveles de IL-6. Los niveles de esta citoquina se correlacionan con la severidad de diversas enfermedades inflamatorias como la AR, artritis juvenil, espondilitis anquilosante y polimialgia reumática75,76. En arteritis de células gigantes, la IL-6 puede ser un marcador más sensible que la VSG para detectar actividad de la enfermedad77.
Conclusión
La respuesta de fase aguda es un fenómeno fisiopatológico importante que contribuye a la capacidad de defensa o de adaptación en estados inflamatorios tanto agudos como crónicos. La velocidad de sedimentación globular (VSG) y la presencia de leucocitosis con desviación a la izquierda son marcadores diagnósticos de enfermedades inflamatorias e infecciosas. La PCR se incrementa en procesos infecciosos, inflamatorios, traumáticos y neoplásicos y actualmente es el marcador inflamatorio con más ventajas en la clínica. La PCR ultrasensible proporciona información más concreta en la práctica clínica con respecto al riesgo cardiovascular. Las proteínas del complemento C3 y C4, se comportan como reactantes de fase aguda positivos en los procesos inflamatorios; sin embargo, bajos niveles se encuentran en el LES activo, las crioglobulinemias y la nefritis post-estreptocócica, debido a la formación y depósitos de complejos inmunes. La ferritina sérica y su forma glicosilada son de utilidad en el estudio de la enfermedad de Still del adulto; niveles considerablemente altos de ferritina sérica total se encuentran durante la fase activa de la enfermedad de Still del adulto, mientras que el porcentaje de ferritina glicosilada se encuentra disminuido (≤20%) tanto en la fase activa de la enfermedad como durante la remisión. Procalcitonina es un marcador útil de sepsis e infecciones graves. Los niveles séricos de citoquinas son cruciales para la generación de la inflamación, su utilidad en la clínica está aún bajo investigación. Finalmente, las concentraciones séricas de los inhibidores de citocinas o receptores solubles de citoquinas son útiles en la clínica, particularmente para el seguimiento de las enfermedades autoinflamatorias; sin embargo, su cuantificación presenta diversas dificultades.
Referencias
1. Gabay C, Kushner I. Acute-phase proteins and other systemic responses to inflammation. N Engl J Med 1999;340:448-454. [ Links ]
2. Morley JJ, Kushner I. Serum C-reactive protein levels in disease. Ann NY Acad Sci 1982;389:406-418. [ Links ]
3. Gitlin JD, Colten HR. Molecular biology of the acute phase plasma proteins. In: Pick E, Landy M, eds. Lymphokines. Vol. 14. San Diego, Calif.: Academic Press, 1987:123-153. [ Links ]
4. Malle E, De Beer FC. Human serum amyloid A (SAA) protein: a prominent acute-phase reactant for clinical practice. Eur J Clin Invest 1996;26:427-435. [ Links ]
5. Dayer E, Dayer JM, Roux-Lombard P. Primer: the practical use of biological markers of rheumatic and systemic inflammatory diseases. Nat Clin Pract Rheumatol 2007;3:512-520. [ Links ]
6. Volamakis JE. Acute-phase proteins in rheumatic disease. En: Koopman WJ, Moreland LW, editors. Arthritis and allied conditions. 5th ed. Philadelphia: Lippincott Williams Wilkins; 2005. p. 505-516. [ Links ]
7. Wiik AS, Fritzler MJ. Laboratory tests in rheumatic disorders. En: Hochberg MC, Silman AJ, Smolen JS, Winblatt ME, Weisman MH, editors. Rheumatology. 4th ed. Philadelphia: Elsevier; 2008. p. 219-232. [ Links ]
8. Tillett WS, Francis T Jr. Serological reactions in pneumonia with a non-protein somatic fraction of pneumococcus. J Exp Med 1930;52:561-571. [ Links ]
9. Hurlimann J, Thorbecke JH, Hochwald GM. The liver as the site of C reactive protein formation. J Exp Med 1966;123:365-378. [ Links ]
10. Mackiewicz A, Speroff T, Ganapathi MK, Kushner I. Effects of cytokine combinations on acute phase protein production in two human hepatoma cell lines. J Immunol 1991;146:3032-3037. [ Links ]
11. Volamakis JE. Human C-reactive protein: expression, structure, and function. Mol Immunol 2001;38:189- 197. [ Links ]
12. Du Clos TW, Mold C. The role of C-reactive protein in the resolution of bacterial infection. Curr Opin Infect Dis 2001;14:289-293. [ Links ]
13. Marnell L, Mold C, Du Clos TW. C-reactive protein: ligands, receptors and role in inflammation. Clin Immunol 2005;117:104-111. [ Links ]
14. Gershow D, Kim S, Brot N et al. C-reactive protein binds to apoptotic cells, protects the cell from assembly to the terminal complement components, and sustains an anti-inflammatory innate immune response: implications for systemic autoimmunity. J Exp Med 2000;192:1353-1363. [ Links ]
15. Pepys MB, Hirschfield GM. C-reactive protein: a critical update. J Clin Invest 2003;111:1805-1812. [ Links ]
16. Verma S, Hong Li S, Badiwala M, Weisel R, et al. Endothelin antagonism and interleukin-6 inhibition attenuate the proatherogenic effects of C-reactive protein. Circulation 2002;105:1890-1896. [ Links ]
17. Vigushin, D.M., Pepys, M.B., and Hawkins, P.N. Metabolic and scintigraphic studies of radioiodinated human C-reactive protein in health and disease. J Clin Invest 1993;91:1351-1357. [ Links ]
18. Ballou SP, Kushner I. Laboratory evaluation of inflammation. En: Harris Jr ED, Budd RC, Firestein GS, Genovese MC, Sergent JS, Ruddy S, Sledge CB, editors. Kelley's Textbook of Rheumatology. 7th ed. Philadelphia: Elsevier; 2005. p. 720-727. [ Links ]
19. Morley JJ, Kushner I: Serum C-reactive protein levels in disease. Ann NY Acad Sci 1982;389:406-418. [ Links ]
20. Cook NR, Buring JE, Ridker PM. The effect of including C-reactive protein in cardiovascular risk prediction models for women. Ann Intern Med 2006;145:21-29. [ Links ]
21. Toloza SM, Uribe AG, McGwin G Jr et al. Systemic lupus erythematosus in a multiethnic US cohort (LUMINA). XXIII. Baseline predictors of vascular events. Arthritis Rheum 2004;50:3947-3957. [ Links ]
22. McQueen FM, Stewart N, Crabbe J, et al. Magnetic resonance imaging of the wrist in early rheumatoid arthritis reveals progression of erosions despite clinical improvement. Ann Rheum Dis 19;58:156-163. [ Links ]
23. Cohick CB, Furst DE, Quagliata S, et al. Analysis of elevated serum interleukin-6 levels in rheumatoid arthritis: correlation with erythrocyte sedimentation rate or C-reactive protein. J Lab Clin Med 1994;123:721-727. [ Links ]
24. Wolfe F, Sharp JT. Radiographic outcome of recentonset rheumatoid arthritis: a 19-year study of radiographic progression. Arthritis Rheum 1998; 41:1571-1582. [ Links ]
25. Ter Borg EJ, Horst G, Limburg PC, van Rijswijk MH, Kallenberg CG. C-reactive protein levels during disease exacerbations and infections in systemic lupus erythematosus: a prospective longitudinal study. J Rheumatol 1990;17:1642-1648. [ Links ]
26. Moutsopoulos HM, Mavridis AK, Acritidis NC, Avgerinos PC. High C-reactive protein response in lupus polyarthritis. Clin Exp Rheumatol 1983;1:53-55. [ Links ]
27. Spoorenberg A, van der Heijde D, de Klerk E, et al. Relative value of erythrocyte sedimentation rate and C-reactive protein in assessment of disease activity in ankylosing spondylitis. J Rheumatol 1999;26:980-984. [ Links ]
28. Cooper C, Snow S, McAlindon TE, et al. Risk factors for the incidence and progression of radiographic knee osteoarthritis. Arthritis Rheum 2000;43:995- 1000. [ Links ]
29. Bedell SE, Bush BT. Erythrocyte sedimentation rate. From folklore to facts. Am J Med 1985;78:1001-1009. [ Links ]
30. ICSH recommendations for measurement of erythrocyte sedimentation rate. International Council for Standardization in Haematology (Expert Panel on Blood Rheology). J Clin Pathol 1993;46:198-203. [ Links ]
31. Miller A, Green M, Robinson D. Simple rule for calculating normal erythrocyte sedimentation rate. BMJ 1983;22:286. [ Links ]
32. Molina J, Bedoya AM, Márquez J. Laboratorio en enfermedades reumáticas. En: Tratado Hispanoamericano de Reumatología, Alarcón-Segovia D, Molina J, Molina JF, Catoggio L, Cardiel MH y Angulo JM. Editorial Nomos S.A., Bogotá, Colombia. 2006;189-202. [ Links ]
33. Chuang T-Y, Hunder GG, Ilstrup DM, Kurland LT. Polymyalgia rheumatica: a 10-year epidemiologic and clinical study. Ann Intern Med 1982;97:672-680. [ Links ]
34. Healey LA. Long-term follow-up of polymyalgia rheumatica: evidence for synovitis. Semin Arthritis Rheum 1984;13:322-328. [ Links ]
35. Hunder GG, Bloch DA, Michel BA, et al. The American College of Rheumatology 1990 criteria for the classification of giant cell arteritis. Arthritis Rheum 1990;33:1122-1128. [ Links ]
36. Bastard JP, Maachi M, Van Nhieu JT, et al. Adipose tissue IL-6 content correlates with resistance to insulin activation of glucose uptake both in vivo and in vitro. J Clin Endocrinol Metab 2002;87:2084-2089. [ Links ]
37. Fincher RM, Page MI. Clinical significance of extreme elevation of the erythrocyte sedimentation rate. Arch Intern Med 1986;146:1581-1583. [ Links ]
38. Campuzano-Maya G. Uso y utilidad clínica de la eritrosedimentación. Medicina & Laboratorio 2000;9:311-345. [ Links ]
39. Fautrel B, Le Moël G, Saint-Marcoux B, et al. Diagnostic value of ferritin and glycosylated ferritin in adult onset Still's disease. J Rheumatol 2001; 28:322-329. [ Links ]
40. Fautrel B, Zing E, Golmard JL, et al. Proposal for a new set of classification criteria for adult-onset still disease. Medicine 2002;81:194-200. [ Links ]
41. Vignes S, Le Moël G, Fautrel B, Wechsler B, Godeau P, Piette JC. Percentage of glycosylated serum ferritin remains low throughout the course of adult onset Still's disease. Ann Rheum Dis 2000;59:347-350. [ Links ]
42. Emmenegger U, Reimers A, Frey U, et al. Reactive macrophage activation syndrome: a simple screening strategy and its potential in early treatment initiation. Swiss Med Wkly 2002;132:230-236. [ Links ]
43. Lee MH, Means RT. Extremely elevated serum ferritin levels in a University Hospital] associated diseases and clinical significance. Am J Med 1995;98:566-571. [ Links ]
44. Cush JJ. Adult onset Stills disease. Bull Rheum Dis 2000;49:6. [ Links ]
45. Nishiya K, Hashimoto K. Elevation of serum ferritin levels as a marker for active systemic lupus erythematosus. Clin Exp Rheumatol 1997;15:39-44. [ Links ]
46. Kawashima M, Yamamura M, Taniai M, et al. Levels of interleukin-18 and its binding inhibitors in the blood circulation of patients with adult-onset Still's disease. Arthritis Rheum 2001;44:550-560. [ Links ]
47. Kawaguchi Y, Terajima H, Harigai M, Hara M, Kamatani N. Interleukin-18 as a novel diagnostic marker and indicator of disease severity in adult-onset Still's disease. Arthritis Rheum 2001;44:1716-1717. [ Links ]
48. Atkinson JP. Complement system. En: Harris Jr ED, Budd RC, Firestein GS, Genovese MC, Sergent JS, Ruddy S, Sledge CB, editors. Kelley's Textbook of Rheumatology. 7th ed. Philadelphia: Elsevier; 2005. p. 342-355. [ Links ]
49. Tam SP, Flexman A, Hulme J, Kisilevsky R. Promoting export of macrophage cholesterol: the physiological role of a major acute-phase protein, serum amyloid A 2.1. J Lipid Res 2002;43:1410-1420. [ Links ]
50. Su SB, Gong W, Gao JL, et al. A seven-transmembrane, G protein-coupled receptor, FPRL1, mediates the chemotactic activity of serum amyloid A for human phagocytic cells. J Exp Med 1999;189:395- 402. [ Links ]
51. He R, Sang H, Ye RD. Serum amyloid A induces IL-8 secretion through a G protein-coupled receptor, FPRL1/LXA4R. Blood 2003;101:1572-1581. [ Links ]
52. Mullan RH, Bresnihan B, Golden-Mason L, et al. Acute-phase serum amyloid A stimulation of angiogenesis, leukocyte recruitment, and matrix degradation in rheumatoid arthritis through an NFkappaB- dependent signal transduction pathway. Arthritis Rheum 2006;54:105-114. [ Links ]
53. Liuzzo G, Biasucci LM, Gallimore JR, et al. The prognostic value of C-reactive protein and serum amyloid a protein in severe unstable angina. N Engl J Med 1994;331:417-424. [ Links ]
54. Cunnane G, Grehan S, Geoghegan S, et al. Serum amyloid A in the assessment of early inflammatory arthritis. J Rheumatol 2000;27:58-63. [ Links ]
55. Müller B, Christ-Crain M, Nylen ES, Snider R, Becker KL. Limits to the use of the procalcitonin level as a diagnostic marker. Clin Infect Dis 2004;39:1867- 1868. [ Links ]
56. Assicot M, Gendrel D, Carsin H, Raymond J, Guilbaud J, Bohuon C. High serum procalcitonin concentrations in patients with sepsis and infection. Lancet 1993;341:515-518. [ Links ]
57. Simon L, Gauvin F, Amre DK, Saint-Louis P, Lacroix J. Serum procalcitonin and C-reactive protein levels as markers of bacterial infection: a systematic review and meta-analysis. Clin Infect Dis 2004;39:206-217. [ Links ]
58. Ugarte H, Silva E, Mercan D, De Mendonça A, Vincent JL. Procalcitonin used as a marker of infection in the intensive care unit. Crit Care Med 1999;27:498-504. [ Links ]
59. Delèvaux I, André M, Colombier M, et al. Can procalcitonin measurement help in differentiating between bacterial infection and other kinds of inflammatory processes? Ann Rheum Dis 2003; 62:337-340. [ Links ]
60. Arkader R, Troster EJ, Lopes MR, et al. Procalcitonin does discriminate between sepsis and systemic inflammatory response syndrome. Arch Dis Child 2006;91:117-120. [ Links ]
61. Schwenger V, Sis J, Breitbart A, Andrassy K. CRP levels in autoimmune disease can be specified by measurement of procalcitonin. Infection 1998;26:274- 276. [ Links ]
62. Scirè CA, Cavagna L, Perotti C, Bruschi E, Caporali R, Montecucco C. Diagnostic value of procalcitonin measurement in febrile patients with systemic autoimmune diseases. Clin Exp Rheumatol 2006; 24:123-128. [ Links ]
63. Navarro MA, Carpintero R, Acín S, et al. Immuneregulation of the apolipoprotein A-I/C-III/A-IV gene cluster in experimental inflammation. Cytokine 2005;31:52-63. [ Links ]
64. Nofer JR, Noll C, Feuerborn R, Assmann G, Tepel M. Low density lipoproteins inhibit the Na+/H+ antiport in human platelets via activation of p38MAP kinase. Biochem Biophys Res Commun 2006;340:751-757. [ Links ]
65. Hyka N, Dayer JM, Modoux C, et al. Apolipoprotein A-I inhibits the production of interleukin-1beta and tumor necrosis factor-alpha by blocking contactmediated activation of monocytes by T lymphocytes. Blood. 2001;97:2381-2389. [ Links ]
66. Marchesi S, Lupattelli G, Lombardini R, et al. Acute inflammatory state during influenza infection and endothelial function. Atherosclerosis 2005;178:345- 350. [ Links ]
67. Lahita RG, Rivkin E, Cavanagh I, Romano P. Low levels of total cholesterol, high-density lipoprotein, and apolipoprotein A1 in association with anticardiolipin antibodies in patients with systemic lupus erythematosus. Arthritis Rheum 1993;36:1566-1574. [ Links ]
68. Park YB, Lee SK, Lee WK, et al. Lipid profiles in untreated patients with rheumatoid arthritis. J Rheumatol 1999;26:1701-1704. [ Links ]
69. Roux-Lombard P, Punzi L, Hasler F, et al. Soluble tumor necrosis factor receptors in human inflammatory synovial fluids. Arthritis Rheum 1993;36:485-489. [ Links ]
70. Gabay C, Cakir N, Moral F, et al. Circulating levels of tumor necrosis factor soluble receptors in systemic lupus erythematosus are significantly higher than in other rheumatic diseases and correlate with disease activity. J Rheumatol 1997;24:303-308. [ Links ]
71. Hull KM, Drewe E, Aksentijevich I, et al. The TNF receptor-associated periodic syndrome (TRAPS): emerging concepts of an autoinflammatory disorder. Medicine 2002;81:349-368. [ Links ]
72. Stojanov S and Kastner DL. Familial autoinflammatory diseases: genetics, pathogenesis and treatment. Curr Opin Rheumatol 2005;17:586-599. [ Links ]
73. Dinarello CA. Blocking IL-1 in systemic inflammation. J Exp Med 2005;201:1355-1359. [ Links ]
74. Sturfelt G, Roux-Lombard P, Wollheim FA, Dayer JM. Low levels of interleukin-1 receptor antagonist coincide with kidney involvement in systemic lupus erythematosus. Br J Rheumatol 1997;36:1283-1289. [ Links ]
75. Tutuncu ZN, Bilgie A, Kennedy LG, Calin A. Interleukin-6, acute phase reactants and clinical status in ankylosing spondylitis. Ann Rheum Dis 1994;53:425-426. [ Links ]
76. Uddhammar A, Sundqvist KG, Ellis B, Rantapää- Dahlqvist S. Cytokines and adhesion molecules in patients with polymyalgia rheumatica. Br J Rheumatol 1998;37:766-769. [ Links ]
77. Weyand CM, Fulbright JW, Hunder GG, Evans JM, Goronzy JJ. Treatment of giant cell arteritis: interleukin-6 as a biologic marker of disease activity. Arthritis Rheum 2000;43:1041-1048. [ Links ]














