Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista Colombiana de Reumatología
Print version ISSN 0121-8123
Rev.Colomb.Reumatol. vol.17 no.2 Bogotá Apr./June 2010
SERIE DE CASOS
Asociation between systemic lupus erythematosus and multiple sclerosis: lupoid sclerosis
Yimy F. Medina1, José B. Martínez1, Andrés R. Fernández1, Gerardo Quintana1, José Félix Restrepo2, Federico Rondón3, Antonio Iglesias Gamarra2
1 Médico Internista, Reumatólogo. Universidad Nacional.
2 Profesor titular de Medicina Interna y Reumatología. Universidad Nacional.
3 Profesor asociado de Medicina Interna y Reumatología. Universidad Nacional.
Recibido: Abril 2 de 2010 Aceptado: Mayo 28 de 2010
Resumen
La esclerosis múltiple (EM) y el lupus eritematoso sistémico (LES) con o sin síndrome antifosfolípido son enfermedades autoinmunes. Se ha descrito en varias ocasiones la asociación de estas enfermedades o se ha descrito el cuadro clínico de la EM con características de laboratorio de LES. Cuando afectan al sistema nervioso central pueden hacerlo en forma definida para cada enfermedad pero también pueden hacerlo en forma interpuesta o combinada de las dos enfermedades, a lo que se le ha llamado esclerosis lupoide, haciendo que en algunos casos sea difícil la diferenciación de las dos enfermedades y por lo tanto direccionar el tratamiento. Presentamos cuatro casos de esclerosis lupoide, discutimos acerca de las características clínicas y de laboratorio de esta entidad y hacemos una diferenciación de la esclerosis múltiple y de la afectación neurológica del LES, especialmente por imágenes y resultados de laboratorio.
Palabras clave: lupus eritematoso sistémico, esclerosis múltiple, sistema nervioso central, esclerosis lupoide.
Summary
Multiple sclerosis (MS) and Systemic Lupus Erythematosus (SLE) with/without antiphospholipid syndrome are autoinmune illnesses. It has been described in many occasions the association of these two illnesses and the clinical picture of MS with characteristics of laboratory of SLE. When they affect to the central nervous system they can make it in a defined form for each illness or they can also make it in interposed or combined form of the two illnesses what has been called lupoid sclerosis; making that in some cases difficult the differentiation of the two illnesses and therefore to address the treatment. We present four cases of lupoid sclerosis, discuss the clinical and laboratory characteristics of this entity and we make a differentiation of the multiple sclerosis with the neurological affectation of SLE especially for images and laboratory results.
Key words: systemic lupus erithematosus, sclerosis multiple, central nervous system, lupoid sclerosis.
Introducción
La esclerosis lupoide es un síndrome raro descrito como la asociación de síntomas similares a la esclerosis sistémica con hallazgos de laboratorio y criterios sugestivos de lupus eritematoso sistémico (LES) que incluyen anticuerpos antinucleares, falsos positivos para sífilis y niveles elevados de IgM policlonal en suero. También se ha denominado como un cuadro de lupus eritematoso sistémico que se asemeja a la esclerosis múltiple (EM). Se ha descrito como paraplejía espástica o como manifestación clínica, dependiendo del sitio de afectación cerebral de la sustancia blanca. Desde que se describió el término de esclerosis lupoide ha cautivado la literatura, pero se ha hecho con cuadros poco definidos y en cierta forma ha desafiado las habilidades diagnósticas de muchos clínicos, ya que impide la diferenciación entre EM y neurolupus y por consiguiente no permite realizar un tratamiento adecuadamente dirigido. La asociación de síntomas de la EM y hallazgos de laboratorio sugestivos de LES fue denominada como esclerosis lupoide por Fulford1 en el hospital de Middlesex con Michael Kremer como autor principal según lo referido por Harris, Hughes y col.2 y otros3. Pero fue Osler en una discusión del diagnóstico de la esclerosis múltiple quien escribió acerca de la esclerosis lupoide: "Parálisis agitans, neurosifilis, compresión de la médula espinal, ciertos casos de paresia general e histeria, pueden simular la enfermedad muy estrechamente"4. Esto demuestra que en algunos pacientes no es posible diferenciar de una manera definitiva estas dos patologías y que comparten características de la EM y del LES con afectación neurológica, particularmente cuando se asocia a anticuerpos antifosfolípidos. Se ha informado acerca de casos de esclerosis lupoide incluso en generaciones sucesivas de familias5 y también en gemelos6. La esclerosis lupoide fue descrita inicialmente como mielopatía asociada a anticuerpos antinucleares (ANAS), como en la descripción de Fullford y Osler, pero posteriormente también se describió la afectación cerebral, especialmente de sustancia blanca.
Presentamos a consideración cuatro casos que representan la esclerosis lupoide, hacemos una revisión de la literatura acerca de esta entidad y tratamos de realizar un diagnóstico diferencial.
Presentación de casos
Caso No. 1
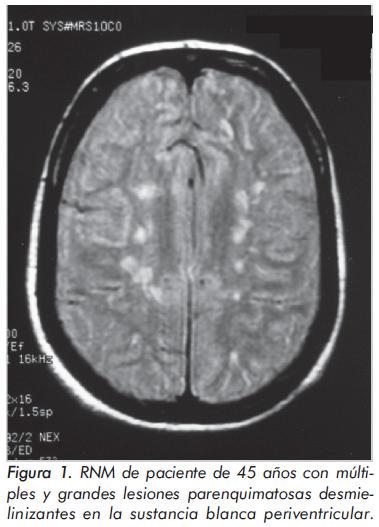
Mujer, de 44 años, quien presentó cuadro de neuritis óptica a los 18 años y de artralgias por algunos años. Diez años después presentó glomerulonefritis y manifestaciones trombóticas dadas por trombosis de la arteria femoral. Artropatía de Jaccoud evidenciada desde hace 7 años. Actualmente presenta secuelas de su compromiso neurológico y en los últimos años marcadas xeroftalmia y xerostomía, considerándose Síndrome de Sjögren secundario. Resonancia Nuclear (RM) cerebral en 1992 con imágenes de múltiples lesiones parenquimatosas desmielinizantes en la sustancia blanca periventricular. RM de control en 1998 con lesiones anotadas (Figura 1). Anticuerpos IgM anticardiolipinas positivas, anticuerpos de IgG altos (79.38) y anticoagulante lúpico positivo. TAC de cráneo de 1999 con atrofia cortical, supra e infratentorial y atrofia del cuerpo calloso. ANAS positivos (1:5120 patrón moteado) y Anti-DNA positivo (1:381). Radiografía del fémur con infartos óseos. Doppler de miembros inferiores con insuficiencia arterial en miembro inferior izquierdo.
Caso No. 2
Mujer de 39 años de edad con cuadro de visión borrosa, pérdida de visión 20/700 con diagnóstico de neuritis óptica y papilitis ojo izquierdo, quien fue tratada con metilprednisolona IV y posteriormente continuando con esteroides orales. Además, fotosensibilidad, caída del cabello, fenómeno de Raynaud monofásico y parestesias en manos y pies. Laboratorios informan ANAS positivos (1:320 patrón moteado), Anti-DNA negativo, C3 y C4 normales, c-ANCAS y p-ANCAS negativos, Anticardiolipinas (aCL) IgG negativo e IgM positivo alto; potenciales evocados visuales muestran prolongación moderada de la latencia P-100 izquierdo, estudio anormal en relación a compromiso desmielinizante prequiasmatico izquierdo, RM cerebral informada como normal. Actualmente con recuperación completa de la visión, con poliartralgias de manos, rodillas y tobillos, sin compromiso neurológico clínicamente evidente al examen físico, en tratamiento con Ácido acetilsalicílico (Asa) 200 mg/ día y Cloroquina 250 mg/día.
Caso No. 3
Mujer de 18 años de edad, nulípara, consultó por cuadro que inició con parestesias y posterior hipoestesia en las 4 extremidades asociado a episodio convulsivo tónico-clónico generalizado que persistió por 1 semana además de movimientos tónico-clónicos en miembro superior derecho con posterior hemiparesia ipsilateral, siendo necesario manejo intrahospitalario por neurología. Fue valorada por el servicio de reumatología en consulta externa por sospecha clínica de vasculítis de SNC. A la revisión por sistemas refería poliartralgias en muñecas, metacarpofalángicas y rodillas de forma simétrica, además de fenómeno de Raynaud y caída de cabello. La paciente tiene antecedente de amaurosis derecha hacía 2 años de 1 mes de duración que resolvió espontáneamente, con un nuevo episodio 6 meses antes de la consulta asociada a mareo y de parestesias generalizadas. Se le documentó tuberculosis ganglionar que fue tratada hace 6 años, hepatitis hace 7 años de etiología no aclarada y artritis séptica de cadera izquierda a los 9 años. Antecedente familiar de madre diabética. Venía recibiendo prednisona 20 mg/día, Asa 100 mg/día. El examen físico inicial fue normal. Se observó en los paraclínicos: ANAS positivos (1:160 patrón moteado), C3 y C4 normales, anticuerpos antifosfolípidos no estandarizados negativos, aCL negativos, B2GP1 negativa y TSH normal. Se hace diagnóstico inicial de Enfermedad de Tejido Conectivo no Diferenciada vs. Enfermedad Mixta del tejido conectivo. En consulta de control a los 3 meses refirió cefalea hemicraneana derecha pulsátil de intensidad y duración variable sin otros síntomas asociados y con paraclínicos solicitados: c-ANCAS y p-Ancas (-), Anti Ro, Anti La, Anti Sm (-), Anti RNP (+) bajo 30.3 (ELISA), ANAS positivos (1:320 patrón homogéneo), Anti DNA negativo, potenciales evocados visuales: anormales, por compromiso desmielinizante prequiasmático bilateral, evidencia de pérdida asociada de fibras de grado moderado, Sialogamagrafía: compromiso funcional moderado, RNM cerebral simple: lesiones hipointensas en T1 e hiperintensas en T2 de predominio subcortical paraventricular pequeñas sin progresión radiológica (Figuras 2, y 3). Con estos hallazgos se plantea la posibilidad diagnóstica de Síndrome de Sjögren con compromiso de SNC y se disminuye dosis de prednisona a 10 mg/día. Valorada por oftalmología que descarta ojo seco por prueba de Schirmer normal; sin embargo evidencia secuelas de neuritis óptica ojo derecho. Control de complemento, anticardiolipinas IgG, IgM y factor reumatoide normales. Al examen físico se evidencia hipoestesia derecha sin otros cambios, haciéndose impresión diagnóstica de Lupus-like vs. Esclerosis lupoide. Se inicia cloroquina 250 mg/día, continuando con prednisona 5 mg/día, Asa 100 mg/ día, suplemento de calcio y vitamina D. Se examina a los 3 meses refiriendo mejoría clínica, con paraclínicos de control: ANAS positivo (1:160 patrón homogéneo), antiSm negativo, PCR negativo. Cuadro hemático y Eritrosedimentación normal, depuración de creatinina: 100.5 mil/min., RNM cerebral sin cambios con respecto a la anterior.
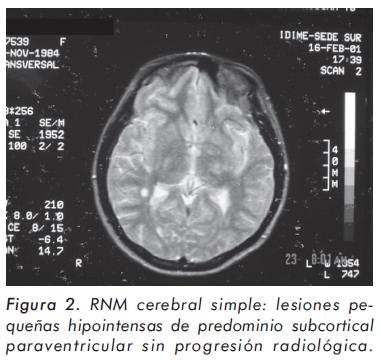
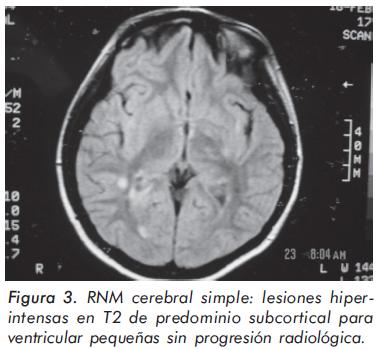
Se solicita valoración por servicio de neurología, quienes consideran cuadro compatible con EM de forma remitente-recaída; sin embargo, no se descarta LES por status focal continuo y pocas lesiones de sustancia blanca cerebral y se le inicia Carbamazepina 800 mg/día. La paciente continuó con manejo instaurado, evolución clínica favorable sin nuevos episodios convulsivos, mejoría de cefalea y de alteraciones sensitivas.
Caso No. 4
Mujer de 42 años, desde hace 2 años con cefalea global intensa pulsátil sin horario definido y duración variable asociada a episodios recurrentes de parestesias y sensación de disminución de la fuerza en miembros superiores que cedía espontáneamente o con ingesta de analgésicos comunes presentando un año después enfermedad cerebrovascular, isquemia fronto-parietal derecha y evento coronario agudo, anemia hemolítica y hallazgo ecocardiográfico de valvulopatía aórtica consistente con doble lesión aórtica, considerándose cuadro clínico sugestivo de LES y síndrome antifosfolípido secundario (SAFS), por lo cual recibió ciclos endovenosos de metilprednisolona 1 gramo/día por 3 días y continuando tratamiento con prednisona vía oral 30 mg/día, warfarina 2.5-5 mg interdiario luego de lo cual consulta a nuestro servicio. Antecedentes de 6 abortos continuos. En revisión por sistemas: fotosensibilidad, artralgias sin artritis en codos, radiocubitocarpianas y metacarpofalángicas, disnea clase funcional II, trastorno en la marcha, disartria, bradilalia, labilidad emocional con llanto fácil y sensación de ansiedad, síntomas presentes desde hace 1 año posterior a hospitalización. Al examen físico, orientada con marcha atáxica, disártrica, con signos vitales adecuados, soplo pansistólico grado IV/VI en foco aórtico auscultable en todo el precordio, livedo reticular en miembros inferiores, marcha atáxica, hemiparesia izquierda con fuerza 3/5 miembro superior y 4/5 miembro inferior, reflejos osteotendinosos +++/++++ izquierdos y respuesta plantar con babinski. Paraclínicos: Anticuerpos antinucleares (ANAS): 1/640 patrón moteado, hipocomplementemia C3: 0.8 – C4: 0.08, Lactato deshidrogenada (LDH) elevada 204 U/L, Coombs directo (+), ecocardiograma: doble lesión aórtica con estenosis severa función sistólica de ventrículo izquierdo 65%, cavidades izquierdas dilatadas. Cateterismo cardíaco: coronarias epicárdicas sanas, doble lesión aórtica con estenosis severa y función sistólica de ventrículo izquierdo 35%. Resonancia magnética cerebral simple: Cambios de pérdida de volumen con lesiones corticales y subcorticales en hemisferio frontal derecho y biparietal.
Se hace diagnóstico de LES con compromiso de sistema nervioso central, síndrome antifosfolípido secundario y valvulopatía aórtica secundaria con cardiopatía dilatada; además, secuelas neurológicas por enfermedad cerebrovascular, anemia hemolítica autoinmune. Se continúa manejo con prednisona vía oral 15 mg/día, cloroquina 250 mg/día, azatioprina 50 mg/día, warfarina 2.5-5 mg interdiario, suplemento de calcio, calcitriol y ácido fólico.
Discusión
La esclerosis múltiple es una enfermedad autoinmune e infrecuente que se ha observado en asociación a otras enfermedades autoinmunes y reumáticas como lupus eritematoso sistémico, artritis reumatoide, tiroiditis de Hashimoto, síndrome de Sjögren, espondilitis anquilosante y esclerosis sistémica7 . Se considera que la EM es una enfermedad autoinmune con blanco en la mielina y desde el punto de vista etiopatogénico se han descrito cuatro patrones: los del tipo I y II, similares a una respuesta mediada por linfocitos T en que los anticuerpos desmielinizantes y el complemento jugarían un importante papel patogénico; y los patrones III y IV, en que se parecerían a una oligodendropatía con una subsiguiente desmielinización. En estos patrones también se han observado diferentes cursos clínicos, siendo el patrón tipo II de características recaída-remisión y el tipo IV de forma primaria progresiva8 . Se han definido diferentes cursos clínicos de esclerosis múltiple que incluyen la remitente-recaída (RR), progresiva secundaria (PS), primaria progresiva (PP) y progresiva remitente (PR)9. La esclerosis múltiple remitente con recaída se caracteriza porque los ataques de disfunción neurológica son seguidos de un grado variable de recuperación y es la clase de EM que se confunde con el neurolupus. Por el contrario, la forma PP se caracteriza por un deterioro continuo de la función neurológica desde el inicio de la enfermedad sin ataques sobrepuestos. Todos los criterios diagnósticos para la esclerosis múltiple tipo RR, incluyendo la de Schumacher10 y cols., los de Poser y cols.11 y el consenso del 2001 publicado por McDonald12 requieren de dos o más eventos separados por más de un mes además de afectación de al menos dos áreas distintas del sistema nervioso central (los llamados criterios de diseminación en tiempo y espacio).El daño neurológico en el lupus sería multifactorial, pero los anticuerpos antifosfolípidos parece que juegan un papel importante13,14. Sin embargo, también se han encontrado anticuerpos antineuronales en líquido cefalorraquídeo (LCR) y en suero de pacientes con neurolupus15,16. También se han descrito en el LES daño celular reversible en la glia y desmielinización17,18. Los mecanismos por los cuales los anticuerpos antifosfolípidos (aPL) podrían inducir una enfermedad similar a la EM incluyen: "el mimetismo molecular" con la mielina u otro componente, eventos trombóticos microvasculares con vasculopatía y "vasculitis" autoinmune similar al LES19 . Además, se ha demostrado la reacción cruzada de los aPL con la mielina, las proteínas relacionadas a la mielina y los antifosfolípidos cerebrales como la cefalina y la esfingomielina20-22.
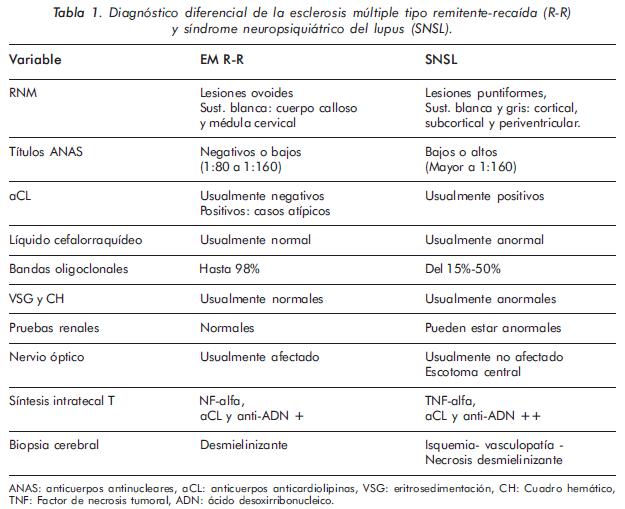
Hay que resaltar que todos los esquemas existentes requieren de la exclusión de otros diagnósticos mediante estudios radiológicos y de laboratorio adecuados antes de la aplicación del algoritmo diagnóstico para la EM23. Como resultado, la sensibilidad, especificidad y exactitud diagnóstica de cada esquema debe ser considerado en el contexto de una población de pacientes en los cuales los diagnósticos alternativos han sido extensamente descartados24. Además, está establecido que las anormalidades en la RNM en cuanto se refieren a la sustancia blanca no son específicas y hay múltiples variables que la pueden afectar, como: edad, infecciones, enfermedades cerebrovasculares, leucodistrofias, neoplasias, déficit de vitamina B12 y enfermedades de tejido conectivo25. De las enfermedades de tejido conectivo que más frecuentemente se asocian a esclerosis múltiple es el LES26. La incidencia de síntomas neurológicos en el LES es del 14% al 75%27,28. Esta variación en la incidencia demuestra de algún modo la amplia gama de manifestaciones neurológicas en el lupus, la heterogeneidad conceptual y la carencia de definiciones estandarizadas del compromiso neurológico. Esto hace especialmente difícil diferenciar la EM del neurolupus y por tanto definir en forma precisa la esclerosis lupoide (Tabla 1).
La Asociación Americana de Reumatología, ante la diversa variedad de términos de afectación del sistema nervioso central y los términos confusos que en ocasiones se utilizaban, como en el caso de la "vasculitis" cerebral, decidió reunir a un panel de expertos, publicar en 1999 una nomenclatura y definir los casos para el síndrome de lupus neuropsiquiátrico (SLNS) (Tabla 2).

No hay anormalidades en la RNM que sean patognomónicas para el SLNS; las más comunes son lesiones focales puntiformes pequeñas en la sustancia blanca, seguidas por la atrofia cortical, cambios de la sustancia blanca periventricular, dilatación ventricular, cambios difusos de la sustancia blanca y los infartos32; mientras que se considera que las lesiones ovoides alrededor del eje longitudinal de las venas medulares y las placas hiperintensas en el cuerpo calloso y en la región cervical de la médula espinal son altamente sugestivas de de la EM33. Además, la RNM puede ser normal en los pacientes con neurolupus que se presentan con cefalea, psicosis, depresión o convulsiones. Esto último se ha atribuido a la falta de especificidad tisular cerebral de estas alteraciones34 y se han encontrado las mismas anormalidades en la resonancia nuclear magnética de los pacientes de LES que tienen síntomas neurológicos y de los que no tienen síntomas neurológicos35. Es igualmente verdadero que la RNM puede ser equívoca en los pacientes de esclerosis múltiple, que sean diagnosticados casos de neurolupus y que al realizarles biopsia de tejido cerebral o se sigan en el tiempo a algunos pacientes se termine estableciendo que es esclerosis múltiple36 . Una característica que se ha descrito en pacientes de LES y es evidencia clínica de afectación neurológica, es que se puede evidenciar la afectación de la médula espinal menos frecuentemente y que cuando existen, ya sea con manifestaciones clínicas o en RNM, estas lesiones medulares son más grandes o extensas y se extienden a varios segmentos, por lo que se ha denominado la mielitis longitudinal37. Se aconseja que en los casos en que el diagnóstico no sea claro se realice la RM periódicamente (idealmente cada 3 meses) o cuando aparezcan nuevos síntomas38,39.La ausencia de lesiones multifocales en la RM tiene un buen valor predictivo negativo para desarrollar EM40. Para algunos autores se pueden diferenciar las lesiones del LES asociadas al SAF que son estáticas en relación a las lesiones de la EM que son dinámicas cuando se realizan sucesivas imágenes de RM41. Combinación del uso de la RNM con otras modalidades de imagen ha mostrado ser una herramienta útil en aumentar la especificidad en el neurolupus; por ejemplo, el uso combinado de RNM y el SPECT ha sido útil para predecir las manifestaciones del neurolupus luego de iniciar terapia con corticoides42.
Para la mayoría de autores no hay duda de que la EM es una enfermedad autoinmune y que se ha relacionado con varias enfermedades y pruebas autoinmunes. La relación con la tiroiditis autoinmune es un ejemplo, ya que está aumentada la prevalencia entre los familiares de primer grado. Probablemente por el mismo mecanismo patogénico se encuentran anticuerpos anti-músculo liso y anti-antígenos nucleares en mayor frecuencia entre los pacientes con EM que en los controles. En un estudio grande, DeKeyser encontró que los pacientes con EM tenían dos veces la probabilidad de tener estos autoanticuerpos en suero que los controles43,44.
En cuanto a los anticuerpos antinucleares (ANAS), están generalmente asociados a enfermedades autoinmunes, pero se encuentran en personas normales en títulos bajos (1:40) en 5% al 35%45. Asímismo, se ha observado una frecuencia alta de títulos positivos en pacientes con EM definitiva y típica sin evidencia de LES (a títulos de 1:80 a 1:320 en la mayoría de casos con patrones homogéneo y moteado) pero no en un rango alto, que es más típico del LES46. Aunque no se conoce que los ANAS tengan un significado patogénico en la EM, su concurrencia puede reflejar una disregulación del sistema inmune. La expresión de estos autoanticuerpos puede también reflejar un "sustrato autoinmune" o ser la forma frustra de una enfermedad autoinmune amplia asociada.
Los anticuerpos antifosfolípido son comunes en la población general a títulos bajos (6%- 45%)47 y a diferencia de la mayoría de los otros anticuerpos no se ha demostrado una prevalencia aumentada de los anticuerpos anticardiolipina en poblaciones no seleccionadas de pacientes con EM48,49. Sin embargo, se han asociado a esclerosis múltiple sin evidencia de LES, siendo el principal isotipo el aCL IgM50. En el trabajo de Fullford y Kremer se describieron seis casos, que al ser analizados con los criterios diagnósticos del presente, al no tener alteración óptica, ni imágenes por imagen cerebrales, potenciales evocados, ni tampoco análisis de bandas oligoclonales, hace suponer que muy probablemente padecieron del Síndrome antifosfolípido. Es de especial mención el estudio de Karussis y cols.51 en el que se observaron títulos de anticuerpos anticardiolipina en 70 pacientes con esclerosis múltiple "clásica" y en 100 pacientes con esclerosis sistémica inusual pero que presentaban características "atípicas". 20 de los pacientes con aCL positivos en forma constante correspondieron al grupo con rasgos atípicos para EM y se distribuyeron así: 15/20 mielopatía, 15/20 neuropatía óptica y 2/20 bandas oligoclonales positivas. El problema surge cuando coexisten la mielitis transversa con la neuritis óptica, ya que hay un número significativo de pacientes que han sido diagnosticados de EM y que con el seguimiento se ha establecido que tienen SAF, razón por la cual los autores aconsejan realizar aPL en aquellos pacientes que tengan por lo menos un cuadro atípico de EM52. Resultados persistentemente negativos hacen del SAF un diagnóstico improbable y resultados persistentemente positivos podrían sugerir un abordaje terapéutico diferente53. La mielitis transversa se ha informado cada vez más en asociación con el SAF con o sin LES y se ha observado una mejoría después de anticoagulación oral54-56. Los pacientes con LES y mielitis transversa tienen una prevalencia más alta de aPL que los pacientes con LES sin mielitis transversa57. La neuritis óptica asociada a SAF es usualmente unilateral contrario a la EM y el LES, en que puede ser bilateral58. Los síntomas sugestivos del sistema nervioso periférico sugieren LES, ya que la EM sólo afecta el SNC59. Otras manifestaciones clínicas que sugieren el SAF son: trombosis, abortos, livedo reticularis y trombocitopenia o de enfermedades del tejido conectivo como fotosensibilidad, rash, artralgias o síntomas sicca60.
El análisis del líquido cefalorraquídeo para elementos celulares y estudio citoquímico es menos probable que sea anormal en la afectación neurológica del LES o del síndrome antifosfolípido comparados con la esclerosis múltiple regular61; sin embargo, esto no es absolutamente suficiente para que sea clínicamente útil62. La pleocitosis linfocítica leve, un índice alto de IgG y las bandas oligoclonales no presentes en el suero (producción intratecal) son comunes en la EM y en el LNS y no se encuentran usualmente en el SAFP63. La eritrosedimentación tiende a ser más elevada en el LES al igual que las alteraciones del cuadro hemático, esto es leucopenia y trombocitopenia junto con alteración de las pruebas renales. Las bandas oligoclonales pueden estar elevadas en ambas enfermedades, pero se encuentra con más frecuencia en la EM.La activación de la red de citoquinas ha sido demostrada en las dos entidades. Varios tipos de alteración del SNC en el LES se han caracterizado mediante la elevación de factor de necrosis tumoral α (TNF-Alfa) en líquido cefalorraquídeo (LCR), elevación de las concentraciones TNF- alfa en sangre, concentraciones elevadas de IL-6 e IL-10 en suero y LCR y síntesis intratecal de IL-6 (la síntesis intratecal de citoquinas se calcula usando la fórmula: Albúmina sérica/albúmina LCRxCitoquinas LCR/ Citoquinas séricas. Link and Tibling 1977). Los pacientes con EM múltiple se caracterizan por concentraciones elevadas de TNF-alfa y IL-6 en LCR y de concentraciones elevadas de síntesis intratecal de TNF-alfa; por tanto, la principal diferencia entre los pacientes de neurolupus y de EM remitente-recurrente parece ser la presencia de la síntesis intratecal de TNF-alfa64.
Asímismo, se han caracterizado algunos cambios inmunosericos en el LCR y en suero de pacientes de EM y LES. Se ha demostrado la elevación de síntesis intratecal de anticuerpos antifosfolípidos en las dos enfermedades. Se ha informado la elevación de aCL y anticuerpos β2glicoproteína en LCR de EM y LES. Similaridad en la producción intratecal de AntisdADN y aCL (IgG) y en anticuerpos antiproteína P ribosomal, aunque los cambios fueron más pronunciados en LES65.
En cuanto al diagnóstico del neurolupus y su distinción con la EM por medio del diagnóstico tisular, muchos clínicos preferirían realizarlo antes de entrar a realizar un tratamiento en base a inmunosupresores, pero la biopsia cerebral raramente es de ayuda además de que es invasiva, siendo aconsejable realizarla cuando hay anormalidades radiológicas para hacerles seguimiento66. La mayoría de los síndromes neurológicos en el LES son causados por isquemia cerebral debido a vasculopatía proliferativa no inflamatoria de pequeños vasos caracterizada por hialinización67. También se han descrito multiinfartos multifocales, atrofia cortical, hemorragias y para efectos de nuestra discusión, se han encontrado desmielinización isquémica y parches múltiples de desmielinización similar a esclerosis68. La vasculitis de los vasos cerebrales se ha documentado en sólo 7% a 15% en autopsias de pacientes de SLNS69.
Cuando hay afectación del nervio óptico, como neuritis óptica, se dice que en el LES hay más frecuentemente persistencia de un escotoma central o una ceguera completa después de un ataque agudo, pero frecuentemente esto es indistinguible al inicio de la enfermedad70.
El tratamiento clásico de la EM es con interferón-β, que reduce las recaídas hasta en un 30% aunque no se ha demostrado que retarde la progresión de la enfermedad además de ser costosa y que puede exacerbar o inducir la actividad lúpica71.
Conclusión
La esclerosis múltiple, el lupus eritematoso sistémico neuropsiquiátrico con o sin síndrome antifosfolípido son enfermedades autoinmunes que tienen sus características clínicas e inmuno patológicas propias, pero que en algunos casos sus manifestaciones neurológicas se sobreponen, lo que se describió hace varias décadas como esclerosis lupoide (asociación de las dos enfermedades o características clínicas de EM con laboratorios de LES). Existen características imagenológicas y de laboratorio que hacen posible su diferenciación. Proponemos los parámetros para esa diferenciación en base a la literatura disponible. La respuesta sorprendente a los anticoagulantes de algunos pacientes con "EM" que tienen aPL positivos es probablemente un argumento fuerte para distinguir estas dos entidades, además de que en la práctica diaria se observa que se confunden las dos entidades con alguna frecuencia siendo la mielitis transversa y las lesiones multifocales de sustancia blanca los factores de confusión más frecuentes.
Referencias
1. Fulford K W M. A collagen disorder of nervous system presenting as multiple sclerosis. Brain 1972; 95:373- 386. [ Links ]
2. Harris EN, Gharavi AE, Mackworth-Young CG, Patel BM, Derue G, Hughes GRV. Lupoid sclerosis: a possible pathogenic role for antiphospholipid antibodies. Ann Rheum Dis 1985;44:281-283. [ Links ]
3. Coles A. Looks like multiple sclerosis, but the ANA is positive: Does my patient have Lupus? Practical neurology. August 2004;212-221. [ Links ]
4. Osler W, McCrae T. Principles and practices of Medicine.Ed 10, New York, D Appleton & Co., 1925, pp. 988-990. [ Links ]
5. Hietaharju A., Pelttola J, Seppa J, Luukkainen R, Dastidar P. The coexistence of systemic lupus erhytematosus and multiple sclerosis in a mother and daughter. Scand J Rheumatol 2001; 30: 120-122. [ Links ]
6. Holmes FF, Stubbs DW, Larsen WE. Systemic lupus erythematosus and multiple sclerosis in identical twins. Arch Intern Med 1967;119(3):302-304. [ Links ]
7. Trostle DC, Helfrich D, Medsger TA Jr. Systemic sclerosis (scleroderma) and multiple sclerosis. Arthritis and Rheum 1986;29(1). [ Links ]
8. Lucchinetti C, Bruck W, Parisi J, Schethauer B, Rodríguez M, Lasssman H. Heterogeneity of multiple sclerosis lesions: Implications for the pathogenesis of demyelination. Ann Neurol 2000;47:707-717. [ Links ]
9. Lubbin FD, Reingold SC. Defining the clinical course of multiple sclerosis: results of an international survey. Neurology 1996;46:907-911. [ Links ]
10. Schumacher FA, Beeve GW, Kibler RF, et al. Problems of experimental trials of therapy in multiple sclerosis. Ann NY Acad Sci 1965;122:552-568. [ Links ]
11. Poser CM, Paty DW, Scheinberg L, et al. New diagnostic criteria for multiple sclerosis. Guidelines for research protocols. Ann Neurol 1983;13:227-231. [ Links ]
12. McDonald WI, Compson A. Edan G, et al. Recommended diagnostic criteria for multiple sclerosis. Guidelines from the international panel on the diagnosis of multiple sclerosis. Ann Neurol 2001;50:121-127. [ Links ]
13. Jennekens F, Kater L. The central nervous system in systemic lupus eryhematosus. Part. Pathogenic mechanism of clinical syndromes: alterature investigation. Rheumatology 2002;41:619-630. [ Links ]
14. Alarcon-Segovia D, Delize M, Oria CV, et al. Antiphospholipid antibodies and antiphospholipid síndrome in systemic lupus erythematosus. A prospective analusis of 5000 consecutive patients. Medicine 1989;68:353-365. [ Links ]
15. Scolding NJ, Joseph FG. The neuropathology and pathogenesis of systemic lupus erythematosus. Neuropath Appl Neurobiol 2002;28:173-179. [ Links ]
16. Scolding NJ, Housten WA, Morgan BP, et al. Reversible injury of cultured rat oligodendrocytes by complement. Immunology 1989;67:441-446. [ Links ]
17. Tourbah A, Clapin A, Gout O, et al. Systemic autoimmune features and multiple sclerosis- a 5 year follow up study. Arch Neurol 1998;55:517-521. [ Links ]
18. Karussis D, Leker RR, Ashkenazi A, Abramsky O. A subgroup of multiple sclerosis patients with anticardiolipin antibodies and unusual clinical manifestations: do the represent a new nosological enty? Ann Neurol 1998;44:629-634. [ Links ]
19. Marullo S, Claufvel JP, Intrato L, Danon F, Brouet JC, Oksenhendler E. Lupoid sclerosis with antiphospholipid and antimyelin antibodies. J Rheumatol 1993;20:747-749. [ Links ]
20. Robos A, Ecvangeloupulou-Katsiri, Leventakou A, Voumvourakis K, Trintafyllou N, Papageourgiou C. Serum IgG and IgM anticardiolipin antibodies in neurological diseases. Acta Neurol Scand 1990; 81:43-45. [ Links ]
21. Report of the therapeutics and technology assesssment Subcommitee of the American Academy of neurology. The utility of MRI in suspected MS. Neurology 2003;61(5). [ Links ]
22. Fulford KWM, Catteral RD, Delhanty JJ, Doniach D, Kremer M: A collagen disorder of nervous system presenting as multiple sclerosis. Brain 1972;95:368-373. [ Links ]
23. Iglesias Gamarra A. Manifestaciones neurológicas del lupus. En: Historia del Lupus. Editorial Panamericana, Agosto 2003. [ Links ]
24. McKune WJ, Golbus J. Neuropsychiatric Lupus. Rheum Dis Clin North Am 1998;14:149-167. [ Links ]
25. Ijdo J.W., A.M. Conti Nelly, P. Greco, M. Abedi, M. Amorg, J.M. Provenzale, T.P. Greco. Antiphospholipid antibodies in patients with multiple sclerosis and MSlike disese illness: MS or APS? Lupus, 1999;8:109-115. [ Links ]
26. Tourbach A, Clapin A, Gout O, Fountain B, Liblan R, Batteux F. Stievenart JL, Weill B. Lyon-Caen. Systemic aotommune features and multiple sclerosis: A 5-year follw-up Study. Arch Neurol, 1998;55:517-521. [ Links ]
27. Cuadrado MJ, Khamashta A, Ballesteros T, Godfrey T, Simon MJ, Hughes, GRV can neurological manifestations of Hughes (antiphospholipid) syndrome be distinguished from Multiple Sclerosis? Medicine 2000;(79):57-68. [ Links ]
28. Aki Hietaharju, Jukka Pelttola, Juha Seppa, Reijo Luukkainen, Prasun Dastidar. The coexistence of systemic lupus erhytematosus and multiple sclerosis in a mother and daughter. Scand J Rheumatol 2001;30:120-122. [ Links ]
29. Sabbadini MG, Manfredi AA, Bozzolo E, et al. Central nervous system involvement in Sytemic lupus Erythematosus patients without overt neuropsychitric manifestations. Lupus 8:11-19. [ Links ]
30. Tellez-Zenteno JF, Remes-Troche JM, Negret Pulido RO. Longitudinal myelitis associated with systemic lupus erythematosus: clicical features and magnetic resonante imaging of six cases. Lupus 10:851-856. [ Links ]
31. Barkhof F, Filippi M, Miller DH, et al. Comparison of MRI criteria at first presentation to predict conversion to clinically definite multiple sclerosis. Brain 1997;120: 2059-2069. [ Links ]
32. Arnold DL, Matthews PM. MRI in the diagnosis and management of multiple sclerosis. Neurology 58(suppl4):S23-S31. [ Links ]
33. Hachulla E, Michon-Pasurel U, Leys D, et al. Cerebral MRI in patients with or without antiphospholipid antibodies. Lupus 1998;7:124-131. [ Links ]
34. Trysberg E and Tarkowski A. Cerebral inflammation and degeneration in systemic lupus eythematosus. Curr Opin Rheumatol 2004,16:527-533. [ Links ]
35. Barred, S., Goodman A, Mattson, D. Frequency of anti-nuclear antibodies in multiple sclerosis. Neurology 1995;45:384-385. [ Links ]
36. DeKeyser. Autoimmunity in multiple sclerosis. Neurology 1988;38:371-374. 37. Craig WY, Ledue TB, Johnson AM & Ritchi RF. The distribution of antinuclear antibody titers in "normal" children and adults. Journal of rheumatology 1999;26:914-919. [ Links ] [ Links ]
37. Cordoliani MA, Michon-Pasturel U, Rerar K, et al. Multiple sclerosis and antiphospholipid antibodies: study of 62 cosecutive patients. Review Medical Interne 1998;19:635-639. [ Links ]
38. Heinslef O, Weill B, Johanet C, et al. Anticardiolipin antibodies in patients of multiple sclerosis do not represent a subgroup of patients according to clinical, familial, and biological characteristics. Journal of neurology, neurosurgery and psychiatry 2002;72:647-649. [ Links ]
39. Roussel V, Yi F, Jauberteau MO, et al. Preud'homme. J. I. Prevalence and clinical significance of antiphospholipid antibodies in multiple sclerosis: a study of 89 patients. Journal of autoimmune 2002;14:259-265. [ Links ]
40. Ferreira S, DCruz DP, Hughes GRV. Multiple sclerosis, neuropsychiatric lupus and antiphospholipid syndrome: Where do we stand?. Rheumatology January 18, 2005. [ Links ]
41. Scott TF, Hess D, Brillman J. Antiphospholipid antibody syndrome mimicking multiple sclerosis both clinically and by magnetic resonance imaging. Arch Intern Med 1994;154:917-920. [ Links ]
42. DCruz D, Mellor-Pita S, Joven B, et al. Transverse myelitis as first manifestations of systemic lupus erythematosus of lupus-like disease: good fuctional outcome and relevance of antiphospholipid antibodies. J Rheumatol 2004;31:280-285. [ Links ]
43. Aziz A, Conway MD, Robertson HJ, Espinosa LR, Wilson WA. Acute optic neuropathy and transverse myelitis in patients with antiphospholipid syndrome: favorable outcome after treatment with anticoagulants and glucocorticoides. Lupus 2000;9:307-310. [ Links ]
44. Kovacs B, Lafferty TL, Lawrence H, DeHoratius RJ. Transverse mielopathy in systemic lupus erythematosus: an analysis of 14 cases and review of the literature. Ann Rheum Dis 2005;59:120-124. [ Links ]
45. Giorgio D, Grabieki CB. Optic neuropathy in systemic lupus erythematosus and antiphospholipid syndrome: clinical features, pathogenesis, review of the literature and proposed ophtalmological driteria for APS diagnosis. Clin Rheumatol 1999;18:124-131. [ Links ]
46. Noseworthy JH, Luchinetti C, Rodriguez M, Wenshenker BG. Multiple sclerosis. N Eng J Med 2000;343: 938-952. [ Links ]
47. Sanna G, Bertolaccini ML, Cuadrado MJ, et al. Neuropsychyatric manifestations in systemic lupus erythematosus: prevalence and associations with antiphospholipid antibodies. J Rheumatol 2003;30: 985-992. [ Links ]
48. Scolding N. Neurological complications of rheumatological and connective tissue disorders. En: Immunological and inflammatory disorders of the central nervous system. 1st edn. (ed. Scolding N) 1999, pp. 147-180. Butterworth-Heinemann, Oxford. [ Links ]
49. Baracza K, Nekam K, Pozsonyi T et al. Investigation of cytokine (tumor necrosis factor-alfa, inerleukin-6, interleukin-10) concentracions in the cerebrospinal fluid of female patients with multiple sclerosis and systemic lupus erythematosus. European Journal of Neurology 2004;11:37-42. [ Links ]
50. Baraczka K, Lakos G, Sipka S. Immuoserological changes in the cerebrospinal fluid and serum in systemic lupus erythematosus patients with demyelinating syndrome and multiple sclerosis. Acta Neurol Scand 2002;105:378-383. [ Links ]
51. Johnsosn RT & Richardson EP. The neurological manifestations of systemic lupus erythematosus. Medicine 1968;47:337-369. [ Links ]
52. Hanly JG, Wals NM, Sangalang V. Brain Pathology in systemic lupus erythematosus. J Rheumatol 1992;19:732-741. [ Links ]
53. Belmont HM, Abramson SB, Lie JT. Pathology and pathogenesis of vascular injury in systemic lupus erythematosus. Interactions of inflammatory cells and activated endothelium. Arthritis Rheum 1996;39:9-22. [ Links ]
54. Oppenheimer S, Hoffbrand BI. Optic neuritis and myelopathy in systemic lupus erythematosus. Can J Neurol Sci 1986;13(2):129-132. [ Links ]
55. Crow MK. Interferon-á: a new target for therapy in systemic lupus erythematosus? Arthritis Rheum 2003; 48:2396-2401. [ Links ]














