Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares en
SciELO
Similares en
SciELO -
 Similares en Google
Similares en Google
Compartir
Revista Colombiana de Reumatología
versión impresa ISSN 0121-8123
Rev.Colomb.Reumatol. v.17 n.2 Bogotá abr./jun. 2010
PRESENTACIÓN DE CASOS
Metabolic bone diseases: clinical and radiologic analysis in five cases
Carlos Darío Ochoa1, Carlos E. Toro1, Fabián Ramírez1, Jaime Mercado2, Orlando Olivares3, José Félix Restrepo1, Federico Rondón1, Antonio Iglesias-Gamarra1
1 Unidad de Reumatología, Escuela de Medicina. Universidad Nacional de Colombia.
2 Nefrólogo, Fresenius. Barranquilla.
3 Nefrólogo, Fresenius. Bogotá.
Recibido: Abril 17 de 2010 Aceptado: Mayo 28 de 2010
Resumen
El estudio de la enfermedad metabólica ósea es amplio y complejo. La enfermedad ósea más reconocida por médicos de todas las especialidades es la osteoporosis, probablemente debido a su elevada frecuencia. No obstante, es importante reconocer que existen numerosas entidades que afectan el metabolismo óseo de diferentes formas, llevando a fragilidad ósea, aumento del riesgo de fractura, osteoporosis u osteocondensación, de acuerdo a cada caso particular. Tanto el diagnóstico clínico como el reconocimiento de la alteración metabólica subyacente son importantes porque la identificación de la anormalidad específica se constituye en la base para el tratamiento. Se presentan 5 casos diferentes en los que un trastorno metabólico conlleva a una patología ósea específica; se discute la patogenia de las calcificaciones arteriales y se presenta una entidad mixta que nosotros llamamos osteoporomalacia.
Palabras clave: enfermedad metabólica ósea, osteomalacia, osteoporomalacia, hiperparatiroidismo, osteodistrofia renal, calcificaciones arteriales.
Summary
The study of metabolic bone disease is broad and complex. The most widely recognized bone disease by physicians of all specialties is osteoporosis, probably due to its high frequency. However, it is important to recognize that there are numerous entities that affect bone metabolism in different ways, leading to brittle bones, increased risk of fracture, osteoporosis or osteocondensation, according to each particular case. Both the clinical diagnosis and recognition of the underlying metabolic abnormality are important because they identify the specific abnormality that will be the base for treatment. There were 5 different cases in which a metabolic disorder leads to specific bone pathology, we discuss the pathogenesis of arterial calcifications and presents a mixed entity we call osteoporomalacia.
Key words: metabolic bone disease, osteomalacia, osteoporomalacia, hyperparathyroidism, renal osteodystrophy, arterial calcification, bone tumor.
Primer caso
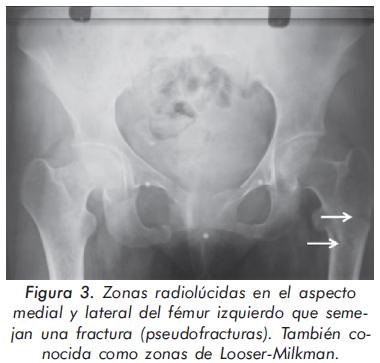
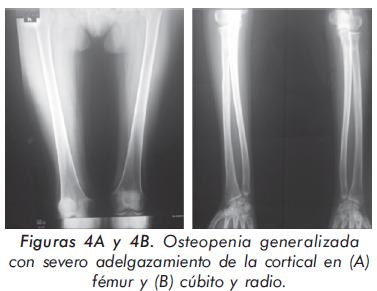
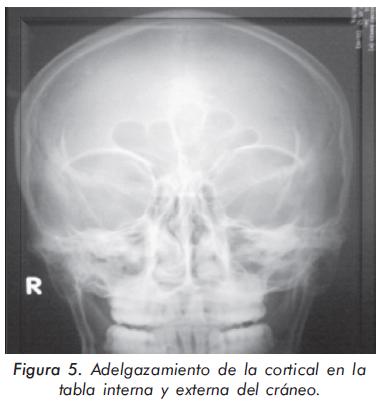
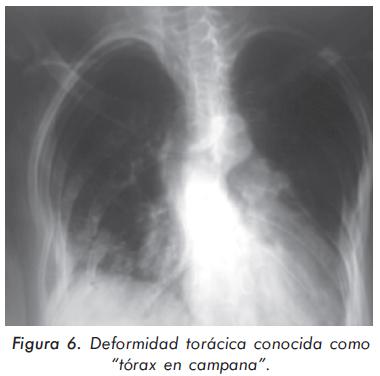
Mujer de 24 años procedente de Mompox; consulta por cuadro de 3 años de evolución de lenta instauración consistente en dolor y debilidad generalizada que incluso le representa disminución de la fuerza, especialmente en miembros inferiores con caídas y dificultad para la marcha. Sin mayores antecedentes, se presenta con un examen físico normal salvo por alteración en la postura demostrado por exageración de la cifosis dorsal (Figuras 1 y 2). Igualmente, presentaba disminución global de la fuerza. Los hallazgos paraclínicos más importantes fueron: hipofosfatemia (1.8 mg/dL), elevación de fosfatasa alcalina total (639U/L) y ósea específica 48 ng/ml con rangos 4.6-14.3 ng/ml, acidosis metabólica (pH 7.31, HCO3 16 mEq/L) y alcalosis urinaria (pH urinario 7.8). La evaluación radiográfica demostró diferentes alteraciones importantes (Figuras 3, 4Ay4B, 5 y 6). En la densitometría corporal total se encontró osteoporosis con T-score de -5.7 en piernas, -3.4 en antebrazos y -1.9 en columna vertebral.

Osteomalacia: secundaria a acidosis tubular renal
La osteomalacia es caracterizada por alteración en la mineralización de la matriz ósea. Tanto el calcio como el fósforo y la vitamina D son necesarios para la mineralización de los huesos. La osteomalacia resulta de una reducida disponibilidad de calcio, fósforo para incorporarse en la hidroxiapatita de los huesos o por deficiencias en la absorción o activación de la vitamina D1-2. Una historia cuidadosa es muy importante en el diagnóstico de esta entidad, poniendo especial atención a los dolores óseos generalizados que comprometen pelvis, columna, costillas y los miembros inferiores o las deformidades esqueléticas como la xifoescoliosis, encorvamiento de los huesos largos o anormalidades pélvicas. Otro dato de suma importancia se trata de las alteraciones para la marcha secundarias a debilidad muscular proximal que se manifiestan como marcha antálgica o de pato. Uno de los signos radiológicos encontrados en la osteomalacia es la presencia de pseudofracturas o zonas de looser's, que son áreas radio lúcidas a través de la cortical (Figura 3), adelgazamiento de la cortical y deformidad torácicas. Como causas de osteomalacia se encuentran los desórdenes renotubulares como la acidosis tubular renal, que puede ser de cuatro tipos. Tipo 1 (Distal), donde los riñones son incapaces de acidificar la orina en presencia de acidosis metabólica en la parte distal del nefrón por alteración en la secreción de hidrogeniones o en la reabsorción de bicarbonato, generalmente de tipo hereditario. La acidosis crónica no tratada puede causar osteomalacia. El calcio es liberado de los huesos como mecanismo buffer y resulta en hipercalciuria. Tipo 2 (Proximal), es el resultado de la incapacidad del nefrón para reabsorber bicarbonato en la parte proximal y es generalmente secundaria a procesos de tipo autoinmune, inducidos por drogas, infiltrativos u otras tubulopatías3. La tipo 3 no está informada. La tipo 4 es la más común y usualmente adquirida en asociación con moderada disfunción renal e hiperkalemia.
Segundo caso
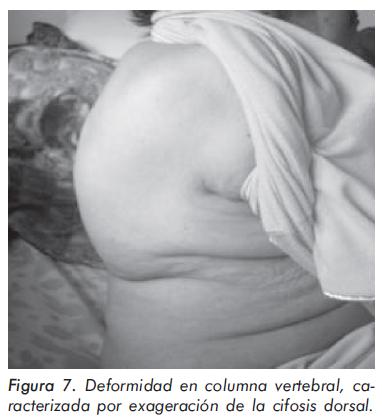
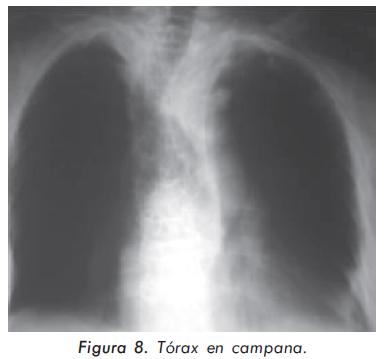
Mujer de 68 años de edad con osteoporosis de larga data documentada por densitometría que ha recibido tratamiento con calcio y vitamina D de forma irregular. Refiere desde hace varios años disminución de estatura, asociada a alteración en la postura por exageración de la cifosis y dorsalgia crónica (Figura 7). La evaluación de laboratorio es normal, salvo por un discreto aumento de la fosfatasa alcalina total (280 U/L). La alteración radiográfica más importante se muestra en la Figura 8.
Osteoporomalacia
La osteoporosis es caracterizada por la baja densidad ósea y el deterioro de la microarquitectura ósea, que reduce la fuerza de los huesos e incrementa el riesgo de fractura; su característica principal está dada por la pérdida de la mineralización ósea y de la matriz ósea que resulta en el mantenimiento de un radio de mineralización/matriz ósea normal. Existen casos de osteoporosis de larga data con tratamientos irregulares en donde se pueden ver alteraciones de la matriz ósea dadas por las deficiencias de los componentes inorgánicos como calcio y fósforo en los cristales de hidroxiapatita, generando deformidades óseas características de la osteomalacia y elevación discreta de la fosfatasa alcalina, situación que bien pudiera ser informada como osteoporomalacia4-6.
Los niveles de fosfatasa alcalina y específicamente la ósea específica se requieren para el proceso de la mineralización ósea y una elevación de sus niveles nos indica un defecto de la mineralización, probablemente la osteoporosis de larga data pudiese desencadenar esto.
En este caso encontramos la osteoporosis de larga evolución con tratamiento irregular y la presencia de deformidades óseas de columna y tórax caracterizadas por cifoescoliosis y tórax en campana más elevación discreta de la fosfatasa alcalina, situación que hace pensar en la combinación de dos entidades: osteoporosis y osteomalacia.
Tercer caso
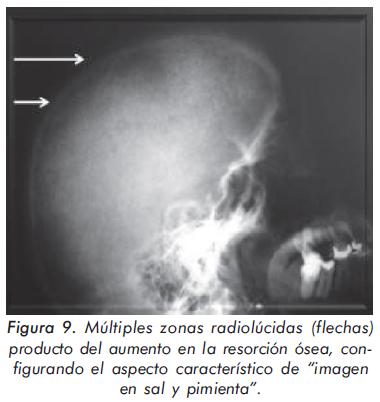
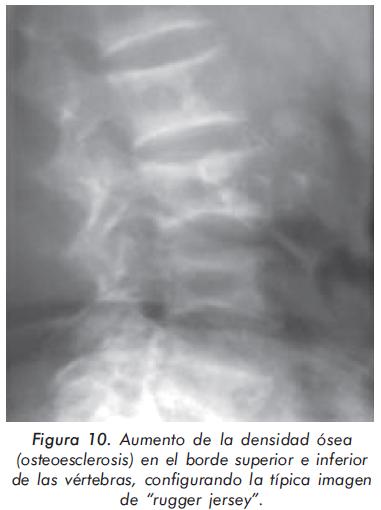
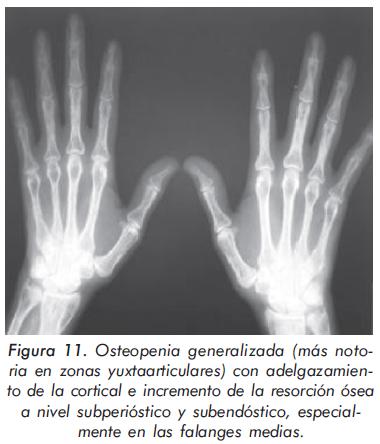
Mujer de 55 años en hemodiálisis desde hace 15 años por falla renal terminal que desarrolla cuadro de hiperparatiroidismo severo, refractario al uso de calcio, vitamina D y quelantes de fósforo, quien consulta por dolor musculoesquelético mal definido. Las alteraciones radiográficas de esta paciente se presentan en las Figuras 9, 10 Y 11.
Los paraclínicos mostraron un calcio 10.7 mg/ dl (8.4-10.2 mg/dl), fósforo 5.8 mg/dl (2.7-4.5 mg/dl), BUN 83 mg/dl, potasio 6.0 mEq/L, Cr 6.1 mg/dl, Fosfatasa Alcalina 601 U/L y Paratohormona 2533 pg/ml (12 pg/ml - 65 pg/ml).
Osteodistrofia renal: hiperparatiroidismo secundario
El compromiso óseo por hiperparatiroidismo en el contexto de osteodistrofia renal se observa en estadios de la falla renal crónica persistente, llevando consigo a una serie de alteraciones a nivel del metabolismo óseo y mineral7. La disminución en la producción de vitamina D es una de las alteraciones más importantes, ya que esta vitamina influencia directa e indirectamente la acción del calcio, el fósforo y la paratohormona8. En términos generales, la disminución en la vitamina D producto de la falla renal se traduce en hipocalcemia por disminución de su absorción, lo que estimula una mayor liberación de paratohormona con la intención de regular la calcemia a expensas del hueso9. El espectro clínico de la osteodistrofia renal es amplio, dependiendo en gran medida de la tasa de recambio óseo. Es así como se puede presentar enfermedad por alto recambio óseo, conocida como osteítis fibrosa quística; o enfermedad por bajo recambio óseo, siendo la osteomalacia y la enfermedad ósea adinámica las representantes de este tipo de anormalidad. Adicionalmente, pueden presentarse cuadros intermedios con manifestaciones mixtas de alto y bajo recambio óseo10. De acuerdo al subtipo de afección específico, el tratamiento con calcio, análogos de vitamina D, quelantes de fósforo, agentes sensibilizadores del receptor paratiroideo sensible al calcio y/o terapia de reemplazo renal permiten controlar o limitar la aparición de la osteodistrofia renal11. La biopsia de hueso en algunos casos cobra mucha utilidad, especialmente cuando se sospecha enfermedad de tipo adinámica ósea dado el riesgo que existe con la utilización de bifosfonatos en este tipo de osteodistrofia renal, ya que pueden empeorarla y se encuentran contraindicados; su mayor utilidad en este contexto de la osteodristrofia renal es que permite discernir entre la enfermedad dinámica y adinámica ósea mejorando la aproximación diagnóstica y terapéutica12.
Esta paciente con falla renal crónica presenta varias características radiográficas propias del hiperparatiroidismo. Primero, imagen en sal y pimienta por aumento de la resorción ósea en la radiografía de cráneo; segundo, esclerosis en el margen inferior y superior de cada vértebra (imagen de rugger jersey) y tercero, osteopenia generalizada en la radiografía de manos con incremento de la resorción ósea a nivel subperióstico y subendóstico13,14.
Cuarto caso
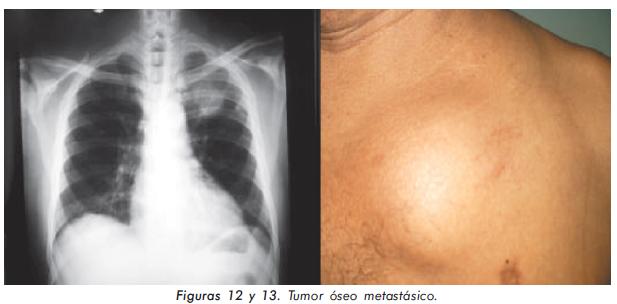
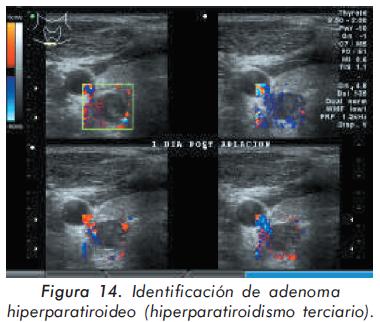
Hombre de 49 años con historia de terapia de reemplazo renal (inicialmente hemodiálisis y posteriormente diálisis peritoneal ambulatoria) desde hace 10 años por falla renal terminal de etiología hipertensiva, que desarrolló de forma abrupta un cuadro de hiperparatiroidismo severo caracterizado por paratohormona en 1266 pg/mL, calcio 10,6 mg/dL y fósforo 6 mg/dL. Clínicamente, el hallazgo más llamativo era la presencia de dolor en la reja costal izquierda, asociado a la presencia de masa (Figuras 12 y 13). El uso de calcio, quelantes de fósforo (incluyendo sevelamer) y análogos de vitamina D no logró controlar el cuadro de hiperparatiroidismo (paraclínicos: PTH 1497 pg/ mL, calcio 7,9 mg/dL y fósforo 13,9 mg/dL), por lo que se sospechó hiperparatiroidismo terciario por desarrollo de adenoma autónomo, producto del aumento sostenido de la PTH durante varios años. Este hallazgo fue confirmado por ecografía (Figura 14). Para el tratamiento de este adenoma se decidió realizar ablación del mismo con alcohol dirigido por ecografía (Figura 15).
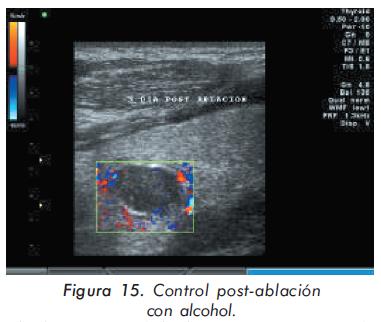
Seis meses después de esta terapia se ha observado un mejor control del cuadro de hiperparatiroidismo (PTH 570 pg/mL).
Osteodistrofia renal: hiperparatiroidismo terciario, tumor óseo metastásico
Algunos casos con osteodistrofia renal de tipo hiperparatiroidismo secundario conllevan a la activación autónoma de las glándulas paratiroides. Esta entidad es conocida como hiperparatiroidismo terciario dentro del espectro de la osteodistrofia renal, siendo del tipo enfermedad ósea dinámica y puede cursar con alteraciones óseas más dramáticas como el tumor óseo metastásico15, siendo una de las estrategias terapéuticas la ablación del adenoma, situación que fue realizada en este paciente con buena respuesta.
Quinto caso
Mujer de 65 años con antecedente de falla renal crónica en hemodiálisis desde hace 2 años por falla renal terminal de etiología diabética hipertensiva con desarrollo de hiperpartairoidismo secundario en tratamiento médico (calcio 10,6 mg/dL, fósforo 6,8 mg/dL y PTH en 1900 pg/mL). En valoración rutinaria se encuentra reforzamiento del segundo ruido en foco aórtico. En la radiografía de tórax se encontró gran calcificación aórtica (Figura 16).
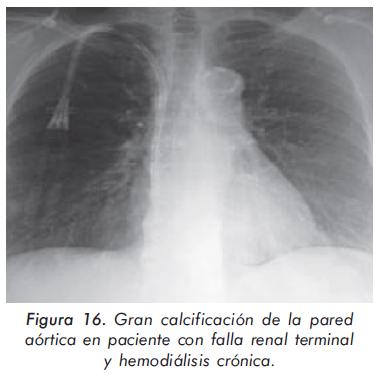
Calcificaciones extra-esqueléticas
A. Vasos de mediano y gran calibre
Una de las complicaciones que genera la osteodistrofia renal, que son poco conocidas por el cuerpo médico, son las calcificaciones extraesqueléticas. Estas calcificaciones comprometen la parte vascular, especialmente la aorta, las arterias coronarias, las carótidas y la femoral, además de calcificaciones distróficas alrededor de las articulaciones16-19. Lo importante es que estas calcificaciones extra-esqueléticas se asocian con un alto recambio óseo y posiblemente representan la movilización de calcio y fósforo de los huesos20. Los trabajos desarrollados por London y cols.21-22, especialmente a partir del 2002 y otro grupo de investigadores, quienes observaron una hiperfosfatemia no controlada y una elevación del producto calcio-fósforo secundario al hiperparatiroidismo secundario. Esto al parecer generó la muerte súbita en algunos pacientes, por lo que se empezó a interesar a los nefrólogos y a los investigadores en este tópico. Pero las calcificaciones extra-esqueléticas se pueden presentar en los pacientes con osteodistrofia renal y bajo recambio óseo; genera un defecto en la matriz ósea por un acomodamiento inadecuado del producto calcio-fósforo, con precipitación a nivel extra-esquelético20-21,23.
Chertow y cols.17 demostraron que al utilizar el sevelamer se disminuye el exceso de calcio y esto disminuye la progresión de las calcificaciones extra-esqueléticas, especialmente a nivel de las arterias coronarias. Uno de los mecanismos propuestos es que los fosfatos puedan ser un regulador, ya que puede transformar las células vasculares a un fenotipo como los osteoblastos y al detectar genes asociados al osteoblastos como el CBFA-1, también se ha demostrado la presencia del transportador del fosfato tipo III, el PIT y, en experimentos in vitro cuando se inhibe este sistema de transporte se disminuyen estos procesos20-26.
B. Vasos de pequeño calibre
Cuando las calcificaciones extra-esqueléticas ocurren en la micro-vasculatura se puede producir la arteriopatía urémica calcificante ó calcifilaxia5,27. Que se debe sospechar cuando las áreas cutáneas se hacen dolorosas, violáceas, induradas y finalmente puede ocurrir mas ulceraciones, especialmente en los miembros inferiores y glúteos.
Este síndrome se ha estudiado en los últimos años, al parecer secundario a las terapias contra el hiperparatiroidismo asociado a los esteroles de la vitamina D, también es más frecuente en los pacientes obesos y diabéticos. Ketteler17 observó una disminución de los niveles de fetuina A, un inhibidor de la calcificación. Otros plantean que la disminución de los niveles de pirofosfato en la vasculatura como un factor importante en la calcificación vascular13,17,27.
Conclusión
Se han presentado 5 pacientes con enfermedad metabólica ósea, que a pesar de algunas similitudes en el cuadro clínico como la cronicidad de los mismos o la presencia de dolor músculo esquelético mal definido, se refieren a cuadros nosológicos diferentes entre sí. (Tabla 1).
TABLA 1Es de suma importancia mantener presente este tipo de desórdenes metabólicos óseos que en algunos casos, de no ser estudiados adecuadamente, pueden pasar desapercibidos y no dárseles el tratamiento adecuado como lo es principalmente la osteomalacia, entidad clínica poco buscada y tratada.
También resaltamos la importancia de un enfoque adecuado desde el punto de vista diagnóstico en los pacientes renales con osteodistrofia renal, situación que deriva un mejor tratamiento de casa desorden en particular.
Es importante resaltar el caso de la osteoporomalacia, entidad no bien descrita en la literatura médica encontrada en pacientes con osteoporosis de larga evolución con tratamiento irregular, dolores óseos que no se encuentran en la osteoporosis pura y la presencia de deformidades óseas con discretos incrementos de la fosfatasa alcalina al igual que la interesante fisiopatología de las calcificaciones arteriales que se presentan en los pacientes renales.
Referencias
1. Firestein G, Budd R, et al. Metabolic Bone Disease. En: Kelley's Textbook of Rheumatology. Eighth Edition. Vol. II, 2008; pp. 1579-1599. [ Links ]
2. Holick MF, Garabedian M. Vitamin D. Photobiology, metabolism, mechanism of action, and clinical applications. En: Primer on Metabolic Bone Diseases and Disorders of Mineral Metabolism, 2006; pp. 106-114. [ Links ]
3. Fauci, Braunwald, Kasper, et al. Disorders of the Kidney and Urinary Tract. In Harrison's principles of internal medicine. 17th Edition 2008; pp. 1797-1806. [ Links ]
4. National Osteoporosis Foundation. Osteoporos Int 1998;4(Suppl):S7-S80. [ Links ]
5. Riggs BL, Melton LJ. The prevention and treatment of osteoporosis. N Engl J Med 1992;327:620-627. [ Links ]
6. Manolagas SC, Jilka RL. Bone Marrow, cytokines, and bone remodeling. N Engl J Med 1995;332:305-311. [ Links ]
7. Hruska K, Teittelbaum S. Renal Osteodystrophy. N Engl J Med 1995; pp. 166-174. [ Links ]
8. Slatopolsky E, Delmez JA. Pathogenesis of secondary hyperparathyroidism. Am J Kidney Dis 1994; 23:229-236. [ Links ]
9. Borrego MJ, Felsenfeld AJ, Martin-Malo A, Almaden Y, Concepción MT, Aljama P, et al. Evidence for adaptation of the entire PTH-calcium curve to sustained changes in the serum calcium in haemodialysis patients. Nephrol Dial Transplant 1997;12:505-513. [ Links ]
10. Sherrard DJ, Hercz G, Pei Y, Maloney NA, Greenwood C, Manuel A, Saiphoo C, et al. The spectrum of bone disease in end-stage renal failure: An evolving disorder. Kidney Int 1993;43:436-442. [ Links ]
11. Martin KJ, Olgaard K, Coburn JW, Coen GM, Fukagawa M, Langman C, et al. Diagnosis, assessment, and treatment of bone turnover abnormalities in renal osteodystrophy. Am J Kidney Dis 2004;43:558-565. [ Links ]
12. Moe S, Drueke T, Cunningham J, et al. Definition, evaluation, and classification of renal osteodystrophy: a position statement from Kidney Disease: Improving Global Outcomes (KDIGO). Kidney Int 2006;69: 1945-1953. [ Links ]
13. Roe S, Cassidy MJ. Diagnosis and monitoring of renal osteodystrophy. Curr Opin Nephrol Hypertens 2000;9(6):675-681. [ Links ]
14. Resnick D, Niwayama G. Parathyroid disorders and renal osteodystrophy. En: Resnick D, Niwayama G, editors. Diagnosis of bone and joint disorders. Philadelphia: W.B. Saunders 1995;2012-2075. [ Links ]
15. Sundaram M. Renal osteodystrophy, Skeletal Radiology 1989; pp. 415-426. [ Links ]
16. Shanahan CM. Mechanisms of vascular calcification in renal disease. Clin Nephrol 2005;63:146-157. [ Links ]
17. Chertow GM, Burke SK, Raggi P. Sevelamer attenuates the progression of coronary and aortic calcification in hemodialysis patients. Kidney 2002;62:245-252. [ Links ]
18. Goodman WG, Goldin J, Kuizon BD, Yoon C, Gales B, Sider D, Wang Y, et al. Coronary-artery calcification in young adults with end-stage renal disease who are undergoing dialysis. N Engl J Med 2000; 342:1478-1483. [ Links ]
19. London GM, Marty C, Marchais SJ, Guerin AP, Metivier F, de Vernejoul MC. Arterial calcifications and bone histomorphometry in end-stage renal disease. J Am Soc Nephrol 2004;15:1943-1951. [ Links ]
20. Martin KJ, Al-Aly Z, Gonzales EA. Renal osteodystrophy in primer on the metabolic bone diseases and disorder of mineral metabolism Edited by Murray S. Favus Chapter 66, pp. 359-366. Published AS. BMR 2006. [ Links ]
21. London G. Cardiovascular disease in end-stage renal failure: Role of calcium-phosphate disturbances and hyperparathyroidism. J Nephrol 2000;15:209-210. [ Links ]
22. London GM, Marty C, Marchais SJ, Guerin AP, Metivier F, de Vernejoul MC. Arterial calcifications and bone histomorphometry in end-stage renal disease. Jam Soc Nephrol 2004;15:1943-1951. [ Links ]
23. Lomashvili KA, Cobbs S, Hennigar RA, Hardcastle KI, O' Neil WC. Phosphate-induced vascular calcification. Role of phyrophosphate and ostepontin. J Am Soc Nephron 2004;15:1392-1401. [ Links ]
24. Ketteler M. Fetuin-A and extraosseous calcification in uremia. Curr Opin Nephrol Hypertens 2005;14:337- 342. [ Links ]
25. Farzaneh-Far A, Shanahan CM. Biology of vascular calcification in renal disease. Nephron Exp Nephrol 2005;101:134-138. [ Links ]
26. Giachelli CM, Jono S, Shioi A, Nishizawa Y, Mori K, Morii H. Vascular calcification and inorganic phosphate. Am J Kidney Dis 2001;38(4 Suppl 1): S34-S37. [ Links ]
27. Jono S, Mckee MD, Murry CE, Shioi A, Nishizawa Y, Mori K, et al. Phospate regulation of vascular smooth muscle cell calcification. Circ Res 2000;87:E10-E17. [ Links ]














