Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares en
SciELO
Similares en
SciELO -
 Similares en Google
Similares en Google
Compartir
Revista Colombiana de Reumatología
versión impresa ISSN 0121-8123
Rev.Colomb.Reumatol. v.17 n.4 Bogotá sep./dic. 2010
ARTÍCULO DE REVISIÓN
1 Kinesiólogo/Fisioterapeuta, Licenciado en Rehabilitación. Dr. Ph.D Major in Physiotherapy. Magíster en Terapia Manual Ortopédica. Director del Programa de Fisioterapia Universidad San Buenaventura-Seccional Cartagena.
2 Médico Cirujana. Universidad Metropolitana de Ciencias de la Salud. Barranquilla. Colombia. Interna Nuevo Hospital Bocagrande. Cartagena. Colombia.
3 Médico Cirujana. Especialista en Medicina Interna. Subespecialista en Reumatología. Hospital Militar Central. Bogotá. Colombia.
Correspondencia: Marco Antonio Morales mmoraleso@usbctg.edu.co
Recibido: 19 de noviembre de 2010. Aceptado: 15 de diciembre de 2010
Resumen
El síndrome fibromiálgico es un síndrome clínico caracterizado por dolor crónico generalizado y reducción de los umbrales del dolor a la palpación. La fisiopatología sigue siendo desconocida, pero cada vez hay más evidencia de que la sensibilización periférica y central provocan una amplificación de los impulsos sensoriales que puede alterar la percepción del dolor en los pacientes.
En su tratamiento resulta fundamental el abordaje multidisciplinario en contraposición a un abordaje biomédico tradicional, dada la enorme complejidad que suelen presentar estos pacientes. El tratamiento debe ser dirigido por el médico, quien hace el diagnóstico y coordina el equipo interdisciplinario, en el que el fisioterapeuta hace la evaluación inicial y realiza el tratamiento de rehabilitación integral y el psicólogo lleva a cabo la evaluación inicial y el tratamiento cognitivo conductual.
En esta revisión, encontraremos las tres áreas más importantes del tratamiento del síndrome fibromiálgico, profundizando en el tratamiento farmacológico y fisioterapéutico, según análisis bibliográfico de la evidencia científica más actual.
Palabras clave: síndrome fibromiálgico, farmacoterapia, fisioterapia.
Summary
The Fibromyalgia Syndrome is a clinical syndrome of chronic widespread pain and reduced pain thresholds to palpation. The pathophysiology remains unknown, but there is increasing evidence that peripheral and central sensitization cause an amplification of sensory impulses that may alter pain perception in Fibromyalgia Syndrome patients. The multidisciplinary approach for its treatment is very important, against the traditional biomedical approach, because of the high complexity of the patients.
Treatment should be directed by the physician, who makes the diagnosis and coordinates the interdisciplinary team, in which the psychologist conducting the initial assessment and cognitive behavioral therapy and the therapist makes the initial assessment and performs comprehensive rehabilitation treatment.
In this review, we find the three most important areas of treatment of fibromyalgia syndrome, furthering the pharmacological treatment and physiotherapy, as literature review the most current scientific evidence.
Key words: fibromyalgia syndrome, pharmacotherapy, physiotherapy.
Introducción
Según el National Institute of Arthritis and Musculeskeletal and Skin diseases (NIAMS) el síndrome fibromiálgico (SFM) se define como un síndrome crónico común caracterizado por dolor muscular difuso, fatiga y puntos sensibles1.
Según la declaración de Copenhague 1992 y sus revisiones posteriores (Bennett 1999, Copenhague Declaration 1993, Wolfe y cols. 1995), la OMS estableció que se considera esta patología como "Un grupo de trastornos reumáticos comunes no articulares, caracterizados por dolor y rigidez de intensidad variable de los músculos, tendones y tejido blando circundante, relacionados generalmente con un cuadro depresivo"2.
El Colegio Americano de Reumatología (ACR) define al SFM como un trastorno musculoesquelético crónico caracterizado por dolor generalizado y sensibilidad en determinados sitios anatómicos, comúnmente acompañado por fatiga3. La etiopatogenia del SFM es probablemente multifactorial y periférica, y los factores centrales se cree que interactúan con el desarrollo de este síndrome. La verdadera incidencia y prevalencia del SFM se desconoce. Sin embargo, los estudios de Norteamérica y Europa han revelado tasas de prevalencia que van desde 1% a 5% en la población general4.
Diagnóstico
En el año 1990 el ACR instauró como elemento diagnóstico "la presencia de dolor difuso de más de tres meses de evolución y sensibilidad al dolor aumentada a la palpación digital en al menos 11 de 18 localizaciones anatómicas propuestas"5. Dichos puntos se denominan "Puntos sensibles" o "Tender Points".
Un estudio realizado por Tastekin en el 2010 buscó evaluar el valor de discriminación de todos los puntos sensibles al dolor, este se realizó en 66 pacientes con SFM. La presión y sus valores umbrales de dolor fueron medidos por un dolorímetro en nueve pares de puntos específicos. Todos los puntos sensibles con determinados valores de la presión de corte se encontraron significativamente en el SFM. El análisis de regresión logística reveló que el epicóndilo lateral y los pares supraespinosos tenían la capacidad de discriminación más potente. También se encontró que el epicóndilo lateral y el segundo punto de la costilla pares fueron los más discriminativos con una sensibilidad y especificidad de 87,9-94,0% y 77,3-84,0%, respectivamente6.
En un estudio multicéntrico realizado en México por Vargas y cols., en el 2006, se buscó desencadenar alodinia mediante un esfigmomanómetro en pacientes con SFM, para probar un test indicativo de SFM, producto de la provocación de dolor durante la prueba de toma de la presión arterial con manguito inflable en el brazo, y se asoció fuertemente con el diagnóstico de SFM. El elemento "sine qua non" para el diagnóstico de SFM es la presencia de los puntos dolorosos en los sitios anatómicos precisos. Esos puntos sensibles reflejan a la vez un estado de alodinia mecánica generalizada, la cual puede ponerse de manifiesto localmente a través de la toma de la presión arterial mediante el manguito inflable7.
Etiopatogenia
La etiología es desconocida, aunque probablemente se trata de un proceso multifactorial8. Como hipótesis, se ha considerado desde que pudiera ser un trastorno muscular primario9, una alteración neuroendocrina10 o un proceso de tipo psicosomático11. Algunos factores que podrían estar implicados en la fisiopatología del SFM son: la alteración de la fase IV del sueño no REM, una respuesta anómala del eje hipotálamo-hipósisissuprarrenal en situaciones de estrés, alteraciones neurofisiológicas o de neurotransmisores (serotonina, sustancia P, somatomedina C, endorfinas), trastornos psiquiátricos como la ansiedad o la depresión, así como factores de índole psicosocial o ambiental. La hipótesis más aceptada es la que plantea la existencia de un trastorno de la percepción, transmisión y modulación del estímulo doloroso, de origen central12.
A manera de recordatorio se llega a establecer un trastorno de los mecanismos nociceptivos estudiado en fluidos cerebroespinales así como también en sustancias del flujo sanguíneo del tálamo y del núcleo caudado en pacientes con bajo umbral de dolor13,14. Al paso de varios años de investigación se han encontrado variaciones significativas de norepinefrina, serotonina, ketamina y sustancia P15,16, pero no está especificado en qué etapa del SFM se investiga ni el nivel de molestia que el paciente refiere. Yasser y cols., en el 200817 investigaron la disfunción del hipocampo en pacientes con SFM mediante espectroscopia por resonancia magnética de protones (1H-MRS), correlacionaron los niveles de los metabolitos obtenidos con los aspectos de la cognición, la depresión y los síntomas del sueño en el grupo de pacientes.
Los niveles de N-acetil aspartato (NAA) del hipocampo derecho e izquierdo fueron significativamente diferentes entre los pacientes y los controles. Los niveles de colina (Cho) en el hipocampo derecho fueron mayores en el grupo de pacientes que en controles, mientras que no se encontraron diferencias con respecto a los niveles de creatina (Cr) en ambos hipocampos. Se indicó que el hipocampo es disfuncional en los pacientes con SFM, como se muestra por los menores niveles de NAA en comparación con los controles, lo que representa una disfunción metabólica neuronal o axonal. A medida que el hipocampo desempeña un papel crucial en el mantenimiento de las funciones cognitivas, la regulación del sueño y la percepción del dolor, se sugiere que la disfunción metabólica del hipocampo puede estar implicada en la aparición de estos síntomas asociados con el SFM18.
En un estudio publicado en el 2010 por Mhalla y cols.,19 se evaluaron 46 pacientes con SFM y 21 sujetos sanos, este estudio evaluó la excitabilidad cortical y la modulación intracortical sistemáticamente, mediante la estimulación magnética transcraneal (TMS) de la corteza motora, en pacientes con SFM. Se buscaron cambios correlacionales en los parámetros electrofisiológicos y las principales características clínicas del SFM como el dolor, la fatiga, la ansiedad, la depresión y catastrofismo. Se concluyó que el SFM está asociado a un déficit en la modulación intracortical donde participan ambos mecanismos: gabaérgica y glutamatérgica19.
Dolor en el SFM
La alodinia/hiperalgesia puede ser, localizada, regional o general. El dolor generalizado en combinación con alodinia/hiperalgesia generalizada se observa en trastornos como el SFM. Si hay dolor muscular generalizado, pero no alodinia y / o hiperalgesia generalizada, la condición se denomina dolor crónico generalizado. La patogénesis del SFM se describe a menudo como desconocido, pero hoy esto no es del todo cierto. A pesar del hecho de que todavía hay lagunas en nuestro conocimiento, sabemos lo suficiente acerca de los mecanismos patogénicos del dolor y la hipersensibilidad del dolor para argumentar que la hipersensibilidad permanente o dolor prolongado puede ser considerada como enfermedad que involucra al sistema nervioso nociceptivo20,21.
El SFM tiene componentes biológicos, psicológicos y sociales. Las señales de dolor en la periferia alcanzan (en la corteza) ambas áreas somatosensoriales, donde se percibe la localización del dolor, duración del dolor y la intensidad del dolor, y otras áreas, por ejemplo, estructuras límbicas, donde las respuestas emocionales al dolor se perciben y se interpretan22.
Muchos síntomas del SFM podrían explicarse por el hecho de que existen vínculos bidireccionales entre el sistema nervioso nociceptivo y el sistema inmunitario, el sistema de regulación del sueño y el sistema de regulación del estrés. Además, recientemente se ha descrito que las vías descendentes de facilitación pueden causar hipersensibilidad generalizada23.
A. Sensibilización central
La sensibilización de las neuronas de transmisión del dolor en el sistema nervioso central, especialmente las neuronas de rango dinámico amplio (RDA) en el asta dorsal, es un evento normal en el dolor agudo. Se convierte en patológico si es de larga data o permanente, como se produce en el SFM. La sensibilización central permanente es considerada como una expresión de la plasticidad neuronal en las neuronas sensoriales primarias y neuronas del asta dorsal, especialmente en las neuronas de RDA. Las neuronas de RDA cambian su estructura, fenotipo, función y la bioquímica. Fibras A-beta obtienen cualidades que son similares a las fibras C, y al tacto o la presión ligera se vuelven dolorosas24. Bendtsen y cols. encontraron que el estímulo (presión) función de la respuesta (dolor) en pacientes con SFM es lineal, indicando que el estímulo de nervios A-beta da lugar a dolor25.
El origen del dolor puede estar en músculos, articulaciones y ligamentos, y la actividad que con mayor probabilidad podría dar lugar a los cambios causados por plasticidad neuronal es la estimulación repetitiva de muchos años en la médula espinal por impulsos en la transmisión del dolor por fibras C y fibras A-beta.
La activación de N-metil-D-aspartato (NMDA) en las neuronas RDA es un paso en el desarrollo de la sensibilización central, y en pacientes con SFM que tienen respuesta a la ketamina es probable que la respuesta se deba a una reducción de la sensibilización central en el nivel de la columna. La ketamina es un antagonista de los receptores NMDA, y un respondedor a la ketamina es una persona en la que la infusión de ketamina reduce el dolor en un 50% o más26.
La misma conclusión puede extraerse del hecho de que la sumación temporal/integración de las señales de dolor de los tejidos profundos y la sumación temporal en pacientes con SFM son atenuadas por los antagonistas de NMDA18,27. La activación de receptores NMDA en las neuronas RDA puede causar la liberación adicional de neuropéptidos como la sustancia P, y estas sustancias se pueden expandir en la médula espinal y el resultado da lugar a la propagación de dolor28.
B. Desinhibición del dolor
La desinhibición del dolor es un resultado de un cambio en el sistema de modulación endógeno descendente. El sistema descendente incluye una red nerviosa que vincula la sustancia gris periacueductal y la médula rostral ventromedial de la médula espinal29. Ren y Dubner miraron la plasticidad de la actividad-dependiente y la modulación descendente, atribuyéndoles una función protectora. La última inhibición crea las condiciones que son buenas para el tratamiento de la lesión29.
En personas con hipersensibilidad permanente del dolor podría haber un estímulo continuo de los tractos facilitadores e inhibidores que darían lugar a un incremento del dolor si la actividad en los tractos inhibitorios disminuye o si la actividad en los tractos facilitadores aumenta. La hipersensibilidad del dolor debida a los cambios en la función de los tractos descendentes puede estar presente en el SFM con inicio en la periferia y en el SFM que comienza en el cerebro. La modulación endógena del dolor en el SFM se encuentra deteriorada con respecto a grupos controles sanos30,31. En las vías descendentes facilitadoras que se originaban en las áreas corticales frontales se ha demostrado que pueden causar un aumento generalizado en las respuestas neuronales a lo largo del neuroeje; esto ha indicado por primera vez que las emociones, tales como el miedo, pueden conducir al desarrollo del dolor generalizado y de la sensibilización32.32.
La sensibilización central de las neuronas que transmiten el dolor y la desinhibición del dolor, como se describió anteriormente, pueden ser una característica de dolor muscular crónico de diferentes orígenes. Cuando la hipersensibilidad del dolor es de larga data o permanente, hay un cambio en la función del sistema nervioso nociceptivo que podría asimilarse a una enfermedad33,34. La hipersensibilidad del dolor es principalmente central, pero la sensibilización periférica también puede estar presente. Con el fin de explicar el dolor muscular en el SFM, que por regla general no es estrictamen te simétrico y tiene distintas localizaciones, los factores periféricos tienen que ser considerados.
Tratamiento
Para obtener un tratamiento realmente efectivo, se debe pensar en un "tratamiento multidisciplinario". Los tratamientos multidisciplinarios, que generalmente se recomiendan para reducir los síntomas en el SFM, incluyen ejercicio físico, medicamentos, educación y terapia cognitivo-conductual35.
A. Tratamiento farmacológico
Para algunos autores, es falso que el SFM se trate de una enfermedad incurable que inexorablemente conduce a la incapacidad laboral absoluta, o que no haya nada que hacer hasta que no aparezca un medicamento del todo eficaz36.
Si recogemos las diferentes revisiones sistemáticas de la literatura médica actual reflejadas en los diferentes documentos realizados por expertos, podemos observar que se utilizan diversos fármacos para el tratamiento del SFM, que se apoyan en algunos ensayos clínicos de calidad que nos permiten medir su grado de eficacia37-39. En la Tabla 1 se mencionara el tipo de evidencia que posee cada uno de los medicamentos utilizados en SFM. Según la medicina basada en evidencia (MBE), hasta la fecha existen tres medicamentos que han sido aprobados por la FDA para el tratamiento de los síntomas del SFM. Ellos incluyen el fármaco antiepiléptico pregabalina y dos inhibidores de la recaptación de serotonina y noradrenalina (IRSN), duloxetina y milnaciprán40.
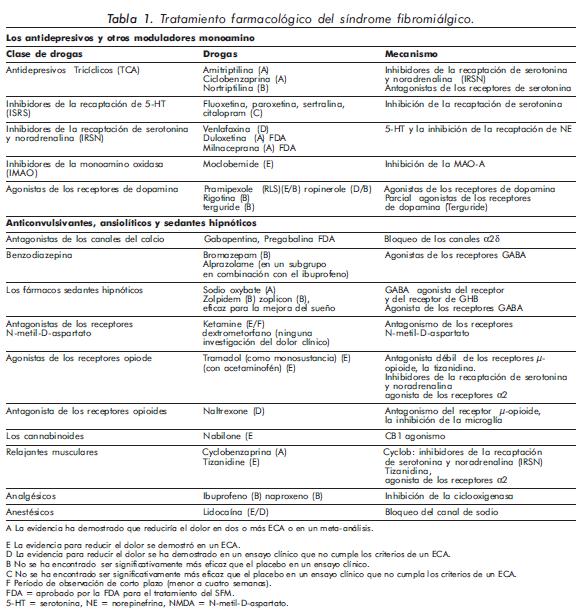
Antiepilépticos (o anticonvulsivantes) Pregabalina y Gabapentina
Los antiepilépticos son ampliamente utilizados en el tratamiento del dolor neuropático, como la neuralgia post herpética y la neuropatía diabética dolorosa41.
La pregabalina está aprobada para el tratamiento de la neuropatía diabética periférica, neuralgia posherpética, así como terapia para las convulsiones, fue el primer fármaco aprobado por la FDA para el tratamiento del SFM. Esta se une a la proteína asociada con A2D auxiliares dependientes de los canales de calcio, modulando la entrada de calcio neuronal, sin afectar los receptores de GABA. Sin embargo, el mecanismo exacto de acción de la pregabalina se desconoce. La reducción de la entrada de calcio en las neuronas podría disminuir la liberación de la sustancia P, el glutamato y la noradrenalina, que actúan como analgésico y ansiolítico.
En un estudio clínico con 529 pacientes con SFM, que fueron asignados a placebo o a una de tres dosis de pregabalina (150, 300 o 450 mg/día) durante ocho semanas, la pregabalina demostró una mejoría significativa en las puntuaciones de dolor, medidas de calidad del sueño, fatiga y globales de cambio42.
Por último, la eficacia de pregabalina en el tratamiento del SFM se evaluó en un metaanálisis de seis estudios controlados aleatorizados (ECA) con más de 2000 pacientes con SFM43. Este análisis evidencia una reducción moderada del dolor, mejoría del sueño, fatiga, ansiedad y una mejor calidad de vida pero no mostró eficacia para el estado de ánimo deprimido.
La gabapentina, que tiene un perfil farmacológico similar al de la pregabalina, se investigó en un ensayo clínico de doce semanas con 150 pacientes con FM, patrocinado por los Institutos Nacionales de Salud de EE.UU44 donde los pacientes tratados con Gabapentina mostraron una mejoría significativamente mayor del dolor que con el placebo. Además, la gabapetina mejoró la impresión global del paciente con SFM. En comparación con el placebo, el tratamiento con gabapentina se asoció con una incidencia significativamente mayor de sedación, mareo y vértigo. En general, los resultados de este estudio indican que la gabapentina tiene una eficacia similar a la pregabalina para los síntomas del SFM43.
Inhibidores duales de la recaptación de la serotonina y la noradrenalina (IRSN)
El primer IRSN disponible es la venlafaxina, antidepresivo que es usado en el tratamiento del dolor neuropático; los recientes datos de los ensayos retrospectivos demuestran que este compuesto es eficaz en la profilaxis de la migraña y la cefalea tipo tensional27. En dos estudios abiertos referentes a la venlafaxina, esta mostró eficacia para el dolor del SFM45,46, particularmente con dosis de 150 mg/día; pero otro ensayo clínico no informó efectos significativos de la venlafaxina sobre el dolor del SFM47.
Dos inhibidores mixtos de la recaptación de serotonina y noradrenalina (IRSN), la duloxetina y el milnaciprán, fueron sometidos a ensayos recientes multicéntricos y demostraron ser eficaces en una serie de síntomas en el SFM, obteniéndose una respuesta en el dolor superior al 30% en el 55% del total de pacientes tratados, frente al 33% de la obtenida en el grupo placebo48.
La duloxetina es un IRSN aprobado por la FDA para el tratamiento del trastorno depresivo y el dolor asociado con neuropatía diabética y SFM. Su principal mecanismo de acción incluye la inhibición de la recaptación de serotonina y norepinefrina sin interactuar con los opioides, muscarínicos, la histamina H1, α-adrenérgicos, dopamina o receptores de serotonina. Los eventos adversos más comunes fueron náuseas (29,3%), cefalea (20,0%), sequedad de boca (18,2%), insomnio (14,5%), fatiga (13,5%), estreñimiento (14,5%), diarrea (11,6%) y mareos (11,0%)38. Se recomienda iniciar a dosis bajas e ir progresando, suministrándolo por la mañana, durante el desayuno49.
Milnacipran, que se utiliza ampliamente como un antidepresivo en Europa y Japón, ha demostrado en un reciente ensayo clínico aleatorizado, publicado por Mease y cols.,50 una reducción del dolor, mejorando la impresión global del paciente y la calidad de vida, con una dosis de 100 mg/día o 200 mg/día, manteniéndose esta respuesta durante más de seis meses. Esta capacidad de atenuar el dolor crónico ha generado un interés considerable para el uso de norepinefrina, IRSN selectivo en el SFM, logrando una reducción del 50% del dolor con dos dosis diarias, demostrando ser estadísticamente superior al placebo. Los efectos adversos fueron generalmente leves y fueron náuseas y dolor de cabeza51.
Por lo tanto, los IRSN resultan ser prometedores en el tratamiento de los pacientes con dolor crónico, incluyendo el SFM.
Los inhibidores selectivos de la recaptación de serotonina (ISRN)
Otra categoría de antidepresivos, que utilizados eficazmente en el SFM son los inhibidores selectivos de la recaptación de serotonina (ISRS), son la fluoxetina, el citalopram, la sertralina, la fluvoxamina y la paroxetina; cada uno ha sido evaluado en ensayos controlados con placebo59,60. En general, los resultados de los ensayos con estos agentes en el SFM han sido negativos respecto a la eficacia del dolor, a pesar de que estos agentes son bien tolerados.
Los nuevos inhibidores "altamente selectivos" de la recaptación de serotonina (por ejemplo, citalopram o escitalopram) parecen ser menos eficaces en el SFM.
Un reciente metaanálisis realizado en 18 ECA confirma que los antidepresivos pueden mejorar el dolor en el SFM, la depresión, la fatiga, los trastornos del sueño y la calidad de vida51, obteniendo una respuesta superior al 30%. Los problemas para los pacientes son generados por la sequedad de la boca y el aumento de peso.
En general se acepta que los ISRS tienen menos efectos sobre el dolor de la FM que los antidepresivos tricíclicos o los inhibidores de la recaptación de serotonina y norepinefrina (IRSN).
Antidepresivos tricíclicos
Una de las terapias farmacológicas más eficaz para el dolor en el SFM incluye dosis bajas de antidepresivos tricíclicos (ATC)52. Estos han sido los fármacos más utilizados y con mayor nivel de evidencia53,54. Los ATC aumentan los neurotransmisores a nivel extracelular mediante la inhibición de su recaptación en los terminales presinápticos. Los ATC, especialmente la amitriptilina y la ciclobenzaprina, químicamente similares a un relajante muscular, pueden mejorar la sintomatología dolorosa, la falta de sueño y la fatiga asociada con el SFM55-57.
La amitriptilina es el fármaco más utilizado a dosis de 25 a 50 mg/día; la dosis inicial debe ser de 10 mg por la noche en una sola toma, e incrementar 5 mg cada semana58,59.
Relajantes musculares
Después de los ATC son los más estudiados en el tratamiento del SFM. Un reciente estudio de tipo metaanálisis para el dolor del SFM indicó que la ciclobenzaprina demuestra beneficios similares a la amitriptilina60. Incluso dosis tan bajas como 4,1 mg al acostarse han demostrado cierta eficacia en el dolor del SFM61. La ciclobenzaprina en Colombia se encuentra sola y asociada a un analgésico; el clonixinato de lisina se ha encontrado que tiene efectos principalmente sedantes, que han demostrado una mejoría en el descanso nocturno y leve reducción del dolor.
Otro medicamento de uso frecuente para el dolor del SFM es la tizanidina. A pesar de estar aprobado por la FDA como un relajante muscular para la espasticidad en esclerosis múltiple y accidentes cerebrovasculares, este medicamento es un agonista de los receptores α-2-adrenérgicos, similares a la clonidina. El tratamiento con Tizanidina (4-24 mg/día) dio como resultado una reducción de los niveles de líquido cefalorraquídeo y la sustancia P en un estudio de pacientes con SFM62.
Analgésicos y antiinflamatorios No existe ninguna evidencia de la eficacia de los antiinflamatorios en el tratamiento de la FM. Existe una evidencia débil sobre la eficacia del opioide tramadol para el control del dolor en la FM. No existe ninguna evidencia de la eficacia de los opioides mayores63.
El tramadol es un analgésico de acción central que se une a los receptores µ de opioide e inhibe la recaptación de la noradrenalina y la serotonina. En un ECA multicéntrico, la combinación tramadol/paracetamol a dosis de 37,5 mg/325 mg resultó ser más eficaz que el placebo en la sintomatología del SFM64. Las reacciones adversas fueron transitorias incluyendo mareos, vértigo, náuseas, vómitos, estreñimiento, somnolencia, dolor de cabeza y debilidad.
Benzodiacepinas
En el SFM las benzodiacepinas no han tenido eficacia significativa según diversos estudios y ensayos. Por ejemplo, el alprazolam a una dosis de 0,5-3,0 mg al acostarse, no resultó ser superior al placebo para el dolor del SFM65, pero sí el clonazepam, un medicamento antiepiléptico aprobado para las crisis de ausencias, y eficaz para el dolor temporomandibular, que se asimila al SFM y el síndrome de piernas inquietas, siendo causa de la vigilia y el sueño fragmentado que aparece en pacientes con SFM66.
Anestesia local
Los anestésicos locales se utilizan con frecuencia para el tratamiento del dolor miofascial, en especial en los puntos gatillo; teniendo en cuenta que el uso de lidocaína intravenosa ha demostrado cierta mejoría en el dolor neuropático en diabetes67 y en la neuralgia posherpética, los pacientes informan un alivio prolongado con este tratamiento. En un ensayo clínico realizado a pacientes con FM, se le inyectaron 50 mg de lidocaína en un solo punto doloroso. Esta inyección no sólo redujo el dolor local en el lugar de inyección, sino también la hiperalgesia generalizada68.
Sedantes e hipnóticos
Los sedantes pueden ayudar en el restablecimiento del sueño no reparador en los pacientes con SFM. Mejorando el sueño y contribuyendo a la disminución de otros síntomas como fatiga. El oxibato de sodio es la sal sódica del gamma hidroxibutirato que, a su vez, es un precursor del ácido gamma-aminobutírico, que tiene propiedades sedantes; este está aprobado por la FDA para el tratamiento de la narcolepsia, y es utilizado por pacientes con SFM ya que tiene un fuerte efecto sedante para aliviar el dolor, la fatiga y restablecer la arquitectura del sueño (aumentando las ondas lentas alfa) en pacientes con SFM. Los efectos secundarios fueron náuseas y mareos69.
Diversos estudios han sido publicados sobre el uso de hipnóticos no benzodiacepínicos en el SFM, como zopiclona y zolpidem. Estos mejoran el sueño, la fatiga, en pacientes con SFM, aunque no tengan ningún efecto significativo sobre el dolor70.
Un estudio evaluó la eficacia y la tolerabilidad del trazodone en el SFM; este dio como resultado una mejora en la calidad del sueño, la duración del sueño y la eficiencia del sueño. Inesperadamente, el efecto secundario más frecuente y grave asociado al trazodone en esta muestra fue la taquicardia, que fue reportado por 14 (21,2%) pacientes71.
B. Tratamiento fisioterapéutico
El tratamiento fisioterapéutico del SFM debe ser abordado pensando en una disfunción a nivel central, y no a nivel local como por mucho tiempo se ha tratado. Por eso las herramientas fisioterapéuticas deben ser usadas de acuerdo con la evidencia que estas presentan.
Neuroestimulación eléctrica transcutánea. La neuroestimulación eléctrica transcutánea (TENS) es una técnica analgésica simple y no invasiva, que se emplea para el manejo del dolor agudo y crónico de origen no maligno. Es una de las formas de electroterapia utilizadas más frecuentemente para aliviar el dolor y que está disponible en todo el mundo. Posee pocos efectos secundarios y no presenta interacciones con medicamentos. No es tóxica y no se puede dar una sobredosis. El aparato de TENS genera corrientes eléctricas pulsadas que se transmiten a través de la piel intacta por medio de electrodos. La manera convencional de usar el TENS es utilizar parámetros eléctricos que activan de manera selectiva las aferencias de gran diámetro, transmisoras de impulsos no dolorosos, sin activar las fibras nociceptivas de pequeño diámetro. La evidencia sugiere que el TENS convencional produce una disminución del dolor, como cuando se frota una parte del cuerpo después de haberse golpeado.
Se ha propuesto que la estimulación eléctrica puede controlar el dolor mediante la estimulación de la producción y liberación de endorfinas y encefalinas. Estas sustancias, conocidas como opiáceos endógenos, actúan de manera similar a la morfina y se sabe que modulan la percepción del dolor. Ellos modulan el dolor por su unión a los receptores opiáceos en el cerebro y otras áreas, en calidad de neurotransmisores y neuromoduladores72
También activan las vías descendentes inhibitorias no opioides (serotonina) del sistema. Se ha demostrado que los niveles de endorfinas y encefalinas se incrementan después de la aplicación de la estimulación eléctrica73. Pero no cualquier corriente, y no cualquiera modulación de esta. La estimulación con corriente pulsante con una frecuencia de menos de diez pulsos por segundo (pps) es la manera más eficaz de aumentar los niveles de endorfinas y encefalinas74. Un estudio reciente encontró que la naloxona, un bloqueador de los receptores MU opiáceos, bloquea la acción analgésica del TENS de baja frecuencia (4 pps), pero no la producida por la TENS de alta frecuencia (100 pps), mientras que naltrindole, un bloqueador de los receptores opioides delta, bloquea sólo la acción analgésica de la TENS de alta frecuencia75.
Se piensa que la estimulación eléctrica puede provocar la producción endógena y la liberación de opiáceos. Esto puede ser causado por la contracción muscular repetitiva o la estimulación nociceptiva repetitiva de las fibras A-delta. Las frecuencias más bajas, de 2 a 10 pps, se suelen utilizar para esta aplicación con el fin de minimizar el riesgo de dolor muscular. Esta aplicación de la estimulación eléctrica se conoce como TENS acupuntura. El TENS acupuntura por lo general controla el dolor durante cuatro a cinco horas después de 20 a 30 minutos de tratamiento. Es eficaz para esta cantidad de tiempo porque la vida media de los opiáceos endógenos liberados es de aproximadamente cuatro horas y media. El TENS de baja frecuencia no debe aplicarse durante más de 30 minutos de una vez, porque la prolongación de la contracción muscular repetitiva producida por el estímulo puede resultar en dolor muscular76,77.
Un estudio realizado por A. Karla y cols., en 2001, tuvo como objetivo demostrar una activación mediada por opiáceos de las vías descendentes inhibidoras de la médula rostral ventral (MRV) en la modulación de la hiperalgesia producida por el TENS de baja (4 Hz) o de alta frecuencia (100 Hz). La conclusión del estudio indicó que la dosis de naloxona y naltrindole utilizados en el estudio bloquea a los receptores µ y σ opioide, respectivamente. Por lo tanto, el TENS de baja frecuencia y el TENS de alta frecuencia producen modulación de la hiperalgesia por la activación de los receptores µ y σ opioide, respectivamente, en la MRV75.
Los parámetros del TENS acupuntura debiesen ser de 5-10 Hz, con un ancho de pulso mayor a 150 microsegundos, en un modo de control descendente, aplicándose no en la zona dolorosa. Este actuará a nivel de las láminas I, II, III, IV-VI, IX y X de Rexed sobre toda la médula espinal78.
Termoterapia
Respecto a la termoterapia estímulos térmicos generales como lo son saunas, zonas húmedas o baños calientes actuarán sobre la región rostral ventromedial bulbar a nivel de las láminas I, II y V de Rexed78,79. Matsushita y cols., en el 200680, estudiaron los beneficios del calor general en pacientes con SFM. Trece pacientes femeninas con SFM (edad media, 45,2 +/-15,5 años de edad, rango, 25-75) que cumplían los criterios del ACR participaron en este estudio. Los pacientes recibieron la terapia de calor general una vez al día durante dos o cinco veces por semana. Los pacientes fueron colocados en la posición supina o sentada, manteniendo una temperatura constante de 60°C durante 15 minutos, y luego fueron trasladados a una sala para mantenerlos a 26-27°C; se cubrieron con una manta del cuello hacia abajo para mantener el calor durante 30 minutos. Las reducciones en el dolor y los síntomas subjetivos se determinaron utilizando la escala visual analógica (EVA) y un cuestionario de impacto de fibromialgia (FIQ). Como resultado, todos los pacientes experimentaron una reducción significativa del dolor a la mitad del EVA inicial, después del primer período de sesiones, y el efecto de la terapia se convirtió en estable, después de diez tratamientos. El dolor y las puntuaciones EVA y FIQ disminuyeron significativamente después de la terapia.
Un reciente estudio (2010), encabezado por Shuji Matsumoto, indicó la eficacia del tratamiento con sauna en el SFM, mejorando los síntomas y la calidad de vida. Se utilizaron los criterios de inclusión según ACR, la EVA, el cuestionario de impacto FIQ y el cuestionario corto SF-36.
Todos los pacientes reportaron una reducción significativa del dolor y los síntomas de 31% a 77% después del programa de terapia térmica de 12 semanas, que se mantuvo relativamente estable (28 a 68%) durante los seis meses de período de seguimiento, es decir, la terapia mejoró tanto en el corto plazo como en el largo plazo y las puntuaciones EVA, FIQ y SF-3681.
Ejercicio físico
Respecto al ejercicio para el tratamiento del SFM una Revisión Sistemática de la Fundación Cochrane publicada en el 2008 tuvo como objetivo primario evaluar los efectos del entrenamiento con ejercicios, incluidos los ejercicios cardiorrespiratorios (aeróbicos), los de fortalecimiento muscular y de flexibilidad sobre el bienestar general, sobre signos y síntomas seleccionados, y la función física en las personas con SFM. Este concluyó que el entrenamiento supervisado con ejercicios aeróbicos tiene efectos beneficiosos sobre la capacidad física y los síntomas del SFM. El entrenamiento de resistencia también puede presentar beneficios sobre algunos síntomas del SFM82.
C. Tratamiento psicoterapéutico
A cargo de un psicólogo clínico competente para estos casos, el cual estará a cargo del tratamiento psico-causal del SFM en donde la psicoterapia deberá ser encausada a controlar y regular el mal manejo del estrés del paciente.
Un reciente estudio publicado por el colegio oficial de psicólogos de Madrid acerca del Tratamiento Cognitivo-Conductual, Protocolizado y en Grupo, de la Fibromialgia tuvo por objetivo comprobar si un programa protocolizado de tratamiento cognitivo conductual, diseñado específicamente para ser aplicado en formato grupal a pacientes con el SFM, puede ayudar a mitigar los problemas emocionales y mejorar el afrontamiento de la enfermedad.
Ellos concluyeron que este programa de tratamiento protocolizado y en grupo ha demostrado ser eficaz para mitigar los problemas emocionales asociados al SFM, disminuyendo los pensamientos rumiativos y mejorando su percepción de autoeficacia en el afrontamiento de su enfermedad. Finalmente se destacó la conveniencia de realizar sesiones de seguimiento-mantenimiento para consolidar los resultados obtenidos83.
Conclusión
El SFM se define como un síndrome crónico común, caracterizado por dolor muscular difuso, fatiga y puntos sensibles. En el año 1990 el ACR instauró como únicos elementos diagnósticos "la presencia de dolor difuso de más de tres meses de evolución y sensibilidad al dolor aumentada a la palpación digital en al menos 11 de 18 localizaciones anatómicas propuestas". Dichos puntos se denominan "Puntos sensibles" o "Tender Points".
La etiología sigue siendo desconocida, aunque probablemente se trata de un proceso multifactorial, donde encontramos interactuando componentes biológicos, psicológicos y sociales causan dolor generalizado, con alodinia/hiperalgesia generalizadas.
Estas señales de dolor en la periferia alcanzan (en la corteza) ambas áreas somatosensoriales, donde se perciben la localización del dolor, su duración y su intensidad, y otras áreas, por ejemplo, estructuras límbicas, donde las respuestas emocionales al dolor se perciben y se interpretan.
Para obtener un tratamiento realmente efectivo, se debe pensar en una evaluación y tratamiento multidisciplinar.
Hasta la fecha, existen tres medicamentos que han sido aprobados por la FDA para el tratamiento de los síntomas del SFM. Ellos incluyen el fármaco antiepiléptico pregabalina y dos inhibidores de la recaptación de serotoninanorepinefrina (IRSN), duloxetina y milnaciprán.
El tratamiento psicológico deberá ser encausado a controlar y regular el mal manejo del estrés del paciente.
El tratamiento fisioterapéutico debe ser efectuado con electroterapia, termoterapia y ejercicio físico.
La aplicación de electroterapia se debe manejar mediante TENS tipo acupuntura con parámetros de 5-10 Hz, con un ancho de pulso mayor a 150 microsegundos, en un modo de control descendente, no aplicándose en la zona dolorosa.
Respecto a la termoterapia, se deben aplicar estímulos térmicos generales como lo son saunas, zonas húmedas o baños calientes, las cuales actuarán sobre la región rostral ventromedial bulbar a nivel de las láminas I, II y V de Rexed. También el entrenamiento supervisado con ejercicios aeróbicos tiene efectos beneficiosos sobre la capacidad física y los síntomas. E l entrenamiento de resistencia también puede presentar beneficios sobre algunos síntomas, pero se necesitan más estudios sobre el fortalecimiento y la flexibilidad muscular y sobre el beneficio del ejercicio a largo plazo para este síndrome.
Declaración de conflicto de intereses
Los autores declaran no tener ningún conflicto de intereses.
Fuente de financiación
Los autores declaran no tener ninguna fuente de financiación.
Referencias
1. Goldenberg DL. Fibromyalgia syndrome: an emerging but controversial condition. JAMA 1997;257:2782-2787. [ Links ]
2. Villanueva VL, Valía JC, Cerdá G, Monsalve V, Bayona MJ, de Andrés J. Fibromyalgia: diagnosis and treatment. Current knowledge. Rev Soc Esp Dolor 2004;11:430-443. [ Links ]
3. Wolfe F, Smythe HA, Yunus MB, Bennett RM, Bombardier C, Goldenberg DL, Tugwell P, et al. Criteria for the classification of fibromyalgia: report of the Multicenter Criteria Committee. Arthritis Rheum 1990;33:160-172. [ Links ]
4. Inanici F, Özdemir O, Aydo T, Sendil A, Kutsal Y, Hasçelik Z. The frequency of fibromyalgia in sport professionals. Rheumatol Intern 2010;1567-1572. [ Links ]
5. Ferran J. Revista informativa Institut Ferran de Reumatologia. Texto elaborado por la asociación británica Action for M.E 2008;2-16. [ Links ]
6. Tastekin N, Uzunca K, Sut N, Birtane M. Discriminative Value of Tender Points in Fibromyalgia Syndrome. Pain medicine 2010;11:466-471. [ Links ]
7. Vargas A, Vargas A, Hernandez-Paz R, Sanchez-Huerta JM, Romero-Ramirez R, mezcua-Guerra L, et al. Sphygmomanometry-evoked allodynia-a simple bedside test indicative of fibromyalgia: a multicenter developmental study. J Clin Rheumatol 2006; 12(6):272-274. [ Links ]
8. Goldenberg DL. Fibromyalgia. En: Klippel JH, Dieppe PA, eds. Rheumatology. St. Louis: Mosby 1994;5:16.1-16.12. [ Links ]
9. Simms RW. Is there muscle pathology in fibromyalgia syndrome? Rheum Dis Clin North Am 1996;22:245-266. [ Links ]
10. Pillemer SR, Bradley LA, Crofford LJ, Moldofsky H, Chrousos GP. The neuroscience and endocrinology of fibromyalgia. Arthritis Rheum 1997;40:1928-1939. [ Links ]
11. Sheon RP, Moskowitz RW, Goldberg VM. Fibromyalgia and other generalized soft tissue rheumatic disorders. Soft tissue rheumatic pain: recognition, management, prevention. 3a ed. Baltimore: Williams & Wilkins 1996;275-01. [ Links ]
12. Sörensen J, Bengtsson A, Ahlner J, Henriksson KG, Ekselius L, Bengtsson M. Fibromyalgia. Are there different mechanisms in the processing of pain? A double blind crossover comparison of analgesic drugs. J Rheumatol 1997;24:1615-1621. [ Links ]
13. Mountz JM, Bradley LA, Modell JG. Fibromyalgia in women: abnormalities of regional cerebral blood flow in thalamus and the caudate nucleus are associated with low pain threshold levels. Arthritis Rheum 1995;38(7):926-938. [ Links ]
14. Russell IJ, Vaeroy H, Nyberg F. Cerebrospinal fluid biogenic amine metabolites in fibromyalgia/fibrositis syndrome and rheumatoid arthritis. Arthritis Rheum 1992;35:550-556. [ Links ]
15. Ablin JN, BarShira A, Yaron M, Orr-Urtreger A. Candidate-gene approach in fibromyalgia syndrome: association analysis of the genes encoding substance P receptor, dopamine transporter and alpha1antitrypsin. Clin Exp Rheumatol 2009;27:33-38. [ Links ]
16. Graven-Nielsen T, Aspegren S, Henriksson KG, Bengtsson M, Sopensen J, Johnson A, et al. Ketamine reduces muscle pain, temporal summation, and referred pain in fibromyalgia patients. Pain 1989;39:171-180. [ Links ]
17. Yasser E, Yasser R, Fatma Z. Hippocampus Dysfunction May Explain Symptoms of Fibromyalgia Syndrome. A Study with Single-Voxel Magnetic Resonance Spectroscopy. J Rheumatol 2008;35:1371-1377. [ Links ]
18. Staud R, Vierck C, Robinson M, Price D. Effects of the N-methyl D-aspartate receptor antagonist dextromethorphan on temporal summation of pain are similar in fibromyalgia patients and normal control subjects. Pain 2005;6:323-332. [ Links ]
19. Mhalla A, Ciampi de Andrade D. Alteration of cortical excitability in patients with fibromyalgia. International Association for the Study of Pain 2010;149:495-500. [ Links ]
20. Vierck Jr. CJ. Mechanisms underlying development of spatially distributed chronic pain (fibromyalgia). Pain 2006;124:242-263. [ Links ]
21. Graven-Nielsen T, Jansson Y, Segerdahl M, Kristensen JD, Mense S, Arendt-Nielsen L, Sollevi A. Experimental pain by ischaemic contractions compared with pain by intramuscular infusions of adenosine and hypertonic saline. European Journal of Pain 2003;7:93-102. [ Links ]
22. Jones A. The role of the cerebral cortex in pain perception. In Justins Douglas M. Refresher Course Syllabus. An updated review Pain 2005;59-68. [ Links ]
23. Suzuki R, Rahman W, Hunt S, Dickenson A. Descending facilitatory control of mechanically evoked responses is enhanced in deep dorsal horn neurones following peripheral nerve injury. Brain Research 2004;1019(3):68-76. [ Links ]
24. Woolf CJ & Salter MW. Plasticity and pain;role of the dorsal horn. In McMahon SB & Koltzenburg M. Text book of pain. Elsevier Churchill Livingstone 2006;91-105. [ Links ]
25. Bendtsen L, Norregaard J, Jensen R, Olesen J. Evidence of qualitatively altered nociception in patients with fibromyalgia. Arthritis and Rheumatism 1997;40:98-102. [ Links ]
26. Henriksson KG. Fibromyalgia from syndrome to disease. Overview of pathogenetic mechanisms. Journal of Rehabilitation Medicine 2003;41:89-94. [ Links ]
27. Graven-Nielsen T, Aspegren S, Henriksson K, Bengtsson M, Sörensen J, Johnson A, Gerdle B, Arendt-Nielsen L. Ketamine reduces muscle pain, temporal summation, and referred pain in fibromyalgia patients. Pain 2000;85:483-491. [ Links ]
28. Mense S. Referral of muscle pain. New aspects ASP Journal 1994;3:1-9. [ Links ]
29. Ren K, Dubner R. Descending modulation in persistent pain. An update. Pain 2002;1-6. [ Links ]
30. Kosek K, Ekholm J, Hansson P. Modulation of pressure pain thresholds during and following isometeric contraction in patients with fibromyalgia and in healthy controls. Pain 1996;64:415-23. [ Links ]
31. Staud R, Robinson ME & Price DD. Isometric exercise has opposite effects on central pain mechanisms in fibromyalgia patients compared to normal controls. Pain 2005;118:176-184. [ Links ]
32. Suzuki R, Rygh LJ, Dickenson AH. Bad news from the brain. Descending 5-HT pathways that control spinal pain processing. Trends in Pharmacological Sciences 2004;25(12):613-617. [ Links ]
33. Bennett R. Fibromyalgia: Present to future. Current Pain and Headache Reports 2004;8:379-384. [ Links ]
34. Clauw DJ, Crofford LJ. Chronic widespread pain and fibromyalgia: what we know, and what we need to know. Best Practice & Research Clinical Rheumatology 2003;17(84):685-701. [ Links ]
35. Gelman SM, Lera S, Caballero F, López MJ. Tratamiento multidisciplinario de la Fibromialgia. Estudio piloto prospectivo controlado. Rev Esp Reumat 2002;29:323-329. [ Links ]
36. López M, Mingote J. Fibromialgia. Clínica y Salud 2008;19(3):343-358. [ Links ]
37. Collado A, Alijotas J, Benito P, Alegre C, Romera M, Sanudo I, et al. Documento de consenso sobre el diagnóstico y tratamiento de la fibromialgia en Cataluña. Med Clin 2002;118:745-749. [ Links ]
38. Rivera J, Alegre-De Miguel C, Ballina J, Carbonell J, Carmona L, Castel B, et al. Documento de consenso de la Sociedad Española de Reumatología sobre la fibromialgia. Reumatol Clin 2006;2:38-49. [ Links ]
39. Carville SF, Arendt-Nielsen S, Bliddal H, Blotman F, Branco JC, Buskila D, et al. EULAR evidence based recommendations for the management of fibromyalgia syndrome. Ann Rheum Dis 2008;67:536-541. [ Links ]
40. Goldenberg DL, Burckhardt C, Crofford L. Management of fibromyalgia syndrome. JAMA 2004; 292:2388-2395. [ Links ]
41. Collins L, Moore A, McQuay & Wiffen P. Antidepressants and anticonvulsants for diabetic neuropathy and postherpetic neuralgia: a quantitative systematic review. J Pain Symptom Manage 2000; 20:449-458. [ Links ]
42. Crofford LJ, Mease PJ, Simpson SL, Young JP Jr, Martin SA, Haig GM, Sharma U. F ibromyalgia relapse evaluation and efficacy for durability of meaningful relief (FREEDOM): a 6-months, doubleblind, placebo-controlled trial with pregabalin. Pain 2008;136:419-431. [ Links ]
43. Häuser W, Bernardy K, Uçeyler N, Sommer C. Treatment of fibromyalgia syndrome with gabapentin and pregabalin: a meta-analysis of randomized controlled trials. Pain 2009;145(1-2):69-81. [ Links ]
44. Arnold LM, Goldenberg DL, Stanford SB, et al. Gabapentin in the treatment of fibromyalgia: a randomized, double-blind, placebo-controlled, multicenter trial. Arthritis Rheum 2007;56 (4):1336-1344. [ Links ]
45. Kosek K, Ekholm J & Hansson P. Modulation of pressure pain thresholds during and following isometeric contraction in patients with fibromyalgia and in healthy controls. Pain 1996;64:415-423. [ Links ]
46. Staud R, Robinson ME & Price DD. Isometric exercise has opposite effects on central pain mechanisms in fibromyalgia patients compared to normal controls. Pain 2005;118:176-184. [ Links ]
47. Zijlstra TR, Barendregt PJ, van de Laar MA. Venlafaxine in fibromyalgia: results of a randomized, placebocontrolled, double-blind trial. Arthritis Rheum 2002;46:S105. [ Links ]
48. Arnold LM, Rosen A, Pritchett YL, D'Souza DN, Goldstein DJ, Iyengar S, et al. A randomized, doubleblind, placebo-controlled trial of duloxetine in the treatment of women with fibromyalgia with or without major depressive disorder. Pain 2005;119:5-15. [ Links ]
49. Arnold L, Pritchett Y, D'Souza D, Kajdasz D, Iyengar S, Wernicke J. Duloxetine for the treatment of fibromyalgia in women: pooled results from two randomized, placebo-controlled clinical trials. J Womens Health (Larchmt) 2007;16(8):1145-1156. [ Links ]
50. Mease PJ, Clauw DJ, Gendreau RM, Rao SG, Kranzler J, Chen W, et al. The efficacy and safety of milnacipran for treatment of fibromyalgia. A randomized, double-blind, placebo-controlled trial. J Rheumatol 2009;36:398-09. [ Links ]
51. Patkar A, Masand S, Krulewicz S, Mannelli P, Peindl K, Beebe L, et al. A randomized controlled, trial of controlled release paroxetine in fibromyalgia. Am J Med 2007;120:448-454. [ Links ]
52. Russell IJ, Perkins AT, Michalek JE. Sodium oxybate relieves pain and improves function in fibromyalgia syn drome: a randomized, double-blind, placebocontrolled, multicenter clinical trial. Arthritis Rheum 2009;60(1):299-09. [ Links ]
53. Goldenberg DL, Burckhardt C, Crofford L. Management of fibromyalgia syndrome. JAMA 2004; 292:2388-2395. [ Links ]
54. Arnold LM, Keck PE. Antidepressant treatment of fibromyalgia: A meta-analysis and review. Psychosomatics 2000;41:104-113. [ Links ]
55. Goldenberg DL. Update on the treatment of fibromyalgia. Bull Rheum Dis 2004;53(1):1-7. [ Links ]
56. Arnold LM, Keck Jr PE, Welge JA. Antidepressant treatment of fibromyalgia: a meta analysis and review. Psychosomatics 2000;41(2):104-113. [ Links ]
57. O'Malley P, Balden E, Tomkins G, Santoro J, Kroenke K, Jackson JL. Treatment of fibromyalgia with antidepressants A meta-analysis. J Gen Intern Med 2000;15(9):659-666. [ Links ]
58. Anderberg UM, Marteinsdottir I, Von-Knorring L. Citalopram in patients with fibromyalgia: a randomized, double-blind, placebo-controlled study. Eur J Pain 2000;4(1):27-35. [ Links ]
59. Önder Özerbil, Nilsel Okudan, Hakký Gökbe. Comparison of the effects of two antidepressants on exercise performance of the female patients with fibromyalgia. Clin Rheumatol 2006;25(4):495-497. [ Links ]
60. Häuser W, Bernardy K, Uçeyler N, Sommer C. Treatment of fibromyalgia syndrome with antidepressants: a metaanalysis. JAMA 2009;301(2):198-09. [ Links ]
61. Tofferi JK, Jackson JL, O'Malley PG. Treatment of fibromyalgia with cyclobenzaprine: a meta-analysis. Arthritis Rheum 2004;51(1):9-13. [ Links ]
62. Xaio Y, Michalek JE, Russell IJ. Effects of tizanidine on cerebrospinal fluid substance P in patients with fibromyalgia. The Royal Society of Medicine Press, The Trinity Press 2002;23-8. [ Links ]
63. Rossy LA, Buckelew SP, Dorr N, Hagglund KJ, Thayer JF, McIntosh MJ, et al. A meta-analysis of fibromyalgia treatment interventions. Ann Behav Med 1999;21:180-191. [ Links ]
64. Bennett RM, K amin M, K arim R, Rosenthal N. Tramadol and acetaminophen combination tablets in the treatment of fibromyalgia pain: a double-blind, randomized, placebocontrolled study. Am J Med 2003;114(7):537-545. [ Links ]
65. Russell I, Fletcher E, Michalek J, McBroom P, Hester G. Treatment of primary fibrositis/fibromyalgia syndrome with ibuprofen and alprazolam: a doubleblind, placebo controlled study. Arthritis Rheum 1991;34(5):552-560. [ Links ]
66. Fishbain D, Cutler R, Rosomoff H, Rosomoff R. Clonazepam open clinical treatment trial for myofascial syndrome associated chronic pain. Pain Med 2000;1(4):332-339. [ Links ]
67. Viola V, Newnham HH, Simpson RW. Treatment of intractable painful diabetic neuropathy with intravenous lignocaine. J Diabetes Complications 2006;20(1):34-39. [ Links ]
68. Micó JA, Ardid D, Berrocoso E, Eschalier A. Antidepressants and pain. Trends Pharmacol Sci 2006;27(7):348-354. [ Links ]
69. Russell J, Perkins T, Michalek E. Sodium oxybate relieves pain and improves function in fibromyalgia syndrome: A randomized, double-blind, placebocontrolled, multicenter clinical trial. Arthritis Rheum 2009;60:299-09. [ Links ]
70. Moldofsky H, Lue F A, Mously C, Roth-Schechter B & Reynolds W J. The effect of zolpidem in patients with fibromyalgia: A dose ranging, double blind, placebo controlled, modified crossover study. J Rheumatol 1996;23:529-533. [ Links ]
71. Morillas-Arques P, Rodriguez CM. Trazodone for the treatment of fibromyalgia: an open-label, 12-week study. BMC Musculoskeletal Disorders 2010;11:204-210. [ Links ]
72. Pert CB, Snyder SH. Opiate receptor demonstration in nervous tissue. Science 1973;179:1011-1014. [ Links ]
73. Siolund BH, Terenius L, Eriksson M. Increased cerebrospinal fluid levels of endorphins after electroacupunture. Acta Physiol Scand 1977;100:382-384. [ Links ]
74. Mannheimer J, Lampe G. Clinical Transcutaneous Electrical Nerve Stimulation, Philadelphia. Davis 1984;331-345. [ Links ]
75. Kalra A, Urban MO, Sluka KA. Blockade of opioid receptors in rostral ventral medulla prevents antihyperalgesia produced by transcutaneous electrical nerve stimulation (TENS). J Pharmacol Exp Ther 2001; 298(1):257-263. [ Links ]
76. Russell I, Orr M, Littman B, Vipraio G, Alboukrek D, Michalek J, Lopez Y, MacKillip F. Elevated cerebrospinal fluid levels of substance P in patients with the fibromyalgia syndrome. Anhritis Rheum 1994;37(11): 1593-1601. [ Links ]
77. Vaerøy H, Helle R, Førre O, Kåss E, Terenius L. Elevated CSF levels of substance P and high incidence of Raynaud phenomenon in patients with fibromyalgia: new features for diagnosis. Pain 1988; 32(1):21-26. [ Links ]
78. Cameron M. Physical Agents in Rehabilitation: From Research to Practice (2nd ed). Philadelphia: Saunders, 2003. [ Links ]
79. Johannesson U, de Boussard CN, Brodda G, BohmStarke N. Evidence of diffuse noxious inhibitory controls (DNIC) elicited by cold noxious stimulation in patients with provoked vestibulodynia. Pain 2007;130(1-2):31-39. [ Links ]
80. Matsushita K, Masuda A, Tei C. Efficacy of Waon therapy for fibromyalgia. Intern Med 2008; 47(16):1473-1476. [ Links ]
81. Matsumoto S, Shimodozono M, Etoh S, Miyata R, Kawahira K. Effects of thermal therapy combining sauna therapy and underwater exercise in patients with fibromyalgia. Complementary Therapies in Clinical Practice 2010;10:1-5. [ Links ]
82.Busch AJ, Barber KAR, Overend TJ, Peloso PMJ, Schachter CL. Ejercicio para el tratamiento del síndrome de fibromialgia (Revisión Cochrane traducida). En: La Biblioteca Cochrane Plus, 2008 Número 2. Oxford: Update Software Ltd. Disponible en: http://www.update-software.com. (Traducida de The Cochrane Library, 2008 lssue 2. Chichester,UK: John Wiley & Sons, Ltd.). [ Links ]
83.Comeche M, Martín A . Tratamiento cognitivo-conductual, protocolizado y en grupo, de la fibromialgia. Clínica y salud 2010;21(2):107-110. [ Links ]














