Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista Colombiana de Reumatología
Print version ISSN 0121-8123
Rev.Colomb.Reumatol. vol.18 no.1 Bogotá Jan./Mar. 2011
ARTÍCULO DE REVISIÓN
2Docente Facultad de Medicina. Escuela de Ciencias de la Salud. Universidad Pontificia Bolivariana. Medellín, Colombia.
3Residente de Oftalmología. Universidad Pontificia Bolivariana. Medellín, Colombia.
4Oftalmóloga Retinóloga, Facultad de Medicina, Universidad Pontificia Bolivariana. Clínica Universitaria Bolivariana. Medellín, Colombia.
5Oftalmóloga Especialista en Uveítis. Clínica Oftalmológica de San Diego. Medellín, Colombia.
6Reumatóloga pediatra. Unidad de Reumatología y Enfermedades Autoinmunes, Clínica Universitaria Bolivariana. Medellín, Colombia.
Correspondencia: Carlos Jaime Velásquez Franco: carjaivel@hotmail.com
Nombre y dirección de la institución o instituciones en las cuales se realizó el trabajo: Clínica Universitaria Bolivariana. Carrera 72 A núm. 78 B 50. Medellín, Colombia. El trabajo no fue soportado por alguna beca o por fondos de la industria farmacéutica.
Los autores declaran no presentar ningún conflicto de interés al momento de la redacción del manuscrito.
Recibido: 22 de diciembre de 2010. Aceptado: 20 de febrero de 2011
Resumen
La uveítis es responsable de la pérdida visual hasta del 10% de la población mundial y es la segunda causa de ceguera tratable en personas de edad productiva, después de la retinopatía diabética. El tratamiento de la uveítis no infecciosa depende de su severidad; existe un alto porcentaje (hasta el 40%) de casos refractarios a inmunosupresores y esteroides a dosis altas. El factor de necrosis tumoral (TNF) es una citoquina fundamental en la patogénesis de la uveítis no infecciosa; su bloqueo selectivo con anticuerpos monoclonales y proteínas de fusión ha demostrado, en series de casos, estudios abiertos y pequeños estudios clínicos aleatorizados, eficacia y seguridad en casos idiopáticos y asociados a enfermedades autoinmunes, en la prevención de recaídas, ahorro de esteroides y pronóstico visual a largo plazo. Sin embargo, se han descrito efectos paradójicos, como la inducción de uveítis asociada al uso de proteínas de fusión contra TNF, como etanercept. Se pretende hacer una revisión exhaustiva de la literatura para determinar el papel de los agentes anti-TNF en el tratamiento de la uveítis no infecciosa refractaria.
Palabras clave: uveítis, infliximab, adalimumab, proteína de fusión TNFR-Fc.
Summary
Uveitis is responsible for visual loss of up to 10% of world population and is the second leading cause of treatable blindness in people of working age, after diabetic retinopathy. The treatment of noninfectious uveitis depends on its severity; there is a high percentage (up to 40%) of cases refractory to immunosuppressants and high-dose corticosteroids. Tumor necrosis factor (TNF) is a key cytokine in the pathogenesis of noninfectious uveitis. Several case reports, open trials and small randomized controlled trials with selective blocking of TNF with monoclonal antibodies (infliximab and adalimumab) and fusion proteins (etanercept) have shown efficacy in the treatment of refractory uveitis, in idiopathic and associated with autoimmune diseases, in preventing relapses, steroid-sparing effect and improvement of long-term visual prognosis. However, there are some reports of paradoxical effects, such as induction of uveitis associated with the use of etanercept. We performed a thorough review of the literature to determine the role of anti-TNF agents in the treatment of refractory non-infectious uveitis.
Key words: Uveitis, infliximab, adalimumab, TNFR-Fc fusion protein.
Definición
La uveítis se define como la inflamación intraocular que compromete estructuras como iris, cuerpo ciliar y coroides, las cuales conforman el tracto uveal, de donde se deriva su clasificación anatómica como: anterior, intermedia o posterior. Obedece a diversas causas, como: infección, malignidad, trauma, toxicidad y, con mayor frecuencia, es idiopática o secundaria a enfermedades autoinmunes1.
Epidemiología
La incidencia de la enfermedad es de 52,4 por 100.000 por año y la prevalencia de 115,3 por 100.000; es causa de pérdida visual en 2,8% a 10% de la población mundial1,2. La edad más frecuente de presentación es entre 20 y 50 años1. Es la segunda causa de ceguera tratable en pacientes en edad productiva, luego de la retinopatía diabética1.
Clasificación
La uveítis se asocia, comúnmente, a enfermedades sistémicas inflamatorias, como: espondiloartritis, artritis idiopática juvenil (AIJ), enfermedad de Crohn, sarcoidosis y enfermedad de Behççet, entre otras. Compromete estructuras como iris, cuerpo ciliar y coroides, las cuales conforman el tracto uveal, de donde se deriva su clasificación anatómica, como: anterior, intermedia, posterior y panuveítis2. (Tabla 1)3.
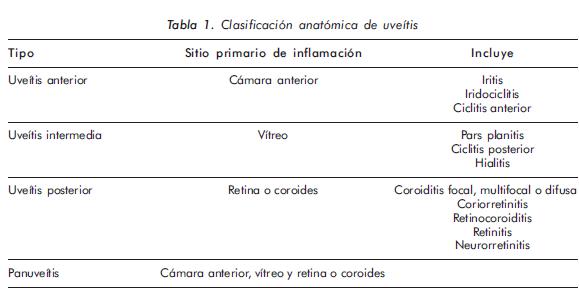
La uveítis anterior es la presentación clínica más común en la práctica oftalmológica y corresponde aproximadamente al 90% de los casos4,5.
Los términos agudo y crónico han sido utilizados indiscriminadamente en la literatura para definir el inicio, curso y duración del episodio de uveítis; sin embargo, se ha definido que éstos deberían ser reservados para la descripción del curso clínico y no para describir el inicio y la duración, como se muestra en la Tabla 2.
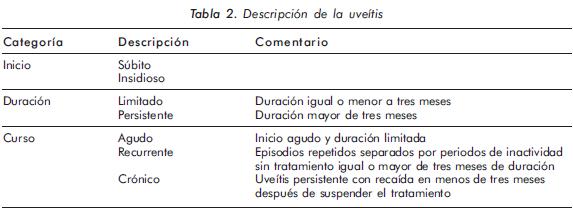
Con respecto a la terminología que hace referencia a la actividad de la enfermedad, se clasifica como: inactiva (celularidad ausente en la cámara anterior), empeoramiento (incremento de dos grados en el nivel de inflamación o el aumento de celularidad de grado 3+ a 4+), mejoría (disminución de dos grados en el nivel de inflamación o disminución a grado 0+) y remisión (inactividad de la enfermedad por un periodo mayor de tres meses después de haberse suspendido el tratamiento).
Al existir cierto grado de subjetividad en la clasificación de celularidad y flare (turbidez en cámara anterior que corresponde a presencia de proteínas), en el SUN (Standarization of Uveitis Nomenclature Working Group) se propone el siguiente esquema para unificar conceptos (Tablas 3 y 4).
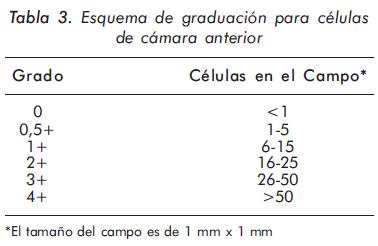
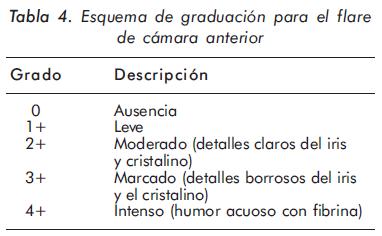
Papel de las citoquinas en la patogénesis de la uveítis
Durante los últimos veinte años varios estudios se han dirigido a evaluar el papel de las citoquinas en el desarrollo de la uveítis. La interleuquina 1 (IL-1) ha sido identificada como partícipe en la ruptura de la barrera hematoretiniana y como potenciador del proceso inflamatorio.
El factor de necrosis tumoral (TNF) es una citoquina pleiotrópica sintetizada principalmente por monocitos, macrófagos y linfocitos T y, en menor cantidad, por neutrófilos y mastocitos, en respuesta a infección o alteración inmunológica. El TNF promueve la inflamación por citotoxicidad directa y por mecanismos indirectos como: producción de citoquinas proinflamatorias, mediadores del ácido araquidónico, metaloproteinasas, quimoquinas, moléculas de adhesión y factores de angiogénesis. Una alteración en la regulación de la producción de TNF en el sitio de daño inmunológico llevará a la activación de células inmunes innatas y a la respuesta inflamatoria crónica, conduciendo a daño tisular. La neutralización de la actividad del TNF lleva a desactivación de la cascada de citoquinas proinflamatorias, disminuyendo el reclutamiento de células al sitio de inflamación, disminución de la angiogénesis mediada por el factor de crecimiento vascular endotelial (VEGF) y alteraciones en las quimoquinas, proteínas de fase aguda y permeabilidad vascular6. La evidencia ha demostrado que hay aumento en los niveles de TNF en los líquidos oculares de los pacientes con uveítis7.
También se ha demostrado que los niveles séricos de TNF se correlacionan con la actividad de la uveítis8. Se ha comprobado en modelos múridos de uveítis no infecciosa que TNF activa a los macrófagos a través del receptor p55, que son las células que, finalmente, generan el daño tisular.
Evidencia de la eficacia de los antagonistas del TNF en el tratamiento de la uveítis y enfermedades asociadas
Si bien la aplicación de esteroides en forma tópica puede ser benéfica en pacientes con enfermedad leve, las formas severas de la enfermedad frecuentemente requieren esteroides sistémicos con o sin drogas inmunosupresoras como metotrexate, ciclosporina A o ciclofosfamida1; es decir, el tratamiento de la uveítis crónica o recurrente, por su gravedad, requiere un abordaje similar al utilizado para el control de la inflamación sistémica; es decir, inmunosupresión agresiva. Este régimen debe ir dirigido, idealmente, a controlar los pasos claves en el proceso inflamatorio, controlándolo de manera eficiente y evitando efectos adversos. Sin embargo, hasta el 30% de los pacientes son refractarios a estos regímenes inmunosupresores y cerca del 40% de los pacientes pueden experimentar una recaída durante el curso de la enfermedad, presentando daño ocular irreversible. A finales de los años noventa se introdujeron los antagonistas del TNF en el tratamiento de la artritis reumatoide (AR) y de la enfermedad de Crohn (EC). Estos medicamentos incluyen los anticuerpos monoclonales anti-TNF: Infliximab (quimérico) y Adalimumab (humanizado) y el receptor soluble de TNF: Etanercept6. Ninguno de los inhibidores del TNF ha sido aprobado para el uso en uveítis por la FDA, excepto en Japón, donde las agencias reguladoras tienen aprobado el uso de infliximab para el tratamiento de la uveítis refractaria9.
A continuación se describirá cada agente antiTNF específico y su evidencia en el tratamiento de la uveítis.
Infliximab
Infliximab es un anticuerpo quimérico que actúa directamente contra TNF. Se aplica de forma intravenosa 5 a 10 mg/kg cada seis a ocho semanas. El uso de infliximab ha sido asociado a efectos adversos, como reactivación de tuberculosis, reacción de hipersensibilidad aguda a la infusión, infecciones del tracto respiratorio, infecciones urinarias y, rara vez, neumonía, celulitis y sepsis10.
Evidencia en uveítis refractaria
La Tabla 5 resume los estudios que han evaluado infliximab en uveítis refractaria.
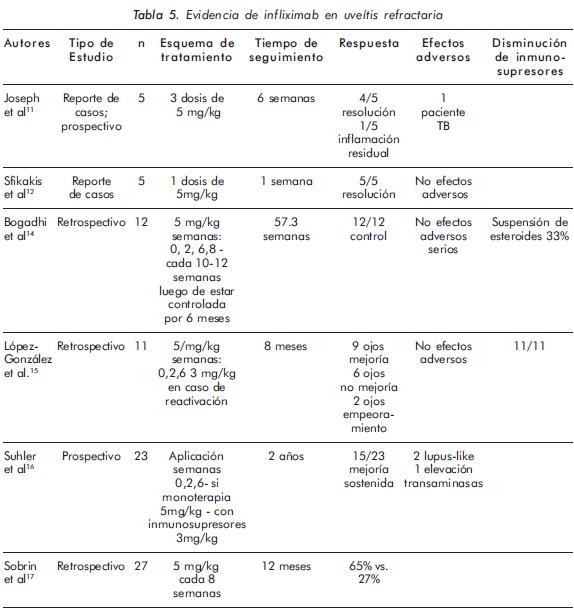
En general, los estudios son reportes de casos y estudios retrospectivos, pero todos coinciden en la mejoría sostenida de los signos inflamatorios, la mejoría de la agudeza visual, la poca frecuencia de efectos adversos y la disminución en los esteroides y en la dosis de varios inmunosupresores.
Evidencia en espondiloartritis Braun y colaboradores18 analizaron pacientes con espondilitis anquilosante (EA); en esta enfermedad, la principal manifestación extraarticular es la uveítis (prevalencia estimada entre el 30% y el 40%). Encontraron 717 pacientes, pero tenían datos completos del seguimiento en 397 pacientes. Noventa de ellos recibieron infliximab y el resto etanercept. La incidencia de exacerbaciones de uveítis anterior en el grupo placebo fue 15,6 por 100 pacientes/año, significativamente mayor que los pacientes que recibieron anti-TNF (6,8 por 100 pacientes/año). El efecto fue mayor con infliximab, aunque no fue estadísticamente significativo comparado con etanercept. No se encontró correlación entre la actividad articular y la recaída de enfermedad ocular.
Guignard y colaboradores19 condujeron un análisis retrospectivo de 46 pacientes con espondiloartritis. El seguimiento promedio fue de 15,2 años. El número de exacerbaciones de uveítis por 100 pacientes/año fue menor con anti-TNF (adalimumab e infliximab) comparados con placebo: 51,8 vs. 21,4 (p = 0,03); RR = 2,4; NNT = 3. Los receptores solubles (etanercept) no disminuyeron el número de exacerbaciones. Aunque no hay estudios específicos, la razón de la diferencia de la eficacia entre los anticuerpos monoclonales y los receptores solubles parece ser que los anticuerpos monoclonales inducen
apoptosis de los linfocitos T al inhibir el receptor transmembrana de anti-TNF, efecto que no ejerce el etanercept. La apoptosis es un fenómeno básico en lo que se ha denominado el "privilegio" inmunológico del sistema ocular.
Lim y colaboradores20 analizaron dos grandes bases de datos norteamericanas y encontraron que se presentaron 14 casos de uveítis asociadas a infliximab, comparados con 43 asociados a etanercept, con diferencias estadísticamente significativas. Se excluyeron del análisis los pacientes con enfermedades sistémicas que podrían causar uveítis.
Evidencia en enfermedad de Behçet
Tugal-Tutkun y colaboradores21 describen pacientes con enfermedad de Behçet (EB), ya que presentan, entre otras manifestaciones oculares, panuveítis no granulomatosa que se manifiesta en forma de ataques recurrentes y explosivos, seguidos por remisiones espontáneas. En este estudio abierto se utilizó infliximab en pacientes con EB cuya uveítis era refractaria a terapia combinada con esteroides, azatioprina (AZT) y ciclosporina A (CsA). Se incluyeron trece pacientes. El 30,8% de los pacientes estuvieron libres de ataques de uveítis. El 78,3% de las recaídas ocurrieron luego del período de infusión (catorce semanas) y cuando se aplicaba infliximab cada ocho semanas. Se logró reducir, de manera significativa, la dosis diaria de esteroides. Si se suspendía el tratamiento aumentaban las recaídas (sólo un paciente obtuvo remisión sostenida a las 54 semanas).
Niccoli y colaboradores22 condujeron un estudio abierto, multicéntrico, con seguimiento a 24 meses, prospectivo, de infusiones de infliximab durante un año en 12 pacientes consecutivos con EB y uveítis posterior bilateral refractaria. El 75% de los pacientes alcanzaron remisión completa sin recaídas. Todos los pacientes alcanzaron remisión completa luego de cuatro infusiones. A la semana 22 todos los pacientes lograron suspender corticosteroides. A los 24 meses, el 78% de los pacientes continuaban en remisión. Se presentó mejoría significativa de la agudeza visual. La frecuencia de ataques pasó de 40 en el año previo al infliximab a cinco luego de terminar este medicamento (p<0,001). No se presentaron efectos adversos.
Alokaily et al.23 reportan dos pacientes con EB con uveítis refractaria a dosis altas de esteroides orales, que mejoraron los índices de inflamación intraocular al iniciar infliximab.
Evidencia en enfermedad de VogtKokanagi-Harada (VKH)
La enfermedad de Vogt-Koyanagi-Harada (VKH) es una condición inflamatoria que compromete los ojos (uveítis bilateral y desprendimiento de la retina), estructuras cutáneas (caída del cabello y despigmentación de la piel) y sistema nervioso central (cambios en la audición y meningismo); sin embargo, existen formas de presentación incompletas con afección ocular aislada. Si bien es una condición de etiología no completamente esclarecida, existe evidencia que sugiere la participación del sistema inmune en su aparición.
Niccoli et al.24 reportaron dos pacientes con VKH resistentes a altas dosis de esteroides, azatioprina y ciclosporina. Se les inició infliximab 5 mg/kg con rápida y duradera remisión de los síntomas oculares y sistémicos. Una hipótesis que sustenta la eficacia de infliximab en esta enfermedad es el papel de la leptina, una adipocitoquina que promueve la producción de IL-17 e IFN-α, generándose un efecto inmunomodulador; los anti-TNF aumentan la liberación y producción de leptina.
Wang et al.25 describieron dos casos de VKH refractarios a prednisona a dosis de 1 mg/kg y a diferentes inmunosupresores (ciclosporina, ciclofosfamida y azatioprina). Se inició infliximab a una dosis de 5 mg/kg cada cuatro semanas. A las cuatro semanas, se lograron desmontar esteroides e inmunosupresores. A 11 meses de seguimiento los pacientes continuaban sin evidencia de inflamación intraocular.
Evidencia en uveítis en la infancia
En general, a pesar de que los pacientes con Artritis Idiopática Juvenil (AIJ) son una población con alta susceptibilidad a esta entidad, existen pocos estudios que evalúen el uso de anti-TNF en uveítis refractaria no infecciosa en pediatría. Con relación a infliximab se encontraron algunas series (Tabla 6), con resultados bastante positivos en cuanto a su eficacia, baja frecuencia de efectos adversos serios y posibilidad de disminuir o suspender esteroides e inmunosupresores. Sin embargo, ninguno de estos estudios analizó un número de pacientes considerable, la metodología dista de ser uniforme (en especial la dosis, tiempo y parámetros de seguimiento) y no existen, hasta el momento, estudios aleatorizados, enmascarados y controlados que evalúen el uso de este medicamento en dicha población.
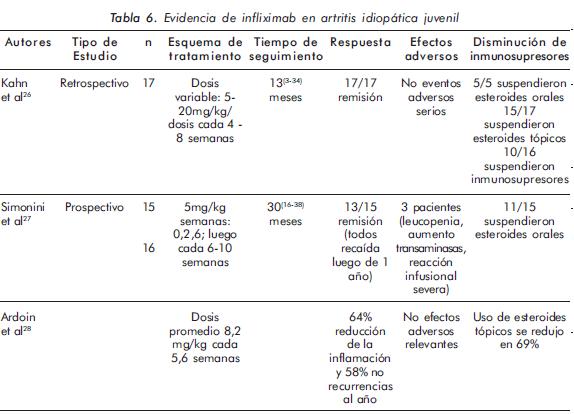
En un interesante estudio, Foeldvari et al.29 analizaron una cohorte transversal de 47 pacientes (81 ojos) con AIJ que utilizaron agentes anti-TNF para uveítis refractaria en 15 centros de reumatología pediátrica a nivel internacional. La duración de la uveítis hasta el comienzo del anti-TNF fue 45,1 meses. Se usó etanercept en 34 casos, infliximab en 25 y adalimumab en tres pacientes. Se observó eficacia del tratamiento con anti-TNF, en general, en dos tercios de los pacientes. El porcentaje de pacientes que no respondieron fue mayor con etanercept (38%) que con infliximab (0%) (p = 0,004); el número de pacientes tratados con adalimumab fue demasiado pequeño para su análisis. Solamente dos (4%) de los pacientes tuvieron que suspender el medicamento por efectos adversos; además, 51% suspendieron el uso de esteroides sistémicos y 32% de esteroides tópicos. Este estudio concluye que, primero, los anti-TNF parecen ser una opción efectiva en esta entidad; segundo, que infliximab parece ser más efectivo que etanercept y, finalmente, los pacientes que no responden a un agente podrían beneficiarse del cambio a otro anti-TNF.
Adalimumab
Es un anticuerpo monoclonal humanizado IgG1 específico dirigido contra TNF, bloqueando su interacción con los receptores de membrana celular p55 y p75; también lisa al TNF expresado en las células in vitro en presencia de complemento y modula la respuesta biológica que es inducida o regulada por TNF, incluyendo cambios en los niveles de moléculas de adhesión responsables de la migración del leucocito (ELAM-1, VCAM-1, ICAM-1). Adalimumab es utilizado en inyección subcutánea de 40 mg con intervalos de dos semanas. Por ser humanizado, presenta menos riesgos de formación de anticuerpos.
Evidencia en enfermedad de Behçet
Mushtaq y colaboradores reportaron su uso en pacientes con panuveítis por enfermedad de Behçet como terapia de mantenimiento luego de inducción de remisión con infliximab y todos permanecieron en remisión30.
Evidencia en uveítis en la infancia
La evidencia del uso de adalimumab, al igual que en los otros anti-TNF, es escasa. De igual forma, los estudios existentes (Tabla 7) muestran, en términos generales, una adecuada eficacia en el control de la uveítis, con escasos eventos adversos serios y contribución a la suspensión de los otros medicamentos en un porcentaje considerable de pacientes. Sin embargo, la ausencia de estudios con un diseño adecuado al propósito no permite realizar afirmaciones contundentes.
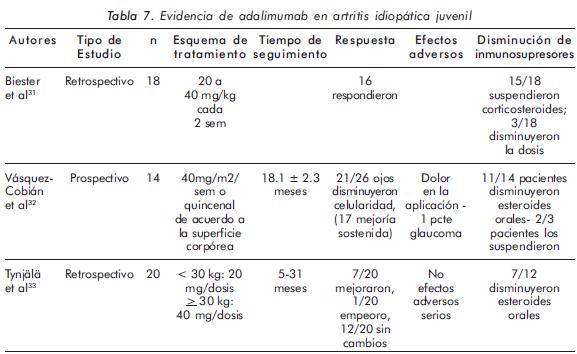
El estudio de Tynjälä y colaboradores33 (Tabla 7) evaluó pacientes con uveítis asociada a AIJ, de los cuales 95% habían recibido manejo con terapia biológica previa con falla (11/11 con etanercept y 13/18 con infliximab), y encontró que, aproximadamente, el 33% de los niños mejoraron. Además se obtuvo una mejor respuesta a menor edad y duración de la enfermedad. Los autores concluyen que, en vista de la no existencia de una terapia óptima para la uveítis refractaria en AIJ, adalimumab podría ser una alternativa.
Evidencia en prevención de recaídas
Guignard y colaboradores19 compararon la eficacia del etanercept, infliximab y adalimumab en la prevención de recaídas de la uveítis asociada a espondiloartritis. El diseño fue retrospectivo. Fueron 55 pacientes; 13 recibieron etanercept, 8 adalimumab y 25 infliximab. El número de recaídas de uveítis antes y luego del inicio de adalimumab fue 60,5 vs. 0 (p = 0,04).
Rudwaleit et al.34 evaluaron el efecto de adalimumab en la frecuencia de recaídas de uveítis anterior aguda en pacientes con espondilitis anquilosante activa; encontraron que éstas se redujeron en 51% en todos los pacientes; 58% en 274 pacientes con historia de uveítis, 68% en 106 pacientes con historia reciente, 50% en pacientes con uveítis sintomática al comienzo y en 45% en 43 pacientes con uveítis crónica. Las recaídas, en todos los subgrupos, fueron leves.
Evidencia en VKH
Díaz-Llopis et al.35 reportan el caso de un hombre de 36 años que presentó pérdida visual aguda (20/200 en ambos ojos), desprendimientos bilaterales exudativos de retina, papilitis y Tyndall vítreo. Inicialmente recibió tratamiento con metilprednisolona (1 gramo IV diario por cuatro días) y posterior dosis de mantenimiento con prednisona y ciclosporina; la inflamación se resolvió y se recuperó la visión completamente en ambos ojos. En los meses siguientes el paciente desarrolló vitiligo y alopecia, y fondo de ojo despigmentado "en sol naciente", lo que confirmó el diagnóstico de VKH completo. Durante el siguiente año, se produjeron frecuentes recidivas de uveítis anterior en ambos ojos al intentar reducir la dosis de prednisona por debajo de 50 mg/día, a pesar de mantener una dosis continua de ciclosporina y asociar frecuentes inyecciones subtenonianas de triamcinolona. Se inició tratamiento con una dosis quincenal de 40 mg de adalimumab durante ocho meses, retirándose progresivamente los corticoides y la ciclosporina sin ninguna recidiva inflamatoria. No se reportaron efectos adversos.
Evidencia en uveítis refractaria
Androudi et al.36 evaluaron la seguridad y eficacia de adalimumab intravítreo en ocho pacientes con uveítis no infecciosa refractaria (especialmente edema macular cistoide como complicación), administrado mensualmente por tres meses. A los seis meses de seguimiento, no hubo diferencias significativas en la agudeza visual corregida. No se presentaron complicaciones.
Díaz-Llopis et al.37 analizaron la eficacia y seguridad de adalimumab en 19 pacientes con uveítis autoinmune refractaria, durante un año. Se logró una mejoría de la agudeza visual en el 31% de los pacientes y el 63% de los casos lograron control de la inflamación intraocular. Se obtuvo resolución completa del edema macular cistoide en el 54,5%; además, se logró una reducción de, al menos, 50% de la dosis de otros inmunosupresores concomitantes. Sin embargo, el 42% tuvieron recaídas durante todo el seguimiento, pero se controlaron con una inyección periocular de esteroide.
Etanercept
Etanercept es una proteína de fusión que contiene un dominio de IgG humana y dos receptores de TNF y se une específicamente a TNF. Es administrado por vía subcutánea en dosis de 25 mg dos veces por semana o 50 mg semanales. El efecto adverso principal de la terapia es la reacción en el sitio de la inyección38.
Evidencia en uveítis en la infancia
El número de investigaciones que evalúan el uso de etanercept, así como el número de pacientes participantes en cada estudio, es limitado (Tabla 8). Además, estos estudios no han mostrado resultados satisfactorios; incluso un ensayo clínico doble ciego, placebo controlado, que incluyó 12 pacientes, realizado por Smith y colaboradores40, no evidenció diferencia entre la administración de placebo o etanercept.
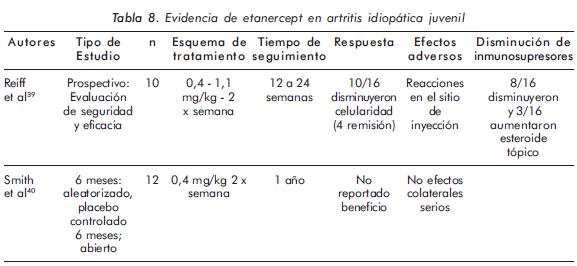
Schmeling et al.41 evaluaron el uso de etanercept en 229 pacientes con AIJ con énfasis en uveítis crónica anterior, tanto nuevos episodios como recaídas. La indicación principal fue enfermedad articular activa. Se encontraron 31 pacientes (13,5%) con historia de uveítis, de los cuales 28 pertenecían a los subgrupos de alto riesgo de enfermedad oligoarticular y seronegativa. Después del inicio de etanercept ocurrieron 29 recaídas en 19 de los 31 pacientes, mientras en dos pacientes ocurrió por primera vez. A pesar de la terapia con etanercept, se presentó uveítis en 12 de 15 pacientes (80%) con más de un episodio previo y en 7 de 16 (44%) con solo un episodio previo.
Evidencia en uveÃtis refractaria en adultos
Smith y col. realizaron un estudio retrospectivo de dieciséis pacientes tratados con inhibidores del TNF (catorce con etanercept y dos con infliximab) por uveítis (nueve pacientes) y escleritis (siete pacientes). Reportaron mejoría en la actividad de la artritis en todos los pacientes. Sin embargo, sólo seis de dieciséis (38%) de los casos con inflamación ocular activa mejoraron después del medicamento. Cinco pacientes desarrollaron el primer episodio de enfermedad ocular mientras recibían la terapia con anti-TNF42. Una de las razones que pretende explicar estos diferentes porcentajes de efectividad es que cada órgano tiene únicas y particulares moléculas de adhesión celular, subtipos de células presentadoras de antígenos, linfocitos y diferentes perfiles de citoquinas en el proceso inflamatorio autoinmune.
Foster y colaboradores realizaron un estudio aleatorizado, placebo controlado, doble ciego, de 20 pacientes con uveítis crónica o recurrente, con inflamación no controlada con metotrexate y que recibieron etanercept. El seguimiento fue de 24 semanas. La resolución del cuadro inflamatorio ocular fue observada en tres de diez pacientes del grupo de tratamiento y cinco de diez en el grupo control. El autor no encontró una diflamación o mejoría visual43.
Evidencia en sarcoidosis
Baughman y colaboradores44 condujeron un estudio aleatorizado, placebo controlado, doble ciego, con etanercept o placebo en dieciocho pacientes con sarcoidosis quienes tenían inflamación ocular activa, por un periodo de seis meses. Tres pacientes en el grupo de tratamiento lograron disminución de la dosis de corticosteroides, pero tres necesitaron un aumento; en el grupo control un solo paciente requirió un aumento de dosis y uno logró disminución. No se demostró una diferencia significativa con el uso de etanercept.
Etanercept: ¿Inductor de uveítis?
Lim y colaboradores20 parten de reportes anecdóticos en pacientes con EA donde etanercept, paradójicamente, es el agente causante de la uveítis. Realizando el análisis de dos grandes bases de datos norteamericanas, encontraron que se presentaron 43 casos de uveítis asociados a etanercept, 14 a infliximab y dos a adalimumab, con diferencias estadísticamente significativas. Además se reportaron cuatro casos de uveítis relacionados con el uso de etanercept que se resolvieron al suspender el medicamento y dos casos adicionales de uveítis recurrentes al reiniciar este receptor soluble. Debe aclararse que se excluyeron del análisis los pacientes con enfermedades sistémicas que podrían causar uveítis.
Saurenmann et al.45 analizaron las historias clínicas de 1109 niños con AIJ entre 1996 y 2003, con uveítis no infecciosa y que estuvieran en tratamiento con un anti-TNF (etanercept o infliximab); una cohorte de este grupo se consideró en mayor riesgo de uveítis: 434 pacientes con AIJ oligoarticular extendida, poliarticular con factor reumatoide negativo y artritis juvenil psoriásica. El grupo control fue constituido por pacientes con AIJ que no habían recibido nunca anti-TNF y donde la uveítis fue previa al uso de estos agentes. De toda la cohorte, 145 pacientes (13,1%) desarrollaron uveítis y 87 pacientes (7,8%) recibieron anti-TNF. 70 pacientes recibieron estos medicamentos sin diagnóstico previo de uveítis. El 68,6% recibió etanercept, 18.6% infliximab y el 12,9% recibieron ambos de manera consecutiva. El seguimiento se hizo, en promedio, durante dos años de terapia. Durante el estudio, dos de los pacientes de la cohorte de alto riesgo presentaron uveítis (4,4%) mientras recibieron anti-TNF y el 2,2% la desarrollaron sin estos medicamentos. En el grupo de alto riesgo, al 13,8% se le diagnosticó uveítis y el 15,7% recibió terapia anti-TNF; además, 45 pacientes recibieron anti-TNF sin uveítis previa. En este subgrupo tampoco se encontró diferencia en el desarrollo de uveítis con estos fármacos (p = 0,49). El resultado principal de este estudio fue que no se encontró diferencia estadísticamente significativa en el desarrollo de uveítis entre los usuarios de anti-TNF, incluso etanercept, y el resto de la cohorte (p = 0,571). Sin embargo, los autores reconocen el bajo poder del estudio para analizar la incidencia de uveítis así como diferencias entre los dos agentes anti-TNF.
Sebastian et al.46 reportaron tres casos de pacientes con uveítis refractaria (enfermedad de Behçet, sarcoidosis y panuveítis idiopática) y se decidió etanercept como primera línea de tratamiento. En todos los casos no se presentó respuesta y todos mejoraron y se logró reducción de la dosis de esteroides orales al cambiar el agente anti-TNF (infliximab en los dos primeros pacientes y adalimumab en el último).
Kakkassery et al.47 siguieron y evaluaron seis pacientes que recibieron etanercept por actividad de sus enfermedades de base (AIJ, espondilitis anquilosante, enfermedad de Still de comienzo en el adulto y psoriasis); todos respondieron bien a la indicación primaria del anti-TNF (compromiso articular refractario), pero todos desarrollaron uveítis por primera vez luego de la aplicación de etanercept; todos recibieron esteroides orales a dosis altas y fueron cambiados a infliximab; de manera consistente, se logró remisión sostenida (hasta 34 meses en promedio) sin recurrencias, en todos los casos.
Sieper et al.48 analizaron la incidencia de uveítis asociada a etanercept reportada en los estudios clínicos de este medicamento en espondilitis anquilosante; encontraron que, en los estudios clínicos aleatorizados, la frecuencia por
100 pacientes/año fue 8,6 (4,5-14,2); ésta fue menor que la frecuencia por placebo (19,3; [11,0-29,8; p = 0,03]; en el estudio con comparador activo (sulfasalazina), las frecuencias fueron similares: 10,7 (5,5-17,6) para etanercept y 14,7 (6,4-26,5) para sulfasalazina (p = 0,49).
Fouache et al.49 describieron los diferentes eventos adversos que ocurrieron en 296 pacientes con espondiloartritis; encontraron tres casos de uveítis anterior aguda (1/100 pacientes/año), los tres tratados con etanercept; no se encontró asociación significativa entre los efectos adversos y un agente anti-TNF específico.
Sharma et al.50, luego de una revisión de la literatura de cinco años de experiencia clínica con agentes anti-TNF en uveítis, concluye que sólo infliximab y adalimumab han demostrado una alta tasa de respuesta, con una rápida inducción de remisión, con frecuentes disminución y suspensión de esteroides e inmunosupresores y una mejoría importante en la calidad de vida de los pacientes.
Conclusiones
Según lo revisado en la literatura, existe evidencia suficiente que demuestra que, en casos de uveítis refractaria, bien sea idiopática o asociada a enfermedades autoinmunes, el bloqueo de TNF ha demostrado eficacia sostenida, con un adecuado perfil de seguridad; se resalta un efecto ahorrador de esteroides, una reducción en el número y dosis de inmunosupresores y una reducción importante en la frecuencia de recaídas. También es claro que hay reportes que relacionan el uso de etanercept con la exacerbación o el desarrollo de uveítis; sin embargo, la mayoría de esta evidencia corresponde a reportes de casos y no existen estudios aleatorizados o de casos y controles que permitan establecer causalidad.
Bibliografía
1. Read RW. Uveitis: advances in understanding of pathogenesis and treatment. Curr Rheumatol Rep 2006;8:260-266. [ Links ]
2. Tugal-Tutkun I, Havrlikova K, Power WJ, Foster CS. Changing patterns in uveitis of childhood. Ophthalmology 1996; 103: 375-383. [ Links ]
3. Jabs DA, Nussenblatt RB, Rosenbaum JT. The Standardization of Uveitis Nomenclature (SUN) Working Group. Standardization of Uveitis Nomenclature for Reporting Clinical Data. Results of the First International Workshop. Am J Ophthalmol 2005;140:509-516. [ Links ]
4. McCannel CA, Holland GN, Helm CJ, Cornell PJ, Winston JG, Rimmer TG. Causes of uveitis in the general practice of ophthalmology. UCLA CommunityBased Uveitis Study Group. Am J Ophthalmol 1996,121:35-46. [ Links ]
5. Bodaghi B, Cassoux N, Wechsler B, Hannouche D, Fardeau C, Papo T et al. Chronic severe uveitis: Etiology and visual outcome in 927 patients from a single center. Medicine 2001;80:263-270. [ Links ]
6. Theodossiadis PG, Markomichelakis NN, Sfikakis PP. Tumor necrosis factor antagonists: preliminary evidence for an emerging approach in the treatment of ocular inflammation. Retina 2007;27:399-413. [ Links ]
7. Singh VK, Rai G. Cytokines in posterior uveitis: An update. Immunol Res 2001;23:59-74. [ Links ]
8. Khera TK, Dick AD, Nicholson LB. Mechanisms of TNF? regulation in uveitis: Focus on RNA-binding proteins. Prog Retin Eye Res 2010;29:610-621. [ Links ]
9. Gullapalli VK, Chu DS. Use of Tumor Necrosis Factor? Inhibitors in Treatment Of Noninfectious Autoimmune Uveitis. Comtemporary Ophthalmol 2008;7:1-8. [ Links ]
10. Lustig MJ, Cunningham ET Jr. Use of immuno suppressive agents in uveitis. Curr Opin Ophthalmol 2003;14:399-412. [ Links ]
11. Joseph A, Raj D, Dua HS, Powell PT, Lanyon PC, Powell RJ. Infliximab in the treatment of refractory posterior uveitis. Ophthalmology 2003;110:1449-1453. [ Links ]
12. Sfikakis PP, Theodossiadis PG, Katsiari CG, Kaklamanis P, Markomichelakis NN. Effect of infliximab onsight-threatening panuveitis in Behçet's disease. Lancet 2001;358:295-296.UVEÍTIS Y TERAPIA ANTI-TNF [ Links ]
13. Fries W, Giofre MR, Catanoso M, Lo Gullo R. Treatment of acute uveitis associated with Crohn's disease and sacroileitis with infliximab. Am J Gastroenterol 2002;97:499-500. [ Links ]
14. Bodaghi B, Bui Quoc E, Wechsler B, Tran TH, Cassoux N, Le Thi Huong D et al. Therapeutic use of infliximab in sight threatening uveitis: Retrospective analysis of efficacy, safety, and limiting factors. Ann Rheum Dis 2005;64:962-964. [ Links ]
15. Lopez-Gonzalez R, Loza E, Jover JA, Benitez Del Castillo JM, Mendez R, Hernandez-Garcia C et al. Treatment of refractory posterior uveitis with infliximab: A 7-year follow-up study. Scand J Rheumatol 2009;38:58-62. [ Links ]
16. Suhler EB, Smith JR, Giles TR, Lauer AK, Wertheim MS, Kurz DE et al. Infliximab Therapy for Refractory Uveitis: 2-Year Results of a Prospective Trial. Arch Ophthalmol 2009; 127:819-822. [ Links ]
17. Sobrin L, Kim EC, Christen W, Papadaki T, Letko E, Foster CS. Infliximab therapy for the treatment of refractory ocular inflammatory disease. Arch Ophthalmol 2007;125:895-900. [ Links ]
18. Braun J, Baraliakos X, Listing J, Sieper J. Decreased Incidence of Anterior Uveitis in Patients With Ankylosing Spondylitis Treated With the Anti-Tumor Necrosis Factor Agents Infliximab and Etanercept. Arthritis Rheum 2005; 52:2447-2451. [ Links ]
19. Guignard S, Gossec L, Salliot C, Ruyssen-Witrand A, Luc M, Duclos M et al. Efficacy of tumour necrosis factor blockers in reducing uveitis flares in patients with spondylarthropathy: A retrospective study. Ann Rheum Dis 2006;65:1631-1634. [ Links ]
20. Lim LL, Fraunfelder FW, Rosenbaum JT. Do Tumor Necrosis Factor Inhibitors Cause Uveitis? A RegistryBased Study. Arthritis Rheum 2007;56:3248-3252. [ Links ]
21. Tugal-Tutkun I, Mudun A, Urgancioglu M, Kamali S, Kasapoglu E, Inanc M et al. Efficacy of Infliximab in the Treatment of Uveitis That Is Resistant to Treatment With the Combination of Azathioprine, Cyclosporine, and Corticosteroids in Behçet's Disease: An OpenLabel Trial. Arthritis Rheum 2005;52:2478-2484. [ Links ]
22. Niccoli L, Nannini C, Benucci M, Chindamo D, Cassarà E, Salvarani C et al. Long-term efficacy of infliximab in refractory posterior uveitis of Behçet's disease: A 24-month follow-up study. Rheumatology 2007;46:1161-1164. [ Links ]
23. Alokaily F, Alsaleh S, Al-Balawi M, Al-Rashidi S. Efficacy of infliximab on the acute attack of uveitis. Saudi Med J 2010;31:82-85. [ Links ]
24. Niccoli L, Nannini C, Cassarà E, Gini G, Lenzetti I, Cantini F. Efficacy of Infliximab in two patients with refractory Vogt-Koyanagi-Harada. Br J Ophthalmol 2009;93:1553-1554. [ Links ]
25. Wang Y, Gaudio PA. Infliximab therapy for 2 patients with Vogt-Koyanagi-Harada Syndrome. Ocul Immunol Inflamm 2008;16:167-171. [ Links ]
26. Kahn P, Weiss M, Imundo LF, Levy DM. Favorable response to high-dose infliximab for refractory childhood uveitis. Ophthalmology 2006;113:860-864. [ Links ]
27. Simonini G, Zannin ME, Caputo R, Falcini F, de Martino M, Zulian F et al. Loss of efficacy during long-term infliximab therapy for sight-threatening childhood uveitis. Rheumatology 2008;47:1510-1514. [ Links ]
28. Ardoin SP, Kredich D, Rabinovich E, Schanberg LE, Jaffe GJ. Infliximab to treat chronic noninfectious uveitis in children: retrospective case series with longterm follow-up. Am J Ophthalmol 2007;144:844-849. [ Links ]
29. Foeldvari I, Nielsen S, Kümmerle-Deschner J, Espada G, Horneff G, Bica B et al. Tumor necrosis factoralpha blocker in treatment of juvenile idiopathic arthritis-associated uveitis refractory to second-line agents: results of a multinational survey. J Rheumatol. 2007;34:1146-1150. [ Links ]
30. Mushtaq B, Saeed T, Situnayake RD, Murray PI. Adalimumab for sightthreatening uveitis in Behçet's disease. Eye 2007;21:824-825. [ Links ]
31. Biester S, Deuter C, Michels H, Haefner R, Kuemmerle-Deschner J, Doycheva D et al. Adalimumab in the therapy of uveitis inchildhood. Br J Ophthalmol 2007;91:319-324. [ Links ]
32. Vazquez-Cobian LB, Flynn T, Lehman TJ. Adalimumab therapy for childhood uveitis. J Pediatr 2006;149:572-575. [ Links ]
33. Tynjälä P, Kotaniemi K, Lindahl P, Latva K, Aalto K, Honkanen V et al. Adalimumab in juvenile idiopathic arthritis-associated chronic anterior uveitis. Rheumatology 2008;47:339-344. [ Links ]
34. Rudwaleit M, Rødevand E, Holck P, Vanhoof J, Kron M, Kary S et al. Adalimumab effectively reduces the rate of anterior uveitis flares in patients with active ankylosing spondylitis: Results of a prospective openlabel study. Ann Rheum Dis 2009;68:696-701. [ Links ]
35. Diaz-Llopis M, Amselem L, Romero FJ, Garcia-Delpech S, Hernandez ML. Adalimumab therapy for Vogt-Koyanagi-Harada Syndrome. Arch Soc Esp Oftalmol 2007; 82:131-132. [ Links ]
36. Androudi S, Tsironi E, Kalogeropoulos C, Theo doridou A, Brazitikos P. Intravitreal adalimumab for refractory uveitis-related macular edema. Ophthalmology 2010;117:1612-1616. [ Links ]
37. Diaz-Llopis M, García-Delpech S, Salom D, Udaondo P, Hernández-Garfella M, Bosch-Morell F et al. Adalimumab therapy for refractory uveitis: A pilot study. J Ocul Pharmacol Ther 2008;24:351-361. [ Links ]
38. Lustig MJ, Cunningham ET Jr. Use of immunosuppressive agents in uveitis. Curr Opin Ophthalmol 2003;14:399-412. [ Links ]
39. Reiff A, Takei S, Sadeghi S, Stout A, Shaham B, Bernstein B et al. Etanercept therapy in children with treatmentresistant uveitis. Arthritis Rheum 2001;44:1411-1415. [ Links ]
40. Schmeling H, Horneff G. Etanercept and uveitis in patients with juvenile idiopathic arthritis. Rheumatology 2005;44:1008-1011. [ Links ]
41. Smith JR, Levinson RD, Holland GN, Jabs DA, Robinson MR, Whitcup SM et al. Differential efficacy of tumor necrosis factor inhibition in the management of inflammatory eye disease and associated rheumatic disease. Arthritis Rheum 2001;45:252-257. [ Links ]
42. Foster CS, Tufail F, Waheed NK, Chu D, Miserocchi E, Baltatzis S et al. Efficacy of etanercept in preventing relapse of uveitis controlled by methotrexate. Arch Ophthalmol 2003;121:437-440. [ Links ]
43. Smith JA, Thompson DJ, Whitcup SM, Suhler E, Clarke G, Smith S et al. A randomized, placebo-controlled, double-masked clinical trial of etanercept for the treatment of uveítis associated with juvenile idiopathic arthritis. Arthritis Rheum 2005;53:18-23. [ Links ]
44. Baughman RP, Lower EE, Bradley DA, Raymond LA, Kaufman A. Etanercept for refractory ocular sarcoidosis: results of a double-blind randomized trial. Chest 2005;128:1062-1067. [ Links ]
45. Saurenmann RK, Levin AV, Feldman BM, Laxer RM, Schneider R, Silverman ED. Risk of new-onset uveitis in patients with juvenile idiopathic arthritis treated with anti-TNF alpha agents. J Pediatr 2006;149:833-836. [ Links ]
46. Sebastian RT, Harding SP, Bucknall RC, Pearce IA. Optimizing the Use of Tumor Necrosis Factor Inhibitors in Refractory Uveitis. Arch Ophthalmol 2006;124: 1505. [ Links ]
47. Kakkassery V, Mergler S, Pleyer U. Anti-TNF-alpha treatment: a possible promoter in endogenous uveitis? Observational report on six patients: Occurrence of uveitis following etanercept treatment. Curr Eye Res 2010;35:751-756. [ Links ]
48. Sieper J, Koenig A, Baumgartner S, Wishneski C, Foehl J, Vlahos B et al. Analysis of uveitis rates across all etanercept ankylosing spondylitis clinical trials. Ann Rheum Dis. 2010;69:226-229. [ Links ]
49. Fouache D, Goëb V, Massy-Guillemant N, Avenel G, Bacquet-Deschryver H, Kozyreff-Meurice M et al. Paradoxical adverse events of anti-tumour necrosis factor therapy for spondyloarthropathies: A retrospective study, Rheumatology 2009;48:761-764. [ Links ]
50. Sharma SM, Nestel AR, Lee RWJ, Dick AD. Clinical Review: Anti-TNF? Therapies in Uveitis: Perspective on 5 Years of Clinical Experience. Ocul Immunol Inflamm 2009;17:403-414. [ Links ]














