Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista Colombiana de Reumatología
Print version ISSN 0121-8123
Rev.Colomb.Reumatol. vol.18 no.3 Bogotá July/Sept. 2011
ARTÍCULO DE REVISIÓN
1Unidad de Artritis, Servicio de Reumatología. Hospital Clínic, Barcelona. Correspondencia: Villarroel 170, 08036, Barcelona, España. Correo electrónico: jagomez@clinic.ub.es
El autor declara no presentar ningún conflicto de interés al momento de la redacción del manuscrito.
Recibido: Marzo 17 de 2011 Aceptado: Mayo 10 de 2011
Resumen
La gota es una artropatía inflamatoria caracterizada por brotes autolimitados de artritis con marcado dolor como consecuencia de los depósitos de cristales de urato monosódico (UMS) en los tejidos articulares y periarticulares. En algunas ocasiones se puede desarrollar una gota tofácea crónica que puede conducir a una importante destrucción articular y por ende una marcada discapacidad. La gota es la causa más común de artritis inflamatoria entre hombres y mujeres post-menopáusicas.
Durante los últimos años se han dado pasos importantes en la patogenia de la gota, tanto a nivel de estudios genéticos, como la participación del inflamosoma, comportándose la gota como una enfermedad auto-inflamatoria.
Adicionalmente, se han desarrollado nuevos agentes farmacológicos incluyendo anti-IL1 (anakinra, rinolacept y canakinumab) e inhibidores de xantina oxidasa (febuxostat) los cuales han demostrado ser útiles en términos de reducción de las concentraciones séricas de ácido úrico (AU) en pacientes resistentes o con intolerancia a las terapias hipouricemiantes convencionales.
Palabras clave: gota, hiperuricemia, inflamosoma, IL-1, alopurinol, febuxostat.
Summary
Gout is an inflammatory arthritis characterized by selflimiting but excruciatingly painful acute attacks. These are a consequence of monosodium urate crystal deposition within articular or periarticular tissue. After years of acute intermittent gout, chronic tophaceous gout can develop. Gout is the most frequent cause of inflammatory arthritis in men and postmenopausic women.
Several important advances had been developed during last years in terms of pathogenic mechanisms, including genetic and inflammatory aspects such as the participation of inflammosome. In that sense, the gout can follow a course similar than othe autoinflammatory disorders.
Additionally, new therapeutic agents had been developed, including anti-IL1 antibodies (anakinra, rinolacept and canakinumab) and xanthine oxidase inhibitors such as febuxostat. Those treatments had demonstrated efficacy in term of lowering serum urate concentrations in refractory patients to conventional treatments.
Key words: gout, hyperuricemia, inflammosome, IL-1, allopurinol, febuxostat.
Introducción
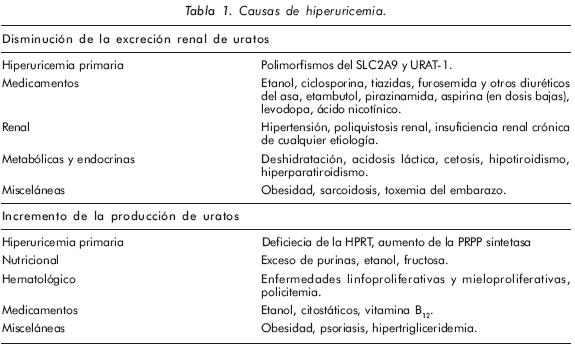
La gota es una enfermedad inflamatoria crónica caracterizada por brotes autolimitados de artritis los cuales se asocian a los depósitos de cristales de urato monosódico (UMS) en los tejidos articulares y periarticulares1,2. La gota es el resultado de concentraciones elevadas y mantenidas de ácido úrico (AU) las cuales se asocian o a una disminución de la excreción renal de uratos o a un incremento de la producción de uratos (Tabla 1). En una importante proporción de los pacientes, la hiperuricemia forma parte de un síndrome metabólico (SM) que en la presencia de ataques gotosos deben alertar al clínico sobre la presencia de co-morbilidades, las cuales en una gran mayoría de las ocasiones son reversibles o por lo menos son modificables realizando cambios en la dieta y en el estilo de vida3,4.
Perspectiva histórica
La gota es una enfermedad milenaria, descrita desde la era de los egipcios (2000 años a.C). Como bien nos explica el Dr. Iglesias y cols.5 el concepto de la gota ha evolucionado desde los tiempos de Seneca, pasando por Hipócrates, Sydenham hasta la introducción de la microscopia con luz polarizada en 1960 por Konh, McCarty y cols.6. Desde hace ya más de 40 años el alopurinol ha sido la piedra angular en el tratamiento crónico de la gota7. George H. Hitchings, James W. Black y Gertrude B. Elion ganaron el premio Nobel de Medicina en 1988 gracias a sus trabajos de farmacología en diversas patologías como la leucemia, la malaria, el herpes y la gota8. No obstante durante las últimas 4 décadas se había avanzado poco en la patogenia y el tratamiento de la gota. Recientes publicaciones relacionadas con la inmunopatogenia y la aparición de nuevos fármacos han hecho reactivar el interés en la reumatología por una patología tan prevalente como antigua.
Nuevos aspectos patogénicos y papel de los inhibidores de IL-1
Se han identificado variantes genéticas, identificándose un nuevo gen transportador, el SLC2A9 el cual se ha asociado a una tasa de excreción menor de ácido úrico. El gen SLC2A9 codifica el transportador de la glucosa-9, un trasportador con una alta afinidad por los uratos. También se ha descrito que el gen de la proteína ABCG2 (ATP-binding cassette, subfamilia G2) está relacionado con la secreción renal de uratos9.
Un grupo alemán demostró que el polimorfismo de la fracción N-terminal del gen URAT-1 estaba estrechamente relacionado con una excreción urinaria reducida de uratos10.
Cinco estudios GWAS llevados a cabo en el mismo periodo de tiempo han descrito una asociación de variantes genéticas de SLC2A9/GLUT9 con unas concentraciones bajas de AU en suero, con unos efectos que eran más intensos en las mujeres (p. ej, diferencia de nivel de AU por copia de un alelo menor, -0.46 mg/dl en las mujeres, frente a -0.22 mg/dl en los varones).
Un metanálisis reciente que incluyó 14 estudios con un total de 28.141 pacientes con ancestro europeo, analizó 954 SNPs (single nucleotide polymorphism) distribuidos en 9 locus. Se encontraron variantes en nueve regiones incluyendo SLC2A9, ABCG2, SLC17A1, SLC22A11, SLC22A12, SLC16A9, GCKR, LRRC16A y PDZK1. Se observó que las variantes genéticas del ABCG2 se asociaban a unas concentraciones mas altas de AU y que estos efectos eran más intensos en lo varones11.
El sistema inmune innato detecta rápidamente tanto a aquellos microorganismos patógenos como a otras "señales de peligro" tales como los cristales de UMS. Cuando estos cristales se depositan en los tejidos sinoviales, las proteínas similares al NOD (NRL, NOD-like receptors) forman complejos multiproteicos conocidos como inflamosomas que activan la secreción de citocinas que producen la inflamación como la interleucina-1β y la interleucina-1812. Dentro de los componentes críticos del inflamosoma se incluyen a el NLRP1, NLRP3, NLRC4 y el adaptador ASC, los cuales participan en las fases posteriores en la activación de las caspasas13. Peñaranda-Parada y cols.14 publicaron recientemente una revisión más extensa sobre los diferentes fenómenos autoinflamatorios y el papel de los inflamosomas.
Recientemente se ha demostrado que la inflamación causada por el UMS es dependiente del inflamosoma y la señalización del receptor de IL1 MyD88-dependiente es esencial para las respuestas inflamatorias. El inflamosoma NALP3 es esencial para la producción IL1B a través del reclutamiento de ASC y la caspasa-1 tras la exposición al USM15. Martinon et al.16 demostraron que los macrófagos de ratón de NALP3-/-, ASC-/- o de los ratones caspasa-1-/- produjeron significativamente menos IL1B madura, en comparación con el tipo de animales salvajes cuando fueron estimulados con UMS. Lo mismo ocurrió cuando se utilizaron los cristales de pirofosfato de calcio como inductor del inflamosoma.
El papel de IL1B en la gota aguda se ha visto reforzado por la eficacia clínica del bloqueo de los receptores IL1B en diversos estudios17. En un estudio, 10 pacientes con gota que no habían tolerado o habían fallado a la terapia convencional fueron tratados durante 3 días consecutivos con 100 mg/día de anakinra; los 10 pacientes respondieron bien, sin efectos adversos considerables18.
El rilonacept es un receptor soluble de la inter-leucina-1 de la unión con el fragmento-cristalizable (Fc) de la inmunoglobulina humana que inhibe la interleucina 1α y la interleucina 1β. El rinolacept está aprobado por la FDA para su utilización en niños con síndromes de fiebre periódica asociada a las criopirinas. En un ensayo multicéntrico, no aleatorizado en pacientes con gota se incluyeron 10 pacientes con una o más articulaciones inflamadas durante 4 semanas o más a los cuales se les administró rilonacept por vía subcutánea, durante 14 semanas19. No se reportaron eventos adversos serios importantes. Tres pacientes desarrollaron anticuerpos no neutralizantes anti-rilonacept sin consecuencias clínicas. Aunque no hubo un efecto significativo en el número de articulaciones inflamadas, las puntuaciones de los pacientes de la escala de dolor en una escala analógica visual disminuyó desde 5,0 hasta 2,8 tras 2 semanas de tratamiento con rilonacept (p < 0,049), con mejoría sostenida a las 8 semanas (1,3, p < 0,049). Las concentraciones de proteína C reactiva se redujeron significativamente. Al momento de la última dosis, el 60% de los pacientes reportaron más de 50% de mejoría en el dolor (p = 0,00015) y el 50% de los pacientes tenían más de 75% de mejoría (p ≤ 0,01)19.
Canakinumab es un anticuerpo monoclonal humanizado anti-interleuquina 1β con una vida media de 28 días el cual tiene la aprobación de la FDA para los síndromes periódicos asociados a criopirinas. En un ensayo multicéntrico, aleatorizado que incluyó 147 pacientes con gota aguda, refractaria o con contraindicaciones a los fármacos anti-inflamatorios no esteroideos y colchicina, se administró una dosis subcutánea de canakinumab (10 mg, 25 mg, 50 mg, 90 mg o 150 mg20. Un total de 57 pacientes con antecedentes similares recibieron una inyección intramuscular de 40 mg de acetónido de triamcinolona. Los 77 pacientes que recibieron canakinumab a dosis de 150 mg respondieron mejor que el acetónido de triamcinolona en términos de reducción del dolor (p < 0,05), y adicionalmente lo hicieron con una mayor rapidez (p = 0,0006). Se reportaron erupciones recurrentes en el 3% de los pacientes que recibieron 150 mg canakinumab frente al 45% de los pacientes tratados con acetato de triamcinolona durante las 8 semanas de seguimiento (p = 0,006). Se reportaron casos aislados de apendicitis y estenosis de la arteria carótida en el grupo con canakinumab y eventos cerebrovasculares en el grupo de acetónido de triamcinolona, aunque no se consideraron relacionados con el tratamiento20.
La inhibición de la IL-1, es un tratamiento prometedor para los pacientes con gota que no toleran los tratamientos convencionales, incluyendo los corticosteroides. Están en marcha ensayos clínicos más grandes con rilonacept y canakinumab, tanto para la gota aguda como para la profilaxis21.
Hiperuricemia asintomática
Desde hace más de 20 años se conoce los efectos deletéreos que puede tener las concentraciones elevadas y mantenidas de AU, incluso en pacientes asintomáticos. Campion y cols22 cuantificaron las consecuencias de la hiperuricemia asintomática en un estudio poblacional prospectivo que incluyó 30147 individuos-años. El estudio "Normative Aging Study" evaluó una cohorte de 2.046 hombres inicialmente sanos los cuales fueron seguidos durante 15 años con determinaciones seriadas de AU. Con niveles basales 9 mg/dl o más, la incidencia anual de artritis gotosa fue de 4,9% en comparación al 0,5% en aquellos con concentraciones entre 7,0 y 8,9 mg/ dl y de 0,1% de pacientes con concentraciones menores de 7,0 mg/dl. Con concentraciones de AU > 9 mg/dl la incidencia acumulada de artritis gotosa a 5 años fue del 22%. Dicha incidencia fue 3 veces mayor en aquellos pacientes con HTA. Los factores predictores de gota fueron la edad, el índice de masa corporal, las concentraciones elevadas del colesterol y el consumo de enol23.
Cada vez es más importante la detección de la afectación articular por cristales de UMS en fase pre-clínicas. La ecografía se ha mostrado como una técnica de imagen sensible al cambio de la actividad inflamatoria que presentan los pacientes, y es capaz de objetivar la respuesta antiinflamatoria de los fármacos empleados. La ecografía ha demostrado ser más sensible que la radiología simple en la detección precoz de erosiones óseas < 2 mm. También permite objetivar el daño estructural en entesis y tendones24. La ecografía también ha demostrado ser una técnica altamente sensible en el diagnóstico de tofos intraarticulares, en algunas ocasiones permitiendo identificar tofos que no se visualizan por la resonancia magnética25.
Hiperuricemia y riesgo cardiovascular
Durante la última década se han dado pasos importantes sobre la relación entre la hiperuricemia y la enfermedad cardiovascular (ECV). Diversos estudios han demostrado que las concentraciones elevadas de AU son un factor de riesgo independiente para el desarrollo de ECV (incluyendo el infarto agudo de miocardio y el ictus)26,27.
Diversos estudios prospectivos han mostrado resultados dispares. Estudios con poblaciones con factores de riesgo cardiovasculares han encontrado que la hiperuricemia es un factor aislado para el desarrollo de ECV. Estudios con población general no han demostrado que la hiperuricemia sea un factor de riesgo cardiovascular por sí solo27,28.
A continuación se comentan diversos estudios que evalúan el riesgo cardiovascular y la hiperuricemia. En el estudio de trabajadores de la salud (Health Professionals Follow-Up Study) la presencia basal de hiperuricemia en hombres se asoció con un riesgo relativo mayor de muerte por causas cardiovasculares con un OR de 1.28 para la mortalidad global, 1,38 para la ECV y de 1,55 para la enfermedad coronaria29.
Estudios poblacionales han establecido una estrecha asociación entre el aumento en las concentraciones de AU y el posterior desarrollo de hipertensión (HTA)30. Incluso dicha asociación se ha establecido en subgrupos poblacionales, como lo son pacientes con artritis reumatoide. El grado de control sobre potenciales factores de confusión de los diversos estudios epidemiológicos en variable, pero en términos generales se han tenido en cuenta diversos factores de la dieta, uso de diuréticos, consumo de enol entre otros.
Existen diversos factores que explican la inter-relación entre la hiperuricemia y la HTA. En modelos animales se ha demostrado que concentraciones moderadamente elevadas de hiperuricemia favorecen el desarrollo de enfermedad renal microvascular y la patología tubulointersticial y activan el eje renina angiotensina. Dicha HTA se revierte una vez iniciada la terapia hipouricémica31.
Dichas observaciones fueron confirmadas recientemente en un estudio con adolescentes recién diagnosticados de HTA e hiperuricemia los cuales experimentaron una reducción en las cifras de tensión tras el tratamiento con alopurinol32.
Otra posible explicación son las alteraciones endoteliales inducidas por la hiperuricemia. Se ha demostrado que existen grados mínimos de actividad en las articulaciones, incluso en la ausencia de brotes de gota. Dicha inflamación crónica contribuye a la ateroesclerosis acelerada que ocurre en los pacientes con gota33.
Las concentraciones elevadas de AU se asociaron a un aumento en la mortalidad en 112 pacientes con insuficiencia cardiaca34. En dicho estudio encontraron que el umbral para ser predictor de mal pronóstico para el AU era > 9,5 mg/dl. En otro estudio con 182 pacientes con insuficiencia cardiaca, aquellos pacientes con unas concentraciones por encima de este umbral tuvieron unas tasas de supervivencia menores a 4 años (19 vs 79%) que aquellos pacientes por concentraciones inferiores27.
Nagahama y cols.35 evaluaron la correlación entre las concentraciones de AU, la obesidad, la HTA, la dislipidemia y la diabetes mellitus (DM) en una cohorte de 9.914 individuos (6.163 hombres y 2.751 mujeres) entre los 18 y los 89 años de edad. Se definió como hiperuricemia valores de AU superiores a 7,0 mg/dl en hombres y 6,0 mg/dl en mujeres. Las OR para la presencia de obesidad, HTA e hipercolesterolemia fueron mayores en los pacientes con hiperuricemia siendo de 1,42 (IC95% 1,25-1,62), 1,16 (IC 95% 1,02-1,3) y 1,80 (IC 95% 1,62-2,0), respectivamente.
Un reciente metanálisis valoró los riesgos relativos (RR) para la ECV en pacientes con hiperuricemia basado en 13 estudios36.
Tras realizar los diferentes ajustes de acuerdo a diversos factores de riesgo, la hiperuricemia confiere un riesgo de 1,09 (IC 95%. 1,03-1,16). Debe tenerse en cuenta que los estudios eran heterogéneos con muchas disparidades entre muestras.
Cuando se realizó un análisis multivariado sobre la mortalidad, el RR fue de 1,09 (IC 95%, 0,98-1,19) en el caso de los hombres y de 1,67 (IC 95% 1,30-2,04) para las mujeres. Por cada aumento de 1 mg/dl en las concentraciones de AU, el aumento global del RR en términos de mortalidad fue de 1,12 (IC 95%, 1,05-1,19).
En conclusión, se encontró en dicho metanálisis, un aumento modesto en el riesgo de ECV asociado a la hiperuricemia. Dicho incremento en el riesgo fue mayor en las mujeres37.
Importancia del control del ácido úrico
Recientemente, un grupo de expertos del EULAR realizaron un consenso sobre 12 recomendaciones basadas en la evidencia para el control de la gota38. Dicho comité de expertos hizo énfasis en la importancia de la educación a los pacientes, de la modificación de los estilos de vida (incluyendo la pérdida de peso, la reducción en la ingesta de enol o la dieta baja en contenidos purínicos de origen animal) y del tratamiento de todas aquellas co-morbilidades que puedan contribuir con la hiperuricemia23,39.
Al mismo tiempo, recomienda la importancia a la hora de tratar a un paciente de tener en cuenta la extensión de los depósitos de urato, las concentraciones basales de uricemia y el número de ataques de gota por año.
¿Cuál debe ser el objetivo de la terapia hipouricémica? Existe una importante evidencia que el tratamiento de la hiperuricemia mejora el pronóstico de los pacientes con artropatía gotosa, ¿pero hasta qué nivel se debe reducir el AU? Diversos estudios han demostrado que aquellos pacientes que alcanzan concentraciones por debajo de 6 mg/dl (360 mmol/l) obtienen mejores resultados que aquellos pacientes con concentraciones superiores, en términos de reducción en el número de ataques, reducción del área del tofo, disminución en los depósitos de cristales en el líquido sinovial y mejoría de la función renal tras la retirada de los anti-inflamatorios no esteroideos (AINEs). El objetivo final debe ser curar la gota40.
Pascual y Sivera41 demostraron que la desaparición de los cristales de UMS puede tardar hasta 33 meses después del brote de artritis. En aquellos pacientes con gotas de reciente inicio los cristales desaparecieron más pronto. En el mismo artículo los autores afirman que uno de los principales objetivos de la terapia hipouricemiante debe ser la total resolución de los cristales.
Alopurinol
El alopurinol reduce las concentraciones de AU mediante la inhibición de la xantina oxidasa (XO), previniendo así la producción de xantinas que como producto del catabolismo de las purinas generan AU.
Se conoce que el alopurinol es un inhibidor competitivo de la XO y junto con el oxipurinol inactiva de forma pseudo-irreversible a dicha enzima, obteniendo como resultado la disminución en la producción de uratos pero también la acumulación de hipoxantina y xantina los cuales se acumulan en los líquidos corporales y producen un estado de xantinuria. El alopurinol reduce substancialmente la excreción urinaria de purinas en la mayoría de los pacientes. La estructura química del alopurinol se esquematiza en la figura 1.
Se sabe que hay una relación inversamente proporcional entre la dosis de alopurinol y las concentraciones de AU. El alopurinol se suele comenzar a dosis de 100 mg/día aumentando 100 mg cada 1-2 semanas en función de las concentraciones de AU y el aclaramiento de creatinina42.
Los efectos adversos del alopurinol incluyen rash (2%), desde vasculitis cutáneas hasta reacciones de hipersensibilidad graves como el síndrome de Stevens-Johnson, la hepatitis, la insuficiencia renal y la supresión medular42.
El alopurinol es un fármaco eficaz, bien tolerado, de cómodo administración y de bajo coste. A pesar de estas ventajas es un fármaco que no controla la hiperuricemia en todos los pacientes, que tiene un efecto menor sobre la regresión en el tamaño y el número de los tofos y que presenta una serie de efectos adversos, fundamentalmente las reacciones cutáneas.
Febuxostat
El Febuxostat, es un potente inhibidor por vía oral de la XO, reduciéndose así las concentraciones de uratos. A diferencia del alopurinol y su metabolito activo, el oxipurinol, el febuxostat no es un análogo de purinas por lo cual solo inhibe la XO y no otras enzimas de las vías metabólicas de las purinas y pirimidinas9,43. La estructura química del febuxostat se esquematiza en la figura 2. El 85% de absorción ocurre tras 1 hora de la ingesta oral, con una vida media entre 4 y 18 horas lo que permite una dosificación de 1 sola toma diaria. Su metabolismo es fundamentalmente hepático en la vía de la unidin-difosfato-glucoronosiltransferasa y en menor medida por el sistema de la citocromo P450; su excreción es de aproximadamente el 50% en las heces y el 50% en la orina. No se requiere de ajustes en la dosis en pacientes con insuficiencia renal o con insuficiencia hepática (leve o moderada). Otra ventaja es su poca interacción con la administración simultánea con derivados cumarínicos43-45.
El febuxostat debe considerarse en pacientes con intolerancia al alopurinol, en todos aquellos pacientes que no consigan el control de la enfermedad con otros fármacos hipouricemiantes y para aquellos pacientes con insuficiencia renal (para aquellos con aclaramiento de creatinina mayor a 30 mL/min). Se debe probar el febuxostat antes de iniciar un proceso de desensibilización al alopurinol. Finalmente, el febuxostat debe utilizarse antes que los medicamentos uricosúricos en pacientes con nefrolitiasis45.
En febrero de 2009 la FDA aprobó el febuxostat para el manejo de la gota a dosis de 40 u 80 mg/día. La agencia europea de medicamentos aprobó el febuxostat a dosis de 80 y 120 mg, antes de los resultados del estudio CONFIRMS46.
Estudios pivotales
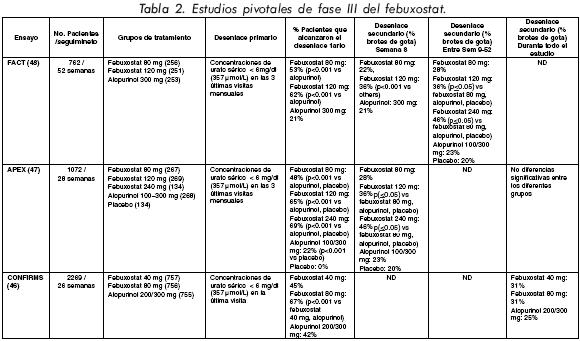
Dos diferentes ensayos fase III con un total de 1832 pacientes fueron realizados en los EEUU. El APEX (Allopurinol and Placebo-Controlled Efficacy Study of Febuxostat)47 y el FACT (Febuxostat versus Allopurinol Control Trial)48. Ambos estudios tienen un diseño similar, incluyendo los desenlaces primarios y los criterios de exclusión lo que permite hacer un análisis conjunto de los datos. Una diferencia importante entre ambos estudios es que en el estudio FACT se permitió incluir pacientes con insuficiencia renal hasta 1,5 mg/dl o aclaramiento de creatinina de 55 ml/min. En el estudio APEX se incluyeron pacientes con mayor afectación de la función renal con concentraciones de creatinina sérica y aclaramiento de creatinina de < 2,0 mg/ dl y > 20 ml/m, respectivamente.
El estudio APEX comparó el febuxostat a dosis de 80, 120 ó 240 mg/día con alopurinol 100 ó 300 mg/día (de acuerdo la función renal) con placebo durante un período de 28 semanas. El estudio FACT comparó febuxostat 80 y 120 mg con alopurinol 300mg/día durante 1 año. La mayoría de pacientes de ambos estudios fueron hombres (95%), con una enfermedad gotosa de larga evolución (promedio 12 años) con una media de concentraciones de AU basal de 9,85 mg/dl (590 mmol/l). En ambos estudios los pacientes recibieron profilaxis con colchicina 0,6 mg/ día o naproxeno 250 mg 2 veces al día durante las primeras 8 semanas.
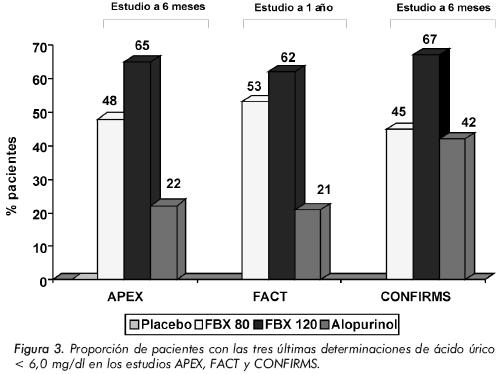
El desenlace principal en ambos estudios fue el porcentaje de pacientes que alcanzaron concentraciones de AU < 6 mg/dl (360 mmol/l) durante las últimas 3 visitas mensuales. Los desenlaces secundarios incluyeron el porcentaje de pacientes que mantuvieron concentraciones de AU < 6 mg/dl en la última visita, la incidencia de ataques gotosos que requirieron tratamiento y el cambio en el número y tamaño de los tofos. En ambos ensayos el febuxostat fue significativamente más efectivo que las dosis convencional de 300 mg de alopurinol (Figura 3). De forma estadísticamente significativa en ambos ensayos, los pacientes tratados con febuxostat alcanzaron concentraciones de AU < 6 mg/dl (48% con 80 mg febuxostat y 65% con 120 mg febuxostat en el APEX; 53 y 62%, respectivamente en el FACT), en comparación que los que recibieron alopurinol 300 mg/día (22% en el APEX y 21% en el FACT; P < 0,001 en ambos estudios).
No se encontraron diferencias en el número de ataques de gota entre los pacientes en los tres brazos de tratamiento. Una vez finalizado el periodo de profilxaxis con colchicina, la incidencia de ataques de gota fue mayor en aquellos pacientes con concentraciones más bajas de AU, lo que se explica probablemente por la movilización continua de cristales de UMS previamente formados, lo que nos indicaría la necesidad de un periodo de profilaxis más prolongado. Los resultados de otros desenlaces secundarios se resumen en la tabla 2.
Más recientemente, se publicó el estudio CONFIRMS46. El propósito de dicho estudio fue comparar la eficacia y seguridad del febuxostat y el alopurinol en pacientes con gota y concentraciones de AU > 8,0 mg/dl.
El estudio incluyó 2269 pacientes los cuales fueron aleatorizados a recibir febuxostat 40 mg, 80 mg o alopurinol 300 mg/día (200 mg en pacientes con insuficiencia renal moderada). Los desenlaces incluyeron la proporción de pacientes que alcanzaron concentraciones < 6 mg/dl. El 65% de los pacientes tenían algún grado de insuficiencia renal, el 64% eran obesos, el 42% tenían dislipidemia y 53% HTA.
El desenlace primario fue alcanzado en el 45%, 67% y 42% en los pacientes tratados con febuxostat 40 mg, 80 mg y alopurinol, respectivamente. El febuxostat a 40 mg/día no fue inferior que el alopurinol, mientras que el febuxostat 80 mg fue superior (P < 0,001). En aquellos pacientes con insuficiencia renal el febuxostat a 80 mg/día fue superior que los pacientes tratados con 40 mg/día o con alopurinol. Otros desenlaces del estudio CONFIRMS se recogen en la tabla 2.
Estudios a largo plazo
Se han desarrollado 2 estudios a largo plazo con el fin de determinar el efecto del febuxostat sobre el control de las concentraciones séricas de ácido úrico, así como también la seguridad y tolerabilidad a largo plazo. Ambos estudios fueron estudios abiertos de extensión de ensayos pivotales previos.
El estudio FOCUS (Febuxostat Open-label Clinical Trial of Urate-Lowering Efficacy and Safety)49 fue un estudio de extensión tras 5 años de seguimiento en el cual se incluyeron a 116 pacientes que continuaron con el tratamiento de febuxostat 80 mg/día. Durante las primeras 24 semanas se permitió diferentes dosificaciones, pero a partir de allí se mantuvieron dosis estables durante todo el estudio. Se administró concomitantemente colchicina 0,6 mg dos veces al día durante las primeras 4 semanas del estudio. De forma similar a los estudios previos, el desenlace principal fue la proporción de pacientes que alcanzaron unas concentraciones séricas mantenidas de AU < 6 mg/dl. El desenlace secundario fue el porcentaje global de reducción de las concentraciones de AU. Se analizó también la proporción de pacientes con AU menor de 5 mg/dl, la proporción de pacientes que necesitaron tratamiento para crisis gotosas y la resolución de los tofos palpables en aquellos pacientes con enfermedad tofácea (22%).
La mayoría de pacientes continuaron tomando la medicación a lo largo del estudio. El número de pacientes que suspendieron el tratamiento fue de 38, 7, 5, 6 y 2 durante el primer, segundo, tercer, cuarto y quinto año, respectivamente. Las principales causas de suspensión de la medicación fueron por voluntad propia de los pacientes (22), por efectos adversos (13), por brotes de gota (8), por pérdida en el seguimiento (5) y por violación en el protocolo (1), entre otras. Un total de 58 pacientes completaron el estudio, de los cuales el 93% alcanzó el desenlace primario. La proporción de pacientes que alcanzaron concentraciones de AU < 6 mg/ dl fue de 78%, 76%, 84% y 90% durante los 4 años, respectivamente. La reducción media de las concentraciones de AU fue mayor del 50% en comparación a las concentraciones basales.
El estudio EXCEL (Febuxostat/Allopurinol Comparative Extension Long-term)50 incluyó a los pacientes que completaron los estudios FACT o APEX. Inicialmente, todos los pacientes recibieron febuxostat 80 mg/día (N = 351 pacientes). No obstante, el protocolo fue modificado a recibir en una relación 2:2:1 en una fase abierta y recibieron 80 mg o 120 mg de febuxostat o alopurinol. De igual manera que en el estudio APEX, la gran mayoría de los pacientes recibieron alopurinol a dosis de 300 mg/día.
Aquellos pacientes con concentraciones de AU por encima de 6 mg/dl tras 6 meses de tratamiento fueron retirados del estudio. En desenlace primario fue la proporción de pacientes con concentraciones de AU < 6 mg/dl en cada visita. Otras medidas de eficacia incluyeron el porcentaje de reducción del AU, con respecto al basal, los cambios en el número y el tamaño de tofos y la frecuencia de números de brotes de ataque de gota que requirieron tratamiento. A pesar que se realizó un análisis estadístico de los resultados, no se suministró la información del valor de p en los diferentes desenlaces de seguridad y eficacia.
La mayoría de los pacientes del estudio EXCEL fueron de raza caucásica, hombres y mayores de 50 años. Se detectaron tofos palpables en al menos el 20% de los pacientes. La mayoría de los pacientes (98%) tenían función renal normal al inicio del estudio.
Un número considerable de los pacientes abandonaron el estudio. De los 1.086 pacientes reclutados, 422 (39%) abandonaron el ensayo antes de los 3 años del estudio. Las principales causas de la retirada fueron la pérdida del seguimiento (8%), razones personales (7%), efectos adversos (7%) y fallos al tratamiento (6%).
A pesar que se permitían ajustes en la dosis, la gran mayoría de pacientes del grupo de febuxostat 80 mg/día permanecieron en dichas dosis. De los 145 pacientes que recibieron alopurinol al inicio, solo 92 pacientes recibían una dosis estable a los 6 meses.
Después del primer mes del tratamiento, el 81 y el 87% de los pacientes que recibieron febuxostat 80 y 120 mg, respectivamente, alcanzaron el desenlace primario, comparado con solo el 46% de los pacientes tratados con alopurinol. Durante la duración del estudio, el 80% de los pacientes tratados con febuxostat mantuvieron concentraciones de AU por debajo de 6 mg/dl. El porcentaje de pacientes que recibieron alopurinol y que alcanzaron el desenlace primario a los 12 meses fue del 82%. No obstante, esto solo incluyó los pacientes que se mantuvieron con alopurinol desde el inicio y no aquellos que fueron cambiados a recibir alopurinol tras recibir febuxostat. La media del porcentaje de reducción del AU en la última visita con respecto a la basal fue de 47%, 53% y 32%, para febuxostat 80, 120 y alopurinol, respectivamente.
En términos generales, el número y el tamaño de tofos disminuyó en los tres grupos de tratamiento, no obstante la reducción fue mayor en los pacientes tratados con febuxostat. De forma adicional, un gran porcentaje de pacientes que recibieron febuxostat vs alopurinol alcanzaron la resolución total de los tofos.
Seguridad del febuxostat
Los principales efectos adversos reportados fueron las alteraciones en el perfil hepático (3%), la diarrea (3%), la cefalea (1%), las náuseas (2%) y el mareo (2%). El porcentaje de pacientes con alteraciones leves en el perfil hepático fue similar en los pacientes tratados con febuxostat y alopurinol (3% vs. 4%, respectivamente). Adicionalmente, se observó un aumento en las concentraciones de TSH (> 5,5 mIU/ml) en un 5% de los pacientes tratados con febuxostat y en un 6% de los pacientes tratados con alopurinol. La incidencia de efectos adversos como mareo, cefalea, diarrea o las náuseas fue similar en los ensayos de fase III, así como en los estudios de extensión.
Los eventos cardiovasculares en los ensayos FACT y APEX fueron numéricamente mayores en los pacientes tratados con febuxostat en comparación a otros tratamientos47,48. En la fase abierta de extensión los eventos cardiovasculares fueron más frecuentes los pacientes tratados con febuxostat (2,7%) que los pacientes tratados con alopurinol. No obstante cuando se ajustó por el resto de medicamentos que tomaban los pacientes, no se encontraron diferencias en ambos grupos.
Los factores asociados a eventos cardiovasculares incluyeron la historia previa de enfermedad ateroesclerótica o infarto de miocardio, insuficiencia cardiaca y la edad superior a 60 años al inicio (p = 0,001 para los 4 factores). No se encontró asociación con los antecedentes de HTA, ictus, DM o dislipidemia. La agencia del medicamento Europea concluye que no se recomienda la utilización del febuxostat en pacientes con antecedentes de enfermedad cardiaca isquémica o insuficiencia cardiaca. La FDA aprueba su utilización pero a dosis entre 40 u 80 mg/día.
Conclusiones y aplicabilidad clínica
La identificación del papel del inflamosoma en la gota abre nuevas vías terapéuticas, tales como la inhibición de la IL-1. En este sentido los anticuerpos monoclonales anti-IL tales como anakinra, rinolacept y canakinumab son alternativas prometedoras para aquellos pacientes refractarios a las terapias convencionales.
El febuxostat reduce y mantiene las concentraciones de AU por debajo de 6 mg/dl incluso tras 40 meses de seguimiento. Dicho tratamiento es significativamente mas efectivo que dosis máximas de alopurinol (300 mg/día). De forma similar el febuxostat fue más eficaz en mantener concentraciones de AU por debajo de 5 mg/dl. El febuxostat esta aprobado en Europa para el tratamiento de la hiperuricemia crónica en presencia de algún evento clínico relacionado (incluyendo historia de tofos o artritis gotosa). Las dosis recomendadas de febuxostat son 80 mg/día, incrementando a 120 mg/día dos a cuatro semanas después hasta alcanzar el objetivo terapéutico (AU < 6 mg/dl). Se recomienda realizar tratamiento profiláctico (colchicina o AINEs) durante los primeros meses del tratamiento.
El febuxostat estaría indicado en pacientes con intolerancia a otros fármacos hipouricemiantes, en pacientes con depósitos extensos de tofos, en pacientes con concentraciones basales elevadas de AU y en pacientes con insuficiencia renal leve a moderada.
Otras ventajas añadidas del febuxostat incluyen su utilidad en pacientes ancianos y en pacientes con insuficiencia leve a moderada. Adicionalmente no interacciona con fármacos habitualmente utilizados en pacientes con gota como la colchicina, la indometacina, el naproxeno, los anticoagulantes orales o la hidroclorotiazida.
No se recomienda el febuxostat en pacientes con cardiopatía isquémica, en pacientes con tratamiento concomitante con azatioprina o mercaptopurina, o en pacientes con insuficiencia renal o hepática grave.
Referencias
1. Neogi T. Clinical practice. Gout. N Engl J Med 2011; 364(5):443-452. [ Links ]
2. Pascual E, Sivera F. Diagnóstico de artropatía microcristalina. Reumatol Clin 2008;4(Supl 3):45-49. [ Links ]
3. Pascual E, Sivera F. Therapeutic advances in gout. Curr Opin Rheumatol 2007;19(2):122-127. [ Links ]
4. Li S, Micheletti R. Role of diet in rheumatic disease. Rheum Dis Clin North Am 2011;37(1):119-133. [ Links ]
5. Iglesias-Gamarra A, Quintana, G, Restrepo Suárez, J F. Prehistoria, historia y arte de la Reumatología Gota y espondilitis anquilosante. Rev Col Reumatol 2006;(13):120-141. [ Links ]
6. Kohn NN, Hughes RE, Mc CD, Jr., Faires JS. The significance of calcium phosphate crystals in the synovial fluid of arthritic patients: the "pseudogout syndrome". II. Identification of crystals. Ann Intern Med 1962;56:738-745. [ Links ]
7. Scott JT. Comparison of allopurinol and probenecid. Ann Rheum Dis 1966;25(6 Suppl):623-626. [ Links ]
8. Day RO, Birkett DJ, Hicks M, Miners JO, Graham GG, Brooks PM. New uses for allopurinol. Drugs 1994;48(3):339-344. [ Links ]
9. Dalbeth N, So A. Hyperuricaemia and gout: state of the art and future perspectives. Ann Rheum Dis 2010;69(10):1738-1743. [ Links ]
10. Graessler J, Graessler A, Unger S, Kopprasch S, Tausche AK, Kuhlisch E, et al. Association of the human urate transporter 1 with reduced renal uric acid excretion and hyperuricemia in a German Caucasian population. Arthritis Rheum 2006;54(1):292-300. [ Links ]
11. Kolz M, Johnson T, Sanna S, Teumer A, Vitart V, Perola M, et al. Meta-analysis of 28,141 individuals identifies common variants within five new loci that influence uric acid concentrations. PLoS Genet 2009;5(6):e1000504. [ Links ]
12. Hoffman HM, Wanderer AA. Inflammasome and IL-1beta-mediated disorders. Curr Allergy Asthma Rep 2010;10(4):229-235. [ Links ]
13. Merriman TR, Dalbeth N. The genetic basis of hyperuricaemia and gout. Joint Bone Spine 2010;78(1):35-40. [ Links ]
14. Peñaranda-Parada E S-BN, Restrepo J F, Rondón-Herrera F, Millán A, Iglesias Gamarra A. Enfermedades Autoinflamatorias. Rev Col Reumatol 2010;17(2): 85-95. [ Links ]
15. Sidiropoulos PI, Goulielmos G, Voloudakis GK, Petraki E, Boumpas DT. Inflammasomes and rheumatic diseases: evolving concepts. Ann Rheum Dis 2008;67(10):1382-1389. [ Links ]
16. Martinon F, Petrilli V, Mayor A, Tardivel A, Tschopp J. Gout-associated uric acid crystals activate the NALP3 inflammasome. Nature 2006;440(7081):237-241. [ Links ]
17. Dinarello CA. Blocking interleukin-1beta in acute and chronic autoinflammatory diseases. J Intern Med 2011; 269(1):16-28. [ Links ]
18. So A, De Smedt T, Revaz S, Tschopp J. A pilot study of IL-1 inhibition by anakinra in acute gout. Arthritis Res Ther 2007;9(2):R28. [ Links ]
19. Terkeltaub R, Sundy JS, Schumacher HR, Murphy F, Bookbinder S, Biedermann S, et al. The interleukin 1 inhibitor rilonacept in treatment of chronic gouty arthritis: results of a placebo-controlled, monosequence crossover, non-randomised, single-blind pilot study. Ann Rheum Dis 2009;68(10):1613-1617. [ Links ]
20. A So DMM, Shamim T Canakinumab (ACZ885) vs. triamcinolone acetonide for treatment of acute flares and prevention of recurrent flares in gouty arthritis patients refractory to or contraindicated to NSAIDs and/or colchicine. Arthritis Rheum 2009;60:LB4. [ Links ]
21. Burns CM, Wortmann RL. Gout therapeutics: new drugs for an old disease. Lancet 2011;377(9760): 165-177. [ Links ]
22. Campion EW, Glynn RJ, DeLabry LO. Asymptomatic hyperuricemia. Risks and consequences in the Normative Aging Study. Am J Med 1987;82(3):421-426. [ Links ]
23. Perez-Ruiz F. Treating to target: a strategy to cure gout. Rheumatology (Oxford) 2009;48 Suppl 2:ii9-ii14. [ Links ]
24. de Miguel E. Papel de la ecografía en las artritis microcristalinas. Reumatol Clin 2008(Supl 3:):50-54. [ Links ]
25. Perez-Ruiz F, Martin I, Canteli B. Ultrasonographic measurement of tophi as an outcome measure for chronic gout. J Rheumatol 2007;34(9):1888-1893. [ Links ]
26. Shah A, Keenan RT. Gout, hyperuricemia, and the risk of cardiovascular disease: cause and effect? Curr Rheumatol Rep 2010;12(2):118-124. [ Links ]
27. Doherty M. New insights into the epidemiology of gout. Rheumatology (Oxford) 2009;48 Suppl 2:ii2-ii8. [ Links ]
28. Krishnan E. Inflammation, oxidative stress and lipids: the risk triad for atherosclerosis in gout. Rheumatology (Oxford) 2010;49(7):1229-1238. [ Links ]
29. Choi HK, Curhan G. Independent impact of gout on mortality and risk for coronary heart disease. Circulation 2007;116(8):894-900. [ Links ]
30. Feig DI, Kang DH, Johnson RJ. Uric acid and cardiovascular risk. N Engl J Med 2008;359(17):1811-1821. [ Links ]
31. Kang DH, Nakagawa T, Feng L, Watanabe S, Han L, Mazzali M, et al. A role for uric acid in the progression of renal disease. J Am Soc Nephrol 2002;13(12): 2888-2897. [ Links ]
32. Feig DI, Soletsky B, Johnson RJ. Effect of allopurinol on blood pressure of adolescents with newly diagnosed essential hypertension: a randomized trial. Jama 2008;300(8):924-932. [ Links ]
33. Wright SA, Filippucci E, McVeigh C, Grey A, McCarron M, Grassi W, et al. High-resolution ultra-sonography of the first metatarsal phalangeal joint in gout: a controlled study. Ann Rheum Dis 2007; 66(7):859-864. [ Links ]
34. Anker SD, Doehner W, Rauchhaus M, Sharma R, Francis D, Knosalla C, et al. Uric acid and survival in chronic heart failure: validation and application in metabolic, functional, and hemodynamic staging. Circulation 2003;107(15):1991-1997. [ Links ]
35. Nagahama K, Iseki K, Inoue T, Touma T, Ikemiya Y, Takishita S. Hyperuricemia and cardiovascular risk factor clustering in a screened cohort in Okinawa, Japan. Hypertens Res 2004;27(4):227-233. [ Links ]
36. Kim SY, Guevara J P, Kim KM, Choi HK, Heitjan D F, Albert DA. Hyperuricemia and coronary heart disease: a systematic review and meta-analysis. Arthritis Care Res (Hoboken) 2010;62(2):170-180. [ Links ]
37. Elisaf M, Tsimichodimos V, Bairaktari E, Siamopoulos KC. Effect of micronized fenofibrate and losartan combination on uric acid metabolism in hypertensive patients with hyperuricemia. J Cardiovasc Pharmacol 1999;34(1):60-63. [ Links ]
38. Zhang W, Doherty M, Bardin T, Pascual E, Barskova V, Conaghan P, et al. EULAR evidence based recommendations for gout. Part II: Management. Report of a task force of the EULAR Standing Committee for International Clinical Studies Including Therapeutics (ESCISIT). Ann Rheum Dis 2006;65(10):1312-1324. [ Links ]
39. Whelton A. Current and future therapeutic options for the management of gout. Am J Ther 2010; 17(4):402-417. [ Links ]
40. Perez-Ruiz F, Liote F. Lowering serum uric acid levels: what is the optimal target for improving clinical outcomes in gout? Arthritis Rheum 2007;57(7):1324-1328. [ Links ]
41. Pascual E, Sivera F. Time required for disappearance of urate crystals from synovial fluid after successful hypouricaemic treatment relates to the duration of gout. Ann Rheum Dis 2007;66(8):1056-1058. [ Links ]
42. Rider TG, Jordan KM. The modern management of gout. Rheumatology (Oxford) 2010;49(1):5-14. [ Links ]
43. Love BL, Barrons R, Veverka A, Snider KM. Urate-lowering therapy for gout: focus on febuxostat. Pharmacotherapy 2010;30(6):594-608. [ Links ]
44. Perez-Ruiz F DN, Schlesinger N. Febuxostat, a novel drug for the treatment of hyperuricemia of gout Future Rheumatol 2008;5:421-427. [ Links ]
45. Edwards NL. Febuxostat: a new treatment for hyperuricaemia in gout. Rheumatology (Oxford) 2009; 48 Suppl 2:ii15-ii19. [ Links ]
46. Becker MA, Schumacher HR, Espinoza LR, Wells A F, MacDonald P, Lloyd E, et al. The urate-lowering efficacy and safety of febuxostat in the treatment of the hyperuricemia of gout: the CONFIRMS trial. Arthritis Res Ther 2010;12(2):R63. [ Links ]
47. Schumacher HR, Jr., Becker MA, Wortmann RL, Macdonald PA, Hunt B, Streit J, et al. Effects of febuxostat versus allopurinol and placebo in reducing serum urate in subjects with hyperuricemia and gout: a 28-week, phase III, randomized, double-blind, parallel-group trial. Arthritis Rheum 2008;59(11): 1540-1548. [ Links ]
48. Becker MA, Schumacher HR, Jr., Wortmann RL, MacDonald PA, Eustace D, Palo WA, et al. Febuxostat compared with allopurinol in patients with hyperuricemia and gout. N Engl J Med 2005;353(23):2450-2461. [ Links ]
49. Schumacher HR, Jr., Becker MA, Lloyd E, MacDonald PA, Lademacher C. Febuxostat in the treatment of gout: 5-yr findings of the FOCUS efficacy and safety study. Rheumatology (Oxford) 2009;48(2):188-194. [ Links ]
50. Becker M SH, MacDonald PA. Urate-lowering therapy in subjects with gout: interim results from the febuxostat comparative extension long-term study (EXCEL). Ann Rheum Dis 2007;66(Suppl II):230. [ Links ]














