Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Acessos
Acessos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares em
SciELO
Similares em
SciELO -
 Similares em Google
Similares em Google
Compartilhar
Revista Colombiana de Reumatología
versão impressa ISSN 0121-8123
Rev.Colomb.Reumatol. v.18 n.3 Bogotá jul./set. 2011
ARTÍCULO DE REVISIÓN
Ricardo Pineda-Tamayo3, Juan-Manuel Anaya4
¿Quién de vosotros queriendo edificar una torre, no se sienta primero y
calcula los gastos, a ver si tiene lo que necesita para acabarla?
Lucas 14:28
1Asistente de Investigación, Centro de Estudio de Enfermedades Autoinmunes (CREA), Universidad del Rosario, Bogotá, Colombia.
2Profesor Asociado. Escuela de Estadística. Universidad Nacional de Colombia, Sede Medellín, Colombia.
3Director, ART-Médica IPS, Medellín, Colombia.
4Profesor Titular y Director, Centro de Estudio de Enfermedades Autoinmunes (CREA), Universidad del Rosario, Bogotá, Colombia.
Los autores declaran no presentar ningún conflicto de interés al momento de la redacción del manuscrito.
Correspondencia: Juan-Manuel Anaya, MD, DrSc (c). Centro de Estudio de Enfermedades Autoinmunes (CREA). Escuela de Medicina y Ciencias de la Salud. Universidad del Rosario, Bogotá, Colombia. Tel.: +57 1 349 9650; fax: +57 1 349 9410. Correo electrónico: anayajm@gmail.com.
Recibido: 25 de abril de 2011 Aceptado: 7 de julio de 2011
Resumen
Los gastos en salud y el uso de medicamentos han aumentado de forma importante en los últimos años, lo que alerta a gobiernos y entes sanitarios y puede relacionarse con algunos fenómenos: prescripción médica poco estandarizada, ganancias exageradas de la industria farmacéutica, avances en biotecnología y desperdicio de recursos, falta de comunicación entre gestores públicos y médicos clínicos y ausencia de regulación en precios de fármacos. La importancia de la farmacoeconomía se fundamenta en varios aspectos: optimización de prescripción médica, papel crucial en la comercialización y la distribución de medicamentos, capacidad de mostrar un amplio panorama del impacto social y económico de las enfermedades, como de abrir perspectivas de investigación en varios campos del conocimiento. Dentro de los tipos de estudios farmacoeconómicos se encuentran los que expresan la unidad de ingreso (costos) en términos monetarios y los resultados en unidades monetarias, naturales o de utilidad: reducción de costos (costo minimización), costo beneficio, costo utilidad y costo efectividad, como también los que estudian el panorama global de las enfermedades (análisis costo de la enfermedad). Los costos en salud se distribuyen de la siguiente manera: costos directos (médicos y no médicos), indirectos (impacto en la sociedad como unidad productiva) e intangibles (relacionados con calidad de vida de pacientes y familiares). La farmacoeconomía permite una mejor práctica clínica, sistemas de salud más eficientes y un consumo de recursos más racional. El uso de estos estudios es necesario para estructurar programas de salud y tomar decisiones. Así mismo es recomendada la inclusión de conceptos de economía de la salud en programas de medicina y ciencias de la salud.
Palabras clave: economía de la salud, farmacoeconomía, economía farmacéutica.
Summary
Health expenditures and medication usage have increased dramatically in last years, situation that alerts governments and health authorities, and than can be related with some facts: not standardized medical prescription, excessive gains of the pharmaceutical industry, recent advances in biotechnology related with resource wastefulness, lack of communication between public health entities and clinical physicians and lack of consistent regulatory policies about drug prices. The importance of pharmacoeconomics is based on some aspects: better medical prescription, important role in commercialization and distribution of medicines, capacity of showing a broad and complete scenario of the social and economic impact of diseases, as opening research perspectives in different scientific fields. Within pharmacoeconomical analyses we can found those that show incomes (costs) in monetary units and show outcomes in monetary, natural or utility units: cost minimization, cost benefit, cost utility and cost effectiveness, and also we can found those analyses that study the general panorama of diseases (cost of illness studies). Health costs can be divided into: direct costs (medical and not medical), indirect (economical impact on society) and intangible (related with quality of life of patients and their families). Pharmacoeconomics can lead to a better medical practice, to more efficient health systems and to a more rational usage of resources. These studies are necessary for a proper structure of health programs, as for decision making. The inclusion of health economics concepts within medical and health sciences curricula is also recommended.
Key words: medical economics, pharmacoeconomics, health care costs.
Introducción
¿Cuánto vale la salud de cada uno? ¿Cuánto un año de vida? ¿Cuánto vale ver bien? ¿Qué agente biológico es más costo-efectivo para tratar la artritis reumatoide?. Estas preguntas todavía no tienen respuesta en nuestro país, ni en muchos otros. Sin embargo, economistas y médicos trabajan de la mano para tratar de responderlas, basados en herramientas de la economía de la salud, y en particular, de un área hasta ahora poco conocida pero muy importante para la toma de decisiones en salud, la farmaco-economía, la cual se define como la rama de la economía de la salud que se ocupa de la identificación, medición y comparación de los costos (recursos consumidos) y las consecuencias (clínicas, económicas y humanísticas) de los medicamentos, como de otras intervenciones médicas y servicios farmacéuticos, para los individuos, la sociedad y los sistemas de salud1,2.
La proporción del producto interno bruto (PIB) empleada en salud ha aumentado de forma importante en los últimos 30 años; sin embargo, la proporción empleada en medicamentos no ha crecido proporcionalmente a este aumento1. En Estados Unidos se ha observado un aumento dramático en el uso de medicamentos sin fórmula médica en los últimos cincuenta años, pasando de 700 millones de dólares en los cincuentas, a billones de dólares actualmente1.
El suministro de medicamentos es un objetivo particular de gobiernos, entes sanitarios y aseguradores, el cual representa del 10 al 15% de la mayoría de los presupuestos gubernamentales en salud (en segundo lugar después de los salarios)3,4. Este suministro debe enmarcarse en términos de eficiencia y optimización de recursos4, teniendo en cuenta que su medición es más sencilla que la de otros costos sanitarios, además de otros fenómenos tales como: la prescripción innecesaria y poco estandarizada por parte del cuerpo médico y las ganancias de la industria farmacéutica, sobredimensionadas en algunos casos3-5. Cabe resaltar que muchas veces las evaluaciones económicas se encuentran ligadas a áreas comerciales de farmacéuticas, lo que puede producir sesgos (selección, análisis metodológico y utilización y difusión de resultados), y lo que hace que prevalezca en su utilización el enfoque de rentabilidad más que los principios de salud pública5, por lo que el Estado debe tener una función rectora y un empoderamiento claro sobre la información y los propósitos de estas evaluaciones.
Los recientes avances en biotecnología han generado un desarrollo impensable en décadas pasadas, cuyas herramientas y ventajas están a plena disposición del cuerpo médico6. La legislación sobre la utilización de estas innovaciones y los vacíos en la regulación del mercadeo de las mismas han llevado a los médicos hacia el riesgo del sobre-tratamiento y el sobre-diagnóstico indiscriminado, con la idea de proteger a sus pacientes y protegerse ellos mismos, situación que tiene en bancarrota el sistema de salud6. Esto responde, en gran parte, a las presiones de la sociedad actual, donde no se tolera la incertidumbre ni la espera, y donde los manejos conservadores a veces son mal vistos, haciendo que el precepto de primero no hacer daño (Primun non nocere) se haya cambiado por hacerlo todo, creyendo que hacerlo evitará que los médicos sean juzgados por colegas, abogados y pacientes informados y demandantes6. Muchos de los exámenes y tratamientos se prescriben tan solo porque son disponibles, antes que su importancia, seguridad y costo efectividad hayan sido determinadas6. Esto impacta profundamente países como el nuestro, ya que pretendemos copiar los modelos y protocolos de países industrializados sin antes considerar que tenemos menos recursos para distribuir, mayores falencias en atención y direccionamiento de recursos y mayores dificultades en el acceso rutinario a tecnologías de avanzada. Además de lo anterior, tenemos un PIB y un ingreso per cápita muy inferior al de los países que pretendemos imitar.
Quién se beneficia realmente cuando se ordena un examen o se instaura un tratamiento: ¿El paciente?, ¿El laboratorio?, ¿Los administradores del sistema de salud?, o ¿Los que invierten en él? De las anteriores preguntas también surge necesariamente la pregunta: ¿Quién pierde atención sanitaria cuando se invierte dinero en intervenciones y tratamientos innecesarios?6.
A pesar que los países andinos (Colombia, Ecuador, Bolivia y Chile) trabajan en la negociación y compra de medicamentos para evitar que los costos elevados perjudiquen sus presupuestos, y que los monopolios de importadores, productores y multinacionales encarezcan aún más los costos del suministro7, en Colombia se ha visto un fracaso de la implementación de políticas de control de precios y regulación de este suministro, llevando al plan obligatorio de salud (POS) al estado de quiebra7.
Si bien los medicamentos no son el mayor gasto en salud, juegan un papel fundamental en el manejo integral y eficiente en pacientes hospitalizados (en promedio cada uno recibe de 6 a 8 fármacos diarios)1. Este hecho explica en parte, la disminución del tiempo de estancia hospitalaria a través de los años1.
Con frecuencia se observa desinterés en los médicos sobre temas económicos. Esto se fundamenta en que existe un conflicto teórico entre clínicos y gestores públicos, ya que los clínicos buscan la mayor eficacia para el paciente a través de una ética individual fundamentada en el principio de beneficencia, mientras que los gestores buscan maximizar la salud para el conjunto de la población a partir de los recursos disponibles según una ética colectiva basada en el principio de justicia8. Desde esta perspectiva puede ser necesario sacrificar recursos para un paciente concreto para obtener un beneficio general8. Es difícil para los médicos aceptar la idea de perder libertad clínica para satisfacer planes gubernamentales, ya que existe una noción general de que la priorización de recursos no les incumbe y no hace parte de su quehacer asistencial8. En la práctica clínica aplican priorización y eficiencia de una manera más o menos intuitiva (ej. cuando un clínico decide qué paciente ocupará una cama en la unidad de cuidado intensivo, o cuando decide no solicitar resonancia magnética a todos los pacientes con cefalea), soportada en el conocimiento de que los recursos, al igual que su tiempo son limitados8. El problema ético real aparece cuando la opción más eficaz no es necesariamente la más eficiente, poniendo en conflicto el interés particular con el colectivo8.
Recientemente ha habido un empoderamiento de economistas, administradores, aseguradores e industria farmacéutica sobre decisiones en salud, desplazando el papel protagónico que tenía el médico3. Hoy la salud se ha vuelto un servicio inmerso en estrategias de mercadeo, influenciado por factores políticos y de rentabilidad. Esta situación, obliga al médico a conocer la interacción entre los recursos, la sociedad y su práctica diaria, en beneficio de los pacientes, del quehacer científico responsable y de su propio bienestar laboral. En el presente artículo se revisan los principales conceptos de la farmacoeconomía, la rama de la economía de la salud que se ocupa del estudio de esta interacción4, y que busca responder a la pregunta de cuánto vale la salud de cada uno9.
La salud como plantea Frenk, representa el punto donde se articulan la política social, con sus metas de equidad y bienestar y la política económica con su interés en la productividad, siendo imposible desligar estos dos aspectos5. En ese sentido la economía de la salud, se define como la aplicación de la teoría económica a fenómenos y problemas relacionados con la salud10. Mushkim definió y describió la economía de la salud como un campo de investigación cuyo objeto de estudio es el uso óptimo de los recursos para la atención de la enfermedad y la promoción de la salud, y su tarea consiste en organizar la eficiencia de los servicios de salud sugiriendo formas para mejorar esta organización11.
Perspectiva histórica
La farmacoeconomía es una ciencia cambiante y relativamente reciente, derivada de la economía de la salud4. Durante los años sesenta, la farmacéutica surge como disciplina y los conceptos de farmacocinética se vuelven parte integral de la educación y la investigación1. Simultáneamente la economía en salud empieza a cobrar importancia estableciéndose como un campo de estudio específico4. En la década de los setenta, surgen los conceptos de costo beneficio y costo efectividad1,4. El primer libro especializado en economía en salud es publicado en 197312. En 1979, Bootman y colaboradores realizan un estudio de costo beneficio del uso de aminoglucósidos en pacientes quemados con septicemia1. En 1986 Townsend acuña el término "farmacoeconomía"1. También en los ochentas, las herramientas de medición de resultados en clínica y salud empiezan a crearse e implementarse4. Desde entonces hasta la actualidad, la farmacoeconomía ha sufrido una transición desde las ciencias económicas hacia el área de la salud.
Importancia de la farmacoeconomía
Ningún país en el mundo cuenta con la capacidad de proveer a través del recurso público todos los servicios en salud que los ciudadanos llegarán a necesitar13. Actualmente el desarrollo acelerado amplía la brecha entre lo tecnológicamente posible y lo económicamente financiable, restricción que fundamenta la importancia de la evaluación económica13. La farmacoeconomía permite optimizar la prescripción médica en términos de costos, objetivos clínicos, utilidad y calidad de vida1,3,4. Por otro lado, apoya decisiones y sustenta comparaciones entre alternativas de manejo (farmacológicas, quirúrgicas, manejo expectante, etc.)1,2.
Orienta y soporta la inclusión de medicamentos en planes de salud5,14. En países industrializados favorece la eficiencia, ya que está definido con exactitud quién y cuánto se debe pagar por el fármaco (60% de la cobertura en medicamentos financiada por el estado)5. En países en desarrollo tiene un enfoque distinto, en el cual se debe dar prioridad al análisis macroeconómico por encima de los fármacos individuales y donde el estado está prácticamente ausente en la definición de mecanismos de financiamiento de medicinas (en muchos países el consumidor paga directamente más del 70% del gasto en medicamentos), encontrando algunos escenarios donde no se trata de elegir la alternativa más apropiada sino en cambio de tener acceso a la única disponible, llegando a extremos donde el objetivo no es la calidad de vida sino la supervivencia5.
Tiene un papel capital en el ingreso al mercado, la comercialización y la distribución de medicamentos14,15, cumpliendo tres objetivos principales: determinar si se continúa en la búsqueda de un nuevo producto (fases investigación o desarrollo), justificar el precio de las alternativas y calcular los precios de reembolso5. Australia y Canadá fueron los primeros países en exigir estudios farmacoeconómicos como requisito legal para determinar el reembolso de nuevos fármacos15. Al respecto algunos autores plantean que la relación costo-efectividad se debe convertir en un requisito legal como son la eficacia y la seguridad14. Para el 2001, cinco países europeos (Portugal, Holanda, Finlandia, Noruega y Dinamarca) incluyeron estos estudios como requisito complementario para la presentación y negociación de precios15. En otras naciones (Francia, Italia, Alemania y Suecia), orientan sobre el papel de los fármacos en la práctica clínica15. Sin embargo, los resultados no deben ser extrapolados de un país a otro, ya que el contexto sociodemográfico y económico, como la configuración de sistemas de salud puede variar entre naciones5. Tampoco basta calcular el costo total de una enfermedad para un periodo de tiempo, o la distribución de costos relacionados (ver más adelante distribución de costos en salud) si no se tiene en cuenta la relación entre estos resultados y el ingreso per cápita y el crecimiento económico del país donde se lleva a cabo el estudio.
Tiene varias ventajas a la hora de analizar el impacto de una enfermedad o intervención: Puede mostrar distintas perspectivas del mismo fenómeno (pacientes y familiares, personal de salud, administradores y sociedad)1,4. Permite comprender mejor el peso de las enfermedades a nivel social y económico, como su relación con el sistema de salud1. Por otro lado, orienta el proceso de toma de decisiones a nivel gubernamental y de salud pública, favoreciendo la correcta distribución de recursos1,4. En el marco científico, revela escenarios para el desarrollo de investigaciones básicas y clínicas y favorece la profundización en aspectos farmacoeconómicos puntuales. Por ejemplo, una vez conocido el impacto global de una enfermedad (análisis costo de la enfermedad) se pueden hacer estudios de costo-efectividad sobre aspectos de interés.
Principios económicos
La economía, definida por algunos como la ciencia de la escasez16, se encarga de las relaciones y alternativas entre las preferencias, las necesidades y la disponibilidad de recursos1. Otras definiciones plantean que es la ciencia que estudia la conducta humana como una relación entre fines y medios escasos aplicables a usos alternativos17. Según A. Smith debemos entender como objeto de la economía el conjunto de productos del trabajo capaces de satisfacer las necesidades humanas17.
Economía del bienestar (Welfare economics). Es la rama de la economía que busca maximizar el bienestar social. Aplicada a la economía de la salud, busca maximizar la salud en torno a preferencias individuales como sociales, yendo más allá del enfoque individualista de bienestar18.
Descuento (discounting). Se define como el proceso mediante el cual se reducen costos y beneficios que ocurren en momentos distintos del tiempo a una medida común, aplicando tasas apropiadas de descuento19. Esto se relaciona con que existe un periodo de tiempo entre la inversión en salud y la obtención del beneficio, lo que explica que se prefiera beneficiarse antes de pagar3,12. Estas tasas oscilan generalmente entre el 3 y el 6 %20.
Incertidumbre (uncertainty). Los datos de análisis económicos provienen de muchas fuentes, las cuales algunas veces son incompletas y no suministran todos los datos necesarios, generando incertidumbre y obligando a trabajar con supuestos sobre algunos parámetros21. Los análisis de sensibilidad, son una herramienta que permite evaluar la incertidumbre dentro de modelos económicos en salud, determinando cual es el impacto de las diferentes variables en los resultados y qué tanto cada variable particular y qué tanto los cambios entre variables afectan estos resultados (Ej. En estudios de costo efectividad se pueden utilizarse para analizar el impacto que tendrían los cambios sobre cada variable en los resultados (razones de costo efectividad)22.
Producto interno bruto (PIB): indicador de todos los bienes y servicios producidos en un país durante un año23. El PIB Real mide las variaciones que experimenta la producción física de la economía entre periodos diferentes, valorando todos los bienes con los mismos precios en unidades monetarias constantes, mientras el PIB Nominal mide el valor de la producción de un determinado periodo a los precios de ese periodo en unidades monetarias corrientes23.
Costo de oportunidad. Se refiere al costo de las oportunidades que se pierden por no dar a los recursos el fin para el que tienen mayor valor24. En salud aplicaría como los beneficios dejados de obtener al escoger una alternativa terapéutica por encima de la siguiente mejor alternativa16, partiendo del hecho que no se puede invertir la misma cantidad de dinero dos veces (alternativas mutuamente excluyentes). La cuestión no es lo que ofrece el nuevo tratamiento sino lo que ofrece por encima de los ya existentes3. En otros escenarios sanitarios cobra importancia el concepto de costo de oportunidad: recursos de inversión perdidos al ser utilizados tratando una enfermedad, cuando no se ofrece el mejor tratamiento o cuando se incurre en desperdicios de insumos o medicamentos.
Costo marginal. Se define como el costo adicional al aumentar la tasa de producción o el volumen de una actividad25. También se puede explicar como el costo adicional en que se incurre al aumentar en una unidad la producción (o prestación del servicio)26. Un escenario que se relaciona con este concepto es el de una intervención que reduce la estancia hospitalaria16: existiría la tentación de evaluar el beneficio teniendo en cuenta el costo de un día promedio (lo que es incorrecto), ya que hay costos capitales fijos que no se modifican o lo hacen de manera insignificante (gastos de laboratorio, cocina y mantenimiento locativo, etc.)16. Los únicos costos que se modifican realmente son los de ocupación física de la cama, comidas, tratamientos y probablemente cuidados de enfermería3,16. Los costos marginales son de difícil medición, por lo que constantemente existe la tendencia de evaluar resultados a través de promedios, generando conclusiones que muestran un ahorro mayor con respecto al que verdaderamente ocurre16. En salud la mejor interpretación sería el costo asignado al último tratamiento o a la atención del último paciente. La estimación de costos marginales puede determinarse de forma más exacta cuando los programas de patologías específicas se enmarcan dentro de objetivos de gestión de riesgo.
Eficacia, efectividad y eficiencia
Los conceptos de eficacia, efectividad y eficiencia se emplean en diversos contextos, sin embargo su aplicabilidad general es similar. En términos de gestión de procesos, la eficacia es el grado en el que se realizan las actividades planificadas y se alcanzan los resultados planificados27. La efectividad es la medida del impacto de la gestión tanto en el logro de los resultado planificados como en el manejo de los recursos utilizados y disponibles y la eficiencia es la relación entre el resultado alcanzado y los recursos utilizados, sin embargo en ciencias de la salud se pueden comprender y aplicar desde otra perspectiva (Tabla 1)27.

En medicina, la eficacia es la medida o evaluación del nivel del logro alcanzado en relación con el objetivo deseado, medido en condiciones ideales, y en el contexto de ensayos clínicos con grupos selectos de pacientes, muchos criterios de inclusión/exclusión, seguimiento estricto y evitando circunstancias que puedan interferir con el proceso28. La efectividad es la medida o evaluación del nivel del logro alcanzado en relación con el objetivo deseado, en condiciones reales y en el contexto de ensayos clínicos modernos con población heterogénea, seguimiento menos riguroso, mayor tamaño de muestra y donde las circunstancias pueden interferir con el resultado28. Puede ocurrir que intervenciones que se muestran eficaces no sean efectivas al ser extrapoladas a un escenario habitual28. La definición de eficiencia es más homogénea y en general se refiere a lo planteado anteriormente27,28. Se entiende que una intervención es más eficiente que otra cuando se obtiene un producto específico mayor con la utilización de los mismos recursos.
Distribución de costos en salud
Esta distribución es importante para comprender la manera en que se organizan los gastos y los recursos sanitarios. Es fundamental para entender los análisis de costo de la enfermedad y para analizar resultados de otros estudios farmacoeconómicos y otros métodos en economía de la salud.
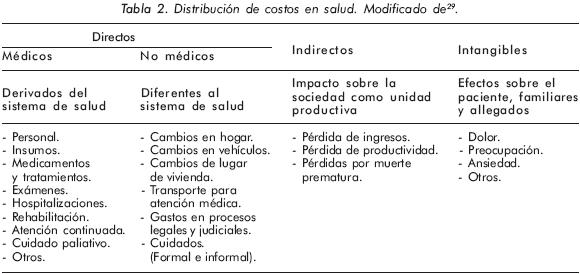
Los costos directos representan los gastos generados directamente por la enfermedad29. Se dividen en médicos y no médicos. Los primeros se relacionan con el sistema de salud (diagnóstico, tratamiento, hospitalizaciones, atención continuada, rehabilitación, cuidado paliativo y otros)29,30, mientras los segundos se asocian con: modificaciones en infraestructura (hogar, auto, etc.) generadas por la patología, gastos por cambio de vivienda, transporte relacionado con atención médica, algunos gastos relacionados con procesos legales y judiciales y cuidados informales29,30.
Los costos indirectos (costos de productividad) son los que afectan a la sociedad como unidad productiva (pérdidas causadas por enfermedad o muerte)29,30. Incluyen: pérdida de ingresos y disminución de productividad por incapacidad laboral (para el paciente, familiares y allegados) y mortalidad temprana3,29-31. Algunos autores prefieren denominarlos costos de productividad para evitar confusiones ya que en contabilidad los costos indirectos se refieren a otro tipo de costos30.
Finalmente los costos intangibles corresponden a factores como dolor, ansiedad, preocupación y otras formas de estrés en pacientes y familiares3,29. Estos generalmente se estudian desde una perspectiva de calidad de vida y a partir de ella se pueden realizar ajustes y cálculos económicos (Tabla 2)29,32.
Perspectiva (visión) en estudios farmacoeconómicos
Los resultados (outcomes) describen el valor y las consecuencias de las intervenciones. Cabe destacar que sus interpretaciones pueden variar de acuerdo a la visión con la cual se apliquen y analicen1.
Visión clínica: médicos, investigadores y otros profesionales de salud, los interpretan en relación a variables clínicas y paraclínicas y perspectivas de estudios de investigación, buscando estandarizar guías de manejo y protocolos diagnósticos, generando caminos hacia nuevos descubrimientos1.
Visión económica: administradores, proveedores de salud, industria farmacéutica, economistas y entes gubernamentales, los interpretan en términos de impacto económico de decisiones en salud y en términos de utilidades y dividendos, teniendo en cuenta al estado como distribuidor de recursos, como también teniendo en cuenta intereses particulares y lucrativos de empresas y mercados1.
Visión humanística: los pacientes, sus familiares y amigos se empoderan cada vez más de su situación en salud, documentándose sobre resultados de terapias a través de internet y otras fuentes de información, donde la principal inquietud son los resultados humanísticos y de calidad de vida y los efectos y beneficios que las intervenciones tendrán en ellos y los que han tenido en otros pacientes1. La inclinación de este grupo es hacia resultados de utilidad más que hacia resultados de efectividad.
Diseños metodológicos en farmacoeconomía
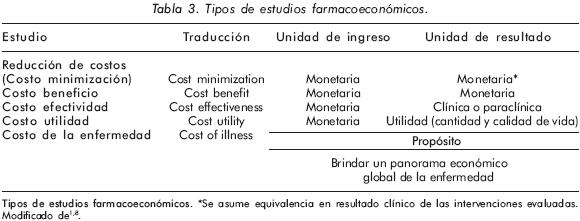
Los componentes esenciales de los estudios farmacoeconómicos son: la perspectiva (visión), el horizonte en el tiempo, los costos y los resultados33, teniendo en cuenta que los costos (ingresos, en inglés incomes) siempre se cuantifican en unidades monetarias y los resultados se expresan tanto en unidades monetarias como en otras unidades1,8,34. Dicho de otra manera, los costos siempre se abordan de una manera común pero los resultados (beneficios) se expresan de formas distintas. El horizonte en el tiempo se refiere al periodo escogido para la realización del estudio. Éste depende del propósito de la investigación (pudiendo ir desde pocas semanas hasta muchos años)21. Al escogerlo es importante que tanto los recursos consumidos como los resultados de los tratamientos a evaluar sean medibles en ese periodo21.
Para la correcta aplicación de la farmacoeconomía se requiere un grupo multidisciplinario (fármacoeconomistas, epidemiólogos, estadísticos, personal de investigación y personal entrenado en recolección de datos)4. En el diseño y la elaboración de estudios farmacoeconómicos existen diferentes metodologías las cuales se resumen a continuación.
Diseños retrospectivos: comprende el análisis de datos de estudios clínicos y de cohorte realizados previamente4. Para algunos autores es el diseño ideal en farmacoeconomía4. Generalmente se utilizan bases de datos (creadas con fines investigativos o administrativos) o se revisan historias clínicas en busca de variables de interés15. Este diseño tiene varias ventajas: permite conocer datos de grupos de pacientes que no intervienen en fases de desarrollo clínico (niños, ancianos, mujeres embarazadas, polimedicados, etc.), posibilita el estudio enfermedades raras y se puede disponer de resultados en un tiempo y a un costo razonables15. También tiene algunas limitaciones: puede haber ausencia de datos en las bases o historias clínicas, pueden aparecer sesgos de muestreo y si se analizan ensayos clínicos finalizados los datos disponibles sobre costos podrían ser parciales o incompletos15.
Diseños prospectivos: pueden ser aspectos económicos como parte adicional de un ensayo clínico o estrictamente evaluaciones económicas4. A veces pueden ser poco útiles por ser largos, demorados y costosos4. Se desarrollan a través de dos métodos: estudios observacionales o ensayos clínicos15. Los primeros tienen la ventaja de ser rápidos en su realización15. Tienen desventajas relacionadas con ausencia de validaciones sistemáticas de la información contenida15. Los ensayos clínicos en farmacoeconomía se usan para obtener datos de eficiencia, dada su validez interna, fiabilidad, credibilidad y relevancia. Tienen el inconveniente que de acuerdo al rigor del estudio, la población incluida podría no representar el conjunto de la población, lo que les restaría validez externa. Adicionalmente, en ellos se mide eficacia y no efectividad, donde no queda claro cuál debería ser la mejor manera de recoger el consumo de recursos15. Para reducir estos problemas se utilizan ensayos clínicos pragmáticos (naturalísticos) con criterios de inclusión poco exigentes, buscando rememorar condiciones habituales y uso de medicamentos en un contexto real15.
Diseños predictivos: cada día son más empleados, por ser prácticos, poco costosos y ofrecer información valiosa4,15. Permiten hacer proyecciones del comportamiento de las intervenciones y sus respectivos resultados15. Las técnicas de modelización se basan en análisis de decisión y son las siguientes: árboles de decisión simples, estos son útiles en tratamientos de enfermedades agudas, con periodos de administración cortos y en donde las recidivas y recaídas no sean predecibles15. En enfermedades crónicas con tratamientos largos y donde las recaídas y recidivas son previsibles se prefiere el uso de modelos de Markov15. Finalmente, los modelos de simulación se emplean cuando existe interrelación compleja entre los factores internos del modelo15. En su realización se emplean datos de diversas fuentes (ensayos clínicos, metaanálisis, bases de datos, historias clínicas, estudios epidemiológicos, paneles de expertos, etc.)4,15. Tienen aplicaciones y ventajas importantes: útiles en condiciones de incertidumbre con información preliminar de variables, en extrapolación de resultados de ensayos clínicos con periodos cortos de seguimiento a escenarios con periodos más largos, en interrelación de variables de eficacia y efectividad, en comparación de alternativas cuando no existen ensayos clínicos que las hayan comparado y en relacionar datos de eficiencia con datos de práctica clínica rutinaria15. No obstante tienen inconvenientes relacionados con su manipulación y con el riesgo de introducir datos o planteamientos sesgados15.
Efectos macroeconómicos de la enfermedad
Las enfermedades, especialmente las crónicas, tienen efectos significativos sobre la economía de las naciones31. Estos se pueden determinar utilizando tres métodos: el primero, el método de costo de la enfermedad (se expondrá más adelante); el segundo corresponde a modelos de crecimiento económico, donde se determinan los efectos en el ingreso nacional evaluando los cambios en la oferta de trabajo y la capacidad de ahorro, y el tercero, el método del ingreso total, pretende medir en términos económicos la pérdida de bienestar social causada por la muerte y los ciclos de salud y enfermedad, para expresarlos como pérdidas que afectan el PIB31. Sin embargo, al compararse estos métodos entre sí revelan diferencias sustanciales en los resultados, lo que dificulta su comparabilidad31.
Tipos de estudios farmacoeconómicos (Tabla 3)
Reducción de costos (Costo minimización)
En este estudio se realiza una comparación de costos entre alternativas que son equivalentes en un resultado o escenario clínico específico, teniendo en cuenta que las unidades de ingreso son monetarias y los resultados también se expresan en unidades monetarias1,8. El primer paso y el más crítico e importante antes de realizar este estudio es la determinación de la equivalencia, la cual se puede realizar a partir de información de ensayos clínicos controlados o metaanálisis, con la necesidad de una evidencia adecuada en estos estudios15,35,36. La equivalencia casi nunca es exacta, por lo que es útil utilizar intervalos de confianza y definir rangos dentro de los cuales se acepta la equivalencia para un escenario especifico, teniendo en cuenta significancia clínica y estadística35. Sin embargo, existen controversias tanto en la determinación como en la inferencia de la equivalencia, dado el riesgo de interpretaciones ambiguas de algunos resultados de ensayos clínicos controlados, relacionadas con las diferencias metodológicas de los estudios de superioridad, equivalencia y no inferioridad utilizados para esta inferencia36. Incluso algunos autores plantean que la realización de estudios de costo minimización solo es adecuada cuando se sustenta en la información y los resultados de ensayos clínicos estrictamente diseñados para estudiar equivalencia36. Otro punto clave es la determinación de la dosis equi-efectiva para la cual las alternativas a comparar tienen el mismo efecto35. Para este propósito se pueden utilizar datos de ensayos clínicos aleatorizados o no aleatorizados, como de estudios de post-comercialización35.
Un ejemplo de la aplicación de reducción de costos es la comparación de dos medicamentos genéricos equivalentes en resultado pero diferentes en forma de administración y adquisición1. Otro escenario es la comparación de un fármaco genérico contra uno de marca3. En el contexto quirúrgico un ejemplo sería la comparación de costos entre dos esquemas luego de una cirugía de bajo riesgo (ambulatoria vs paciente hospitalizado), teniendo en cuenta que el desenlace clínico no cambiaría para ninguno de los dos grupos12.
Su principal limitación es la falta de estandarización y acuerdo en la determinación de la equivalencia, y la dificultad en la interpretación de los ensayos clínicos para este propósito35,36. Según esta dificultad, cabe resaltar que los resultados de estudios de reducción de costos deben ser interpretados con cautela y analizados con mucho rigor cuando orientan sobre la escogencia de alternativas y cuando ayudan al diseño de políticas públicas36.
Costo beneficio
En este tipo de análisis se identifican los beneficios de las intervenciones y se convierten en unidades monetarias (contemplando los cambios de la moneda en el tiempo)1,4. Esta conversión permite comparar diferentes resultados en una unidad estable y consistente (el dinero)12. Por ejemplo, se puede comparar una intervención que otorgue cantidad y calidad de vida (bypass coronario) contra una que solo ofrezca calidad de vida (reemplazo total de cadera) utilizando una unidad común12.
Los estudios de costo beneficio utilizan métodos para medir las preferencias de los pacientes por las alternativas. En este contexto un método bien conocido es el de la voluntad de pago (willingness to pay)12. Esta se define como la máxima cantidad que una persona está dispuesta a pagar por un bien o servicio o por evitar un mal o una pérdida37. Se mide de forma indirecta analizando pagos de servicios realizados en el pasado o de forma directa a través de encuestas sobre el fenómeno de interés38. En los estudios de perspectiva social donde intervienen todos los actores del sistema y dependiendo de la complejidad del mismo, la voluntad de pago es mucho más amplia en su concepción y más difícil en su evaluación. Aparece entonces la pregunta: ¿cuánto está dispuesto a pagar el sistema por obtener un determinado desenlace? Hay que tener en cuenta que dependiendo de la visión la voluntad de pago puede percibirse de forma diferente (pacientes, pagadores, aseguradores y prestadores de servicios).
Este análisis orienta decisiones sobre distribución de recursos siendo útil en la comparación de diferentes programas (ej. programa de cuidado neonatal vs programa rehabilitación cardiaca), porque le da un valor económico a beneficios expresados en varios tipos de unidades1.
Existen críticas en torno a que algunos beneficios (calidad de vida, satisfacción con programas y sistemas de salud, condiciones laborales de personal de salud, entre otros) son de difícil medición y difícil conversión a dinero1. El aspecto más controversial se refiere a expresar la salud en términos de dinero y en darle un valor monetario a eventos aparentemente invaluables como: la pérdida de la visión de un ojo, la pérdida de la audición, la insuficiencia renal, o incluso la muerte12. Sin embargo, esta práctica está bien establecida en la industria de seguros, donde los eventos y las enfermedades tienen valores asignados12, y se reporta desde épocas tan antiguas como Mesopotamia, dónde ya se describía a través de algunas leyes del código de Hammurabi relacionadas con la práctica médica39.
Costo efectividad
Es el más utilizado en clínica y farmacéutica, sin embargo de forma frecuente el término costo efectividad se utiliza incorrectamente haciendo alusión a resultados de todos los tipos de estudios farmacoeconómicos33. Es útil en la identificación de preferencias entre alternativas, donde los datos iniciales se expresan en unidades monetarias y los resultados en variables clínicas o paraclínicas1,3,8. Es importante para justificar inversiones en todos los campos de la salud33. Ejemplos de su aplicación son: la comparación de dos o más tratamientos en la reducción del dolor o en la disminución del colesterol o la tensión arterial1.
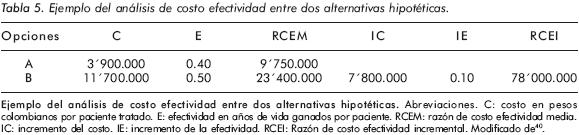
Para el análisis de los resultados existen dos indicadores importantes. El primero es la razón de costo efectividad media (RCEM), la cual se obtiene al dividir el costo neto de la intervención por su beneficio neto (efectividad)40. Las intervenciones que tienen RCEM bajas son costo-efectivas (eficientes), porque tienen un costo menor por cada unidad de efectividad que producen, a diferencia de las que tienen RCEM altas (poco eficientes)40. El segundo es la razón de costo efectividad incremental (RCEI, en inglés Incremental Cost Effectiveness Ratio, ICER) la cual compara costos y resultados entre las alternativas a estudio (Tabla 4)3,40. Generalmente se compara un nuevo fármaco con el más usado del mercado para determinada indicación, pero esto no limita las comparaciones, incluso el manejo expectante puede ser una alternativa en la comparación. La RCEI informa del costo adicional por unidad de beneficio también adicional40.

En el siguiente ejemplo (Tabla 5), se comparan dos alternativas hipotéticas: A corresponde a la práctica clínica habitual mientras B corresponde a un nuevo tratamiento, suponiendo que los costos están en pesos colombianos por persona ($3'900.000 para A y $11'700.000 para B) y los resultados se expresan en años de vida ganados por persona tratada (0,4 para A y 0,5 para B). La RCEM más baja corresponde a la práctica clínica habitual ($9'750.000 para A vs. $23'400.000 para B)40. La RCEI de interés se calcula dividiendo el costo de B menos A, sobre la efectividad de B menos A ($7'800.000 dividido en 0,1 años de vida ganados). La RCEI entonces es de $78'000.000, lo que representa lo que cuesta realmente cada unidad adicional ganada sobre A en la puesta en práctica de la nueva intervención B. La pregunta luego del análisis sería: ¿Se debe gastar $78'000.000 de pesos para ganar un año de vida extraordinario con el nuevo tratamiento B frente al habitual A?40. Se puede decir que la intervención B es mejor que A, sin embargo también es más costosa. No se podrá tomar una decisión entre ambas sin establecer un límite para el costo por unidad de resultado (años de vida ganados para este caso)40. Si bien el uso de la RCEM es acertado, es menos informativo que la RCEI, porque esta última contempla simultáneamente las cuatro variables en cuestión (CA, CB, EA, EB)40. Las directrices internacionales señalan que la RCEI es la medida que debe utilizarse para estudios de costo efectividad40
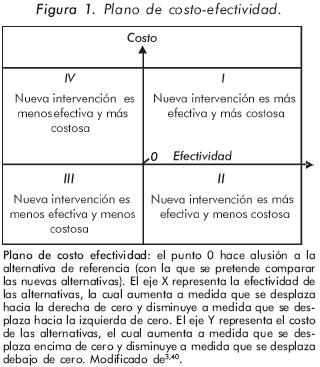
Los resultados se interpretan a través de los índices mencionados y su posterior ubicación en el plano de costo-efectividad (Figura 1)3,40. Las intervenciones ubicadas en el cuadrante II son ideales, mientras las del cuadrante IV son desfavorables3,40. Las ubicadas en los cuadrantes I y III generan incertidumbre y deben analizarse de acuerdo al máximo valor de RCEI que se esté dispuesto a aceptar40. La utilización de estas alternativas (I y III) depende del médico, las políticas de manejo de pacientes y los presupuestos disponibles3,33. En la práctica la mayoría de las comparaciones se ubican en el cuadrante I (ocurre frecuentemente cuando se compara una alternativa común con una nueva o de reciente aparición)40. Dado los recursos limitados hay que buscar puntos medios entre costos y efectividad, apoyados en dos elementos para hacerlo: el presupuesto y el costo por unidad de efectividad adicional40. En el primer caso deben buscarse alternativas que maximicen el beneficio sin agotar el presupuesto. De acuerdo al ejemplo anterior (Tabla 5) se buscaría la alternativa que ofrezca el mayor número de años de vida ganados teniendo en cuenta un presupuesto determinado40. En el segundo caso debe determinarse el precio máximo a pagar por unidad de efectividad40.
A pesar de su gran utilidad, este estudio tiene algunas desventajas: no puede comparar unidades clínicas y efectos naturales distintos (ej. Expectativa de vida vs mejoría de función física) y no puede orientar de manera directa sobre la eficiencia en la distribución de recursos y sobre la toma de decisiones40. Uno de los mayores retos es evaluar la eficiencia de las intervenciones en subgrupos de pacientes40.
Costo utilidad
Este estudio es una adaptación del análisis de costo efectividad1, el cual orienta decisiones entre intervenciones teniendo en cuenta la visión del paciente (ej. cirugía vs. quimioterapia en pacientes con cáncer)1,3,41. Los resultados se expresan en unidades de utilidad que evalúan la salud de forma cuantitativa y cualitativa (morbilidad y mortalidad), generalmente a través de costo por año de vida ajustado por calidad (AVAC, Quality adjusted life year (QALY) en inglés)1,41. La aplicación de AVAC se fundamenta en que la salud se puede reducir a dos componentes: cantidad y calidad de vida41. Cualquier estado de salud puede representarse con una combinación de estos dos, lo que hace útil la medida cuando los pacientes prefieren calidad que cantidad de vida y cuando ocurre lo contrario41, lo cual permite la comparación de estados de salud muy diversos41. La salud de una persona puede calcularse como la suma de calidad de vida durante su vida (ej. 5 años en silla de ruedas, 10 años con buena salud, 3 años con cáncer de próstata y luego la muerte), lo que se expresaría: [(calidad de vida en silla de ruedas: 5 años) + (calidad de vida con buena salud: 10 años) + (calidad de vida con cáncer de próstata: 3 años) + (muerte)]41.
Para calcular AVAC, se determina la calidad de vida estimada (utilidad o bienestar asociado al estado de salud correspondiente) expresándola en una escala que va desde 0 (la muerte) hasta 1 (salud ideal), contemplando a veces valores negativos que corresponden a estados de salud considerados por el paciente como peores que la muerte (este aspecto puede resultar controversial en algunos escenarios)15,41. Con base en lo anterior y en la expectativa de vida ofrecida por la intervención o el tiempo transcurrido en un estado específico de salud se pueden calcular AVAC y AVAC ganados (Tabla 6)3. Luego, de acuerdo al costo de la intervención se calcula el costo por cada AVAC ganado3. El valor de un AVAC con buena salud es de 1, la dificultad radica en el cálculo de la salud en las distintas condiciones de enfermedad41. Para este propósito se utilizan dos métodos de obtención de preferencias: el primero es el de compensación temporal, el cual tiene en cuenta la cantidad de vida que una persona estaría dispuesta a ceder por una mejora en su calidad de vida (ej. En una esperanza de vida de 30 años una persona estaría dispuesta aceder 6 años de vida sana por no estar ciega)41. El segundo es el de la lotería estándar, donde las preferencias en la calidad de vida se miden por el riesgo de muerte que una persona estaría dispuesta a asumir por evitar cierto problema de salud (ej. Para evitar estar 30 años ciego una persona estaría dispuesta a asumir un riesgo de muerte del 10% vs. un 90% de posibilidades de recuperar buena salud)41.

Este estudio puede ser útil en la definición de prioridades sanitarias a partir de costos por AVAC (como se utilizó en Oregon (Estados Unidos) dentro del programa Medicaid), a pesar de lo anterior, establecer listas de prioridades de acuerdo a AVAC no está exento de controversias, ya que para priorizar recursos y tomar decisiones hay factores políticos y sociales que también deben ser tenidos en cuenta41. Los costos por AVAC pueden orientar sobre la inclusión, retiro o modificación de intervenciones en programas y presupuestos sanitarios40. Por ejemplo: en Estados Unidos, Canadá y algunos países europeos una intervención se considera aplicable si el costo por AVAC ganado es menor de US$ 50.000 e inaceptable cuando es mayor a US$ 100.000, generando una zona de incertidumbre entre US$ 50.000 y US$ 100.00040. Para otros países las alternativas son aceptables si se encuentran por debajo de 3 veces el PIB per cápita.
Este estudio es criticado por varias razones: la medida del beneficio y los resultados de utilidad se pueden ver influenciados por el nivel de renta de las personas41. Al medirlo a través de la disposición a pagar (voluntad de pago) los que tienen mayor renta tendrán mayor disposición de invertir o acceder a servicios y tratamientos, situación que se reduce con la aplicación de AVAC41. Otro punto de discusión es que los métodos empleados para determinar la utilidad (compensación natural y lotería estándar) comparten los problemas de todo método de obtención de preferencias: las respuestas están sujetas a la manera en que se pregunte y se desarrolle la encuesta41. Anexamente, al evaluar la calidad de vida se asume que esta será constante, lo que no tiene en cuenta los cambios en las percepciones que los pacientes pueden desarrollar con el tiempo (adaptación y resiliencia: escenarios frecuentes en enfermedades crónicas)41. Genera controversia si se debe aplicar o no el descuento económico (discounting) al cálculo de los AVAC, ya que si se aplica se asumiría menos valor a un año de vida que está alejado en el tiempo, haciendo que los tratamientos preventivos pierdan atractivo frente a los curativos41. Otra limitación es la relacionada con la heterogeneidad de los pacientes y el hecho que en la práctica las preferencias son muy variables41. Lo anterior se solucionaría obteniendo las utilidades para cada paciente individual, sin embargo esto podría hacer inviable la aplicación del estudio40.
Costo de la enfermedad
Este análisis cuantifica los costos atribuibles a una enfermedad para un periodo determinado de tiempo, ofreciendo información sobre el gasto de recursos y la distribución de costos [directos, indirectos e intangibles (en algunos casos)]29,32. Su aplicación es común, especialmente en la literatura médica, aunque su validez como herramienta para la toma de decisiones es cuestionada por muchos economistas y expertos en economía de la salud30,42, sin embargo es utilizado con frecuencia por el banco mundial, la organización mundial de la salud (OMS) y el instituto nacional de salud de los Estados Unidos30. Muchos análisis de costo de la enfermedad han sido fundamentales en estructuración de políticas y debates de salud pública, ya que remarcan la magnitud del impacto de una enfermedad en la sociedad o en una parte de ella43. Es importante para la evaluación de nuevas terapias, ya que ofrece una línea de base para descubrimientos y nuevos estudios terapéuticos1. Tiene relevancia en estudios ambientales y ocupacionales relacionados con la salud43,44. Sus resultados son útiles en el ámbito sanitario y político43. También han llegado a impactar otras esferas, como ocurrió con el estudio de Miller y colaboradores sobre el impacto del tabaquismo en los Estados Unidos para 1993, el cual fue utilizado por el estado para demandar la industria tabacalera y recuperar las pérdidas financieras del programa Estadounidense Medicaid43,45.
Este análisis intenta mostrar un resumen de la realidad de la enfermedad en términos económicos (pudiendo involucrar también algunos aspectos humanísticos y de calidad de vida en este proceso) para cada individuo afectado1,31. Tiene dos objetivos fundamentales: mostrar cuánto gasta la sociedad en una patología determinada (también se puede evaluar cuanto se ahorraría si la enfermedad no existiera, aunque este propósito genera controversias y plantea dificultades metodológicas) y determinar los componentes de los costos, y la contribución en ellos de los diferentes sectores de la sociedad42. Este estudio se puede aplicar desde diversas perspectivas (sociedad, sistema de salud, administradores y pagadores, inversionistas, gobiernos y pacientes y familiares) lo que puede generar variaciones en los costos que se incluyen en el análisis (desde una perspectiva social se incluirían la mayoría de costos, desde la perspectiva del sistema de salud solo los costos médicos, etc.) por lo que es importante al inicio del estudio definir la perspectiva de interés43.
Existen dos enfoques esenciales para el desarrollo del análisis. El primero es el de incidencia, donde se evalúan los costos de la enfermedad desde el diagnóstico hasta el desenlace final (este es más complejo, costoso y dispendioso, por lo que es menos utilizado a pesar que puede ser muy valioso al brindar información de una manera longitudinal)15,42. El segundo, el de prevalencia (es el más frecuente), mide los costos relacionados con la enfermedad durante un lapso de tiempo (generalmente un año, pero podría utilizarse otro horizonte de tiempo)15,42. La principal diferencia es que generalmente los resultados de costos son mayores en el enfoque de prevalencia que en el de incidencia, especialmente en patologías que producen secuelas a largo plazo30.
Sin embargo, tiene algunas limitaciones: No incluye información adicional y valiosa ofrecida por estudios de costo efectividad y costo beneficio30,43. La variabilidad en los métodos empleados puede limitar la comparabilidad de resultados43. Existe aún más variabilidad ya que los estudios varían de acuerdo a la perspectiva (visión), las fuentes de información, la inclusión de costos y el horizonte en el tiempo43. Es criticado porque no tiene en cuenta prevención en los resultados y también porque puede centrar la atención sobre patologías de gran impacto, restándole atención a intervenciones en enfermedades menos frecuentes que podrían favorecer eficiencia (un ejemplo es la fenilcetonuria, la cual si no se trata genera importante disfunción cognitiva y la cual no presenta una gran carga social, sin embargo la prevención es simple y poco costosa y genera grandes ahorros en salud y beneficios en los individuos que la padecen)42. También plantea algunas controversias relacionadas con la medición de costos indirectos, ya que estos, según critican algunos autores se calculan de una manera simplista, teniendo en cuenta el tiempo laboral perdido por muerte prematura y por días de incapacidad laboral por enfermedad (generalmente reportados por el paciente, llevando a sobre-estimaciones)31. Este enfoque de medición de costos indirectos tiene algunas falencias: en países subdesarrollados cuando un integrante del hogar no puede trabajar frecuentemente es reemplazado por otro familiar, generando cambios mínimos en los egresos31. Por otro lado, cada día de ausencia laboral no representa necesariamente una pérdida de ingreso real o una pérdida para la economía31. A pesar de las críticas y limitaciones, constituye una herramienta muy útil para determinar un panorama inicial de una enfermedad, abriendo perspectivas para una mayor comprensión de su impacto.
Conclusiones
El entendimiento de la farmacoeconomía permite una mejor práctica clínica en términos de análisis de resultados y costos. También ofrece un panorama del impacto social de las enfermedades y su relación con salud pública, economía de gobiernos y sistemas de salud, abriendo perspectivas de investigación en varias ramas del conocimiento. Los estudios de farmacoeconomía deberían ser realizados y comprendidos a fondo por las entidades estatales encargadas de la regulación de precios e inclusión de medicamentos en programas de salud, especialmente en países como el nuestro donde existen pocos recursos y poca eficiencia en su distribución. Así mismo es recomendable que la economía de la salud sea incluida en los currículos de medicina y ciencias de la salud, y que en ese contexto sea asumida con el rigor y la importancia que merece. Esta recomendación gana importancia en un país como el nuestro, lleno de factores que entorpecen el acceso equitativo a la salud.
Es importante recordar que una evaluación económica es buena en el sentido en que la evidencia médica en la cual se basa es buena también36. El desafío como planteó Bootman, pionero de la farmacoeconomía: no es entender las herramientas de investigación en farmacoeconomía, sino en cambio saber cómo y cuándo utilizarlas1.
Agradecimientos
Los autores expresan su gratitud a David Bardey, Profesor de Economía, Universidad del Rosario, por sus comentarios y fructíferas conversaciones sobre el particular y a los dos revisores anónimos por sus pertinentes comentarios. Este trabajo fue financiado, en parte, por una beca para la investigación de Lafrancol S.A. a través de la Oficina de Donaciones de la Universidad del Rosario, Bogotá, Colombia.
Referencias
1. Bootman JL, Townsend RJ, McGhan W F. Principles of pharmacoeconomics. 3ed: Whitney Harvey books; 2005. [ Links ]
2. Bandivadekar M, Mahajan A, Shah D. Pharma-coeconomics: considerations in health care management. Pharma Times 2006;38(12):22-25. [ Links ]
3. Walley T. Pharmacoeconomic and economic evaluation of drug therapies. En: Du Soich P, Erill S, Orme M, editores. The IUPHAR Compendium of Basic Principles for Pharmacological Research in Humans [Libro en línea]. Irvine, CA: International Union of Basic and Clinical Pharmacology; 2004;67-75. [Citado 2011 Mar 16]. Disponible en: http://www.iuphar.org/clin_hu.html [ Links ]
4. Wertheimer A, Chaney N. Pharmacoeconomics [En línea]. 2003 [Citado 2011 Mar 18]. Disponible en: http://www.touchbriefings.com/pdf/15/pg031_r_wertheimer%5B1%5D.pdf [ Links ]
5. Velásquez G. Farmacoeconomía ¿Evaluación científica o estrategia comercial?. Rev Panam Salud Pública. 1999;5(1):54-57. [ Links ]
6. Palfrey J. Daring to practice low-cost medicine in a high-tech era. N Engl J Med 2011;364(11):e21. [ Links ]
7. Bravo Borda A. Monopolio vs acceso a los medicamentos. Portafolio [Internet] 2011 Mar 8 [Citado 2011 Mar 20]; Disponible en: http://www.portafolio.co/opinion/monopolio-vs-acceso-los-medicamentos [ Links ]
8. Sacristán JA, Ortún V, Rovira J, Prieto L, García Alonso F. Evaluación económica en medicina. Med Clin (Barc) 2004;122(10):379-382. [ Links ]
9. ¿Cuánto vale la salud de cada uno?. El tiempo [Internet]. 2011 Mar 10 [Citado 2011 Mar 17]; Disponible en: http://www.eltiempo.com/opinion/editoriales/ARTICULO-WEB-NEW_NOTA_INTERIOR-8996882.html [ Links ]
10. Culyer JA. The dictionary of health economics. Cheltenham (UK): Edwardelgar publishing limited; 2005. Health economics; p. 150. [ Links ]
11. Lopera Sierra J F. Restrepo JH, editor. Introducción a la economía de la salud en Colombia. Medellín: Universidad de Antioquia, 2008; 269 p (Reseña). Rev Gerenc Polit Salud 2009;8(16):191-194. [ Links ]
12. Dundee University. Pharmacoeconomics [En línea]. [Citado 2011 Mar 18]; Disponible en: http://www.dundee.ac.uk/memo/memoonly/PHECO0.HTM [ Links ]
13. Ministerio de la protección social. Colciencias. Centro de Estudios e investigación en salud de la Fundación Santa Fe de Bogotá. Escuela de Salud Pública de la Universidad de Harvard. Guía Metodológica para desarrollo de guías de atención Integral en el sistema general de seguridad social en salud colombiano. Bogotá: Ministerio de la protección social; 2010. [ Links ]
14. Collazo Herrera MM, Yáñez Vega R. La farmaco-economía ¿Debe ser de interés para el ámbito regulatorio de los medicamentos? ReES 2005;4(5):238-243. [ Links ]
15. Soto Álvarez J. Estudios de farmacoeconomía: ¿Por qué, cómo, cuándo y para qué?. Medifam. 2001;11(3):147-155. [ Links ]
16. Haycox A. What is health economics? [En línea]. 2003 [Citado 2011 Mar 24]. Disponible en: http://www.medicine.ox.ac.uk/bandolier/painres/download/whatis/What_is_health_econ.pdf [ Links ]
17. Diccionario de economía política. Madrid: Alfredo Ortells; 1986. Economía; p. 646-654. [ Links ]
18. Raftery J. Economic evaluation: an introduction. BMJ 1998;316(7136):1013-1014. [ Links ]
19. Culyer JA. The dictionary of health economics. Cheltenham (UK): Edwardelgar publishing limited; 2005. Discounting; p. 100. [ Links ]
20. Robertson J, Lang D. Use of pharmacoeconomics in prescribing research part 1: costs-moving beyond the acquisition price for drugs. J Clin Pharm Ther. 2003; 28(1):73-79. [ Links ]
21. Walter E, Zehetmayr S. Guidelines on health economic evaluation - Consensus paper. Viena: Institute for Pharmacoeconomic Research (Austria); 2006. [ Links ]
22. Arnold RGJ. Pharmacoeconomics - From theory to practice. Londres: Taylor & Francis Group; 2010. [ Links ]
23. Dornbusch R, Fisher S, Startz R. Macroeconomía. 9ed: McGraw Hill; 2004. [ Links ]
24. Pindyck RS, Rubinfeld DL. Microeconomía. 5Ed. Madrid: Prentice Hall; 2001. [ Links ]
25. Culyer JA. The dictionary of health economics. Cheltenham (UK): Edwardelgar publishing limited; 2005. Marginal cost; p. 205. [ Links ]
26. Wonnacott P, Wonnacott R, McConnel RC, Frank RH, Brue SL. Microeconomía. México DF: McGraw Hill; 1996. [ Links ]
27. República de Colombia. Agencia Presidencial para la Acción Social y la Cooperación internacional. Norma Técnica de Calidad en Gestión Pública -NTCGP 1000. Bogotá; 2004. [ Links ]
28. Conde Olasagasti JL, Gonzalez J. Evaluación de tecnologías sanitarias. En: Gimeno J, Rubio S, Tamayo P, editores. Economía de la salud: instrumentos. Madrid: Ediciones Díaz de Santos 2006;8-11. [ Links ]
29. Trisolini M, Honeycutt A, Wiener J, Lesesne S. Multiple Sclerosis International Federation. RTI international. Global economic impact of multiple sclerosis. Londres; 2010. [ Links ]
30. Tarricone R. Cost-of-illness analysis What room in health economics? Health Policy 2006;77(1):51-63. [ Links ]
31. Dele O, Mathers D Colin, Adam T, Ortegon M, Strong K. The burden and costs of chronic diseases in low income and middle income countries. Lancet 2007;370(9603):1929-1938. [ Links ]
32. Kobelt G, Berg J, Lindgren P, Fredrikson S, Jonsson B. Costs and quality of life of patients with multiple sclerosis in Europe. J Neurol Neurosurg Psychiatry 2006;77(8):918-926. [ Links ]
33. Arenas-Guzman R, Tosti A, Hay R, Haneke E. Pharmacoeconomics - an aid to better decision-making. JEADV. 2005;19(Suppl 1):34-39. [ Links ]
34. Palmer S, Byford S, Raftery J. Types of economic evaluation. BMJ 1999;318(7194):1349. [ Links ]
35. Newby D. Use of pharmacoeconomics in prescribing research part 2: cost minimization analysis-when are two therapies equal? J Clin Pharm Ther. 2003;28(2): 145-150. [ Links ]
36. Haycox A, Walker A. What is cost-minimisation analysis?. [En línea]. 2009 [Citado 2011 May 24]. Disponible en: http://www.medicine.ox.ac.uk/bandolier/painres/download/whatis/What_is_cost-min.pdf [ Links ]
37. Culyer JA. The dictionary of health economics. Cheltenham (UK): Edwardelgar publishing limited; 2005. Willingness to pay; p. 371. [ Links ]
38. O'Brien B, Viramontes JL. Willingness to pay: A valid and reliable measure of health preference?. Med Decis Making 1994;14(3):289-297. [ Links ]
39. Sánchez-Crespo R. Historia clásica - El código de Hammurabi. 2007 [Citado 2011 Mar 20]. Disponible en: http://www.historiaclasica.com/2007/05/el-cdigo-de-hammurabi.html [ Links ]
40. Prieto L, Sacristán JA, Antoñanzas F, Rubio-Terrés C, Pinto JL, Rovira J. Análisis coste-efectividad en la evaluación económica de intervenciones sanitarias. Med Clin (Barc) 2004;122(13):505-510. [ Links ]
41. Pinto Padres JL, Puig Junoy J, Ortún Rubio V. Análisis coste-utilidad. Aten Primaria 2001;27(8):569-573. [ Links ]
42. Byford S, Torgerson DJ, Raftery J. Cost of illness studies. BMJ 2000;320(1335):1335. [ Links ]
43. Segel JE. Cost of Illness Studies - A primer. North Carolina (US). RTI UNC Center of Excellence in Health Promotion Economics; 2006. [ Links ]
44. Cost of illness handbook. USEPA Enviromental protection agency (US). [En línea]. 2011 [Citado 2011 May 24]. Disponible en: http://www.epa.gov/oppt/coi/index.html [ Links ]
45. Miller LS, Zhang X, Novotny T, Rice D P, Max W. State estimates of medicaid expenditures attributable to cigarette smoking, fiscal year 1993. Public Health Reports 1998;113(2):140-151. [ Links ]














