Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista Colombiana de Reumatología
Print version ISSN 0121-8123
Rev.Colomb.Reumatol. vol.18 no.3 Bogotá July/Sept. 2011
ARTÍCULO DE REVISIÓN
Debo reconocer que un hombre que concluye que un argumento
no tiene realidad, porque se le ha escapado a su investigación,
es culpable de imperdonable arrogancia
David Hume
1MSc, Coordinador de la unidad de Inmunología, Facultad de Medicina, Universidad del Rosario.
2MD, Estudiante de toxicología, Facultad de Medicina, Universidad del Rosario.
3MD. Profesor titular, Facultad de Medicina, Universidad Nacional de Colombia.
Los autores declaran no presentar ningún conflicto de interés al momento de la redacción del manuscrito.
Recibido: 13 de junio de 2011 Aceptado: 11 de agosto de 2011
Resumen
La regulación inmunológica constituye tanto un mecanismo importante para el mantenimiento de la homeostasis del sistema inmune como para el establecimiento de la tolerancia hacia antígenos propios evitando el desarrollo de enfermedades autoinmunitarias. Así mismo, juega un papel relevante en el mantenimiento de la tolerancia periférica mediante el control de una pequeña población de células T circulantes denominadas células T reguladoras (Treg), las cuáles parecen haber migrado del timo durante estadios relativamente tardíos1.
El término "células T reguladoras" se refiere a células que activan o suprimen la función de otras células. Aparentemente, controlan el desarrollo de enfermedades autoinmunitarias (lupus, tiroiditis, diabetes tipo I y enfermedad inflamatoria intestinal entre otras) el rechazo de injertos, y pueden jugar un papel crítico en el control del asma y la alergia.
Palabras clave: fenotipo, singénicos, FoxP3, TGF-β, anergia, autóloga, escurfina, Treg, APC, células presentadoras de antígeno, receptor de células T (TCR), Complejo Mayor de Histocompatibilidad (CMH).
Summary
Immune regulation is both an important mechanism for maintaining immune system homeostasis and for the establishment of tolerance towards self antigens in order to prevent the development of autoimmune diseases. It also plays an important role in maintaining peripheral tolerance by controlling a small population of circulating T cells, called regulatory T cells (Treg), which seems to have migrated from the thymus during relatively late stages1.
The term "regulatory T cells" refers to cells that activate or suppress the function of other cells. Apparently, controlling the development of autoimmune diseases (For instance, lupus, thyroiditis, type I diabetes and inflammatory bowel disease among others), graft rejection and may play a critical role in asthma and allergy.
Key words: phenotype, syngeneic, FoxP3, TGF-β, anergy, autologous, escurfina, Treg, antigen presenting cells (APC), T cell receptor (TCR), Mayor Histocompatibility Complex (MHC).
Introducción
A finales de 1960 se descubre la existencia de dos grandes poblaciones de linfocitos, T y B, cada uno de ellos con una función específica. A inicios de 1970 con la colaboración de las Universidades de Tokio y Yale, Tomio Tada Chiba, reconoce que las células T no solamente tienen una función ayudadora sino que también pueden modular la respuesta. Gershon y Kondo3, notaron que una subpoblación de células T podía deprimir la respuesta inmune y que también mediaba una regulación supresora diferente a la ejecutada por las células T ayudadoras. Esta subpoblación fue llamada inicialmente célula T supresora, la cual se ha venido estudiando extensamente demostrando la existencia de varias subpoblaciones, algunas de ellas antígeno-específicas, otras sin especificidad alguna, otras secretoras de factores supresores y poblaciones con diferentes fenotipos y modos de supresión4-5.
El fenotipo de células T con actividad supresora se ha evaluado en modelos murinos por la expresión de marcadores Lyt-1 (CD5) y Lyt-2 (CD8), con un aumento en la expresión de Lyt-2. Sin embargo la revisión activa de estas células, en la que se involucraron muchos inmunólogos, colapsó abruptamente a mediados de 1980, cuando el escrutinio de los ratones de prueba por técnicas moleculares demostró que no existía el gen I-J, sobre el cual se había asumido codificaba esta misma molécula y la localizaba dentro del complejo genético MCH6. Hoy se evalúa este suceso de forma retrospectiva y se concluye que hubo varias fallas en la interpretación del estudio; falla en el uso de marcadores confiables para la diferenciación de células T supresoras de otras subpoblaciones de células T, ambigüedad en las bases moleculares de la supresión inmunológica y dificultad en la preparación de clones de células T supresoras antígeno específicas. Posteriores hallazgos generaron un ambiente favorable para las T supresoras a las cuales se les atribuyó la generación de citoquinas inmunosupresoras o reguladoras. Para 1990 fue muy comprensible que la IL-10 diferenciará a T reguladoras llamadas TH34.
Dada la ausencia de evidencia molecular sobre las células T Supresoras, en Japón nace otro concepto sobre las células T reguladoras (Treg). Yazuaki Nishizuka y Teruyo Sakakura en The Aichi Cancer Research Institute (Nagoya), encontró que en la timectomía neonatal a los 4 días de nacidos podía inducir varias enfermedades autoinmunes. Encontró que la trasferencia de células T inmaduras (timocitos) de animales singénicos no tratados inhibía la autoinmunidad, indicando que los animales normales no solo inducían células T autoreactivas potencialmente patogénicas, sino también inducía células T (CD4+) que suprimían la respuesta inmune5.
Sakaguchi continuó la investigación y demostró que la población de células T supresoras existía en ratones que expresaban CD4+, CD5high Pero al avanzar encontró que CD25 era un marcador específico de estas células, a las que llamó células T reguladoras (Treg)5. Sakaguchi y cols., han demostrado que las fallas en los mecanismos que regulan la tolerancia a lo propio son los directamente responsables del desarrollo de la enfermedad autoinmune y que las poblaciones directamente comprometidas son las subpoblaciones de células T CD4+ que expresan constitutivamente la cadena á del receptor de IL-2 (CD25+) y el factor de trascripción Foxp3.
Fenotipo de células T reguladoras (Treg)
Las células Treg presentan marcadores específicos tales como el receptor relacionado con la familia de receptores del TNFα inducido por glucocorticoides (GITR) y el factor de trascripción Foxp3 y muestran elevados niveles de CD11a (LFA-1), CD44, CD54 (ICAM-1) y CD103 en ausencia de aparente estimulación antigénica. Estas células exhiben otros marcadores de superficie como: CD45RB, CTLA-4 (antígeno-4 de linfocitos T citotóxicos), CD122, CD103 (integrina αaEb7), CD134 (OX40) y CD62L (L-selectina). Las células Treg expresan elevados niveles de receptores de quimocinas CCR5 en modelos murinos y su contraparte en el humano, CCR4 y CCR8. (Figura 1). Estas células poseen un receptor T (TCR) muy diverso, lo cual les confiere la capacidad de reconocer un gran número de antígenos y adicionalmente presentar una alta afinidad hacia los antígenos propios. Durante su producción tímica requieren la combinación de fuertes señales antigénicas para la unión del TCR, así como una máxima coestimulación, de tal modo que cuando vayan a migrar a los tejidos periféricos, sean completamente funcionales7-8.
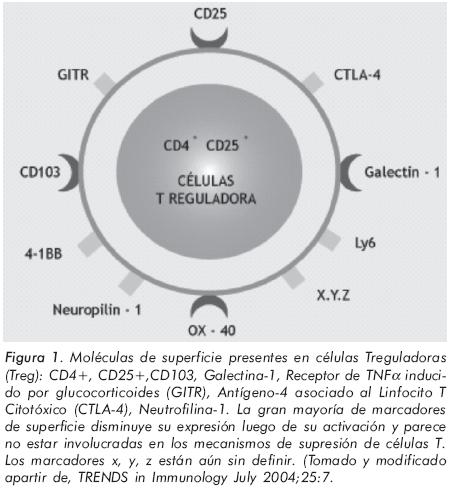
Aproximadamente del 5 al 10% de las células T CD4+ periféricas expresan constitutivamente CD25+. CD25 no parece ser un marcador exclusivo de las células Treg, más bien refleja una absoluta dependencia de la IL-2 para su función y mantenimiento periférico1, debido a que no proliferan en presencia de antígenos o anticuerpos contra CD3. En ausencia de la IL-2 exógena, las células TCD25+ estimuladas suprimen la proliferación tanto de las células T CD4+ como de células T CD8+ por una reacción dependiente de secreción de IL-10 y TGF-β. En éste sentido,son células que inhiben la respuesta inmune al modular la actividad de otros tipos celulares, como: linfocitos T CD4+ y CD8+, células presentadoras de antígenos (APCs), macrófagos y células NK7.
Otros biomarcadores expresados en células T CD4+CD25+.
Además de la expresión de CD4+, las células Treg expresan otros biomarcadores identificados como específicos al compararlos con los marcadores expresados en células CD4+CD25-e incluyen: galectina-1, TNF-R2, TGF-βR1, PD1 (muerte celular programada), neurofilina-1. Ninguno de estos marcadores de superficie celular parece ser responsable de mediar la supresión en células CD4+CD25+. El papel supresor de CTLA-4 en células CD4+CD25+ en individuos con enfermedad autoinmune activa, no ha sido esclarecido. GIRF ha sido reportado como marcador importante en la función de las células T CD4+CD25+, y es diferencialmente expresado en células T CD4+CD25+, pero también se expresa en células T CD4+CD25- activadas9-10. Recientemente se descubrieron dos nuevos marcadores en células T reguladoras: FoxP311 (factor de transcripción nuclear) y LAG-3 (gen 3 de activación linfocitaria)12-13. Una característica importante que ha sido evaluada por McHugh en estas células es la acción de los corticoides, haciendo referencia al receptor de la neuropilina-1 como un receptor importante en la angiogénesis y activación de células Treg10.
Marcadores serológicos y celulares involucrados en los mecanismos supresores de células reguladoras.
a. CTLA-4 (Antígeno-4 asociado al Linfocito T Citotóxico): es una molécula expresada en la superficie de la mayoría de los linfocitos T activados. Su función es regular la homeostasis y la tolerancia periférica inmunológica inhibiendo la activación de los linfocitos T. Dos mecanismos han sido postulados para mediar la inhibición por CTLA-4 de la respuesta de los linfocitos T: Señalización negativa y antagonismo competitivo de la vía de coestimulación mediada por CD28/B7. Las diferentes moléculas que participan en la activación e inactivación de los linfocitos T han sido analizadas con el objetivo de diseñar estrategias terapéuticas de tolerancia inmunológica14.
b. IL-2 (interleucina 2): es una proteína de bajo peso molecular secretada principalmente por células T, con alta actividad proliferativa, con acción autocrinaparacrina. compuesta por 133 aminoácidos y de peso 15,4 kda. Actúa como factor de crecimiento de los linfocitos T, induce todos los tipos de subpoblaciones de linfocitos y activa la proliferación de linfocitos B. Su gen se localiza en el cromosoma 4, La IL-2 es fundamental para los linfocitos Th2 y para la proliferación y diferenciación de las células Treg, cuyo receptor conocido como CD25, se puede encontrar tanto en las células T efectoras, como en las células Treg de memoria. La IL-2 también interviene en la reacción inflamatoria estimulando la síntesis de interferón, induce la liberación de IL-1, TNF-alfa y TNF-Beta. IL-2 es necesario para el establecimiento de la memoria inmunitaria celular, así como para el reconocimiento de autoantígenos y antígenos foráneos14.
c. IL-10 (interleucina-10): esta proteína es producida en concentraciones relativamente altas por células Treg También conocida como factor de inhibición de la síntesis de citocinas (CSIF sus siglas en inglés), es una citocina con propiedades antiinflamatorias capaz de inhibir la síntesis de citocinas proinflamatorias por los linfocitos T y los macrófagos. Ha sido demostrada su presencia en las placas ateroscleróticas humanas, observándose en estudios experimentales que niveles bajos de IL-10 favorecen el desarrollo de lesiones ateroscleróticas más extensas y morfológicamente más inestables14.
No siempre es necesario el estimulo de IL-10 para que las células Treg sean activadas, ya que para ello fueron clasificadas en células Treg naturales y Treg inducibles, de acuerdo al estimulo desencadenante de su activación. Las células T naturales representan aproximadamente del 5 al 10% de la población celular total de LT CD4+ y son seleccionados como linfocitos T sencillos positivos15. Los efectos supresores de las células Treg son dados por el contacto célula-célula en un proceso dependiente de la señalización del CTLA-4 o por citocinas tales como el TGF-β8,2. Este efecto supresor de las células TCD25+ puede ser bloqueado por la presencia de IL-6, producida a menudo por las células dendríticas que han sido activadas por el receptor tipo Toll tipo 4 (TLR-4)2.
La IL-10 es una citocina fundamental asociada con la generación de respuestas inflamatorias fuertes (Th1), capaces de eliminar ciertos agentes patógenos, previniendo así inmunopatología y mortalidad. Pero también puede suprimir reacciones Th1 protectoras, produciendo infecciones crónicas. La IL-10 puede ser producida por linfocitos T reguladores CD4+CD25+FoxP3, así como también por otros tipos de células, incluyendo linfocitos Th2, linfocitos B y células presentadoras de antígeno. ¿Pero cual es la célula productora de IL-10 durante las respuestas vigorosas Th1? Sacks y colaboradores usando un modelo de infección crónica con Leishmania major, el cual está asociado con una respuesta sostenida tipo Th1 en presencia de un aumento de IL-10, demostraron que la IL-10 era producida por células de la inmunidad innata, linfocitos Treg CD4+CD25+ FOXP3+ presentes en la dermis de ratones infectados con L.major16. Para identificar la fuente celular de IL-10 en este modelo, los investigadores reconstituyeron ratones deficientes en el gen Rag (gen activador de recombinación1) denominados Rag-/- o ratones deficientes en Rag e incapaces de producir IL-10 denominados Rag-/-,IL-10-/-con células provenientes de ratones de IL10 -/- o ratones normales, restringiendo de esta manera la fuente de IL-10 a linfocitos T o células no T. Ellos demostraron que a pesar que la principal fuente de IL-10 en esta enfermedad eran las células de la inmunidad innata, la sola producción de IL-10 por linfocitos T-antígeno específicos era suficiente para suprimir la inmunidad protectora frente a L.major Sorprendentemente, estos linfocitos T CD4 eran CD25- y FOXP3- y la mayoría producían IFN-gamma17.
En paralelo con estos resultados, Anderson y cols, demostraron que la fuente celular principal de IL-10 en la infección con T.gondii eran los linfocitos T CD4+CD25-FOXP3- productores de IFN-gamma17. La caracterización adicional de estas células productoras de IL-10 demostró que expresaban el factor de transcripción T-bet asociado con Th1, indicando que estas células provienen de los mismos precursores de linfocitos Th1 clásicos. Los investigadores también demostraron que estas células producen IL-10 después de ser activadas por lo que no son un fenotipo estable, mientras que la producción de IFN-gamma no es afectada por el estado de activación de la célula17.
Ambos estudios demostraron que los linfocitos Th1 CD4+CD25-FOXP3-T-bet+ productores de IFN-gamma son la fuente crucial de la IL-10 reguladora. Los investigadores han sugerido que la producción de IL-10 por linfocitos Th1 puede ser un mecanismo de control de retroalimentación para limitar el daño al huésped causado por la respuesta fuerte Th1 mientras se mantiene la respuesta efectora18.
d. TGF-β pertenece a una superfamilia de factores de crecimiento que incluye tres isoformas7, 8,19. Es una proteína homodimérica, producida por una gran variedad de células, como plaquetas, células endoteliales, linfocitos y macrófagos. Se sintetiza como un precursor inactivo, que debe ser escindido proteolíticamente para generar la proteína activa, se une a dos receptores celulares (tipo I y II) con actividad serina-treonina kinasa, y desencadena la fosforilación de factores citoplásmicos denominados Smads, de los que existen diferentes formas19,20.
Los Smads fosforilados se unen a Smad-4 para formar heterodímeros que entran en el núcleo y se asocian a otras proteínas de unión a ADN para activar o inhibir la transcripción de genes específicos. TGF-β tiene actividad pleiotrópica, a veces opuesta en función del tipo de tejido afectado y el tipo de daño14.
En la mayoría de las células epiteliales, TGF-β es un inhibidor del crecimiento, ya que promueve la expresión de inhibidores del ciclo celular de las familias Cip/Kip e INK4/ARF. En cuanto a las células del mesénquima, el efecto de TGF-β depende del entorno, pero puede promover la invasión y la metástasis durante el crecimiento de un tumor. A menudo, durante el desarrollo de un tumor se pierde TGF-β, lo que proporciona una ventaja adaptativa a las células tumorales14.
TGF-β tiene una fuerte acción antiinflamatoria, pero puede amplificar algunas funciones inmunes. Los ratones knock-out para TGF-β1 presentan defectos en los linfocitos T reguladores, lo que genera una inflamación extensa con abundante proliferación de linfocitos T y diferenciación de CD4+ en linfocitos "helper" Th1 y Th214.
Maduración intratímica
El repertorio de células Treg se forma en el timo por un proceso de selección positiva y negativa, la avidez determina el destino de las células T. A una avidez baja las células reciben la señal necesaria para su sobrevivencia. A una señal alta las células potencialmente autorreactivas son eliminadas y son seleccionadas negativamente (mueren por apoptosis) caracterizándose por tener una alta afinidad por el CMH clase II, lo cual predispone un alto de riesgo de generar reacciones autoinmunitarias. Las células que mantienen una avidez intermedia son FoxP3- y se diferencian en células efectoras convencionales (Th0) Figura 2.
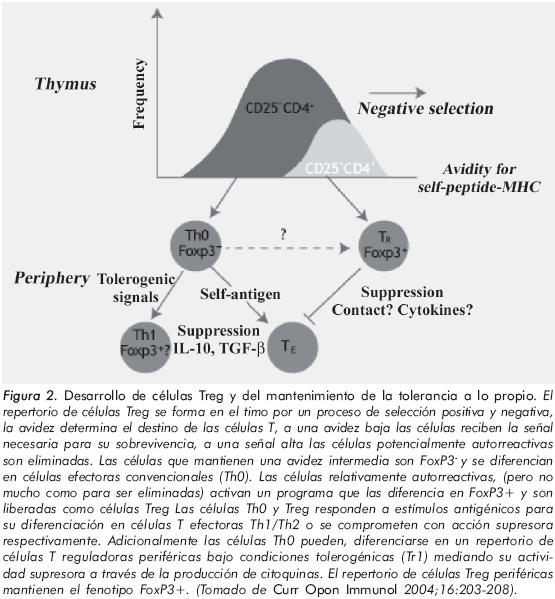
Las células Treg inician su función efectora en el momento en que la célula presentadora de antígeno (CPA), se une al linfocito T regulador mediante la expresión de CD80 (B7 1), CD86 (B7 2) y CTLA-4, CD28, respectivamente. Después del contacto, los linfocitos Treg sintetizan el gen Foxp3, el cual compite con el factor nuclear de células T activadas (NFAT) en la porción 5', en la región promotora de genes que codifican para la IL-2, IL-4, TNFα y GM-CSF, conllevando a la inhibición de la activación de la cascada inflamatoria asociada al reclutamiento y proliferación de los linfocitos Th14.
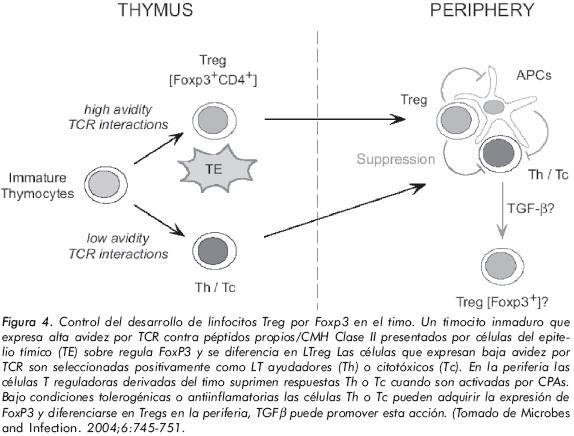
El timo produce la mayoría de las células Treg CD4+CD25+, así como de otras subpoblaciones de célula T, distintas del linaje de células Treg presentes en la circulación. Los timocitos Treg CD4+CD25+ son fenotípicamente similares a las células Treg presentes en los compartimentos periféricos con un equivalente funcional de anergia y de acción supresora demostrado en ensayos "invitro". Los timocitos CD4+CD25+, expresan marcadores de superficie clásicos como: CTLA-4 (antígeno 4 asociado a células T citotóxicas, GITR (proteína asociada al receptor de TNF inducida por glucocorticoides)9. La depleción de timocitos CD4+CD25+ inducen enfermedad autoinmune en modelos murinos, se sugiere que el timo normal continuamente está produciendo tanto linfocitos T CD4+CD25-efectores como células Treg CD4+CD25+ 9,10.
Durante la maduración de las células T en el timo, las células T expresan un amplio repertorio de receptores (TCR) constituidos por cadenas αβ o γδ las que se combinan de forma aleatoria, pero solamente las células T que expresan un TCR, que reconocen con moderada afinidad los péptidos propios, maduran completamente para ubicarse en los órganos linfoides secundarios. Uno de los fenotipos de células T que posiblemente escapa de la selección negativa dentro del timo, son las células T reguladoras CD4+CD25+; sin embargo, son varias las subpoblaciones de células T involucradas en los mecanismos de regulación. Para algunos investigadores las células Treg salen del timo a la circulación como células T naive, con un fenotipo CD45RA+ GIRF(-); de hecho estas células son capaces de suprimir la proliferación de células efectoras activadas policlonalmente, que pierden la capacidad para reaccionar o suprimir respuestas contra autoantígenos9.
Poblaciones de células reguladoras
Recientemente se ha intensificado el estudio sobre el control de las células Treg en el control de la respuesta inmune, identificándose varias subpoblaciones tanto en murinos como en humanos, los cuales incluyen regulación cruzada sobre Th1 y Th2. Dentro del repertorio de células reguladoras se han identificado las siguientes subpoblaciónes de células T y poblaciones de células dendríticas tolerogénicas:
- Células T CD4+ productoras de factores solubles TGFβ-1 (Th3), capaces de inhibir el desarrollo de algunas enfermedades autoinmunes.
- Células Treg CD4+ tipo 1 (Tr1), productoras de altos niveles de IL-10 que inhiben respuesta de células Th1.
- Células CD8+CD28-con actividad supresora, células T asesinas naturales cuya actividad depende del contacto fas/fasL (NKT).
- Células T γδ, con una importante actividad reguladora.
- Células Treg CD4+, caracterizadas por una alta expresión de CD25+ (receptor de IL-2 cadena á) llamados Treg CD4+CD25+, que se encuentran tanto en timo como en sangre periférica y están involucradas en los mecanismos activos de tolerancia periférica de células T autorreactivas, las que han escapado de la selección tímica21,22,23.
- Células dendríticas tolerogénicas estimuladas con Galectina-1 son capaces de actuar como 'proyectiles silenciadores' cuando son administradas terapéuticamente.
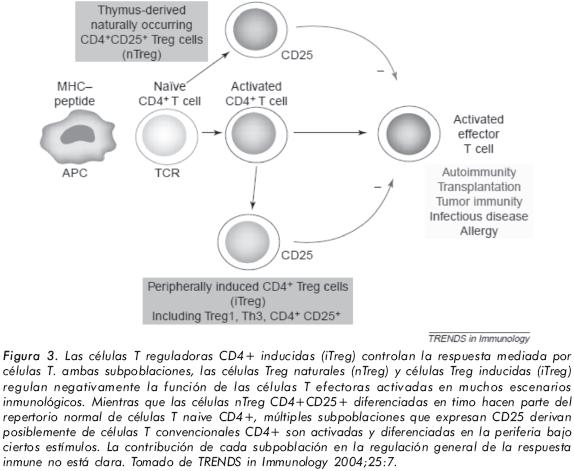
Basados en los extensos datos obtenidos de modelos murinos, se han propuesto dos subpoblaciones que difieren en términos de especificidad y mecanismos efectores: las células reguladoras naturales llamadas Treg CD4+CD25+, también llamadas Treg Profesionales, que se desarrollan en el timo, y son el resultado de la maduración de células T específicas de antígeno. Una característica importante es que son de larga vida, especializadas en la prevención de reacciones autoinmunes. Las células Treg naturales, por su parte, se desarrollan en el timo durante los estados tempranos de desarrollo fetal. La segunda subpoblación denominada células T reguladoras inducibles o adaptativas (Tr1, Th3 y otras células,) se desarrollan como consecuencia de la activación de células T maduras bajo condiciones particulares de exposición subóptima de antígenos o coestimulación24'25.
· Células T reguladoras naturales (nTreg)
Una de las subpoblaciones de células Treg que ha sido ampliamente estudiada, es el de las células T reguladoras naturales (nTreg) que se caracteriza por presentar algunas moléculas de superficie, entre las que se encuentran CD4+ CD25+ Foxp3+. Las células nTreg, adquieren su capacidad reguladora intratímicamente y representan del 1 al 10% del total de células T CD4+. En los compartimentos linfoides, los linfocitos Treg presentan TCRs que no tienen afinidad por el reconocimiento de péptidos propios y se autorregulan con el fin de prevenir la autoinmunidad11,12.
Los nTreg presentan cierta similitud con los linfocitos T de memoria y su repertorio TCR es tan diverso como el de cualquier otra célula T26; no obstante, los nTreg son anérgicos in vitro en presencia de estímulos convencionales de linfocitos T como el anti-CD3 soluble o unido a placa. Esta anergia puede contrarrestarse por medio de la adición de citoquinas como IL-15, IL-18 e IL-2, las que anulan las propiedades supresoras de los nTreg27, 11, 12. Sin embargo, in vivo los nTreg sufren una expansión clonal tras exposición a antígenos, manteniendo sus propiedades supresoras; su papel esencial en la tolerancia y en la regulación inmune ha sido ilustrado por diferentes hallazgos de mutaciones en el gen Foxp3, desencadenando autoinmunidad y enfermedades alérgicas28,12.
Las células nTreg son anérgicas para inducir la expresión de TCRs polimórficos con alta afinidad antigénica y producción de citoquinas in vitro; por tanto no son patogénicas, no obstante su aparente alta reactividad a antígenos propios29. Las células nTreg pueden expandirse activamente y mediar la supresión antígeno especifica in vivo. La eliminación o anulación funcional de las células nTreg de sangre periférica en modelos animales, lleva al desarrollo espontáneo de enfermedades autoinmunes. Además, la depleción de nTreg provoca efectiva inmunidad a tumores, aumentando la respuesta inmune a bacterias, hongos, protozoos, nematodos y virus; el disparo de la respuesta alérgica a agentes ambientales y la ruptura de la tolerancia materno fetal durante el embarazo. Es así como las células nTreg FoxP3+, no solamente regulan la respuesta autoinmune sino que además suprimen una variedad de respuestas patológicas inflamatorias en un amplio espectro de antígenos no propias30.
· Treg inducibles
Son inducidas en la sangre periférica por la conversión de células T inmaduras CD4+ CD25- en presencia de un microambiente particular. Generadas por estimulación antigénica bajo condiciones especiales en la periferia, las células Treg inducibles, denominadas también células reguladoras adaptativas, expresan el CD25 durante el curso de una respuesta inmunológica normal, pero de manera variable. Esta subpoblación celular incluye dos subconjuntos similares, estas son las células Th3 y Tr1, las cuales difieren en la secreción del factor de crecimiento transformante beta (TGF-β) e IL-10, respectivamente. A diferencia de los clones celulares Tr1, las células TCD4+CD25+ inducibles expresan significativamente altos niveles de CD25, no proliferan en respuesta a citocinas y, más importante aún, no producen IL-102. Las células Tregs inducibles han demostrado desarrollarse durante la inducción de la tolerancia oral a un alérgeno y podrían jugar un papel importante en la inducción de la tolerancia durante la inmunoterapia, sin embargo, su fenotipo es mucho menos estable que el de las células Tregs. naturales1.
Las células T reguladoras CD4+ inducidas (iTreg) controlan la respuesta mediada por células T ambas subpoblaciones, las células Treg naturales (nTreg) y células Treg inducidas (iTreg) regulan negativamente la función de las células T efectoras activadas en muchos escenarios inmunológicos (Figura 3). De este modo, los mecanismos de supresión para las células Tregs inducidas se regulan principalmente a través de la secreción de citocinas tales como la IL-10 y el TGF-β7,19.
· Células Trl
En cuanto a las células Tr1, éstas tienen una baja capacidad proliferativa y producen altos niveles de IL-10, bajos niveles de IL-2 y no producen IL-4. Estas células antígeno-específicas suprimen la proliferación de las células TCD4+ en respuesta al antígeno, y previenen la inducción de colitis experimental en ratones con SCID (inmunodeficiencia combinada severa). Adicionalmente, disminuyen la expresión de moléculas co-estimuladoras y la producción de citocinas pro-inflamatorias por las células presentadoras de antígenos (APC), pero para ello requieren ser activadas a través de su TCR para ejercer dicha función supresora31. Éstas células son abundantes particularmente en el tracto gastrointestinal, en donde cumplen un papel importante al disminuir la regulación de la respuesta inflamatoria desencadenada por la flora comensal1.
· Células Th3
Estas son células T CD4+ CD25+ inducidas por antígenos orales en los nódulos linfáticos mesentéricos, las cuáles fabrican TGF-β y cantidades variables de IL-4 e IL-10. Actúan primordialmente sobre las células T efectoras y suprimen el desarrollo de encefalomielitis autoinmunitaria experimental (EAE), lo cual destaca su capacidad para inhibir los efectos patogénico de células T autorreactivas8, 2.
· Células CD8 supresoras
Estas células actúan primordialmente sobre las células presentadoras de antígenos (CPA). Asimismo, se cree que inducen la aparición de células presentadoras reguladoras CD1868.
Células TNK reguladoras (TNK Reg)
Las células TNK, constituyen un sublinaje de células T con propiedades únicas tales como: reactividad hacia antígenos lipídicos presentados a través de la molécula CD1d, expresión de una cadena invariante del TCR y requerimientos diferentes para la selección tímica a las células T convencionales. Estas células expresan moléculas coestimulatorias como CD40L y producen citocinas como el IFN-γ y la IL-12, la cuáles conllevan a la activación de células dendríticas y al direccionamiento de las respuestas hacia un patrón de tipo Th1. Sin embargo, las células T NK también pueden producir citocinas de tipo Th2 como la IL-4, IL-10 e IL-13 después de la estimulación, por lo cual serían capaces de modular diferentes respuestas inmunológicas y procesos patogénicos tales como el asma, especialmente a través de la inducción de la activación de células dendríticas con propiedades reguladoras y productoras de IL-10, la cual es esencial para la generación de células T CD4 reguladoras7. Las células T NK reguladoras han mostrado ejercer una actividad reguladora fuerte en enfermedades autoinmunitarias tales como la diabetes mellitus y la encefalomielitis autoinmunitaria experimental (EAE) y dependen básicamente de la IL-15 para su supervivencia2.
Las células TNK Reg reconocen compuestos de 2-galactosilceramida que son presentados por moléculas CD1b o CD1d y pueden activarse generando citocinas típicas de la respuesta Th1, o secretar IL-10, llevando a cabo de este modo su papel regulador8.
Células dendríticas tolerogénicas
No son células T, producen la enzima indolamina-2,3 dioxigenasa (IDO), la cuál es responsable de la degradación del triptófano que es a su vez un aminoácido esencial para los microorganismos patógenos. En el tracto respiratorio, las células dendríticas forman una densa red dentro de y debajo de la submucosa en donde se especializan en la captura de alérgenos y partículas inhaladas20. Las células dendríticas del tracto respiratorio juegan un papel importante en la activación y reclutamiento tempranos de las células Th2 hacia las vías aéreas. Estas células son capaces de capturar alérgenos inhalados y transportarlos rápidamente hacia los nódulos linfáticos regionales para poder llevar a cabo la presentación antigénica a los linfocitos T. Dicha migración es modulada principalmente por la expresión de receptores de quimiocina sobre su superficie. Después de la exposición al alérgeno, las células dendríticas expresan altos niveles de MHC clase II y CD11c. Una vez en los nódulos linfáticos regionales, las células dendríticas estimulan a las células T nativas, dando lugar así, al inicio de la respuesta inflamatoria por la inducción de la activación de los linfocitos Th1 y Th2, los cuáles se activan dependiendo del antígeno desencadenante de la respuesta20.
En cuanto a su mecanismo de acción asociado a neoplasias, en el momento en que es necesario silenciar la respuesta inmunológica, la galectina-1 (una proteína que se une a cadenas de azúcares presentes en ciertas células del sistema inmune y que es producida por células cancerosas para neutralizar los linfocitos T activados destinados a destruirlas) incrementa sus niveles y en éste sentido, las células dendríticas (normalmente involucradas en iniciar y amplificar la respuesta inmune activando linfocitos T) exponen azúcares específicos y se tornan células dendríticas capaces de silenciar y frenar la respuesta inflamatoria. Estas células adquieren el nombre de "células dendríticas tolerogénicas" (ya que son capaces de generar tolerancia). Una vez que este fenómeno sucede se desencadena una cascada de eventos moleculares que determinan el silenciamiento de la respuesta inmunológica. La segunda etapa de este circuito involucra la liberación de IL-27 por parte de estas células dendríticas tolerogénicas, las cuáles son capaces de convertir células T activadas en "células T regulatorias" productoras de IL-10, la cual puede finalmente suprimir la respuesta inflamatoria en diversos escenarios, como enfermedades autoinmunes (ej. Esclerosis múltiple, artritis reumatoidea), infecciones y tumores). De este modo, las células dendríticas tolerogénicas estimuladas con Galectina-1 son capaces de actuar como 'proyectiles silenciadores' cuando son administradas terapéuticamente32.
Mecanismo de acción de células T reguladoras
El mecanismo preciso por el que las células Treg ejercen supresión se desconoce, se piensa que se requiere contacto célula-célula, aunque hay algunos estudios que muestran un aumento en la actividad de las células Treg inducida por citoquinas. La actividad reguladora también puede ser inducida en los linfocitos T vírgenes por numerosos factores ambientales y los ejemplos más comunes de estas células T reguladoras inducidas (iTregs), son las células CD4+ Tr1 y Th3. Al contrario de los linfocitos Treg CD4+CD25+ derivados del timo, la mayoría de los iTreg, median la supresión, principalmente por medio de la secreción de citocinas26.
Las células Treg han surgido como un bastión importante en la inmunopatología de las enfermedades autoinmunes como en el Lupus Eritematoso Sistémico (LES). Los trabajos de Grossman et al. (2004)33, han demostrado que las células Treg adaptativas humanas con un fenotipo similar al de las células NK reguladoras, expresan cantidades importantes de granzima B y desarrollan una actividad lítica dependiente de perforinas. Han demostrado además, que las células nTreg CD4+CD25+ naturales activadas expresan granzima A con niveles bajos de granzima B. Estas dos subpoblaciones de T reguladoras ejercen una actividad citolítica sobre células autólogas, incluyendo células CD4+CD8+ y CD14+ (dendríticas maduras e inmaduras); esta citotoxicidad es dependiente de la unión con CD18, pero es independiente de Fas/FasL.
Hay varios mecanismos que explican la actividad citotóxica de algunas subpoblaciones de Treg, los defectos en la actividad reguladora en estas subpoblaciones está asociado con varias patologías que incluyen: Linfohistocitosis, Síndrome de Grincellis y enfermedad proliferativa ligada al cromosoma X34. Aunque las células T CD4+ expresan perforinas y granzimas, la importancia funcional de la exocitosis de los gránulos no es clara33. Las células T CD4+ con actividad reguladora, generalmente han sido clasificadas en dos subtipos: naturales y adaptativas basados en su ontogenia y modo de acción35.
· FoxP3, un regulador crítico en el desarrollo y función de los linfocitos Treg
Es un gen que se encarga del desarrollo y funcionamiento de las células Treg y, asimismo, es utilizado como un marcador para la subpoblación de estas células. La expresión de Foxp3 es típica de células CD4+CD25+ y se correlaciona con la actividad supresora de estas células. Foxp3, a pesar de ser un marcador distintivo de las células Tregs, puede ser también expresado por células T efectoras después de su activación7,19,36. El gen está ubicado en el cromosoma X, en donde codifica para la proteína escurfina. En cuanto a la estructura del Foxp3, éste consta de un dominio N- terminal que media la activación y la represión de la transcripción, dedos de Zinc y dominios de cremallera de leucina que median la homo y hetero-oligomerización del Foxp3 con ciertas miembros de su misma familia, y un dominio carboxiterminal que media su anclaje a elementos de respuesta específicos del ADN. Foxp3 también contiene residuos que contribuyen a la asociación física del Foxp3 con otros elementos de transcripción, incluyendo el factor nuclear de células T activadas (NFAT) y Runx1/ AMI1, los cuáles hacen parte del mecanismo de transcripción y de las funciones supresoras de las células Tregs20. La deficiencia del Foxp3 da origen a diferentes síndromes autoinmunes como: enteropatía ligada al cromosoma X (IPEX), poliendocrinopatías, entre otras8. Los hallazgos del síndrome IPEX están determinados por una desregulación inmunológica. Esta enfermedad se presenta típicamente durante la infancia y se asocia a enteropatía, endocrinopatía autoinmunitaria, citopenia y dermatitis. La endocrinopatía autoinmunitaria se caracteriza por el comienzo temprano de diabetes mellitus tipo I, frecuente durante el primer año de vida. El hiper o hipotiroidismo resultante es también bastante común. Varias de las desregulaciones alérgicas en el síndrome IPEX resultan de la presencia de precursores de células Tregs que secretan grandes cantidades de citocinas de tipo Th2, especialmente de IL-4, lo cual conlleva a pensar que la alergia a las comidas es una manifestación de la deficiencia de las células Treg inducibles. En éste sentido, la deficiencia de Foxp3 en los precursores de las células Treg conlleva a que éstas pierdan su función como células supresoras. Asimismo, dicha deficiencia acarrea un aumento en la tasa de apoptosis en células Treg, debida a una falta de respuesta de ciertos factores de crecimiento como IL-237.
Según ciertas investigaciones, la presencia en un nivel alto así como la expresión persistente de Foxp3, son importantes para el mantenimiento de la función supresora. Por otro lado, la expresión de la molécula CD127 está inversamente correlacionada con la de Foxp3, de modo que, hasta el momento, las células Tregs se conocen por ser CD4+CD25 con altos niveles de Foxp3 y bajos de CD12736.
Estudios recientes revelan la existencia de una pequeña población de células T CD4+CD25- (1-2% de células T CD4+) que expresan niveles intermedios de mRNA FoxP3 y también desarrollan actividad de Treg La relevancia de estas células en la homeostasis y su importancia en la ontogenia no es conocida28, 38. La naturaleza precisa de la señal tímica requerida para el desarrollo de los Treg no es clara, pero algunos conceptos empiezan a emerger, como el de que la población funcionalmente madura de Treg surge en el timo y que las primeras células FoxP3+ son detectadas en estado de timocito sencillo positivo CD4+, Figura 4. Evidencias sugieren que la señal desarrollada por células Treg requieren de una única interacción entre el receptor TCR y células del estroma tímico que presentan péptidos asociados a la molécula CMH de clase II39.
Células Treg activadas por microorgccanismos y su papel en la autoinmunidad
Mientras que algunos agentes infecciosos se han relacionado con la aparición de la enfermedad autoinmune, también hay evidencia de que ciertos agentes infecciosos podrían inhibir la patología autoinmune40,41. Los estudios iniciales sobre autoinmunidad resaltaron el papel de los agentes infecciosos en el desarrollo de la enfermedad autoinmune, a través del mimetismo molecular y de la sobre activación de las células T42. Por ejemplo las reacciones cruzadas entre los antígenos del estreptococo del grupo A y el músculo cardiaco han mostrado ser las responsables de el desarrollo de la enfermedad cardiaca autoinmune43.
La infección directa de un tejido que conduce a la destrucción y a la liberación de autoantígenos podría ser la explicación en el inicio de la respuesta autoinmune. Un ejemplo de este mecanismo es lo observado por el virus de la rubeola en la infección de las células beta del páncreas y su asociación con la aparición de la diabetes melitus tipo 1 en modelos animales44. Sin embargo los estudios recientes muestran algunos ejemplos de procesos infecciones en los que se ha impedido el inicio de la enfermedad autoinmune45,41. Las infecciones bacterianas generan la activación principalmente de macrófagos, células B reguladoras y células T reguladoras, lo cual conlleva la producción de citocinas inmunosupresoras tales como la IL-10 y el TGF-β por parte de los macrófagos y células T reguladoras inducidas; en cuanto a las células B reguladoras, éstas van a generar IL-10 y TGF-β1. La producción de estas citoquinas inhibe directamente el desarrollo de respuestas inflamatorias (figura 5) Hay que tener en cuenta que el número de células Treg puede verse incrementado por la presencia de infecciones8.
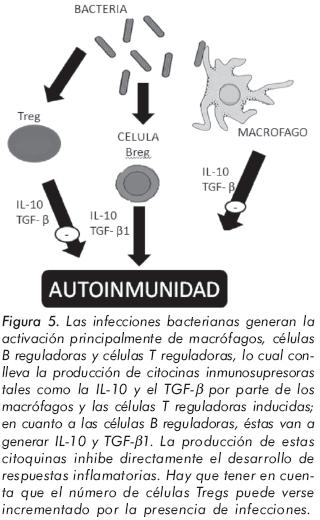
Las infecciones bacterianas y virales generan la activación de las células TNKreg, las cuales ejercen varias funciones relacionadas con la inhibición de las respuestas autoinmunitarias, la lisis de las células infectadas y la activación de macrófagos, entre otras; cuando no se llevan a cabo estas funciones adecuadamente, se produce la autoinmunidad.
Las células TNK Reg reconocen compuestos de 2-galactosilceramida que son presentados por moléculas CD1b o CD1d y pueden activarse generando citocinas típicas de la respuesta Th1, o secretar IL-10, llevando a cabo de este modo su papel regulador8.
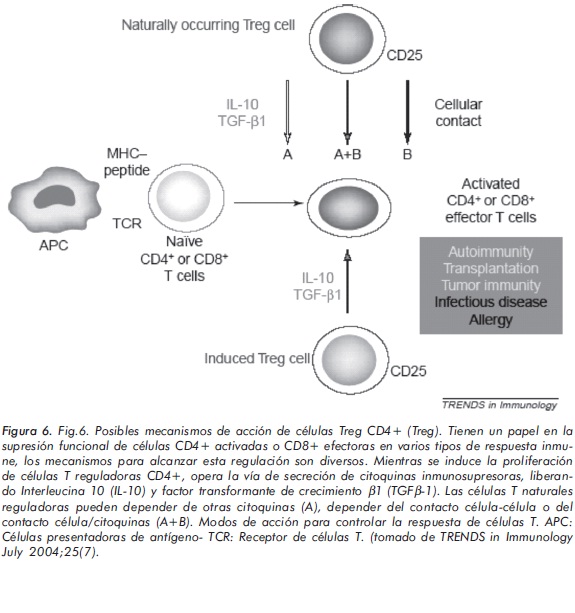
Supresión por citoquinas por parte de células T CD4+CD25+ naturales (nTreg)
Como se mencionó anteriormente varios tipos de subpoblaciones de células Treg se han identificado presentando diversos fenotipos específicos, algunas de estas poblaciones liberan patrones de citoquinas específicas. Una vez son activadas,realizan regulación cruzada sobre Th1 y sobre Th2, regulan la producción de IL-10 en células Tr1 e inducen liberación de TGFβ (factor transformante de crecimiento beta) en células Th3 (figura 6). Dentro de las señales requeridas por parte de las células Treg para inducir supresión se necesita el estímulo sobre TCR (receptor de la célula T) con la consecuente liberación de IL-2. Las Treg pueden ejercer la acción tanto sobre CD4+ como CD8+21,46,21. En un estudio reciente, Sugimoto y cols, reportaron que las células T CD4+CD25+, pueden ser expandidas por células dendríticas en ausencia de citoquinas exógenas y que la expansión e inducción de la actividad supresora requiere de la coestimulación de B7 en el contacto célula-célula47.
Implicación de los linfocitos Treg en la fisiopatología del Lupus Eritematoso Sistémico (LES).
El lupus es un desorden multisistémico que se caracteriza por síntesis de autoanticuerpos que inducen la formación de complejos inmunes circulantes los cuales se localizan en varios órganos causando daño tisular importante. El concepto de que las células T median la supresión de la autoinmunidad y regulan la respuesta inmune fue descrito hace 40 años, a mediados de los años 90 cuando Sakaguchi demostró que las subpoblaciones de linfocitos T expresaban altos niveles de receptores para IL-2 cadena α (CD25+), y eran capaces de prevenir el desarrollo de enfermedades autoinmunes sistémicas en ratones timectomizados. Son muchos los estudios que analizan el fenotipo de células Treg y su importancia en el desencadenamiento del lupus Eritematoso sistémico, pero ninguno se centra en los mecanismos involucrados en las vías de señalización mediados por la proteína zeta (ζ)48.
El concepto de que los Treg juegan un papel relevante en la prevención de los desordenes autoinmunes ha sido ampliamente soportado. El LES representa el prototipo clásico de la enfermedad autoinmune sistémica en el que la perdida de la tolerancia a antígenos propios conduce a la activación y expansión de linfocitos autorreactivos, producción descontrolada de muchos autoan-ticuerpos y liberación de mediadores inflamatorios que finalmente dañan muchos órganos49. Se asume que la alteración de la respuesta inmune, en este desorden multisistémico se debe a la pérdida de la tolerancia, sin embargo los mecanismos de tolerancia central parecen no estar afectados en los modelos animales que desarrollan lupus, no obstante se piensa que la ruptura de la tolerancia es un evento esencialmente de la periferia. En este contexto la hipótesis de un defecto significativo en el número y en la función de células T reguladoras cobra relevancia. El modelo hipotético de que las células T reg se encuentran disminuidas en número y en funcionalidad supone una atractiva estrategia terapéutica, ya que podría ofrecer nuevas formas para el tratamiento de esta devastadora enfermedad50.
Los estudios anteriores se centraron en la caracterización fenotípica de las células T circulantes con un limitado aporte debido a las dificultades al no poder diferenciar bien esta subpoblación de Treg, además los resultados no eran consistentes en parte porque las investigaciones se llevaron a cabo en diferentes fases de la enfermedad y con tratamientos que involucraban diferentes inmunosupresores. Los recientes trabajos de askenasy y kaminitz, han permitido demostrar una mayor actividad supresora en linfocitos Treg con una mayor expresión de CD25+ en pacientes con LES49.
Con el fin de distinguir con más precisión entre células Treg y células T activadas, se han realizado estudios de evaluación de expresión de ARNm Foxp3 en linfocitos CD4 + CD25 + de pacientes con LES. La disponibilidad de nuevas herramientas para la detección de Foxp3 por citometría de flujo ha mejorado la fiabilidad de los datos. Es evidente que en el análisis de los diferentes estudios de células CD4+CD25, no arrojen datos concluyentes debido a la extrema heterogeneidad de este subgrupo de células T. sin embargo los estudios de Suarez Han permitido demostrar que hay un número reducido de células CD4 + CD25high circulantes en pacientes con Lupus51.
Los análisis de los resultados sobre la expresión de Foxp3 en células T CD4+ de pacientes con LES es más compleja, ya que la evaluación de su expresión se ha llevado a cabo con métodos diferentes y se ha analizado dentro de subgrupos de células diferentes. Es de gran interés la observación de que la expresión de Foxp3, tiende a reducirse en células T CD4+ que aumentan la expresión de CD25+ en pacientes con LES y un aumento en la expresión de FoxP3+ en el subgrupo de células T que carecen de CD25 en superficie. Los estudios recientes en células de pacientes con LES muestran un fenotipo T CD4+, CD25-/low circulación Foxp3 + +, que podrían ser consideradas células Treg52.
Bases patogénicas de LES pueden resultar también por un desequilibrio entre las células T efectoras y reguladoras, y no sólo por un defecto en las células Treg Existe alguna evidencia de que la función supresora alterada es demostrable cuando las células Treg son co-cultivadas con células T efectoras autólogas, pero no con las células T efectoras de donantes sanos, lo que sugiere una posible resistencia de las células T efectoras a la inhibición de Treg50,53,54.
Es concebible que existen muchas discrepancias acerca de los hallazgos de células Treg en el desarrollo del LES, es posible que su actividad pueda depender de variables como: las diferentes fases de actividad de la enfermedad y tratamientos inmunosupresores que pueden afectar a la viabilidad y función de las células T. En este contexto, la terapia con corticosteroides suele ser capaz de aumentar la circulación de subpoblaciónes de células con el fenotipo de las células Treg55,56. Estos resultados están de acuerdo con la observación general de que en la fase activa de la enfermedad se presenta un numero reducido y / o un defecto en el funcionamiento de las células Treg El funcionamiento defectuoso parece estar asociado con las fases activas de la enfermedad, un fenotipo y función similar a los controles es el hallazgo más frecuente en células Treg de pacientes con LES inactivo55,56.
En conclusión, los datos disponibles parecen indicar que la molécula CD25 no es un marcador de superficie suficiente para distinguir las células Treg en LES. A pesar de que el factor de transcripción Foxp3 es actualmente el marcador más específico de las células CD4+ Treg, se hace necesaria la presencia de otros marcadores de superficie para identificar células T reg.
Uno de los marcadores utilizados actualmente es el receptor GITR identificado en células Treg de ratones y de seres humanos.GITR es una glicoproteína transmembrana de tipo I, clonada en 1997 en ratones y en seres humanos57,58. GITR se une y activa varias proteínas asociadas al receptor de TNFα (TNFαR),como TRAF el cual posee un dominio de muerte que contienen proteínas de modulación de la familia de las caspasas como Bcl-2.La activación fisiológica y farmacológica de receptores GITR exacerba el desarrollo de enfermedades autoinmunes e inflamatorias57,58.
Sin embargo, la inhibición de la actividad supresora de células Treg es transitoria. Por otra parte, GITR-coactiva las células Treg inhibiendo la proliferación e induciendo un estado anérgico. En particular, la activación de GITR aumenta la actividad de las células T, tanto a través de la coestimulación de células T efectoras y la inhibición de la actividad de regulación Tcell, incluyendo las células T reguladoras59. Sin embargo, la inhibición de la actividad supresora de células Treg es transitoria. Aún no está claro si GITR es un marcador de las células Treg humanas, pues se ha demostrado, que sólo el 5% de los T CD4 + CD25 + son positivos para GITR. Hay pocos datos publicados sobre la expresión y función GITR en las células T59.
Manejo de las células Treg como tratamiento en enfermedades autoinmunitarias y cáncer
La manipulación de las células Treg es una estrategia atractiva para la inmunoterapia, tal y como ha sido sugerido por la transferencia adoptiva de células Treg en el tratamiento experimental de enfermedades autoinmunitarias. Estrategias de tratamiento similares están empezando a ser desarrolladas en humanos, en quienes se tiene previsto que la terapia celular con células Treg antígeno específicas podría conllevar al desarrollo a largo plazo de la modulación inmune sin conllevar a problemas asociados a la inmunosupresión o a la toxicidad sistémica37.
En cuanto al cáncer, y de acuerdo a la evidencia arrojada, las células Treg ejercen un papel crítico en los circuitos regulatorios inmunes al atenuar la inmunidad antitumoral. En éste sentido, para mejorar el pronóstico de los pacientes con neoplasias, se hace necesario el manejo de compuestos como la ciclofosfamida, la cual antagoniza la función de las células Treg. Por otro lado, estudios adicionales han demostrado que el empleo de anticuerpos que bloqueen al CTLA-4, ha establecido actualmente la habilidad de este esquema de efectuar la sustancial destrucción del tumor37.
Agradecimientos
A Paola Santamaría estudiante de quinto semestre de medicina de la Universidad Colegio mayor de Nuestra señora del Rosario por su activa participación en la revisión del tema y su valiosa colaboración en la elaboración del escrito.
Bibliografía
1. Juang CM, Hung C F, Yeh JY, Horng HC, Twu N F, Cheng MH, Wen KC, Yuan CC, Chao KC, Wu TC, Yen MS. Regulatory T cells: potential target in anticancer immunotherapy. Taiwan J Obstet Gynecol 2007;46(3):215-221. [ Links ]
2. Akbari Omid, Stock Philippe, DeKruyff Rosemarie, Umetsu Dale. Role of regulatory T cells in allergy and asthma. Current Opinion in Immunology 2003;15:627-633. [ Links ]
3. Gershon, R. K. and Kondo, K. Cell interactions in the induction of tolerance: the role of thymic lymphocytes. Immunology 1970;18:723. [ Links ]
4. Sakaguchi S, Wing K and Miyara M. Regulatory T cells a brief history and perspective. Eur. J. Immunol 2007;37:S116-S123. [ Links ]
5. Hisashi A. et al. The Study of regulatory T cells and NKT cells in Japan: A historical perspective. International Immunology. 2009;21(10):1101-1103. [ Links ]
6. Green D.R., Flood, P.M. and Gershon, R. K., Immunoregulatory T-cell pathways. Annu. Rev. Immunol 1983;1:439-463. [ Links ]
7. Velásquez Sonia, García Luis, Álvarez Cristian. Las células T reguladoras y su influencia en la sobrevida del trasplante renal. Medicina 2007;67:491-501. [ Links ]
8. Jaramillo Francisco, Gómez Luis Miguel, Anaya Juan Manuel. Células T reguladoras, infección y autoinmunidad: implicaciones en terapéutica. Asociación colombiana de infectología 2006;10(3):178-180. [ Links ]
9. Shimizu J, Yamazaki S, Takahashi T, Ishida Y, Sakaguchi S:Stimulation of CD25(R)CD4(R) regulatory T cells through GITR breaks immunological self-tolerance. Nat Immunol 2002;3:135-142. [ Links ]
10. McHugh RS. CD4+CD25+ immunoregulatory T cells: gene expression analysis reveals a functional role for the glucocorticoid induced TNF receptor. Immunity 2002;16:311-323. [ Links ]
11. Fehervari Z, Sakaguchi S. Development and function of CD25+CD4+ regulatory T cells. Curr Opin Immunol 2004;16:203-208. [ Links ]
12. Sakaguchi S. Natural arising CD4+ regulatory T cells for immunologic self-tolerance and negative control of immune response. annu. Rev. Immunol 2004;22: 531-562. [ Links ]
13. Aristimuño V. Carolina, T, Caracterización de linfocitos Treg y células dendríticas en pacientes con esclerósis Múltiple Recurrente remitente 2007, Universidad Complutense, Madrid. [ Links ]
14. Kumar Path, Abul K. Abbas, Nelson Fausto and Jon Aster. "Ch-Tissue Renewal, Regeneration and Repair", Saunders (Elsevier) (ed.). 2009. Robbins & Cotran Pathologic Basis of Disease, 8th edición. [ Links ]
15. Daniele N, Scerpab MC, Landia F, Canigliac M, Jan Mieleb M, Locatelli F, Isacchi G, Zinnoa F, Treg cells: Collection, processing, storage and clinical use Pathology-Research and Practice 2011;207:209-215. [ Links ]
16. Sacks D, Anderson C. Re-examination of the immunosuppessive mechanisms mediating-cure of Leishmania infection in mice. Immunol Rev 2009;201: 225-238. [ Links ]
17. Anderson C, Oukka M, Kuchroo V. CD4+CD25-FOXP3-TH1 cells are the source of IL-10-mediated immune suppression in chronic cutaneous leishmaniasis. J Exp Med 2007;204:285-297. [ Links ]
18. Jankovic, D. et al. Conventional T-bet+FOXP3-TH1 cells are the major source of host-protective regulatory IL-10 during intracellular protozoan infection. JEM 2007;204:2:273-283. [ Links ]
19. Cabezas Lopategui, Cervantes Llano, Pentón Rol. Respuesta inmune en la neuromielitis óptica. Anales de medicina interna 2008;25(7):362-365. [ Links ]
20. Burchell T. Jennifer, Strickland H. Deborah, Stumbles Philip. The role of dendritic cells and regulatory T cells in the regulation of allergic asthma, pharmacology and therapeutics 2010;125:1-10. [ Links ]
21. Shevach, E.M. et al. Control of T cell activation by CD4+CD25+ suppressor T cells. Novartis Found. Symp 2003;252:24-36. [ Links ]
22. Maloy KJ, Powrie F. Regulatory T cells in the control of immune pathology. Nat Immunol 2001;2:816-822. [ Links ]
23. Pearson CL, McDevitt HO. Redirecting Th1 and Th2 responses in autoimmune diseases. Curr Top Microbiol Immunol 1999;238:79-122. [ Links ]
24. Suciu-Foca N, Manavalan JS, Cortesini R. Generation and function of antigen-specific suppressor and regulatory T cells. Transpl Immunol 2003;11:235-244. [ Links ]
25. Hayday A, Tigelaar R. Immunoregulation in the tissues by gammadelta T cells. Nat Rev Immunol 2003;3: 233-242. [ Links ]
26. Berthelot, J.M., Maugars, Y. Role for suppressor T cells in the pathogenesis of autoimmune diseases (including rheumatoid arthritis). Facts and hypotheses Joint Bone Spine 2004;71:374-380. [ Links ]
27. Koenen H, Fasse E, Joosten I. IL-15 and cognate antigen successfully expand de novo-induced human antigen-specific regulatory CD4+ T cells that require antigen-specific activation for suppression. J Immunol 2003;171:6431-6441. [ Links ]
28. Hori S, Nomura T, Sakaguchi S: Control of regulatory T cell development by the transcription factor Foxp3. Science 2003;299:1057-1061. [ Links ]
29. Sakaguchi S., Yamaguchi T., Nomura T., Ono M. Regulatory T cells and immune tolerance. Cell 2008; 133(5):775-787. [ Links ]
30. Piccirillo C, Thornton A. Cornerstone of peripheral tolerance: naturally occurring CD4+CD25+ regulatory T cells. Trends Immunol 2004;25:374-380. [ Links ]
31. Gagliani Nicola, Ferraro Alessandra, Grazia Ronca-rolo, Battaglia manuela. Autoimmune diabetic patients undergoing allogeneic islet transplantation: are ready for a regulatory T-cell therapy? Elsevier, 2009. [ Links ]
32. Croci Diego, Bianco Germán, Toscano Marta, Salatino Mariana, Stupirski Juan Carlos. Galectina-1 como una posible diana terapéutica en enfermedades auto-inmunes y el cáncer. Natureinmunology. 2007 Academia Nacional de Medicina. [ Links ]
33. Grossman WJ, Verbsky JW, Barchet W, Colonna M, Atkinson J P, Ley TJ, Human T regulatory cells can use the perforin pathway to cause autologous target cell death. Immunity 2004;21:589-601. [ Links ]
34. Arico M, Imashuku S, Clementi R, et al. Hemophagocytic lymphohistiocytosis due to germline mutations in SH2D1A, the X-linked lymphoproliferative disease gene. Blood 2001;97:1131-1133. [ Links ]
35. Bluestone, J.A., and Abbas, A.K. Natural versus adaptive regulatory T cells. Nat. Rev. Immunol 2003;3:253-225. [ Links ]
36. Gerli Roberto; Nocentini Giuseppe; Alunno Alessia; Bartoloni Elena; Bianchini Rodolfo; Bistoni Onelia; Riccardi Carlo. Identification of regulatory T cells in systemic lupus erythematosus. El sevier 2009;00756:1-5. [ Links ]
37. Chi-Mou Juang, Chien-Fu Hung, Jiun-Yih Yeh, Huann-Cheng Horng, Nae-Fong Twu, Ming-Huei Cheng, Kuo-Chang Wen, Chiou-Chung Yuan, Kuan-Chong Chao, TC Wu. Regulatory T Cells: Potential Target in Anti-cancer Immunotherapy. Taiwanese Journal of Obstetrics and Gynecology 2007;46:215-221. [ Links ]
38. Fontenot JD, Gavin MA, Rudensky AY: Foxp3 programs the development and function of CD4RCD25R regulatory T cells. Nat Immunol 2003;4:330-336. [ Links ]
39. Khattri R, Cox T, Yasayko SA, Ramsdell F. An essential role for Scurfin in CD4RCD25R T regulatory cells. Nat Immunol 2003;4:337-342. [ Links ]
40. Zaccone P, Cooke anne, Infectious triggers protect from autoimmunity, Seminars in Immunology 2011;23: 122-129. [ Links ]
41. Cooke A, Zaccone P, Raine T, Phillips JM, Dunne DW. Infection and autoimmunity: are we winning the war, only to lose the peace? Trends Parasitol 2004; 20:316-321. [ Links ]
42. Weigle WO. Self-nonself recognition by T and B lymphocytes and their roles in utoimmune phenomena. Arthritis Rheum 1981;24:1044-1053. [ Links ]
43. Ellis NM, Kurahara DK, Vohra H, Mascaro-Blanco A, Erdem G, Adderson EE, et al. Priming the immune system for heart disease: a perspective on group A streptococci. J Infect Dis 2010;202:1059-1067. [ Links ]
44. Rayfield EJ, Kelly KJ, Yoon JW. Rubella virus-induced diabetes in the hamster. Diabetes 1986;35:1278-1281. [ Links ]
45. Lehuen A, Diana J, Zaccone P, Cooke A. Immune cell crosstalk in type 1 diabetes. Nat Rev Immunol 2010; 10:501-513. [ Links ]
46. Thornton, A.M. and Shevach, E.M. CD4þCD25þ immunoregulatory Tcells suppress polyclonal Tcell activation in vitro by inhibiting interleukin 2 production. J Exp Med 1998;188:287-296. [ Links ]
47. Sugimoto A, Suzuki M, Otani T, Okochi A, Takeuchi M, et al. HOZOTs, novel human regulatory T-cell lines,exhibit helper or suppressor activities depending on dendritic cell or anti-CD3 stimulation. Exp Hematol 2009;37:1454-1463. [ Links ]
48. Sakaguchi S, Sakaguchi N, Asano M, Itoh M, Toda M. Immunologic self tolerance maintained by activated T cells expressing IL-2 receptor α chain (CD25), breakdown of a single mechanism of self tolerance causes various autoimmune disease. J Immunol 1995;155: 1151-1164. [ Links ]
49. Askenasy N, Kaminitz A, Yarkoni S. Mechanisms of T regulatory cell function. Autoimmun Rev 2008;7:370-375. [ Links ]
50. Mellor-Pita S, Citores MJ, Castejon R, Tutor-Ureta P, Yebra-Bango M, Andreu JL, et al. Decrease of regulatory T cells in patients with systemic lupus erythematosus. Ann Rheum Dis 2006;65:553-554. [ Links ]
51. Suárez A, López P, Gómez J, Gutiérrez C. Enrichment of CD4+ CD25high T cell population in patients with systemic lupus erythematosus treated with glucocorticoids. Ann Rheum Dis 2006;65(11):1512-1517. [ Links ]
52. Zhang B, Zhang X, Tang F, Zhu L, Liu Y. Reduction of forkhead box P3 levels in CD4+CD25 high T cells in patients with new onset systemic lupus erythematosus. Clin Exp Immunol 2008;153:182-187. [ Links ]
53. Chowdary Venigalla RK, Tretter T, Krienke S, Max R, Eckstein V, Blank N, et al. Reduced CD4+,CD25- T cell sensitivity to the suppressive function of CD4+CD25high CD127low regulatory T cells in patients with systemic lupus erythematosus. Arthritis Rheum 2008;58:2120-2130. [ Links ]
54. Lee HY, Hong YK, Yun HJ, Kim YM, Kim JR, Yoo WH. Altered frequency and migration capacity of CD4+ CD25+ regulatory T cells in systemic lupus erythematosus. Rheumatology 2008;47:789-794. [ Links ]
55. Valencia X, Yarboro C, Illei G, Lipsky PE. Deficient CD4+CD25 (high) T regulatory cell function in patients with active systemic lupus erythematosus. J mmunol 2007;178:2579-2588. [ Links ]
56. Cepika AM, Marinic I, Morovic-Vergles J, Soldo-Juresa D, Gagro A. Effect of steroids on the frequency of regulatory Tcells and expression of FOXP3 in a patient with systemic lupus erythematosus: a two year follow-up.Lupus 2007;16:374-377. [ Links ]
57. Kwon B, Yu KY, Ni J, Yu GL, Jang IK, Kim YJ, et al. Identification of a novel activation-inducible protein of the tumor necrosis factor receptor superfamily and its ligand. J Biol Chem 1999;274:6056-6061. [ Links ]
58. Krausz LT, Bianchini R, Ronchetti S, Fettuciari K, No-centini G, Riccardi C. GITRL system, a novel player in shock and inflammation. Sci World J 2007;7:533-566. [ Links ]
59. Ramirez-Montagut T, Chow A, Hirschhorn-Cymerman D, Terwey TH, Kochman AA, Lu S, et al. Glucocorti-coid-induced TNF receptor family related gene activation overcomes tolerance/ignorance to melanoma differentiation antigens and enhances antitumor immunity. J Immunol 2006;176:6434-6442. [ Links ]














