Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista Colombiana de Reumatología
Print version ISSN 0121-8123
Rev.Colomb.Reumatol. vol.19 no.1 Bogotá Jan./Mar. 2012
INVESTIGACIÓN ORIGINAL
Luis Alonso González Naranjo1
1Sección de Reumatología. Departamento de Medicina Interna. Facultad de Medicina. Universidad de Antioquia, Medellín, Colombia.
2Grupo de Inmunología Celular e Inmunogenética. Facultad de Medicina. Universidad de Antioquia. Medellín, Colombia.
Correspondencia: Mauricio Restrepo E.: mauresco90@hotmail.com
Los autores declaran no presentar ningún conflictode interés al momento de laredacción del manuscrito.
Recibido: 8 de agosto de 2011.Aceptado: 16 de febrero de 2012.
Resumen
Los agentes biológicos inhibidores del factor de necrosis tumoral alfa (anti-TNF) se constituyen en un avance muy significativo en el tratamiento de los pacientes con espondilitis anquilosante (EA), demostrando una notable mejoría de sus síntomas, de su función y de su calidad de vida. Sumado a esta excelente respuesta clínica, se ha demostrado igualmente mejoría de la inflamación, demostrada mediante pruebas de laboratorio y estudios de resonancia nuclear magnética. A pesar de esta clara evidencia, la conexión entre actividad inflamatoria y progresión estructural no está tan claramente establecida como en artritis reumatoide (AR), y la evidencia de la eficacia de los anti-TNF en la prevención de la progresión del daño radiológico crónico en EA es deficiente. Se revisan las evidencias y las teorías actuales respecto a este crucial tema y se hace mención del importante papel de la proteína DKK-1, inhibidora de la vía Wnt. Esta proteína ha emergido recientemente como un regulador fundamental en la biología ósea y se constituye en una conexión clave entre inflamación, osteoporosis y remodelación articular.
Palabras clave: espondilitis anquilosante, anti-TNF, progresión radiográfica, proteína Dickkopf-1.
Summary
The anti-TNF biological agents constitute a major advance in the treatment of patients with ankylosing spondylitis (AS) showing a remarkable improvement in symptoms of patients, their function and quality of life. In addition to this excellent clinical response, it has also been clearly demonstrated improvement of inflammation as evidenced by laboratory tests and MRI studies. Despite this clear evidence, the connection between inflammatory activity and structural progression is not as clearly established as in rheumatoid arthritis, and the evidence of anti-TNF therapy to prevent chronic EA radiological damage is poor. We review the evidence and current theories about this crucial issue and mention the important role of DKK-1 protein, an inhibitor of the Wnt pathway. This protein has recently emerged as a key regulator in bone biology and constitutes a key link between inflammation, osteoporosis and joint remodeling.
Key words: spondylitis, ankylosing, tumor necrosis factor-alpha inhibitors, radiographic progression, Dickkopf-1 protein.
Introducción
Los agentes biológicos inhibidores del factor de necrosis tumoral alfa (anti-TNF) se constituyen en un avance muy significativo en el tratamiento de los pacientes con espondilitis anquilosante (EA), demostrando una notable mejoría de sus síntomas, de su función y de su calidad de vida. Sumado a esta excelente respuesta clínica, se ha demostrado igualmente mejoría de la inflamación, constatada mediante pruebas de laboratorio y estudios de resonancia nuclear magnética. A pesar de esta clara evidencia, la conexión entre actividad inflamatoria y progresión estructural no está tan claramente establecida como en la artritis reumatoide (AR), y la evidencia de la eficacia de los anti-TNF en la prevención de la progresión del daño radiológico crónico en EA es deficiente.
La presente revisión recoge las evidencias actuales respecto al papel de estos medicamentos en la prevención de ese daño estructural progresivo y la modificación de la historia natural de este grupo de enfermedades. Se hizo una búsqueda libre en Pubmed usando los términos «spondylitis», «ankylosing», «Tumor Necrosis Factor-alpha inhibitors», y «radiographic progression», y luego se ampliaron las fuentes mediante búsqueda manual dentro de las bibliografías de estas referencias originales.
Las espondiloartritis y su impacto clínico
Las espondiloartritis son un grupo de enfermedades relacionadas con características clínicas diferentes y una predisposición genética común1. La principal asociación genética identificada es con el antígeno HLA-B272, pero es claro que existen otros genes involucrados en su patogénesis3,4. Las principales manifestaciones clínicas de este grupo de enfermedades son dolor lumbar inflamatorio, artritis periférica, entesitis y uveítis anterior, entre otras. Se han definido al menos cinco subtipos de estas enfermedades: espondilitis anquilosante (EA), artritis reactiva, artritis soriática, artritis asociada con enfermedad inflamatoria intestinal y espondiloartritis indiferenciada1. Todas estas enfermedades han sido mejor entendidas y caracterizadas durante los últimos años, y se ha estimado que las espondiloartritis como grupo pueden ser más prevalentes incluso que la artritis reumatoide5.
Dentro del grupo de las espondiloartritis, la EA es la más representativa, y se caracteriza por ser una enfermedad inflamatoria, progresiva y crónica que afecta a hombres y mujeres con inicio de síntomas durante la segunda a tercera década de la vida, y con gran impacto en la calidad de vida y la productividad laboral6. Se manifiesta usualmente de manera lenta e insidiosa lo cual lleva a un significativo retraso desde el inicio de los síntomas hasta el momento del diagnóstico. El tiempo descrito clásicamente hasta el momento del diagnóstico es de diez años. En una cohorte descrita de la ciudad de Medellín el tiempo hasta el momento del diagnóstico osciló entre cinco y ocho años7. En otro informe que describió las características de 139 pacientes consecutivos evaluados en un servicio de reumatología de la ciudad de Bogotá el retraso hasta el momento del diagnóstico fue en promedio de 6,4 ± 7,8 años8. Para clasificar a un paciente con EA se utilizan los criterios modificados de Nueva York9, los cuales son altamente específicos pero carecen de la sensibilidad necesaria para hacer diagnósticos tempranos y llegar de manera oportuna a los pacientes en una época de grandes avances «imaginólogicos» y terapéuticos.
Progresión radiográfica: historia natural
Los pacientes que sufren de EA presentan un gran deterioro en su funcionalidad y calidad de vida determinado fundamentalmente por la progresión radiográfica evidenciada por la anquilosis axial progresiva en columna y articulaciones sacroiliacas. Carette y colaboradores informaron el seguimiento de 51 pacientes con EA con un tiempo promedio de enfermedad de 38 años. En ese reporte, el 41 % de los pacientes progresó hasta restricción espinal grave; de ellos, el 81 % la presentaban ya durante los primeros diez años de evolución de su enfermedad. Por otro lado, el 74 % de los que tuvieron restricción leve a los diez años no progresaron más después de esa primera década. Finalmente, no hubo nuevas caderas afectadas después de diez años de enfermedad10. Estos hallazgos sugieren que el curso de la enfermedad es variable y que la primera década de evolución de la enfermedad es el período de mayor impacto estructural.
En un informe más reciente se reportó también que la progresión radiográfica en EA es bastante variable y que muchos pacientes muestran altas tasas de progresión. Adicionalmente se subraya el hecho de que predecir la progresión radiográfica sigue siendo una tarea difícil, y que solo la presencia de sindesmofitos durante la evaluación inicial es predictiva de daño futuro adicional. Finalmente, los autores proponen diferenciar a los pacientes de una manera individual teniendo en cuenta su tasa de progresión como pacientes con rápida, moderada o lenta progresión radiográfica, determinado precisamente por el conteo de nuevos sindesmofitos11.
La EA ocasiona un grave deterioro en la calidad de vida y la funcionalidad del paciente no solo por la actividad inflamatoria sino también por el daño estructural radiológico12. La primera se expresa mediante lumbalgia crónica de carácter inflamatorio, rigidez matinal, fatiga, entesitis y dolor glúteo alternante, entre otras; la segunda genera restricción progresiva de la movilidad espinal en diferentes planos y de la expansión torácica. La inflamación parece ser más importante durante las etapas tempranas de la enfermedad y el daño estructural puede ser más importante durante las etapas tardías13. El daño estructural radiológico, determinado por erosiones, sindesmofitos y anquilosis progresiva, impacta sobre la funcionalidad del paciente a largo plazo y es independiente de la actividad de la enfermedad, por lo cual, el daño radiológico estructural es un importante blanco de las intervenciones terapéuticas14.
Los tratamientos tradicionales para la espondilitis anquilosante, como antiinflamatorios no esteroideos (AINE), fármacos modificadores del curso de la enfermedad (DMARD), y terapia física, tienen utilidad limitada en la mayoría de los pacientes15-18. Por el contrario, los fármacos anti-TNF (etanercept, infliximab, adalimumab,golimumab) han demostrado gran eficacia clínica en ensayos terapéuticos de buena calidad19-22.
La progresión radiográfica en las espondiloartritis no es igual que en la artritis reumatoide:
Sería fácil pensar que los anti-TNF modifiquen el daño estructural radiológico en EA tal como ha sido demostrado en AR. En primer lugar, los estudios de laboratorio e histopatológicos demuestran niveles incrementados de TNF en suero, sinovia, hueso subcondral y entesis de pacientes con EA, lo cual lo posiciona como un potencial blanco terapéutico23,24. En segundo lugar, los anti-TNF han cambiado radicalmente el manejo de los pacientes con EA al ofrecer un extraordinario beneficio sobre los síntomas del paciente y las escalas de funcionalidad y calidad de vida19-22.
Las experiencias positivas en el campo de la AR pueden generar la falsa percepción de que bloquear la cadena de inflamación lleva indefectiblemente a detener el daño radiológico eventual en la EA. No obstante, existen grandes diferencias entre estas dos entidades nosológicas y su curso radiológico en respuesta a las terapias disponibles. Primero, a diferencia de lo que ocurre en AR, no existe evidencia contundente que demuestre que la inflamación de la columna en EA precede al daño radiológico de una manera causal. Además, como se mencionó previamente, ha resultado difícil encontrar la manera de predecir daño estructural futuro en EA, excepto por la presencia de daño al inicio, lo cual, sin embargo, no es un verdadero factor de predicción14,25.
La progresión radiográfica en EA también difiere de la progresión en AR con respecto a la velocidad con la cual se instaura. En EA es un proceso lento que puede tardar varios años, mientras que en algunos pacientes con AR y un alto nivel de actividad inflamatoria pueden detectarse cambios radiológicos incluso tres meses después del inicio de la enfermedad. En la EA, usando los métodos actuales de progresión radiográfica, se requieren mínimo dos años para poder distinguir de manera confiable verdadera progresión de ruido de fondo o imprecisión de la medida14. Otra importante diferencia entre estos dos procesos es el tipo de daño radiológico observado. La AR es una enfermedad de resorción ósea progresiva y nula esclerosis o reparación; por el contrario, aunque en la EA pueden observarse erosiones en forma temprana, realmente predomina un estado de neoformación ósea con sindesmofitos y anquilosis progresiva dominando el daño crónico26,27.
Claro papel de los anti-TNF en la sintomatología y funcionalidad de los pacientes
De manera clara y consistente, los anti-TNF han demostrado que mejoran los síntomas y la funcionalidad de los pacientes con una notoria mejoría en la calidad de vida. Los estudios reportan mejoría de síntomas como dolor lumbar, dolor nocturno, fatiga, entesitis y artritis periférica; mejoría en desenlaces basados en escalas combinadas como ASAS 20/50/70; mejoría en marcadores de respuesta de fase aguda; mejoría en escalas de actividad, fatiga, funcionalidad y calidad de vida; y mejoría de parámetros de evaluación de la restricción de la movilidad19-22. A pesar de que los pacientes se encuentren ya con anquilosis espinal total, se ha demostrado mejoría en los signos y síntomas de enfermedad activa28. Los resultados favorables son persistentes y existe evidencia de la dramática mejoría clínica en estudios con más de ocho años de seguimiento y con buena tolerancia en general29.
Estudios imaginológicos
Además de la importante mejoría clínica de estos pacientes, existe evidencia fuerte de la mejoría radiológica de las lesiones inflamatorias agudas. Mediante técnicas de resonancia magnética es ahora posible evaluar la extensión y la morfología de las lesiones inflamatorias tempranas en los pacientes con espondiloartritis30. Diversos estudios con diferentes anti-TNF han demostrado que estos medicamentos mejoran las lesiones inflamatorias agudas observadas mediante resonancia magnética tanto en columna vertebral como en articulaciones sacroiliacas31,32. Tal mejoría ocurre también en forma rápida y sostenida en el tiempo.
Aunque la resonancia magnética ha permitido evaluar las lesiones inflamatorias espinales y sacroiliacas facilitando el diagnóstico temprano de los pacientes y ofreciendo la posibilidad de evaluar la regresión de las mismas lesiones agudas, la evaluación y el seguimiento de los cambios crónicos y estructurales se basa en las imágenes de la radiología simple. Se ha convenido que al evaluar la progresión radiológica en EA se debe determinar la presencia de erosiones, sindesmofitos, anquilosis y nuevas formaciones óseas. Se ha demostrado que los sindesmofitos son los mejores elementos para predecir progresión radiológica, y se considera que el periodo mínimo de seguimiento debe ser de dos años33. De los diversos métodos existentes para la gradación de la progresión radiológica, uno de los más aceptados y utilizados por su buena sensibilidad es el modified Stoke Ankylosing Spondylitis Spinal Score (mSASSS), el cual utiliza placas laterales de columna cervical y lumbar para cuantificar la presencia de erosiones, sindesmofitos o anquilosis como marcadores de daño estructural crónico34.
Evidencias actuales para la evaluación del impacto sobre la progresión radiográfica
La doctora Désirée van der Heijde y sus colaboradores revisaron los estudios recientes que han investigado la eficacia de los anti-TNF sobre la progresión del daño estructural en la EA35. Uno de ellos utilizó etanercept36, otro utilizó infliximab37 y un tercero, adalimumab38. Van der Heijde y colaboradores revisaron estudios con dos años de seguimiento que comparaban la progresión radiográfica entre los pacientes incluidos en esos estudios y aquellos incluidos en una cohorte internacional de seguimiento conocida como Outcome Assessments in Ankylosing Spondylitis International Study (OASIS). Esta cohorte inició en 1996 y se trata de un estudio observacional internacional llevado a cabo en Holanda, Bélgica y Francia, el cual ha reclutado pacientes consecutivos seguidos por más de diez años, estudiados con radiografías anuales y manejados con las guías usuales según la mejor evidencia disponible para la época, fundamentalmente con AINE, analgésicos y terapia física39.
En cada uno de estos estudios comparativos se utilizó un diseño similar. Se incluyeron pacientes de las pruebas originales de eficacia clínica de cada uno de los tres anti-TNF evaluados y se compararon con pacientes de esa cohorte histórica OASIS. En general, los pacientes eran comparables entre sí respecto a la positividad del antígeno HLA-B27, la respuesta de fase aguda, daño estructural radiográfico y uso de AINE. Aunque los índices de actividad y de funcionalidad eran más bajos en aquellos pacientes de la cohorte histórica, no había diferencias en las medidas de restricción de la movilidad, el uso de analgésicos o el grado de daño radiográfico estructural. Adicionalmente, en cada una de las tres comparaciones por separado se hizo un análisis de sensibilidad utilizando de la cohorte histórica OASIS solamente a aquellos pacientes que hubieran cumplido los criterios de entrada a cada uno de los ensayos clínicos terapéuticos respectivos con cada anti-TNF. Esto último con el fin de hacerlos más comparables y disminuir los sesgos inherentes al uso de controles históricos.
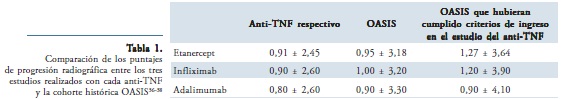
En el estudio con etanercept el puntaje de progresión radiográfica mSASSS fue de 0,91 ± 2,45, mientras que para los pacientes de la cohorte OASIS fue de 0,95 ± 3,18, y para aquellos pacientes de la cohorte que hubieran cumplido los criterios de ingreso al estudio original de etanercept, el puntaje de progresión radiográfica fue de 1,27 ± 3,64. En ningún caso hubo diferencias estadísticamente significativas entre estos grupos36. Los otros dos estudios que utilizan diseños similares para comparar la progresión entre los pacientes de la cohorte OASIS y pacientes tratados con infliximab o adalimumab muestran resultados muy parecidos a los observados con etanercept37,38. En la tabla 1 se comparan los puntajes de progresión radiográfica entre los diferentes estudios reportados.
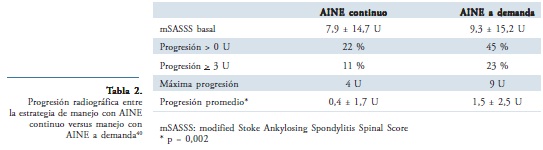
También se encuentra publicado un artículo que compara en este caso el uso de AINE a demanda frente al uso continuo. En ese estudio participaron pacientes con EA que hubieran hecho parte de un estudio original de seis semanas que comparó celecoxib, ketoprofeno y placebo. En dicho estudio Wanders et al40. asignaron de manera aleatoria a 215 pacientes con EA a recibir o tratamiento continuo con AINE o tratamiento a demanda con AINE durante un período de dos años. En general se utilizó celecoxib a una dosis entre 100 y 200 mg dos veces al día, o podía cambiarse a otro AINE, mientras se mantuviera la misma estrategia de tratamiento. Después de dos años el promedio en la escala de progresión radiológica evaluada mediante mSASSS fue de 0,4 ± 1,7 para el grupo de tratamiento continuo comparado con 1,5 ± 2,5 en el grupo de tratamiento a demanda, lo cual fue una diferencia con significancia estadística (p = 0,002). En la tabla 2 se muestran las principales diferencias observadas con estas dos estrategias respecto a la eficacia. Hubo tendencia a mayor frecuencia de eventos adversos en el grupo con tratamiento continuo pero sin una diferencia significativa. Dentro de estos sobresalieron hipertensión, dispepsia y dolor abdominal como los más relevantes. En resumen, en pacientes sintomáticos con EA una estrategia de tratamiento con uso continuo de AINE reduce la progresión radiográfica sin incrementar sustancialmente la toxicidad asociada40,41.
Limitaciones de los estudios
Frente a esta disociación entre el extraordinario control de síntomas clínicos y cambios inflamatorios tempranos observados mediante resonancia magnética y la inefectividad para detener la progresión radiográfica por parte de los anti-TNF, se plantean diferentes hipótesis. Si bien pueden surgir críticas frente al uso de controles históricos en los estudios que evaluaron la respuesta de los anti-TNF, en los tres experimentos reportados se hizo análisis de sensibilidad haciendo comparación no solo con toda la cohorte sino también con el subgrupo de pacientes que hubieran cumplido los criterios de ingreso a los respectivos ensayos clínicos para de esta manera hacerlos más homogéneos y comparables.
Un argumento adicional sería plantear que los pacientes observados tenían mucho daño previo y un tiempo considerable de evolución de la enfermedad, siendo estas dos variables situaciones que dificultan observar pequeños beneficios de las terapias a evaluar. De la mano de este argumento puede agregarse que los cambios a vigilar son de lenta progresión y que quizás solo dos años de seguimiento sean un tiempo insuficiente para observar diferencias significativas. Para apoyar este último punto aparece publicado un análisis parecido a los mencionados pero con un tiempo de seguimiento de cuatro años42. Allí los autores reportan que la terapia con infliximab parece desacelerar discretamente la tasa de progresión radiográfica al comparar con la cohorte histórica OASIS; no obstante, la principal utilidad del estudio es demostrar una vez más que el bloqueo de esta importante citoquina no inhibe por completo la progresión radiográfica de los cambios estructurales crónicos en los pacientes con EA.
Características particulares del proceso inflamatorio y reparativo en las espondiloartritis
Una explicación más racional y con creciente evidencia experimental, se basa en reconocer y entender las diferencias en el comportamiento biológico y su impacto estructural de la EA en comparación con otras artropatías inflamatorias. Se acepta que esta enfermedad está caracterizada por varias etapas consecutivas que pueden denominarse como de inflamación, fibrosis y osteogénesis. Durante la etapa de inflamación predominará un infiltrado inflamatorio mononuclear, macrófagos, osteoclastos y una gran angiogénesis. Los blancos terapéuticos durante esta fase serán principalmente citoquinas inflamatorias como TNF alfa e interleuquina-6, además de moléculas de coestimulación. Una segunda etapa estará caracterizada por la presencia de fibroblastos, tejido fibroso de reparación y angiogénesis adicional. El blanco terapéutico principal durante esta fase será el factor de crecimiento transformante beta. Una etapa posterior o de osteogénesis estará dominada por osteo-blastos activados y nueva formación de hueso, siendo las dianas principales las proteínas morfogenéticas del hueso y la vía Wnt43-45.
Dentro de las diversas vías moleculares estudiadas, se ha dado cada vez más importancia a la vía de la proteína Dickkopf-1. Las proteínas Dickkopf (DKK) son ricas en cisteína. De ellas, DKK-1 es un inhibidor natural de la vía Wnt. La vía Wnt es una cascada de señalización celular pleiotrópica involucrada en procesos básicos tales como comunicación intercelular, desarrollo embrionario y homeostasis tisular. En el hueso la vía Wnt tiene papeles esenciales en la regulación del recambio óseo, que se constituyen especialmente en mediadores de la ostoblastogénesis46-48.
El TNF alfa estimula la producción de DKK-1 el cual suprime la formación de hueso mediante la inhibición del desarrollo y la función del osteoblasto mediado a través de la vía Wnt. En condiciones normales existe un equilibrio entre los sistema osteoprotegerina/ligando del receptor activador del factor nuclear kB (RANKL) y DKK-1/Wnt. En estados inflamatorios con exceso de TNF alfa, esta citoquina favorecerá la aparición de erosiones óseas por la activación de los osteoclastos mediante mayor producción de RANK ligando y disminución de la osteoprotegerina, así como también mediante el aumento en la producción de DKK-1 que a su vez inhibe la vía Wnt y la consecuente formación de nuevo hueso. El uso de anti-TNF podría entonces disminuir la producción de DKK-1, liberando de esta manera a la vía Wnt de su inhibición natural y favoreciendo la osteo-blastogénesis, lo que sumado al bloqueo de la osteoclastogénesis induce la formación de hueso que se refleja en el crecimiento de osteofitos y en la formación de puentes óseos46-52. Este balance alterado entre los sistemas OPG/RANKL y DKK-1/Wnt observado durante estados inflamatorios puede verse magnificado en los pacientes con EA ya que en ellos existen niveles mucho más bajos de DKK-1 al comparar con controles sanos y con pacientes con artritis reumatoide46 (ver tabla 3).

Conclusiones
Los agentes biológicos anti-TNF se constituyen en un importantísimo avance en el manejo de los pacientes con EA, demostrando una notable mejoría en los síntomas de los pacientes, en su función y en su calidad de vida. Sumado a esta excelente respuesta clínica se ha verificado también mejoría de la inflamación, demostrada mediante pruebas de laboratorio y estudios de resonancia nuclear magnética. A pesar de estas claras evidencias, la conexión entre actividad inflamatoria y progresión estructural no está tan claramente establecida como en la artritis reumatoide, y la evidencia de los anti-TNF para prevenir el daño radiográfico crónico en EA es deficiente. Es posible que el poco tiempo de seguimiento de los estudios y las dificultades éticas para hallar un grupo control adecuado hagan difícil demostrar en la actualidad este beneficio adicional con el uso de estos medicamentos. Sin embargo, parecen existir razones biológicas que podrían explicar la disociación entre estas respuestas.
A diferencia de otras enfermedades reumáticas inflamatorias tales como artritis reumatoide y artritis psoriática, la progresión estructural en EA parece ser independiente del TNF. A pesar de que esta citoquina es responsable de los signos y síntomas inflamatorios, lo esperable es que los agentes anti-TNF no solo no inhiban la formación de nuevo hueso, sino que la estimulen, al inhibir la resorción ósea mediada por el TNF y estimular la osteoblastogénesis al bloquear el inhibidor DKK-1, ya de por sí disminuido en los pacientes con EA.
Será necesario hallar nuevas estrategias de combinación de las alternativas terapéuticas disponibles (AINE continuo/anti-TNF) que demuestren controlar la progresión radiográfica de los cambios estructurales crónicos y no solo mejoría de los signos y síntomas inflamatorios tempranos. Es necesario encontrar otros fármacos con diferentes blancos moleculares para cumplir con ese objetivo final con menos toxicidad que las terapias actualmente disponibles.
Finalmente, la proteína DKK-1 ha surgido recientemente como un regulador clave de la biología del hueso. Ella ha sido relacionada con alteraciones en la masa ósea y con la remodelación articular en enfermedades reumáticas tales como artritis reumatoide y EA. Se constituye, entonces, en una conexión clave entre inflamación, osteoporosis y remodelación articular, y por lo tanto en un promisorio blanco terapéutico para diversas condiciones reumatológicas.
Referencias
1. Zochling J, Brandt J, Braun J. The current concept of spondyloarthritis with special emphasis on undifferentiated spondyloarthritis. Rheumatology 2005;44:1483-1491. [ Links ]
2. Sheehan NJ. HLA-B27: what's new? Rheumatology 2010;49:621-631. [ Links ]
3. Breban M. Genetics of spondyloarthritis. Best Pract Res Clin Rheumatol 2006;20:593-599. [ Links ]
4. Bautista-Molano WA, Londoño JD, Romero C, Ávila M, Valle RR. Espondiloartritis y su asociación con el Complejo Mayor de Histocompatibilidad. Rev Colomb Reumatol 2011;18:34-41. [ Links ]
5. Akkoc N. Are Spondyloarthropathies as Common as Rheumatoid Arthritis Worldwide? A Review. Curr Rheum Rep 2008;10:371-378. [ Links ]
6. Braun J, Sieper J. Ankylosing spondylitis. Lancet 2007;369:1379-1390. [ Links ]
7. Márquez J, Pinto L F, Candia DL, Restrepo M, Uribe E, Rincón O, et al. Espondiloartritis en el Hospital Pablo Tobón Uribe. Descripción de una cohorte. Rev Colomb Reumatol 2010;17:80-85. [ Links ]
8. Londoño JD, González LA, Ramírez LA, Santos P, Ávila M, Santos AM, et al. Caracterización de las espondilo-artropatías y determinación de factores de mal pronóstico en una población de pacientes colombianos. Rev Colomb Reumatol 2005;12:195-207. [ Links ]
9. van der Linden S, Valkenburg HA, Cats A. Evaluation of diagnostic criteria for ankylosing spondylitis. A proposal for modification of the New York criteria. Arthritis Rheum 1984;27:361-368. [ Links ]
10. Carette S, Graham D, Little H, Rubenstein J, Rosen P. The natural disease course of ankylosing spondylitis. Arthritis Rheum 1983;26:186-190. [ Links ]
11. Baraliakos X, Listing J, von der Recke A, Braun J. The Natural Course of Radiographic Progression in Ankylosing Spondylitis - Evidence for Major Individual Variations in a Large Proportion of Patients. J Rheumatol 2009;36:997-1002. [ Links ]
12. Landewé R, Wanders AJ, Mielants H, Dougados M, van der Heijde D. Function in patients with ankylosing spondylitis is the resultant of patient reported disease activity and radiographic damage of the spine [abstract]. Ann Rheum Dis 2004;63(Suppl 1):88-89. [ Links ]
13. Machado P, Landewé R, Braun J, Hermann KG, Baker D, van der Heijde D. Both structural damage and inflammation of the spine contribute to impairment of spinal mobility in patients with ankylosing spondylitis. Ann Rheum Dis 2010;69:1465-1470. [ Links ]
14. van der Heijde D, Landewé R, van der Linden S. How Should Treatment Effect on Spinal Radiographic Progression in Patients With Ankylosing Spondylitis Be Measured? Arthritis Rheum 2005;52:1979-1985. [ Links ]
15. Escalas C, Trijau S, Dougados M. Evaluation of the treatment effect of NSAIDs/TNF blockers according to different domains in ankylosing spondylitis: results of a meta-analysis. Rheumatology 2010;49:1317-1325. [ Links ]
16. Dagfinrud H, Kvien TK, Hagen KB. The Cochrane review of physiotherapy interventions for ankylosing spondylitis. J Rheumatol 2005;32:1899-1906. [ Links ]
17. Chen J, Liu C. Sulfasalazine for ankylosing spondylitis. Cochrane Database Syst Rev 2005;18(2):CD004800. [ Links ]
18. Chen J, Liu C, Lin J. Methotrexate for ankylosing spondylitis. Cochrane Database Syst Rev 2006;18(4): CD004524. [ Links ]
19. Calin A, Dijkmans BAC, Emery P, Hakala M, Kalden J, Leirisalo-Repo M, et al. Outcomes of a multicentre randomised clinical trial of etanercept to treat ankylosing spondylitis. Ann Rheum Dis 2004;63:1594-1600. [ Links ]
20. van der Heijde D, Dijkmans B, Geusens P, Sieper J, DeWoody K, Williamson P, et al. Efficacy and Safety of Infliximab in Patients With Ankylosing Spondylitis Results of a Randomized, Placebo-Controlled Trial (ASSERT). Arthritis Rheum 2005;52:582-591. [ Links ]
21. van der Heijde D, Schiff MH, Sieper J, Kivitz AJ, Wong RL, Kupper H, et al. Adalimumab effectiveness for the treatment of ankylosing spondylitis is maintained for up to 2 years: long-term results from the ATLAS trial. Ann Rheum Dis 2009;68:922-929. [ Links ]
22. Inman RD, Davis JC, van der Heijde D, Diekman L, Sieper J, Kim SI, et al. Efficacy and Safety of Golimumab in Patients With Ankylosing Spondylitis Results of a Randomized, Double-Blind, Placebo-Controlled, Phase III Trial. Arthritis Rheum 2008;58:3402-3412. [ Links ]
23. Braun J, Bollow M, Neure L, et al. Use of immuno-histologic and in situ hybridization techniques in the examination of sacroiliac joint biopsy specimens from patients with ankylosing spondylitis. Arthritis Rheum 1995;38:499-505. [ Links ]
24. Davis JC. Understanding the Role of Tumor Necrosis Factor Inhibition in Ankylosing Spondylitis. Semin Arthritis Rheum 2004;34:668-677. [ Links ]
25. Landewé R, van der Heijde D. A systematic comparison of rheumatoid arthritis and ankylosing spondylitis: structural outcomes. Clin Exp Rheumatol 2009;27: S102-S107. [ Links ]
26. Baraliakos X, Listing J, Rudwaleit M, Haibel H, Brandt J, Sieper J, et al. Progression of radiographic damage in patients with ankylosing spondylitis: defining the central role of syndesmophytes. Ann Rheum Dis 2007; 66:910-915. [ Links ]
27. Huang W, Schwarz EM. Mechanisms of Bone Resorption and New Bone Formation in Spondyloarthropathies. Curr Rheum Rep 2002;4:513-517. [ Links ]
28. van der Heijde D, Pangan AL, Schiff MH, Braun J, Borofsky M, Torre J, et al. Adalimumab effectively reduces the signs and symptoms of active ankylosing spondylitis in patients with total spinal ankylosis. Ann Rheum Dis 2008;67:1218-1221. [ Links ]
29. Baraliakos X, Listing J, Fritz C, Haibel H, Alten R, Burmester GR, et al. Persistent clinical efficacy and safety of infliximab in ankylosing spondylitis after 8 years-early clinical response predicts long-term outcome. Rheumatology 2011; doi: 10.1093/rheumatology/ker194. [ Links ]
30. Zochling J, Baraliakos X, Hermann KG, Braun J. Magnetic resonance imaging in ankylosing spondylitis. Curr Opin Rheumatol 2007;19:346-352. [ Links ]
31. Rudwaleit M, Baraliakos X, Listing J, Brandt J, Sieper J, Braun J. Magnetic resonance imaging of the spine and the sacroiliac joints in ankylosing spondylitis and undifferentiated spondyloarthritis during treatment with etanercept. Ann Rheum Dis 2005;64:1305-1310. [ Links ]
32. Baraliakos X, Davis J, Tsuji W, Braun J. Magnetic resonance imaging examinations of the spine in patients with ankylosing spondylitis before and after therapy with the tumor necrosis factor alpha receptor fusion protein etanercept. Arthritis Rheum 2005;52:1216-1223. [ Links ]
33. Baraliakos X, Listing J, Rudwaleit M, Haibel H, Brandt J, Sieper J, et al. Progression of radiographic damage in patients with ankylosing spondylitis: defining the central role of syndesmophytes. Ann Rheum Dis 2007;66: 910-915. [ Links ]
34. Creemers MCW, Franssen MJAM, van 't Hof MA, Gribnau FWJ, van de Putte LBA, van Riel PLCM. Assessment of outcome in ankylosing spondylitis: an extended radiographic scoring system. Ann Rheum Dis 2005;64:127-129. [ Links ]
35. Holliman K. No Clear Connection Between Inflammation & Disease Progression in AS. TNF blockers decrease symptoms but seem to have little impact on structural damage. The Rheumatologist 2010; octubre. [ Links ]
36. van der Heijde D, Landewé R, Einstein S, Ory P, Vosse D, Ni L, et al. Radiographic progression of ankylosing spondylitis after up to two years of treatment with etanercept. Arthritis Rheum 2008;58:1324-1331. [ Links ]
37. van der Heijde D, Landewé R, Baraliakos X, Houben H, van Tubergen A, Williamson P, et al. Radiographic findings following two years of infliximab therapy in patients with ankylosing spondylitis. Arthritis Rheum 2008;58:3063-3070. [ Links ]
38. van der Heijde D, Salonen D, Weissman BN, Landewé R, Maksymowych W P, Kupper H, et al. Assessment of radiographic progression in the spines of patients with ankylosing spondylitis treated with adalimumab for up to 2 years. Arthritis Res Ther 2009;11:R127. [ Links ]
39. Spoorenberg A, van Tubergen A, Landewé R, Dougados M, van der Linden S, Mielants H, et al. Measuring disease activity in ankylosing spondylitis: patient and physician have different perspectives. Rheumatology 2005; 44(6):789-795. [ Links ]
40. Wanders A, Heijde D, Landewé R, Béhier JM, Calin A, Olivieri I, et al. Nonsteroidal antiinflammatory drugs reduce radiographic progression in patients with ankylosing spondylitis: a randomized clinical trial. Arthritis Rheum 2005;52:1756-1765. [ Links ]
41. Poddubnyy D, Song IH, Sieper J. A systematic comparison of rheumatoid arthritis and ankylosing spondylitis: non-steroidal anti-inflammatory drugs. Clin Exp Rheumatol 2009;27:S148-S151. [ Links ]
42. Baraliakos X, Listing J, Brandt J, Haibel H, Rudwaleit M, Sieper J, et al. Radiographic progression in patients with ankylosing spondylitis after 4 yrs of treatment with the anti-TNF-alpha antibody infliximab. Rheumatology 2007;46:1450-1453. [ Links ]
43. Andreu JL, Otón T, Sanz J. Terapia anti-TNF en espondilitis anquilosante: control sintomático y modificación del daño estructural. Reumatol Clin 2011;7:51-55. [ Links ]
44. Baker-LePain JC, Nakamura MC, Lane NE. Effects of inflammation on bone: an update. Curr Opin Rheumatol 2011;23:389-395. [ Links ]
45. Poddubnyy D, Appel H, Sieper J. Investigation of involved tissue in axial spondyloarthritis-what have we learnt from immunohistochemical studies? Best Pract Res Clin Rheumatol 2010;24:715-719. [ Links ]
46. Diarra D, Stolina M, Polzer K, Zwerina J, Ominsky MS, Dwyer D, et al. Dickkopf-1 is a master regulator of joint remodeling. Nat Med 2007;13:156-163. [ Links ]
47. Daoussis D, Andonopoulos A P. The Emerging Role of Dickkopf-1 in Bone Biology: Is It the Main Switch Controlling Bone and Joint Remodeling? Semin Arthritis Rheum 2011 Mar 22. [Epub ahead of print] [ Links ]
48. Uderhardt S, Diarra D, Katzenbeisser J, David J P, Zwerina J, Richards W, et al. Blockade of Dickkopf (DKK)-1 induces fusion of sacroiliac joints. Ann Rheum Dis 2010;69:592-597. [ Links ]
49. Schett G, Rudwaleit M. Can we stop progression of ankylosing spondylitis? Best Pract Res Clin Rheumatol 2010;24:363-371. [ Links ]
50. Lories RJ, Luyten F P, de Vlam K. Progress in spondylarthritis. Mechanisms of new bone formation in spondyloarthritis. Arthritis Res Ther 2009;11:221. [ Links ]
51. Zhang X, Aubin JE, Inman RD. Molecular and cellular biology of new bone formation: insights into the ankylosis of ankylosing spondylitis. Curr Opin Rheumatol 2003; 15:387-393. [ Links ]
52. Schett G. Bone formation versus bone resorption in ankylosing spondylitis. Adv Exp Med Biol 2009; 649:114-121. [ Links ]














