Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista Colombiana de Reumatología
Print version ISSN 0121-8123
Rev.Colomb.Reumatol. vol.19 no.3 Bogotá July/Sept. 2012
ARTICULO DE REVISIÓN
1Departamento de Medicina Interna. Facultad de Medicina. Universidad Nacional de Colombia. Bogotá, Colombia.
2Clínica de Artritis Temprana S.A.S; Cali, Colombia.
Correspondencia: Antonio Iglesias Gamarra: iglesias.antonio1@gmail.com
Los autores declaran no presentar ningún conflicto de interés al momento de la redacción del manuscrito.
Recibido: 23 de julio de 2012 - Aceptado: 1 de septiembre de 2012
Resumen
Las vasculitis primarias constituyen un grupo de enfermedades reumáticas con expresión clínica variable y pronóstico reservado cuando no se tratan adecuadamente. En esta revisión haremos un análisis pormenorizado del tratamiento en las diferentes formas de vasculitis primaria, iniciando con el uso de los corticoides, desde casi su descubrimiento en 1949, pasando por otros inmunosupresores como: ciclofosfamida, metotrexate, azatioprina, mofetil, micofenolato, al igual que medicamentos biológicos como rituximab y anti-TNF. Una mención especial se hace sobre las guías de tratamientos para las vasculitis, tanto de grandes como de pequeños vasos, implementadas desde 2009 por el Grupo Europeo de Estudio de las Vasculitis.
Palabras clave: vasculitis primarias, granulomatosis con poliangeitis, arteritis de Takayasu, poliarteritis nodosa, poliangeítis microscópica, arteritis de células gigantes.
Summary
Primary vasculitis is one of the rheumatic diseases with variable clinical expression and poor prognosis when not treated properly. In this review we analyze detailed treatment of this disease in different forms of primary vasculitis, starting with the use of corticosteroids from almost its discovery in 1949, to other immunosuppressant's such as cyclophosphamide, methotrexate, azathioprine, mycophenolate mofetil, as well as biological drugs such as rituximab and anti-TNF. Special mention is made on the guidelines of treatment for vasculitis of both large and small vessel, implemented since 2009 by the European Group Study of Vasculitis.
Key words: Primary vasculitis, Wegener granulomatosis, Takayasu arteritis, poliarteritis nodosa, microscopic poliangeitis, giant cell arteritis.
Introducción
Antes de 1950, la morbimortalidad asociada a las vasculitis primarias era muy alta, un ejemplo de ello era que la mediana de la sobrevida era de apenas cinco meses en la granulomatosis con poliangeitis (Granulomatosis de Wegener), y la mortalidad era similar en cualquier caso de vasculitis primaria y secundaria.
El uso de los glucocorticoides se inició, el 21 de septiembre de 1948, para el tratamiento de una paciente con artritis reumatoide que se encontraba hospitalizada en la Clínica Mayo, por un grupo de investigadores extraordinarios conformado por Hench, Kendal, Slocumb y Polley, quienes habían descubierto la molécula y se iniciaba su utilización en la clínica1,2. La cortisona fue introducida por los reumatólogos para el manejo de las vasculitis primarias, consideradas enfermedades "huérfanas" porque no tenían tratamiento efectivo; de igual manera se conocieron los eventos adversos presentados por los corticoides, descritos por Polley y Slocumb3. Para que la historia del tratamiento de las vasculitis se pueda comprender coherentemente, debe leerse en el orden cronológico de la descripción de los medicamentos y en el inicio de su prescripción en la enfermedad. Empezaremos esta historia con los glucocorticoides, porque fueron los primeros que se formularon para la terapia de las vasculitis.
Uso de la cortisona en vasculitis
La cortisona que se sintetizó en la Clínica Mayo, se utilizó por primera vez para tratar la artritis reumatoidea en 1948-1949, y la fiebre reumática en 1949. Se postuló que podría utilizarse para tratar la panarteritis nodosa (PAN), que junto con el lupus eritematoso sistémico fueron denominadas enfermedades del colágeno por Klemperer, Pollack y Baehr4 en 1942.
Archie H. Baggenstoss, Richard M. Shick y Howard F Polley5,6, la utilizaron por primera vez en un médico de 45 años que consultó a la Clínica Mayo en Rochester, el 18 de julio de 1949, con un cuadro grave caracterizado por compromiso constitucional y con daño de varios órganos como piel, corazón, riñón, tracto gastrointestinal y pulmón; se le administró la cortisona el 28 de julio de 1949, diez días después de su admisión, con un diagnóstico de PAN. Este paciente fue tratado durante 75 días y recibió 3.62 g de cortisona; a las 48 horas el paciente presentó mejoría, pero finalmente falleció. En la autopsia se observó una mejoría de las lesiones vasculíticas en las arterias de mediano calibre. El segundo caso, fue una paciente de 48 años de edad, quien consultó dos meses después, estuvo bajo observación por 146 días y recibió 13.72 g de cortisona. Ambos pacientes murieron por fallas cardiaca y renal. El tratamiento de estos dos pacientes con cortisona permitió analizar la mayoría de los aspectos inflamatorios, así como las lesiones histológicas de la enfermedad.
En 1951, Drury, Hickey y Malone7 del Mater Misericordiae Hospital en Dublín, utilizaron la cortisona para tratar un paciente de 47 años. Lo importante de este caso es que se usó el término mononeuritis múltiple por primera vez, denominación que utilizaron Lovshin y Kernohan en 1949, quienes la habían observado en ocho casos7.
The Medical Research Council by the Collagen Diseases and Hypersensitive Panel
En las décadas de los años 1940 y 1950 las vasculitis primarias eran entidades desconocidas, proponiéndose el mecanismo de hipersensibilidad para explicar algunos elementos patogénicos liderados por Rich8,9.
Rackemann y Greene en 193910 y Rich y Gregory9 en 1943, explicaban la etiología de la PAN como un proceso mediado por hipersensibilidad; otros como Harkavy11 la explicaban como una alergia, y Friedberg y Cross12 como de origen estreptocócico. Para esta época sólo se utilizaban la sulfonamida, la penicilina y la difenhidramina para el tratamiento de esta patología. Dada la carencia de medicamentos y la poca casuística, el profesor Geofrey. A Rose13 organiza un pequeño comité para manejar a estos pacientes con cortisona y ACTH, que era con lo único que se contaba como tratamiento para un gran número de enfermedades "huérfanas" de la época, aduciendo que los glucocorticoides eran beneficiosos en aquellas patologías relacionadas con "hipersensibilidad" y "alergia". El profesor Geofrey A. Rose, quien trabajaba en el St. Mary Hospital y en el Paddington General Hospital, de Londres, realizó el primer trabajo serio sobre una de las vasculitis primarias, incluyendo los pacientes de nueve centros de enseñanza (hospitales universitarios), desde 1946 hasta 1953, con diagnóstico de PAN, obteniendo biopsias en diferentes tejidos de 111 pacientes y con la participación de médicos ingleses y norteamericanos, siendo éste uno de los primeros estudios multicéntricos realizados en el mundo13.
Rose organiza un panel que logra asociar a los mejores clínicos de la época, los profesores: G. W Pickering, EGL. Bywaters, J F. Danielli, PG. Gell, J.H. Kellgren, DA. Long, A. Neuberger, H. Nicholson, FTG. Prunty, AHT. Robb-Smith, G. Payling Wrigh, JR. Duthrie y E.T. Conybear. El panel se organiza en 1950, siendo ese momento contemporáneo a la síntesis de la cortisona y de la ACTH. Su primer objetivo era recopilar los pacientes con diagnóstico de panarteritis nodosa, 111 en total, a quienes se les practicó biopsia y se compararon con un grupo control retrospectivo; por primera vez se realiza un estudio de casos y controles y la cortisona se utiliza en el grupo con tratamiento, concluyendo que la cortisona mejora los síntomas y signos de la enfermedad, pero, además, plantea que los grupos retrospectivos no son adecuados e informa sobre los eventos adversos secundarios de los esteroides. El estudio con cortisona se logró realizar en 17 pacientes13.
Algunos artículos mencionan el uso de la cortisona en el trabajo clásico de Jacob Churg y Lotte Strauss sobre la angeítis alérgica y granulomatosa14,15; sin embargo, al revisar el texto original no se menciona, pero es factible que ésta ya se haya utilizado dado que Louis Sofer, de este mismo hospital, (Monte Sinaí de Nueva York) ya la prescribía para el tratamiento del lupus eritematoso sistémico. A pesar de que todos los informes sobre la evolución de los pacientes con este medicamento reportan beneficio, cinco años después, en el trabajo de Kulka16, se describen claramente las complicaciones de la vasculitis reumatoide, como el compromiso segmentario de los nervios periféricos, el infarto del miocardio, la perforación y la hemorragia gastrointestinales, afirmando, además, en forma temeraria, que después del tratamiento con corticoides la arteritis se disemina más y es una causa de muerte, aseveración que logró retrasar el uso de la cortisona en el tratamiento de estas patologías. Dos años después de esta afirmación, Ferguson y Slocumb17 de la Clínica Mayo, en 1961, analizaron 64 pacientes con vasculitis reumatoide y concluyeron que lo que se requiere es un incremento adecuado de la dosis de esteroides, con una reducción gradual y luego un mantenimiento con la dosis mínima requerida. Este artículo ofrece una enseñanza extraordinaria porque informa, por primera vez, del uso de los glucocorticoides en la vasculitis reumatoide, aplicándose esto muchos años después para el manejo racional de estos medicamentos en las vasculitis primarias y secundarias, y en un gran número de enfermedades diferentes a éstas.
A pesar del uso de los glucocorticoides, en las décadas de los años 60 y 70 el mecanismo de acción de estos no se conocía, pero su utilización en las vasculitis primarias y secundarias se empezó a difundir con mayor seguridad. Trabajos como los de Frohnert en 1967, que ratificaba la mejoría en la sobrevida de 10% a 48% a cinco años en poliarteritis nodosa18, sirvieron para que otros autores como Barbara Ansell, una de las pioneras de la reumatología pediátrica, empezara a utilizar los glucocorticoides en pacientes pediátricos complicados con artritis, compromiso gastro intestinal y renal en 1970 (niños con el síndrome de Henoch-Schönlein), así como en otras vasculitis específicas como se mencionara por otros autores.
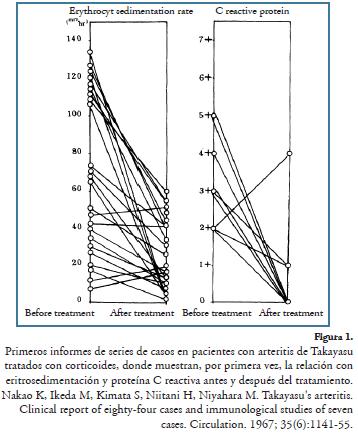
En la arteritis de Takayasu, entidad informada inicialmente por Sabory19 en 1856 y Kussmaul en 1872, como la arteritis que compromete la aorta de etiología desconocida, relacionada posteriormente con el informe de Takayasu, en 190820, de una mujer con manifestaciones oculares, se inicia el uso de corticoides de forma similar a la gran mayoría de vasculitis, considerándose como el tratamiento de elección, con el inicio de altas dosis, a razón de 1 mg/kg/día, por tres meses, alcanzando remisión en aproximadamente 60% de los casos, con posterior disminución gradual crónica según la evolución21; aunque con presentación de varios episodios de recaídas asociados a la disminución de la dosis del corticoide22. Su uso se encuentra de forma inicial en la publicación de Nakao en 1967 (Figura 1), en el cual se analiza un grupo de pacientes tratando de reconocer algún factor relacionado con la etiología de la enfermedad, así como estudiando el curso de la enfermedad en 29 pacientes tratados con esteroides, evidenciando un beneficio en más del 50%, aún con remisión total de la fase aguda, dado que el tratamiento no continuó de forma crónica respecto a variables clínicas, angiográficas y de laboratorio. Así mismo, informó ausencia de mejoría de las arteritis en relación con el tratamiento antituberculoso, infección que se relacionaba con la enfermedad en esa época23. Más tarde, Fraga A., en su trabajo demuestra el beneficio del manejo prolongado con esteroides de esta patología en 12 pacientes, dando base al inicio de estudios al respecto24.
La granulomatosis con poliangeitis (granulomatosis de Wegener -GW-), condición descrita y reconocida por la formación de granulomas necrotizantes y glomerulonefritis, fue tratada desde su inicio con esteroides, con reportes iniciales en los años 50, principalmente en cuadros clínicos de granulomas necrotizantes de la línea media, por Moore en 195125 y Hagens en 195326. Más tarde, tras una mejor caracterización de la enfermedad, aparecen los primeros trabajos como el de Beidleman B. en 196327, en los que el uso de esteroides mejora parámetros inflamatorios de la enfermedad con mayores efectos si ésta es severa, sin demostrar mejoría en la sobrevida a pesar del tratamiento, hecho que degeneró a los corticoides en los años 60 y 70, cuando se administraban de manera constante como lo menciona Fauci AS. en su artículo de revisión en 197828, en el cual dice que existían unas consideraciones especiales para la adición de corticoide a la terapia citotóxica con ciclofosfamida que se venía desarrollando. Las condiciones mencionadas eran enfermedad renal o pulmonar fulminante, serositis, enfermedad cutánea severa y cualquier compromiso ocular; según publicaciones de él mismo, al analizar 18 casos en 197329 y 21 casos, en asociación con Wolf, en 197430.
La enfermedad de Churg Strauss (CS), descrita en 1951 tras el análisis de 13 casos con hipereosinoflia y vasculitis sistémica, en pacientes con asma y rinitis, siempre ligó los esteroides a su tratamiento, pero con informes mas tardíos que para otras patologías, siendo el más preciso el realizado por Chumbley LC. en 197731, el cual, al recoger una muestra de 30 pacientes, la mayoría hombres, demuestra la utilidad de este medicamento en la mejoría de la supervivencia. Este artículo fue referenciado en repetidas ocasiones en relación con el inicio de esta terapia en este tipo de vasculitis, lo que no permitió que estudios aleatorizados corroboraran este beneficio, el cual es reafirmado más tarde en trabajos como el de Guillevin en 1988 que estudió 165 pacientes con PAN y CS32.
A pesar de toda la evidencia a favor del corticoide en varios tipos de vasculitis, su uso no ha sido igual en la vasculitis crioglobulinémica, en la cual el corticoide no ha mostrado un beneficio real para estos pacientes, con una respuesta similar y sólo con algo de mejoría en los signos inflamatorios como artritis, pero sin modificación del curso de la enfermedad o cuando existe compromiso neurológico o renal, comparado con el uso solo de interferón gamma. Las observaciones iniciales se dieron en 1980 por Gorevic PD., quien presentó la falta de utilidad para la modifcación del curso de la enfermedad33, dato corroborado, en 1992, por Angelo Vacca, quien encontró beneficio en control de artralgias, púrpura y disminución de criocrito, tanto con defazacort como con prednisolona34. De igual forma se conoce que la tasa de recaídas no sufre modifcación, aunque el tiempo en el cual se produce la primera recaída es más prolongado, ocurriendo tres meses después del uso de la terapia combinada, de corticoides con interferón, como único beneficio35.
Una de las enfermedades que nos enseña cómo fue evolucionando el tratamiento de las vasculitis primarias es la arteritis de células gigantes, ya que ésta es la vasculitis más frecuente y una de las pocas patologías sobre las que existe información completa acerca de la evolución de su tratamiento, como lo describe Gene G. Hunder, profesor emérito de la Mayo Clinic College of Medicine en su artículo "The early history of giant cell arteritis and Polymialgia Rheumatica: frst descriptions to 1970"36.
La historia de la arteritis de células gigantes inicia con BT. Horton, TB. Magath y GE. Brown, en 1932, quienes describen en la Clínica Mayo la arteritis de los vasos temporales, que Hutchinson37 informó por primera vez en Londres en 1889. En el artículo de Horton y Magath38,39 se describe, en forma anecdótica, la utilización del yoduro de potasio y pequeñas dosis de arsfenamina. Meade y cols.40 en 1950, utilizaron la histamina intravenosa en un paciente con arteritis temporal (AT); Rice-Oxley y Cooke41 utilizaron la clortetraciclina; Roberts y Askey42 mejoraban la cefalea al utilizar hidrocloruro de procaína en 1948. Un año después, en 1949, el grupo investigador de la síntesis de la cortisona, la utilizó en pacientes con artritis reumatoide y se analizó su uso en otras patologías infamatorias1,2.
Basado en esto, Shick, Baggentoss, Fuller y Polley5,6 iniciaron la administración de cortisona y de ACTH en la panarteritis nodosa, en tanto que Tate y Wheeler col.43 y Kersley en 195144 la usaron en la arteritis de células gigantes. Seis años después de estas últimas publicaciones, el grupo que dirigía Schick, conformado por Birkhead y Wagener45, estudiaron 55 pacientes con diagnóstico de arteritis temporal, se les practicó biopsia a todos, y se administró un esquema terapéutico de acetato de cortisona 300 mg intramuscular seguido de 150 a 200 mg vía oral hasta que la sedimentación globular estuviese normal o casi normal. Después de la sexta semana se disminuyó gradualmente, pero algunos pacientes con la reducción de los esteroides presentaron recaída, por lo que la terapia se prolongó hasta por 9 a 12 meses. A tres de estos pacientes se les administró prednisolona por vía oral a una dosis de 75 mg/día, luego se redujo a 50 mg durante seis semanas y se inició su reducción cada tres a cuatro días hasta la suspensión. A este grupo de 55 pacientes en estudio, que podemos decir "controlado", lo comparó con 53 sujetos de la Clínica Mayo de la época preesteroidea y con 250 pacientes de la literatura que consultaron por disminución de la agudeza visual y ceguera45. Observaron que en los pacientes que utilizaron la cortisona se prevenía en forma dramática la pérdida de la visión, sugiriendo la importancia de ésta para el tratamiento de la arteritis temporal45.
En cuanto a la polimialgia reumática (PR), que se asocia a pacientes con AT, Meulengracht y Schwart46 utilizaron terapia física y radioterapia en 1952; Barber en 195747, Gordon en 196048 y Boyle y Beatty en 196149 utilizaron los salicilatos. Forestier y Certonciny50 en 1953, y los investigadores mencionados previamente utilizaron además, codeína, fenilbutazona y oxifenbutazona que eran los antiinfamatorios que se utilizaban en esa época. G. Kersley44 fue el primero en utilizar los glucocorticoides y la ACTH para tratar a tres de 13 pacientes, con una buena respuesta. Barber47 notó la efectividad de la cortisona al igual que Gordon48, quien trató 13 de 21 pacientes con prednisona, utilizando una dosis de 30 a 40 mg/día, por 10 a 21 días, que redujo cada dos a cinco semanas. Con estudios posteriores de Boyle y Beatty, en 1961, se sugiere que se debería iniciar el tratamiento con una dosis más pequeña de 15 mg/día. Weissenbach y cols.51 informaron que la aplicación del medicamento vía intramuscular es efectiva en el tratamiento de la polimialgia reumática, aunque estudios posteriores de Hamrin y cols. en 196452, Alestig y Barr en 196353 y Paulley y Hughes en 196054, aconsejaban que cuando los pacientes con polimialgia reumática cursen con arteritis de células gigantes, la dosis de esteroides debería ser mayor. En 1971, Hamilton, Shelley y Tumulty55, en su artículo clásico de la revista Medicine, describen y confirman las observaciones anteriores sobre la respuesta dramática a los corticoides de los pacientes con arteritis temporal y polimialgia reumática. Todas las investigaciones anteriores relacionadas con AT y PR nos enseñaron cómo debería ser el uso de los glucocorticoides para tratar las vasculitis primarias.
Reconocida la importancia del uso de los corticoides en esta patología, ensayos ulteriores como los de Aiello y Trautmann en 1993, encontraron el beneficio para prevenir la ceguera, reduciéndola a menos del 1%56 y la importancia del uso de altas dosis de esteroide en los casos severos57, con requerimientos posteriores de corticoide a largo plazo, dado la alta frecuencia de recaídas tras su suspensión (entre 40 y 50%) como lo demostró Salvarani y Macchioni en su seguimiento de pacientes a cinco años en 198758, con una alta frecuencia también de eventos adversos, sin reconocer, hasta el momento, criterios para definir la duración de la terapia59.
Cuatro artículos, en nuestro criterio, fueron de una gran trascendencia para el uso racional de los gluco-corticoides en los pacientes con vasculitis primaria y secundaria y, por ende, su uso en el tratamiento de las enfermedades reumatológicas y de otras especialidades. En su orden de publicación fueron los informes de Ferguson y Slocumb en 196117, Torn en 196660, Axelrod en 197661 y el de Fauci, Dale y Ballow en 197662. Al analizar estas publicaciones, los glucocorticoides deben utilizarse cuando exista una indicación clínica para su uso: 1) en todos aquellos casos que la vida del paciente esté en peligro, 2) compromiso de órganos vitales como: cerebro, pulmón, riñones, corazón, tracto gastrointestinal, lesiones extensas de piel, 3) cuando se documente mononeuritis múltiple y polineuropatía, 4) síndrome de pulmón-riñón, 5) glomerulonefritis proliferativas y segmentarias, 6) cuando existe evidencia de laboratorio y clínica de compromiso sistémico, como la presencia de síntomas constitucionales dados por pérdida de peso, fiebre, mialgias, artralgias, elevación de los reactantes de fase aguda, trombocitosis, 7) ante la sospecha de una vasculitis severa cuando el tratamiento debe iniciarse en forma temprana, con el apoyo del médico reumatólogo o el experto en vasculitis, y la ayuda de los aspectos clínicos y de laboratorio. Con estos puntos considerados, la inducción del tratamiento se debe realizar con una dosis de 1 mg/kg de peso, siempre utilizarlo en dosis divididas de acuerdo con la gravedad de la enfermedad y del órgano blanco comprometido13,60,62.
En uno de los primeros libros sobre vasculitis primaria, titulado "In the vasculitis major problems in internal medicine", publicado en 1982, T Cupps y Anthony Fauci63, afrmaron que los glucocorticoides se han utilizado en el tratamiento de las vasculitis y constituyen la piedra angular de la terapéutica en estas patologías.
Pulsos de metilprednisolona
En las décadas de 1950 y 1960 el uso de los glucocorticoides para tratar a los pacientes con PAN y GW era lo único establecido para suprimir la actividad infamatoria, pero el mantenimiento de dosis altas generaba una serie de eventos adversos muy conocidos para esa época. El uso de los glucocorticoides para tratar estas vasculitis era empírico, ya que no se conocía la etiología y la patogénesis de las vasculitis, pero en 1958 los investigadores Frank Dixon, Vásquez, Weigle y Cochrane64 estudiaron en forma experimental en modelos animales la enfermedad del suero, en la que se demuestra la presencia de arteritis y de complejos inmunitarios en las paredes de los vasos, igual conclusión fue planteada más tarde por Sokolof, en 195365, para artritis reumatoide y lupus. Gocke y cols.66 demostraron el antígeno australiano y los complejos antígeno-anticuerpo en la sangre y los asociaron a la patogénesis de la arteritis sin demostrarse éstos en la lesión arterítica, aunque Howell y Epstein67 sí lograron demostrar la presencia de complejos inmunitarios en la GW. Además de los estudios sobre patogénesis de las vasculitis, Yu y cols.68, en 1974, estudiaron los efectos de los glucocorticoides en los linfocitos T y B. Butler y Rosen, en 197369, observaron cómo una dosis alta por vía oral de metilprednisolona en cursos breves produce una caída de los niveles de IgG, un incremento de su catabolismo y síntesis; describieron también que los granulomas mejoraban rápidamente con la metilprednisolona a dosis altas por vía endovenosa más que por la vía oral. Estos estudios de la utilización de dosis altas de metilprednisolona en pacientes para el rechazo del trasplante renal y la nefropatía lúpica, permitieron la posibilidad de su uso en vasculitis primarias severas.
Con estos antecedentes, para explicar la patogénesis de las vasculitis y los eventos adversos de los glucocorticoides, Bell y cols.70 en 1971 y Feduska y cols.71 en 1972, demostraron el beneficio de las dosis altas de glucocorticoides a 30 mg/kg, denominadas pulsos, en el rechazo de los pacientes con trasplante renal. Cathcart y cols.72 en 1976, utilizaron los pulsos de metilprednisolona para tratar la glomerulonefritis proliferativa difusa con rápido deterioro de la función renal en pacientes con lupus y notaron la mejoría no sólo clínica sino de los tejidos renales. Con los estudios mencionados anteriormente, G.H Neild y H.A. Lee73 del Wessex Regional Renal Unit y del St Mary Portsmouth en el Reino Unido, utilizaron, en 1977, los pulsos de metilprednisolona para tratar dos pacientes con PAN y semilunas en tejido renal con dosis de 30 mg/kg por cuatro, con intervalos de 48 horas, describiendo mejoría del compromiso renal, de los síntomas y menos eventos adversos. Con base en esto, la demostración de la mejoría de los pacientes con enfermedad severa y control rápido del proceso infamatorio, además del inicio del uso de pulsos de corticoide desde los trabajos descritos en PAN en 1977, se extendió su uso a otras patologías que de forma usual son severas con compromiso de órganos que amenazan la vida del paciente, como la granulomatosis con poliangeitis y en general a todas las vasculitis con anticuerpos ANCA positivos así como en arteritis de Takayasu.
Lo anterior, sumado a la confusión de criterios diagnósticos para diferenciar la variedad de formas de vasculitis primarias de pequeño vaso y poliarteritis nodosa, no ha permitido contar con ensayos clínicos que comparen dosis o diferentes esquemas de esteroides, tanto así que a pesar de ser los pulsos, la terapia a largo plazo con corticoides, parte primordial en el tratamiento, las guías la encuentran con un nivel de evidencia 3 y grado de recomendación C en los tiempos actuales74.
En la GW se extendió su uso luego del inicio del tratamiento de PAN con pulsos de esteroide, principalmente en el compromiso renal, el cual es causa frecuente de mortalidad en estos pacientes. Esto se basó en trabajos como los de Bolton y Couser en 197975, en los cuales no hacen distinción de la causa de la glomerulonefritis rápidamente progresiva con informes posteriores como los de Harrison HL y col. en 1980, que analizaron la utilidad de pulsos de esteroides junto con citotóxicos como terapia inicial76. Ya en 1986, con la publicación de Leavitt RY y col.77 que demostró la respuesta a los pulsos en estos pacientes, que también presentan formas pulmonares severas, permitió la extrapolación de la terapia de altas dosis de esteroides para el manejo de otro tipo de vasculitis con compromiso pulmonar frecuente como la granulomatosis con poliangeitis eosinofílica (Churg Strauss). En 1987 aparece la primera publicación, MacFadyen R78, respecto de su utilidad, con el informe de un caso en un paciente en quien se utilizó prednisolona 100 mg oral previamente y que, por no mejoría, se le administró 1 gramo de metilprednisolona por cuatro días.
Como se ha visto en esta revisión, los glucocorticoides, a pesar de no ser probados en grandes ensayos clínicos, son, sin duda, el medicamento de elección para casi todas las variedades de vasculitis y el uso de los pulsos de corticoide en las formas severas. Caso similar se evidencia en la arteritis de células gigantes, donde se requieren altas dosis iniciales de 0.5 g para los cuadros de isquemia severa o alteraciones visuales79,80. No obstante, estudios observacionales realizados más tarde, como los de Chevalet P en el 200081, Liu en 200182, Foroozam en 200383 y Hayreh en el 200384, no encontraron beneficio; dicha evidencia fue refutada después con el único ensayo clínico al respecto realizado por Mazlumzadeh en 200685, en el cual 27 pacientes fueron aleatorizados a recibir metilprednisolona 15 mg/kg/dosis, por tres días o placebo, encontrando beneficio en el control de la enfermedad, reducción de dosis de corticoide, a pesar que se excluyeron pacientes con complicaciones oculares severas agudas, quienes al parecer obtienen mayor beneficio.
Ciclofosfamida
Los medicamentos inmunosupresores se conocen también como medicamentos citotóxicos y antimetabolitos; fueron introducidos como agentes quimioterapéuticos para el tratamiento del cáncer como un derivado de la mostaza nitrogenada. Es un agente alquilante que actúa en todas las fases del ciclo celular y su acción es mayor en los linfocitos T que en los B86.
La Escuela Española de Medicina Interna, dirigida por uno de los grandes investigadores como Jiménez-Díaz86, publicó, por primera vez, en 1951, en la revista Jama, la utilización de la mostaza nitrogenada para el tratamiento de la artritis reumatoide, junto con la observación de Chasis, Goldring y Baldwin87 en 1951, al utilizar metil-bis (B-cloroetil), amino hidrocloruro de mecloetamina o mostaza nitrogenada o Mustargen®, producto elaborado por Merck Sharp & Dohme, para el tratamiento de la glomerulonefritis y del síndrome nefrótico. Posteriormente, se realizaron otros estudios para tratar la nefropatía lúpica por Dustan, Corcoran y Haserick88, en 1951, y en 1954 Edmund Dubois89 utilizó la mostaza nitrogenada para la primera serie de 25 pacientes con nefritis lúpica. La ciclofosfamida, como nuevo compuesto sintetizado, fue utilizada, por primera vez en reumatología, por Moncrief y cols.90, en 1969, al tratar 46 niños con síndrome nefrótico. Después el tratamiento de la nefritis lúpica fue uno de los objetivos del Instituto Nacional de Salud de Estados Unidos, NIH (por sus siglas en inglés), desde 1969, siendo en 1971 cuando aparece el primer artículo de Steinberg al respecto91,92,93,94 por lo que fue a partir de esta época que empezó a utilizarse la ciclofosfamida en nefritis lúpica en Chicago, Nueva York e Inglaterra, y se iniciaron los primeros protocolos en reumatología.
La PAN (panarteritis nodosa), primera patología relacionada con el grupo de vasculitis, como se ha mencionado, tenía alta mortalidad, llegando a casi el 100% en casos severos sin tratamiento y con leve mejoría tras al inicio del uso de corticoides18, lo cual hacía prioritaria la inclusión adjunta de otra terapéutica y es así como descripciones de casos entre 1971 y 197695,96,97, sumados a la experiencia adquirida en G W, de la cual se hablará más adelante, permitieron el inicio de agentes alquilantes y ciclofosfamida, siendo este último el único citotóxico aprobado y que ha demostrado su beneficio, hasta el día de hoy para esta enfermedad, aunque sin prolongación de la sobrevida en estos pacientes98,99.
Basados en trabajos de Walton100, quien analizó una cohorte histórica de pacientes con granulomatosis con poliangeitis , en 1958 observó que el pronóstico en estos pacientes con GW para esa época era muy pobre con el uso de los corticoides solamente, y sobre todo cuando los pacientes tenían compromiso renal, siendo la enfermedad fatal en los siguientes cinco meses con sólo el 4% de sobrevida a los dos años. Otros informes, como los de Sandler y McGregor101 en 1963, indicaban que los glucocorticoides, a pesar de ser formalmente los primeros y por largo tiempo los únicos medicamentos en la década de los 50 para tratar las vasculitis como la PAN y la GW, no eran útiles; Beidelman en 196327, Fred y cols. en 1964102 y Grahne y Zecher en 1966103, sostuvieron que eran parcialmente útiles.
En 1954 se produjeron los primeros informes del uso de agentes citotóxicos con mostaza nitrogenada en el tratamiento de la GW por Fahey J104, Greenspan en 1965105 con ciclofosfamida en granuloma letal de la línea media y Mcilvanie SK en 1966106 con el uso de clorambucil, siendo en 1967 Hollander y Manning107 quienes trataran 26 casos, bien documentados de GW en la literatura americana, con glucocorticoides como agente terapéutico esencial pero en asociación de alquilantes. Ellos encontraron una sobrevida de 12.5 meses comparados con los pacientes no tratados informados por Walton100 en 1958, cuya sobrevida era, en promedio, de cinco meses. Los glucocorticoides mejoraban la reacción infamatoria temprana y los síntomas, pero no tenían una respuesta adecuada en riñón y en pulmón, y en la presentación de eventos adversos indeseables frecuentes, como lo describía Raitt108 en 1971, hecho que concluyó en que la terapia basada con corticoide y no en agentes alquilantes debía reevaluarse.
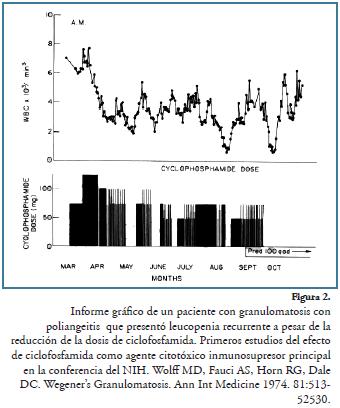
Más tarde, como se menciona en el apartado de esteroides, los autores Fauci y Wolf29,30, en 1973 y 1974, informaron, en un número mayor de pacientes, la ventaja de usar agentes alquilantes como ciclofosfamida en el manejo de pacientes con GW, usando unas dosis de 1 a 2 mg/kg y según respuesta y monitoreo de células blancas, aumento de dosis de 25 mg/día o ciclos cortos de esteroides, con un tiempo de tratamiento no definido hasta de 60 meses en algunos pacientes (Figura 2). Anthony Fauci entra, entonces, al NIH donde se comienza a emplear este esquema terapéutico descrito, referenciado desde entonces como protocolo de Fauci o el NIH-standard en múltiples publicaciones.
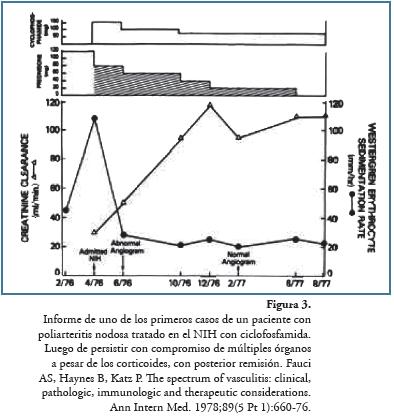
En 1978 Fauci y cols. informaron la excelente respuesta de dos pacientes con PAN con aneurismas abdominales, quienes fueron tratados con ciclofosfamida oral a razón de 1-2 mg/kg/día más prednisona interdiaria, con remisión a las pocas semanas y desaparición de los aneurismas un año después109 (Figura 3). En un artículo en 1983, Fauci110 informó que con base en un estudio de 85 pacientes confrmaba la utilidad del régimen terapéutico, renovó la importancia del uso de los corticoides de forma crónica y continua, acompañados de ciclofosfamida en todos los pacientes, evidenciando la aplicabilidad de este medicamento por encima de otras alternativas como azatioprina y clorambucilo, que no habían demostrado ser mejores, fgurando este protocolo en referencias hasta la actualidad111.
En la década de los 90 ocurren fenómenos importantes: la clasificación del consenso de Chapell Hill en 1994112 y la agrupación de varias formas de vasculitis en ANCA positivas. Como resultado de esto se empezaron a generar guías y preguntas nuevas.
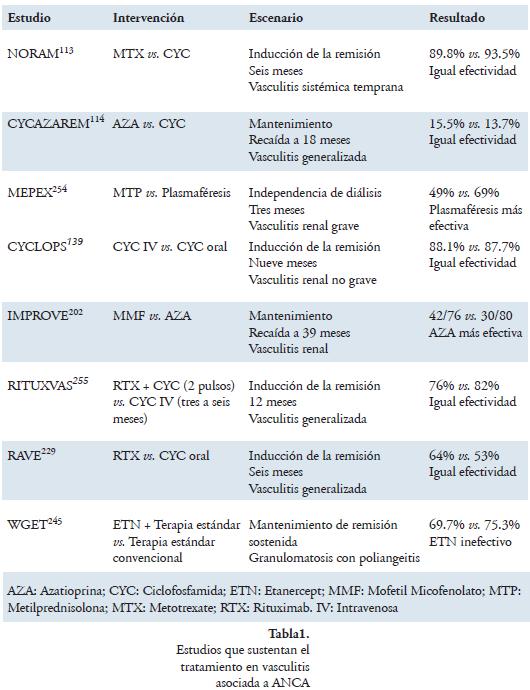
La toxicidad de la ciclofosfamida y, por tanto, frecuente aparición de eventos adversos permitió, en forma más exhaustiva, tratar de buscar su reemplazo. Surgieron varios famosos estudios al respecto; el estudio NORAM113 en 2005, comparó metotrexate con ciclofosfamida como inductor de remisión siendo el primero útil en casos no severos pero no en compromiso renal o pulmonar; el estudio CYCAZAREM114, en 2003, comparó la ciclofosfamida con azatioprina para mantenimiento, los encontró iguales en cuanto a la ocurrencia de recaídas siendo la azatioprina menos tóxica, y otros estudios menores que compararon micofenolato mofetil con ciclofosfamida, mostrándose mejor la primera en alcanzar la remisión pero con la necesidad de estudios adicionales115,116. Con el inicio de la era de medicamentos biológicos el estudio RAVE-INT evidenció la no inferioridad del rituximab en comparación con ciclofosfamida para la inducción y una posible ventaja en los pacientes refractarios.
En la vasculitis eosinofílica de CS los informes del uso de agentes alquilantes son más rezagados si tenemos en cuenta que informes de casos como el de Fauci A. en 1979117 en vasculitis severa y Gintaras E. en 1980118 sólo mencionan esta terapia como alternativa en GW, encontrando sólo hasta 1986, por Leavitt RY77, las primeras referencias en esta patología específcamente. En 1991, conformado el French Vasculitis Study Group, se realizan los primeros ensayos clínicos que comparaban la terapia combinada de esteroide más ciclofosfamida con plasmaféresis, con resultados muy importantes que ratifcaban lo provechosa, en términos de respuesta y disminución de recaídas, la dosis de 2 mg/kg/día, dejando sin campo de acción la plasmaféresis que no demostró ninguna utilidad27,98-108,110-114,116-119. De los mismos autores M. Gayraud, L Guillevin P. , del grupo francés, surgieron en los años 94120 y 96121 otros dos estudios que, por primera vez, comparaban en forma directa, dosis y vías de administración de ciclofosfamida en CS y PAN de buen pronóstico, con pulsos de 0,6 g/m2 de superficie corporal mensual, por 12 meses, sin hallar diferencias con la dosis oral usual y la ineficacia de la plasmaféresis aun en pacientes con factores de mal pronóstico.
Contrario a lo anterior, otras formas de vasculitis con compromiso de grandes vasos han tenido escasa evidencia del uso de la ciclofosfamida, encontrando datos sólo en arteritis de Takayasu. Debido a que la frecuencia de respuesta a los esteroides así como para otras vasculitis era parcial, con informes de 20% por Lupi21 y 60% por Nakao23, se publicó en 1985 un único ensayo en la literatura del uso de citotóxicos, en siete pacientes sin adecuada respuesta de un grupo de 16, con dosis de 2 mg/kg/día basados en los esquemas propuestos para GW y PAN, con adecuada respuesta122.
Pulsos de ciclofosfamida
Uno de los planteamientos para utilizar los intravenosos (IV) de ciclofosfamida, sustituyendo la vía oral en pacientes con enfermedad sistémica severa y progresiva como vasculitis, la nefropatía proliferativa difusa y otras enfermedades del tejido conjuntivo, era que la respuesta por vía oral se presentó al décimo día, lo que para una enfermedad activa severa era catastrófico. Este hecho llevó a que el NIH planteara la idea de utilizar los pulsos de ciclofosfamida para el tratamiento de la nefritis proliferativa difusa inicialmente.
Observaciones en las clínicas de lupus y de vasculitis del hospital St Tomas en Londres, dirigido por Graham Huges, determinaron que la administración por pulsos IV de ciclofosfamida tenían los mismos beneficios, menos eventos adversos y se podían administrar en forma ambulatoria. Este grupo empezó a utilizar 500 mg por pulsos intravenosos cada tres semanas. Con trabajos ulteriores como el de Houssiau y cols.123 en 1991, con dosis de 500 mg, en periodos cortos, en pacientes con nefritis lúpica, se originó el concepto del EuroLupus. Un año después el mismo grupo comienza a utilizar los pulsos, no sólo en la nefropatía lúpica sino en las enfermedades graves del tejido conjuntivo y en 16 casos de vasculitis sistémica como GW y PAN, con posibles informes previos que hacen referencia a pulsos pero que no usan dosis altas (100 a 200 mg) del medicamento, como lo conocemos en la actualidad y como se usó en la nefritis lúpica.
Siendo la vasculitis un grupo de patologías con compromiso ocasionalmente fulminante, tardío a la implementación de terapia con ciclofosfamida, se inició su uso en pulsos a dosis moderadas, como Fauci A. describe en su revisión de 197828, dividiendo los pacientes en presentaciones clínicas severas que requieren dosis de 4 mg/kg/día, por tres a cuatro días, encontrando que la implementación de estas dosis de tratamiento se vieron íntimamente ligadas a la necesidad de mejorar el curso clínico de los pacientes con compromiso renal severo y, específcamente, con glomerulonefritis rápidamente progresiva124 u ocasionalmente compromiso pulmonar, igualmente importante.
Luego, en 1979, se publica el uso de ciclofosfamida en vasculitis severa, indistintamente del diagnóstico específco125, donde aclaran la inclusión de PAN y CS, base para futuras publicaciones de estudios no aleatorizados con régimen terapéutico en varias dosis altas, con pulsos de 4 a 5 mg/kg/dosis, como las de Fauci y Haynes en el análisis de 85 casos en 1983110, de Leavitt RY. en 198677 en vasculitis pulmonar, Chung Chow en 1989 específcamente en un caso de CS con dosis de 750 mg/m2/dosis126, Falk en 1990127 con 70 pacientes con GW y PAN a dosis de 0,5 gr/m2 superficie corporal (sc), Reinhold-Keller en 1994 con 43 diagnosticados con GW y dosis de 0,66 gr/m2sc128, Nachman en 1996129 con 124 casos incluyendo 78 poliangeítis microscópicas, Martín-Suárez130 y Boki131 en 1997 con 156 casos incluyendo 30 pacientes con PAN y 10 con CS y dosis de 0,5 g al mes, y por último Adu132, Guillevin133 en 1997 y Haubitz en 1998134.
La poliangeítis microscópica (PAM) así como las dos anteriores, hace parte de las llamadas vasculitis con anticuerpos anticitoplasma de neutróflos (ANCA) frecuentemente positivos. Inicialmente fue descrita como la forma microscópica de la poliarteritis nodosa en 1923 por Wohlwill, caracterizada por el compromiso renal con histología que mostraba glomerulonefritis necrotizante135. Dado que en esta entidad se describían como síndrome de sobre posición de poliangeítis y que no se incluyó en el estudio de criterios diagnósticos del American College of Rheumatology, ACR, en 1990, la historia del tratamiento de la PAM se limita hasta su descripción separada de PAN en el consenso de Chapel Hill en 1994112, luego del reconocimiento previo de la presencia de anticuerpos ANCA asociados136. Para esos momentos se agruparon las vasculitis ANCA positivas, de tal forma que se presenta un esquema terapéutico común en tres fases, siendo éstas: la inducción, mantenimiento y seguimiento a largo plazo. Conociendo que los bolos de ciclofosfamida habían sido ya usados en GW, CS y en PAN con compromiso renal microscópico que posiblemente correspondía a PAM, esto impulsó la continuación de los mismos esquemas de tratamiento, sin poner en duda su beneficio137,138.
En estos primeros protocolos en los cuales se trataron de unifcar las terapias, la ciclofosfamida era parte primordial del tratamiento en las dos primeras fases, y los pulsos como parte esencial en pacientes con compromiso sistémico o renal severos. En la fase de inducción, sin embargo, el uso de pulsos endovenosos de ciclofosfamida en comparación con terapia oral no había mostrado diferencia en ausencia de ensayos clínicos hasta el momento, como lo escribe Falk RJ. en 1990127, en una serie de 70 casos que incluían GW y PAN, la buena respuesta a esta terapia se logró resolver cuando se empezaron a hacer los estudios controlados que se llevaron a cabo en el 2009. El estudio CYCLOPS por el grupo European Vasculitis Study Group, uno de los ensayos clínicos más grandes que incluía pacientes con GW, PAM y vasculitis limitada al riñón, reafrmó la utilidad para remisión en cualquiera de los dos regímenes, sea oral o en pulsos endovenosos de ciclofosfamida, pero con menor toxicidad en pacientes que usaban los pulsos139,140.
Metotrexate
Esta molécula se empezó a utilizar en reumatología para tratar la artritis reumatoide y la psoriasis en 1951 por Gubner y cols.125 Seis años después, en 1957, Allison y Bettley141 utilizaron el metotrexate para tratar una úlcera crónica y luego, en 1986, Luis Espinoza y cols.142 lo utilizó, a una dosis de 20 mg/semana, para tratar a ocho pacientes con úlceras crónicas asociadas a vasculitis reumatoide, durante 12 semanas, con mejoría de las lesiones. Los primeros que utilizaron el metotrexate en el tratamiento de vasculitis primaria fueron Capizzi y Bertimo de la universidad de Yale143 en 1971, en asociación a los glucocorticoides en dos pacientes con granulomatosis con poliangeitis , uno de éstos, además, con azatioprina.
En México, Antonio Fraga, Mintz y Orozco144 en 1974, utilizaron el metotrexate por vía intravenosa, durante 18 meses, para tratar dos pacientes con poliarteritis PAN, con mejoría de su cuadro clínico. Observaron que después de los 14 meses de tratamiento no se encontraban aneurismas pero sí infarto cortical renal y cambios vasculares hipertensivos. Seis años después, Hyman Tannenbaum145 combina la terapia de glucocorticoides con metotrexate 25 mg IV para tratar un paciente de 38 años con panarteritis PAN, con una dosis total acumulada de 465 mg del medicamento, con mejoría de su cuadro clínico. Escasa literatura se encuentra posterior a esta descripción99,146, limitándose a formas cutáneas sin compromiso sistémico147,148, lo que refeja la utilidad del metotrexate en estas patologías, sin ser tenido en cuenta como recomendación en las guías actuales74.
A partir de la década de 1980 y al inicio de la década de 1990 se incrementó el número de informes de pacientes tratados con metotrexate por vía oral, pero en casos no severos; con el tiempo se conoció mejor su mecanismo de acción, al disminuir el número y función de los linfocitos B, alterando la quimiotaxis y la adhesión de los neutróflos a las células endoteliales. En 1992, Hofman y cols.149, y en 1995 Sneller del grupo de Anthony Fauci150, en pacientes con angeítis granulomatosa, utilizaron en forma prospectiva metotrexate a una dosis de 0.3 mg/kg de peso, inicialmente 15 mg/semana que se podía incrementar hasta 20 y 25 mg/semana, en combinación con glucocorticoides. Se observó una remisión en el 71%, aunque un 40% de los sujetos presentó recaídas posiblemente debido a que los corticoides se habían descontinuado, y la aparición en el 5% de los pacientes de neumonitis asociada a metotrexate. Lo importante es que con estos trabajos se logró demostrar que el metotrexate puede ser una terapia alterna para tratar a los pacientes con GW como inducción.
En las publicaciones posteriores de Groot en 1998151 y Stone en 1999152 se mencionaba que si ésta podría llegar a ser la terapia de elección en algunos pacientes por encima de los otros medicamentos, especialmente de la ciclofosfamida. La respuesta a esta pregunta fue resuelta seis años más tarde con el estudio NORAM113, como se mencionó previamente, en el cual el metotrexate mostró su utilidad en relación con la mejor terapia hasta el momento, la ciclofosfamida, en casos no severos o sistémicos incluyendo pacientes con GW y escasos con PAM, agrupados como vasculitis ANCA positivas. Teniendo esto en cuenta, la literatura es escasa en PAM, relegada a la agrupación con otras patologías, con algunos casos en los estudios tanto en terapia de inducción como de mantenimiento ya descritos.
En otro tipo de vasculitis, en el síndrome de CS ocurre lo mismo, encontrándose una sola referencia respecto al tratamiento de inducción con metotrexate, por Metzler en 2004, con 11 pacientes sin enfermedad severa o compromiso de órgano vital153, en éste se concluye que la terapia de inducción con metotrexate es efectiva, con remisión del 72%. Para el mantenimiento tampoco se cuenta con estudios o referencias diferentes a la previa donde el uso de este medicamento parece ser limitado.
Se iniciaron nuevos trabajos en el NIH, con motivo de evitar los efectos tóxicos de la ciclofosfamida por vía oral como mantenimiento, después de una inducción con ciclofosfamida y glucocorticoides, pretendiendo reemplazar este medicamento. En el trabajo de Sneller y cols. en 1995150, los pacientes recibieron un régimen de tratamiento con corticoides pero asociado a una dosis oral de metotrexate (20-25 mg/semanal en cambio de ciclofosfamida), que se continuó por 1-2 años después de la remisión. De los 42 pacientes, 33 (79%) entraron en remisión y fue inefectivo en tres pacientes. Diecinueve pacientes recidivaron a los 29 meses después de suspender el metotrexate y cuando se les había reducido la dosis a 15 mg/semana. Los pacientes con enfermedad pulmonar severa o que tuvieran una creatinina mayor de 2.5 mg/dl se excluyeron del protocolo.
Los estudios de Hofman y cols.149, en 1992, Sneller y cols., en 1995150 y Langford y cols., en 1997154, demostraron que el metotrexate es una terapia alternativa en pacientes con granulomatosis de GW para el mantenimiento en vasculitis primarias, y con esto se podrían evitar los eventos adversos agresivos derivados de la ciclofosfamida. Subsecuentemente, de Groot y cols.155, siguieron 65 pacientes con GW generalizada, quienes habían recibido ciclofosfamida por pulsos o por vía oral como inducción asociada a glucocorticoides; 22 de estos se encontraban en remisión parcial o completa y recibieron metotrexate IV con y sin prednisona. La remisión completa o parcial se mantuvo en el 86% de los 22 pacientes que recibieron metotrexate solamente y en el 91% de los pacientes que recibieron metotrexate más prednisona, confirmando la utilidad en el mantenimiento y reducción de las recaídas.
Posteriormente, aparecen las publicaciones de tres estudios, de Langford y cols.156-158 del NIH, realizados en los años 1999, 2000 y 2003, quienes utilizaron metotrexate para mantener la remisión y encontraron que 22 de los 42 pacientes presentaron recaídas a los 15 meses en promedio. Reinhold-Keller y cols.159, con los mismos criterios de uso del metotrexate de los otros protocolos, observaron recaídas en 26 de 71 pacientes, es decir, 36.6% a los 19.4 meses. La dosis aproximada que recibían era 18 mg/semana. Las recaídas se presentaron especialmente a nivel del riñón en 16 de 26 individuos y los eventos adversos fueron la leucopenia y la neumonitis en el 5%, eventos menores a los ocasionados en comparación con la ciclofosfamida oral.
Es común que las vasculitis requieran largos periodos de terapia con esteroide con eventos adversos frecuentes, como sucede con la arteritis de células gigantes; esto sumado a la alta frecuencia de recaídas y casos resistentes ha impulsado que metotrexate así como otros fármacos se desarrollen como adyuvantes. Los primeros informes son de Krall en 1989160 quien trató tres pacientes sin respuesta a esteroides con mejoría luego de metotrexate, con dosis que oscilaron entre de 7,5 a 12 mg semanales. Hernández-García en 1994161 con 11 pacientes, encontraron disminución en los requerimientos de esteroide y también lo encontró Van Der Veen en 1996162. En el siguiente siglo aparece el primer ensayo clínico controlado163 con 21 pacientes, que concluye que no existe beneficio en el ahorro de corticoide. Desde ese entonces, en 2001 y 2002, aparecen dos ensayos clínicos más grandes, con resultados contradictorios. Jover JA en el 2001164 encuentra beneficio en disminuir recaídas y ahorrar esteroides, resultados totalmente opuestos al estudio más grande, hasta la fecha, con 98 pacientes en el año siguiente165. Con motivo de resolver esta dificultad se realiza un metaanálisis en 2006166 de los estudios descritos que determina que sí existe beneficio con el uso del metotrexate en reducir las recaídas y disminuir la dosis de esteroide acumulada, razón por la que tiempo más tarde las guías del EULAR167 recomiendan su uso en 2009. En la otra forma frecuente de vasculitis de grandes vasos, la arteritis de Takayasu, se encuentra el uso de metotrexate en informes de casos en el mismo periodo, siendo el inicial en 1989 con Liang GC.168 y descripciones sucesivas de Mevorach en 1992 con un caso169 y Hofman en 1994170, únicas referencias en las guías actuales donde se recomienda esta terapia para esta variedad de vasculitis167.
Azatioprina
Este medicamento inmunosupresor, al igual que la ciclofosfamida, se empezó a utilizar en las enfermedades reumáticas. Es un antagonista de las purinas y es uno de los primeros medicamentos inmunosupresores que se empezó a utilizar en las vasculitis primarias. Fred y cols., en 1964102, utilizaron esteroides y azatioprina para tratar un paciente con G W. Posteriormente se publicaron algunos casos aislados como los de Bouroncle y cols., en 1967171, Kaplan y cols.172, Norton y cols., en 1968173, Elsner y cols.174, Choy y cols.175, Choy, Gould et al, en 1969, Peermohamed y cols. en 1969176, quienes trataron casos de GW en la mayoría de las veces utilizando la asociación de azatioprina con corticoides, con mejoría del cuadro clínico. Años más tarde, en 1973, en el artículo de Fauci y Wolf29 se usó azatioprina para tratar algunos pacientes con GW a quienes se les había administrado ciclofosfamida y tenían una leucopenia severa. De esta manera se empezó a usar azatioprina como inductora de remisión. Cooper y cols., en 1978177 utilizaron azatioprina para tratar un paciente con síndrome de CS, así como John Lanham y cols.178, que tratan a cuatro pacientes con esta patología.
Debido a las dudas que generaron los trabajos de Fauci y Wolf29,110 sobre la posibilidad de que azatioprina indujera remisión, Parry y cols., en 1996179 y Jayne, Rasmussen Andrassy y cols., en 1997137 con la publicación en Mayo Clinic Proceedings por el grupo EUVAS, analizan los diferentes regímenes terapéuticos en la época encontrando la azatioprina como agente de mantenimiento importante con un papel ausente como inductor. Los mismos autores, tratando de verifcar la utilidad de la azatioprina como mantenimiento con menor grado de toxicidad que la ciclofosfamida, publican, en 2003, un estudio aleatorizado con 155 pacientes con vasculitis asociada a ANCA114, que incluyó pacientes con GW y PAM en una proporción importante (39%), comparando el uso de azatioprina contra dosis diarias de ciclofosfamida en el mantenimiento de la remisión. Los pacientes fueron inducidos con ciclofosfamida oral y prednisolona, lo que indujo una remisión que se logró en el 93% de los sujetos. Después de lograr la remisión, se establecieron dos brazos: un grupo de pacientes recibió azatioprina (2 mg/kg/día) y el otro brazo continuó recibiendo ciclofosfamida oral con 10 mg de prednisolona al día. A los 12 meses ambos grupos fueron tratados con azatioprina (1.5 mg/kg/ día) y prednisona (7.5 mg/día). A los 18 meses no se encontró una diferencia signifcativa, con respecto a recaídas entre los dos grupos: azatioprina (15.5%) y ciclofosfamida oral (13.7%).
Este estudio demostró la posibilidad de mantener la remisión en pacientes con vasculitis asociada a ANCA prescindiendo de la ciclofosfamida por vía oral. El estudio, cuya hipótesis era que azatioprina era equivalente a ciclofosfamida en mantener la remisión en pacientes con GW y poliangeítis microscópica (PAM), se conoce como CYCAZAREM (Cyclophosphamide versus azathioprine for the remission phase of vasculitis), el cual refutó el concepto de que el uso prolongado de ciclofosfamida es mejor porque controla la enfermedad. Se demostró que 12 meses de ciclofosfamida no fue más efectivo que tres meses de ciclofosfamida como inductor, seguidos por azatioprina para mantener la remisión. Este estudio demuestra que se puede reducir el tiempo de exposición a la ciclofosfamida y, por tanto, reevalúa el concepto de duración de la ciclofosfamida por vía oral.
Más tarde, en 2004. Slot y cols.180, encuentran que en 128 pacientes con vasculitis ANCA positivas, que incluían en esta ocasión un número no conocido de personas con CS, la eficacia de azatioprina para prevenir los eventos de recaída depende, de forma importante, del estado de positividad o negatividad de los ANCA al momento del cambio de ciclofosfamida a azatioprina, terminada la fase de inducción. Demostrada la utilidad de azatioprina en el mantenimiento, en 2008 se comparó, en 123 pacientes con GW y PAM, con metotrexate en cuanto a perfil de seguridad y eficacia en el estudio WEGENT181, con ocurrencia de menos eventos adversos en el grupo de azatioprina, sin diferencia en el tiempo a la recaída, posicionándola como una de las mejores opciones de tratamiento.
En cuanto a la arteritis de células gigantes, la evidencia se remonta a 1986 con M de Silva182 que hace referencia a casos anecdóticos previos de tratamientos con azatioprina no informados en la literatura; este estudio aleatorizado con 31 pacientes encuentra que el desenlace primario de utilidad para reducir la dosis de esteroide es estadísticamente signifcativo a las 52 semanas de seguimiento, pero a pesar de esto, debido a que no hay mayor evidencia adicional en la actualidad, no hay una recomendación para su uso en esta enfermedad167.
Diferentes metas han sido planteadas para pacientes con arteritis de Takayasu, siendo de gran interés el beneficio de estos medicamentos en regresión o no progresión de lesiones estenóticas vasculares como primera complicación de la enfermedad. Los primeros informes del uso de azatioprina son de Kerr183 y Cybulska184, en 1994, posteriormente, en el 2003, Valsakumar185 publica un estudio con 15 pacientes a dosis de 2 mg/kg/día, en quienes se realizó angiografía previa y posterior a un año de tratamiento, con resultados similares a otros trabajos con metotrexate170,186 y esteroides solos en los cuales no hubo reversión de las lesiones, sin aparición de nuevas estenosis.
Mofetil micofenolato
El mofetil micofenolato (MM) es un fármaco inmunosupresor con una relativa baja tasa de toxicidad, dado su mecanismo de acción linfoselectivo187. El ácido micofenólico es el metabólico activo del MM, inhibe reversiblemente la inosinmonofosfato-deshidrogenasa, enzima clave en la síntesis de novo de las purinas188,189. Su uso clínico se inició en la década de los 90, especialmente, en el tratamiento de pacientes trasplantados190, extendiéndose después a pacientes con artritis reumatoide191. La primera experiencia, publicada, con la administración de MM en cuatro pacientes con vasculitis sistémica asociada a ANCA no especifcada la informó Nowack en 1997192. Posteriormente aparecen más informes del mismo caso, el mismo autor y cols. publicaron, en 1999, un estudio piloto prospectivo, no cegado, realizado en Alemania en 11 pacientes con vasculitis sistémica pauciinmunes, a quienes administraron terapia de mantenimiento con MM e informaron que el fármaco fue bien tolerado, efectivo y con baja toxicidad193.
Desde esta época surgen la gran mayoría de trabajos y grandes estudios; Haidinger, en 2000, publica un estudio sobre el tratamiento de vasculitis de pequeño vaso asociada a ANCA con MM, informando plausibilidad terapéutica194. Nachman presenta, en el mismo año, un trabajo sobre viabilidad terapéutica con MM para las recaídas de las vasculitis de pequeño vaso129. Le Hello informa, en 2002, la mejoría de un pioderma gangrenoso en un paciente con GW con la administración de MM195. Haubitz publica, en 2002, una serie de cinco pacientes con enfermedad renal terminal secundaria a vasculitis asociada a ANCA, en los cuales se utilizó como terapia de mantenimiento MM, mostrando mejoría en el pronóstico de la enfermedad196. Assaf informa en 2004, un paciente con síndrome de CS exitosamente tratado con MM197. Los estudios de terapia de mantenimiento se desarrollaron luego de la propuesta del uso de MM como terapia de inducción en vasculitis. Waiser y cols., publicaron el primer caso de un paciente con vasculitis asociada a ANCA, quien alcanzó la remisión con el uso de MM como terapia de inducción en una recaída198. Seguidamente Langford publica, en 2004, una serie de casos de catorce pacientes con GW con MM como terapia de mantenimiento, siendo ésta bien tolerada pero con alta frecuencia de recaídas (43%)199. Joy, en 2005, publicó un estudio piloto usando MM en las recaídas o resistencia de las vasculitis de pequeño vaso, mostrando ser una opción razonable en el tratamiento de esta patología200. Para el año 2006, en un artículo de revisión de Koukoulaki, se evaluó la eficacia y tolerabilidad de MM en 51 pacientes con vasculitis sistémica asociada a ANCA, observando una eficacia y tasa de recaídas variables, probablemente asociadas a las dosis utilizadas de MM201.
La literatura más reciente al respecto se encuentra muy cercana, en el 2010, Hiemstra y cols., del grupo EUVAS202, incluyen 156 pacientes con GW y PAM aleatorizados a MM o azatioprina con un seguimiento de 39 meses, evidenciando mayor número de recaídas con MM con igual aparición de eventos adversos, razón para que posiblemente no continúe como recomendación en la terapia de mantenimiento actuall74.
Otro aporte completamente diferente se desarrolló con base en la búsqueda de una terapia alterna a la usual con ciclofosfamida para inducir la remisión. Basados en la excelente respuesta en el manejo de rechazo agudo de trasplantes203 y los primeros trabajos en nefritis lúpica204, en 1999 comienzan a aparecer informes de casos de pacientes con vasculitis severas que responden al tratamiento con MM como inductor. Es el caso de Hu W. en glomerulonefritis rápidamente progresivas205, Waiser J.198 en un paciente con GW que no toleraba la ciclofosfamida y Joy MS, en 2005200, que trató 12 pacientes con vasculitis ANCA positivos, en recaída con MM, con una remisión de 60% a seis meses. En el año 2007, en una investigación de Stassen y cols., administraron dosis de MM de 1 g dos veces al día como inductor de remisión en 32 pacientes con vasculitis activa que no podía ser tratada con ciclofosfamida, induciendo remisión completa de la enfermedad en 78% de los individuos, parcial en 19% y no respondieron el 3%116.
En la actualidad ya contamos con ensayos aleatorizados comparativos: el primero realizado en China en el 2008, por Weixin Hu y cols.115, con 35 pacientes diagnosticados con vasculitis ANCA positivos que se aleatorizaron a MM o ciclofosfamida, y como resultado se obtuvo mayor cantidad de personas en remisión a los seis meses en el grupo de MM (77.8% vs. 47.1%), así como una mayor recuperación de la función renal y disminución a la normalidad de los niveles séricos de ANCA. En el 2009 las guías EULAR dados estos antecedentes74, recomiendan el uso de MM en pacientes con recaídas o persistencia de la enfermedad, junto con otros medicamentos. Posterior a la guía se encuentra únicamente, como trabajo principal, el realizado por Francisco Silva en 2010 en la Clínica Mayo, con 17 pacientes diagnosticados con PAM que fueron inducidos y mantenidos con MM, con una adecuada respuesta y 13 pacientes persistiendo en remisión por 18 meses206. También se han informado efectos adversos con el uso de MM en pacientes con vasculitis207 similares a los otros medicamentos, siendo los más frecuentes las infecciones202, por ejemplo, Woywodt y cols., en 2000, informaron sobre un caso de colitis por citomegalovirus durante el tratamiento con MM para una GW208.
Con respecto a la terapéutica para otro tipo de vasculitis con MM, Daina y cols., describen tres pacientes, en 1999, con arteritis de Takayasu quienes respondieron bien con 2 g diarios de MM y no presentaron efectos adversos mayores209, de la misma forma, en el 2007 Shinjo y cols.210, y en 2010 Ruchika Goel y cols.211, escribieron conclusiones similares; sin embargo, no hay mención de este medicamento en las guías para el manejo de vasculitis de grandes vasos, quizás por falta de evidencia más fuerte.
En contraste, MM parece ser inefectivo en el tratamiento de la enfermedad de Behcet, según un trabajo informado por Adler en 2001212. Worm publicó en el 2000 un informe de caso sobre un paciente tratado exitosamente con MM para una vasculitis urticariante hipocomplementémica213. En la vasculitis crioglobulinémica asociada a hepatitis C la información es muy pobre, a pesar del conocimiento de la asociación de esta infección con múltiples manifestaciones autoinmunes214 y de la hipótesis del efecto antiviral similar a la ribavirina del MM215. Se encuentran, por tanto, informes de pacientes tratados con MM en múltiples enfermedades autoinmunes216, incluyendo vasculitis. Por ejemplo: Lerardi, en 2003217, con manifestaciones hematológicas como anemia hemolítica; Reed, en 2001218, con glomérulo nefritis y vasculitis, Capponetto, en 2001, con miastenia gravis219.
En cuanto a los pacientes sin infección por virus de la hepatitis C la recomendación por las guías, sin evidencia de peso al respecto, es dirigir el tratamiento de forma similar a las vasculitis ANCA positivas, donde el uso de MM es limitado, como se expuso previamente74.
Rituximab
La utilización de rituximab, en las vasculitis sistémicas asociadas a ANCA, surge de la observación clínica que en aproximadamente 10% de los pacientes la enfermedad es refractaria al tratamiento convencional con ciclofosfamida220,221. Rituximab es un anticuerpo monoclonal quimérico que induce una depleción selectiva de los linfocitos B, mediante la unión al antígeno de superficie CD20, su interés en el uso para enfermedades autoinmunes está en crecimiento. Specks y cols., en 2001, publicaron un informe de caso sobre un paciente con granulomatosis con poliangeitis con recaída de la enfermedad y toxicidad por ciclofosfamida, a quien administraron rituximab logrando la remisión, constituyendo el primer reporte al respecto222. En 2003 fueron publicadas dos pequeñas series de pacientes con vasculitis asociadas a ANCA, en quienes se obtuvo algún beneficio con la administración de rituximab223,224. Posteriormente, el estudio de Karina Keogh y cols., en 2005220, valoró la eficacia del rituximab en varios pacientes con vasculitis asociada a anti-proteinasa 3, quienes no habían presentado respuesta favorable a ciclofosfamida; evaluaron 11 pacientes y concluyeron que rituximab, en este grupo de pacientes, puede ser una opción terapéutica efectiva y segura, igual que como se planteaba para casos refractarios luego de la inducción exitosa225, sugerencia de las guías actuales.
Posteriormente, hay informes de casos de tratamientos exitosos con este medicamento226,227. Keogh publica en 2006 un ensayo piloto, prospectivo, no cegado en 10 pacientes, sobre el uso de rituximab en vasculitis asociada a ANCA, mostrando que el anti-CD20 fue bien tolerado e inducía remisión en este grupo de sujetos228. Jhon Stone y cols., publicaron en New England Journal of Medicine, en 2010, un ensayo doble ciego, aleatorizado, multicéntrico, de no inferioridad, comparando el uso de rituximab versus ciclofosfamida en vasculitis asociada a ANCA, en el que evidenciaron que la terapia anti-CD20 no fue inferior a ciclofosfamida para la inducción y remisión de la vasculitis229. Cartin-Ceba informó en 2011, en un estudio piloto no cegado, en tres pacientes con síndrome de CS, variedad escasamente incluida en otros estudios, con compromiso renal sin mejoría a corticoides, que la administración de rituximab fue segura y exitosa en estos individuos230.
Además, de las terapias previamente descritas el uso de terapia biológica, especialmente con rituximab, ha sido estudiado como monoterapia o en asociación a la terapia antiviral en vasculitis crioglobulinémica231, la primera en general en pacientes con pobre respuesta a tratamiento inicial con terapia, encontrándose una respuesta clínica completa hasta del 70% en ensayos no controlados, así como una adecuada respuesta a un segundo ciclo después de la primera recaída232, a pesar de la posible relación del uso de la terapia con un aumento en el conteo de la carga viral233.
Anti-TNF
Los medicamentos que bloquean el factor de necrosis tumoral alfa (anti-TNF) han sido también empleados para el tratamiento de las vasculitis. Los primeros estudios publicados fueron informes de caso; Hassard en 2001 informó sobre un paciente con enfermedad de Behcet gastrointestinal tratado con infiximab234, Robertson informó el tratamiento de ulceraciones genitales y orales en enfermedad de Behcet con infiximab, obteniendo mejoría en el paciente235 y Goossens publicó, en 2001, remisión de la misma enfermedad con infiximab236.
Para el tratamiento de la granulomatosis con poliangeitis , Stone empleó, en 2001, etanercept sumado a la terapia convencional en un estudio a seis meses no cegado, el cual fue bien tolerado, con pocos eventos adversos237. De esta forma, fue abierto un gran campo de investigación en el tratamiento de las vasculitis sistémicas con la utilización de la terapia biológica238. Luego Booth, en 2002, describió seis pacientes con vasculitis refractaria asociada a ANCA tratados con infiximab, recomendando una nueva alternativa terapéutica para esta patología239, lo mismo que Lamprecht en 2002, quien evaluó la inducción de remisión en seis pacientes con granulomatosis de GW refractaria a la terapia convencional, logrando la remisión de cinco pacientes durante 6 a 24 meses de seguimiento240. El mismo año Arbach publicó tres informes de caso de pacientes con síndrome de CS refractarios a ciclofosfamida, en quienes utilizó etanercept en un caso e infiximab en dos pacientes, obteniendo un aceptable perfil de seguridad241. Aparecen los primeros estudios de Booth en 2004, quien publica un ensayo clínico, prospectivo, multicéntrico, no cegado sobre la utilización de infiximab en pacientes con vasculitis sistémica asociada a ANCA, observando 88% de remisión, 20% de exacerbaciones en respondedores iníciales y 21% de infecciones severas242.
Contrario a lo que se había informado respecto a la inducción de remisión en vasculitis ANCA positivas, Chandesris, en 2004, informa la administración de infiximab en dos pacientes con vasculitis secundaria a crioglobulinemia mixta asociada a hepatitis C, con resultados desalentadores en la evolución clínica de los pacientes; por tanto, no recomienda su utilización243. También se han utilizado los anti-TNF en el tratamiento de la arteritis de Takayasu. Hofman, en 2004, publicó un estudio piloto para el tratamiento de las recaídas de esta enfermedad con anti-TNF, evidenciando mejoría y una aceptable remisión de la arteritis, advirtiendo la necesidad de posteriores estudios controlados y aleatorizados, siendo Hofman, en el mismo año244 uno de los autores de los pocos estudios, reclutando 15 pacientes con Takayasu activo o refractario, siete tratados con etanercept y ocho con infiximab, concluyendo que estos medicamentos pueden ser útiles para inducir la remisión y mantenimiento libre de recaídas, lo que justifica la realización de un ensayo clínico controlado aún más grande.
Paralelamente, se evaluó la importancia de la terapia biológica como mantenimiento; en 2005, es publicado en New England Journal of Medicine un ensayo clínico aleatorizado, controlado con placebo, para evaluar el mantenimiento de la remisión con etanercept en 180 pacientes con GW, y se demostró que el anti-TNF no es efectivo en el mantenimiento de la remisión y además se presentó una alta tasa de complicaciones asociadas al tratamiento245, hallazgo corroborado por Sangle en 2007, cuando publicó un estudio prospectivo con pacientes en recaída de vasculitis sistémica, quienes recibieron infiximab durante seis meses, presentando mayores efectos adversos y falta de beneficios clínicos246. Antes de este último, en una revisión clínica de Huugen en 2006 sobre el papel de los anti-TNF en vasculitis sistémica, se encontró que los ensayos clínicos no han mostrado un claro beneficio en esta patología; por el contrario, algunos trabajos no han encontrado efectividad y más aún otros muestran un aumento de los efectos adversos, principalmente en la terapia de mantenimiento247, 248.
Con respecto a otros medicamentos biológicos, Nishimoto en 2008, en un informe de caso, describe que la molécula tocilizumab (anticuerpo humanizado contra el receptor de IL-6) fue efectivo para tratar un paciente con arteritis de Takayasu refractaria, complicada con colitis ulcerativa249. Un estudio prospectivo, publicado por Laurino en 2010, que incluyó 14 pacientes con exacerbación de vasculitis asociada a ANCA o recaída, utilizó adalimumab por tres meses en combinación con ciclofosfamida, y las tasas de respuesta y eventos adversos fueron similares a la terapia convencional250. En cuanto a otras variedades de vasculitis, Cantini informó la utilización de infiximab en arteritis de células gigantes en cuatro pacientes con resultados alentadores251 y Tan informó un desenlace similar con etanercept252. Gary S Hofman, en 2007253, publicó uno de los estudios más grandes al respecto con 44 pacientes aleatorizados a placebo o infiximab; este estudio se detuvo tempranamente por el resultado de análisis internos en la semana 22, no encontrando diferencias en los desenlaces primarios como ausencia de recaídas y disminución de dosis de corticoide, pero con un aumento importante en episodios infecciosos. Más tarde, otro ensayo doble ciego, controlado con placebo, no permitió sacar conclusiones definitivas sobre la utilidad de etanercept en pacientes con arteritis de células gigantes248. En la tabla 1 encontraremos un resumen de los estudios realizados con diferentes medicamentos, las formas de intervención y los resultados en vasculitis asociada a ANCA.
Tocilizumab
La interleucina 6 (IL-6) es una molécula con gran potencial antiinfamatorio y efectos pleiotrópicos sistémicos. El bloqueo de la acción de la IL-6 con tocilizumab (TCZ), un anticuerpo monoclonal humanizado contra el receptor de IL-6, ha demostrado ser efcaz en el tratamiento de la artritis reumatoide (AR) y la artritis idiopática juvenil (AIJ) de inicio sistémico y está aprobado para tales usos256.
La IL-6 tiene un papel importante en la fisiopatología de la arteritis de células gigantes (ACG) y la arteritis de Takayasu (AT), que son consideradas vasculitis de grandes vasos257. Se han demostrado niveles tisulares elevados de IL-6 en las arterias de pacientes con ACG que mostraron ser más resistentes a la terapia con corticosteroides258. Los niveles séricos de IL-6 también se han encontrado elevados en ACG y en AT259,260.
Es así como un nuevo escenario se abre para el TCZ en el tratamiento de las vasculitis de grandes vasos, como la ACG y la AT; que aún no se ha contemplado en las recomendaciones internacionales167.
Lo que se conoce de TCZ en vasculitis de grandes vasos proviene de informes de casos y de series de casos donde el uso de la molécula ayudó al tratamiento.
En el caso reportado de una mujer con AT refractaria activa, complicada por colitis ulcerativa (CU), mejoró las manifestaciones clínicas y de laboratorio de la AT, así como disminuyó la actividad de la CU249. TCZ se utilizó con éxito en un paciente con AT refractaria a múltiples inmunosupresores convencionales y dos bloqueadores del factor de necrosis tumoral (anti-TNF), a dosis de 8 mg/kg mensual, por seis meses. Los índices de actividad infamatoria se normalizaron y la prednisolona pudo ser disminuida261.
En ACG, se informó un caso refractario con ileítis y dependencia de altas dosis de esteroide a pesar de metotrexate. Después de las infusiones de TCZ no se encontraron recaídas a los seis meses, incluso con disminución de los corticosteroides262. En una serie de casos con siete pacientes (cinco con ACG y dos con AT); tres con diagnóstico reciente y cuatro resistentes a corticosteroides; se utilizó TCZ y durante el seguimiento todos obtuvieron una rápida respuesta, con normalización de los reactantes de fase aguda y una disminución progresiva de la dosis de prednisolona, sin recaídas o efectos adversos relacionados263. TCZ funciona en casos refractarios al tratamiento convencional con esteroides, con o sin asociación de otro inmunosupresor264. No existen, por ahora, resultados de ensayos clínicos controlados y aleatorios que evalúen la efectividad de TCZ en el tratamiento de la ACG y la AT y que comparen su eficacia contra los esquemas establecidos. Dos ensayos clínicos están en etapa de reclutamiento para evaluar el TCZ en el tratamiento de pacientes con ACG y polimialgia reumática (PMR). (A Phase II, Randomized, Double-blind, Placebo Controlled Study of Tocilizumab in Patients with Giant Cell Arteritis.ClinicalTrials.gov identifer: NCT01450137; Phase IIa of Tocilizumab in the Treatment of Polymyalgia Rheumatica. ClinicalTrials.gov identifer: NCT01396317).
Hoy, ante la dificultad que pueden ofrecer los esquemas actuales de tratamiento en vasculitis de grandes vasos, TCZ cuenta con la sustentación de que su efecto podría resultar beneficioso en estos escenarios265.
Guías de tratamiento
El Grupo Europeo para el estudio de las EUVAS, publicó en 2009 las recomendaciones EULAR para el tratamiento de las vasculitis primarias de pequeño y mediano vaso, marcando un punto importante de partida, unifcando toda la literatura en regímenes terapéuticos únicos. Recomiendan la combinación de ciclofosfamida (IV u oral) y glucocorticoides para la inducción de la remisión74. El régimen diseñado es ciclofosfamida 15 mg/kg (máximo 1.2 g) cada dos semanas por los primeros 3 pulsos, seguido por infusiones cada tres semanas por los próximos tres a seis pulsos132,266. Los pulsos IV de ciclofosfamida han sido usados en PAN y síndrome de CS con igual eficacia y menor incidencia de eventos adversos que las bajas dosis orales diarias de ciclofosfamida, por lo que la sugerencia es a preferir el uso IV120,267. También está recomendada la combinación de metrotexate (oral o parenteral) y glucocorticoides como alternativa, menos tóxica, a la ciclofosfamida para la inducción de remisión en vasculitis asociada a ANCA que no amenacen la vida o tengan compromiso de órganos, especialmente riñón113.
Los glucocorticoides a altas dosis son una parte importante de la terapia de inducción de la remisión; es común iniciar con prednisolona 1 mg/kg/día y no reducir a menos de 15 mg/día en los primeros tres meses137. Cuando se requiere un rápido efecto, los pulsos de metilprednisolona pueden ser usados en adición a la prednisolona oral como parte de la terapia de inducción133. La plasmaféresis está recomendada en pacientes seleccionados con enfermedad renal rápidamente progresiva, con el fin de salvar la función renal254. La terapia de mantenimiento está recomendada con una combinación de glucocorticoides a bajas dosis y azatioprina sobre lefunomida o metotrexate159,180,268, siendo el primero el más recomendado. En cuanto a la terapia en pacientes con cuadros refractarios, existe evidencia escasa y en ocasiones inconsistente; sin embargo, se ha recomendado el uso del MM, rituximab, infiximab, gamaglobulina endovenosa para especifcar mayores datos de beneficios de cada uno de estos.
También, en 2009, EUVAS, publicó las recomendaciones EULAR para el tratamiento de las vasculitis de grandes vasos167. Este grupo de estudio recomienda el inicio temprano de glucocorticoides a altas dosis para la inducción de remisión. Los pulsos de metil-prednisolona pueden ser útiles en fases tempranas de la enfermedad con manifestaciones oculares iniciales en arteritis de células gigantes, especialmente. La dosis inicial de prednisolona es 1 mg/kg/día, la cual debería ser mantenida por 1 mes y después gradualmente disminuida hasta 10-15 mg/día a los tres meses59,85,269. Otra recomendación sobre vasculitis de grandes vasos, es el uso de un agente inmunosupresor como terapia coadyuvante. Se puede administrar metotrexate como medicamento ahorrador de esteroides y tiene un efecto modesto en reducir la tasa de recaídas163,166. La combinación de infiximab y glucocorticoides no reduce el riesgo de recaída comparada con la monoterapia con glucocorticoides; por tanto, no se recomienda su uso en arteritis de células gigantes253. La azatioprina y el metotrexate se pueden utilizar como coadyuvantes en la terapia de la arteritis de Takayasu; pueden ayudar a mejorar el control de la enfermedad y facilitan la disminución de la dosis de glucocorticoides, sin beneficio sobre regresión de lesiones estenóticas185.
Referencias
1. Hench PS KE, Slocumb CH, Polley HF. The efect of a hormone of the adrenal cortex (17-hydroxy-11-dehydro-corticosterone; compound E) and pituitary adrenocortico-tropic hormone on rheumatoid arthritis: preliminary report. Proc Staf Meet Mayo Clin. 1949; 1949(24):181-97. [ Links ]
2. Hench PS SC, Barnes AR, Smith HL, Polley HF, Kendall EC. The efects of the adrenal cortical hormone 17-hydro-xy-II-dehydrocorticosterone (compound E) on the acute phase of rheumatic fever: preliminary report. Proc Staf Meet Mayo Clin. 1949; 24:277-97. [ Links ]
3. Polley HF SC. Behind the scenes with cortisone and A.C.T.H. Mayo Clin. Proc. 1976; 51:476. [ Links ]
4. Klemperer P PA, Baehr G. Difuse collagen disease. J AMA. 1942; 119:331-2. [ Links ]
5. Shick RM BA, Fuller B F, Polley H F. Efects of cortisone and ACTH on periarteritis nodosa and cranial arteritis: preliminary report. Proc Staf Meet Mayo Clin. 1950; 25:135. [ Links ]
6. Baggenstoss AH SR, Polley H F. The efect of cortisone on the lesions of polyarteritis nodosa. Am J Pathol. 1951; 27:537-59. [ Links ]
7. Drury MI, Hickey MD, Malone J P. A case of polyarteritis nodosa treated with cortisone. Br Med J. 1951 Dec 22; 2(4746):1487-9. [ Links ]
8. AR R. Hypersensitivity in disease. Harvey Lect. 1946; 42:106-47. [ Links ]
9. Rich AR GJ. The experimental demonstration that periarteritis nodosa is a manifestacion of hypersensitivity. Bull Johns Hopkins Hosp. 1943; 72:65-88. [ Links ]
10. Rackemann FM GJ. Periarteritis nodosa and asthma. Tr A Am Physicians. 1939; 54:112-8. [ Links ]
11. Harkavy J. Vascular allergy. Clinics. 1946 Aug; 5(2):504-49. [ Links ]
12. Friedberg CK CL. Arch Intern Med 1934; 54:170. [ Links ]
13. Rose GA. The natural history of polyarteritis. Br Med J. 1957 Nov 16; 2(5054):1148-52. [ Links ]
14. Churg J, Strauss L. Allergic granulomatosis, allergic angiitis, and periarteritis nodosa. Am J Pathol. 1951 Mar-Apr; 27(2):277-301. [ Links ]
15. Godman GC, Churg J. Wegener's granulomatosis: pathology and review of the literature. AMA Arch Pathol. 1954 Dec; 58(6):533-53. [ Links ]
16. Kulka J P. The vascular lesions associated with rheumatoid arthritis. Bull Rheum Dis. 1959 Dec; 10:201-2. [ Links ]
17. Ferguson RH, Slocumb CH. Peripheral neuropathy in rheumatoid arthritis. Bull Rheum Dis. 1961 May; 11:251-4. [ Links ]
18. Frohnert P P, Sheps SG. Long-term follow-up study of periarteritis nodosa. Am J Med. 1967 Jul; 43(1):8-14. [ Links ]
19. Savory WS. Case of a Young Woman in whom the main Arteries of both Upper Extremities and of the Left Side of the Neck were throughout completely Obliterated. Med Chir Trans. 1856; 39:205-19. [ Links ]
20. Takayasu M. Case with unusual changes of the central vessels in the retina. Acta Soc Ophthal Jap. 1908 (12):554. [ Links ]
21. Lupi-Herrera E, Sánchez-Torres G, Marcushamer J, Mispireta J, Horwitz S, Vela JE. Takayasu's arteritis. Clinical study of 107 cases. Am Heart J. 1977 Jan; 93(1): 94-103. [ Links ]
22. Maksimowicz-McKinnon K, Clark TM, Hofman GS. Limitations of therapy and a guarded prognosis in an American cohort of Takayasu arteritis patients. Arthritis Rheum. 2007 Mar; 56(3):1000-9. [ Links ]
23. Nakao K, Ikeda M, Kimata S, Niitani H, Niyahara M. Takayasu's arteritis. Clinical report of eighty-four cases and immunological studies of seven cases. Circulation. 1967 Jun; 35(6):1141-55. [ Links ]
24. Fraga A, Mintz G, Valle L, Flores-Izquierdo G. Takayasu's arteritis: frequency of systemic manifestations (study of 22 patients) and favorable response to maintenance steroid therapy with adrenocorticosteroids (12 patients). Arthritis Rheum. 1972 Nov-Dec; 15(6):617-24. [ Links ]
25. Moore PM, Beard EE, Thoburn T W, Williams HL. Idiopathic (lethal) granuloma of the midline facial tissues treated with cortisone: report of a case. Laryngoscope. 1951 Apr; 61(4):320-31. [ Links ]
26. Hagens EW, Parry N, Markson D. Corticotropin (ACTH) in lethal granuloma of the nose and face. AMA Arch Otolaryngol. 1953 May; 57(5):516-19. [ Links ]
27. Beidleman B. Wegener's Granulomatosis; Prolonged Terapy with Large Doses of Steroids. JAMA. 1963 Nov 30; 186:827-30. [ Links ]
28. Fauci AS, Haynes B, Katz P. The spectrum of vasculitis: clinical, pathologic, immunologic and therapeutic considerations. Ann Intern Med. 1978 Nov; 89(5 Pt 1):660-76. [ Links ]
29. Fauci AS, Wolf SM. Wegener's granulomatosis: studies in eighteen patients and a review of the literature. Medicine (Baltimore). 1973 Nov; 52(6):535-61. [ Links ]
30. Wolf SM, Fauci AS, Horn RG, Dale DC. Wegener's granulomatosis. Ann Intern Med. 1974 Oct; 81(4):513-25. [ Links ]
31. Chumbley LC, Harrison EG, Jr., DeRemee RA. Allergic granulomatosis and angiitis (Churg-Strauss syndrome). Report and analysis of 30 cases. Mayo Clin. Proc. 1977 Aug; 52(8):477-84. [ Links ]
32. Guillevin L, Le Ti Huong D, Godeau P, Jais P, Wechsler B. Clinical findings and prognosis of polyarteritis nodosa and Churg-Strauss angiitis: a study in 165 patients. Br J Rheumatol. 1988 Aug; 27(4):258-64. [ Links ]
33. Gorevic PD, Kassab HJ, Levo Y, Kohn R, Meltzer M, Prose P, et al. Mixed cryoglobulinemia: clinical aspects and long-term follow-up of 40 patients. Am J Med. 1980 Aug; 69(2):287-308. [ Links ]
34. Vacca A D F. Defazacort versus prednisone in the treatment of EMC: A between-patient controlled clinical study. Int Arch Allergy Immunol. 1992; 99:306. [ Links ]
35. Dammacco F, Sansonno D, Han JH, Shyamala V, Cornacchiulo V, Iacobelli AR, et al. Natural interferon-alpha versus its combination with 6-methyl-prednisolone in the therapy of type II mixed cryoglobulinemia: a long-term, randomized, controlled study. Blood. 1994 Nov 15; 84(10):3336-43. [ Links ]
36. Hunder GG. The early history of giant cell arteritis and polymyalgia rheumatica: frst descriptions to 1970. Mayo Clin. Proc. 2006 Aug; 81(8):1071-83. [ Links ]
37. Hutchison. Diseases of the arteries. Arch Surg. 1890; 1:323. [ Links ]
38. Horton BT MT, Brown GE. An undescribed form of arteritis of the temporal vessels. Proc Staf Meet Mayo Clin. 1932; 7:700-1. [ Links ]
39. Horton BT M T. Arteritis of the temporal vessels: report of 7 cases. Proc Staf Meet Mayo Clin. 1937; 12:548-53. [ Links ]
40. Meade DK, Blumenthal LS, Holmes DB. Temporal arteritis; report of a case treated with intravenous histamine. South Med J. 1950 Jan; 43(1):40-3, illust. [ Links ]
41. Rice-Oxley JM, Cooke AM. Temporal arteritis. Two cases treated with aureomycin. Lancet. 1951 Jan 13; 1(6646):89-90. [ Links ]
42. Roberts AM, Askey JM. Temporal arteritis; relief of headache by injection of procaine hydrochloride. J Am Med Assoc. 1948 Jun 19; 137(8):697-9. [ Links ]
43. Tate WM, Wheeler JA. Temporal arteritis: report of a case with ACTH therapy. J Kans Med Soc. 1951 Aug; 52(8):374-7. [ Links ]
44. Kersley. A myalgic syndrome of the aged with systemic reaction. Proc II Congr Europ Reum (Barcelona) 1951:388-9. [ Links ]
45. Birkhead NC, Wagener H P, Shick RM. Treatment of temporal arteritis with adrenal corticosteroids; results in fifty-five cases in which lesion was proved at biopsy. J Am Med Assoc. 1957 Mar 9; 163(10):821-7. [ Links ]
46. Meulengracht E, Schwartz M. The course and prognosis of periarthrosis humeroscapularis with special regard to cases with general symptoms. Acta Med Scand. 1952 Aug 5; 143(5):350-60. [ Links ]
47. Barber HS. Myalgic syndrome with constitutional efects; polymyalgia rheumatica. Ann Rheum Dis. 1957 Jun; 16(2):230-7. [ Links ]
48. Gordon I. Polymyalgia rheumatica. A clinical study of 21 cases. Q J Med. 1960 Oct; 29:473-88. [ Links ]
49. Boyle AC, Beatty DC. Polymyalgia Rheumatica. Proc R Soc Med. 1961 Aug; 54(8):681-4. [ Links ]
50. Forestier J, Certonciny A. [Rhizomelic pseudo-polarythritis]. Rev Rhum Mal Osteoartic. 1953 Dec; 20(12):854-62. [ Links ]
51. Weissenbach R, Nobillot A, Freneaux R, Coste F. [Rhi-zomelic Pseudo-Polyarthritis]. Sem Hop. 1963 Oct 14; 39:2073-80. [ Links ]
52. Hamrin B, Jonsson N, Landberg T. Arteritis in "Polymyalgia Rheumatica". Lancet. 1964 Feb 22; 1(7330):397-401. [ Links ]
53. Alestig K, Barr J. Giant-cell arteritis. A biopsy study of polymyalgia rheumatica, including one case of Takayasu's disease. Lancet. 1963 Jun 8; 1(7293):1228-30. [ Links ]
54. Paulley J W, Hughes J P. Giant-cell arteritis, or arteritis of the aged. Br Med J. 1960 Nov 26; 2(5212):1562-7. [ Links ]
55. Hamilton CR, Jr., Shelley WM, Tumulty PA. Giant cell arteritis: including temporal arteritis and polymyalgia rheumatica. Medicine (Baltimore). 1971 Jan; 50(1):1-27. [ Links ]
56. Aiello PD, Trautmann JC, McPhee TJ, Kunselman AR, Hunder GG. Visual prognosis in giant cell arteritis. Ophthalmology. 1993 Apr; 100(4):550-5. [ Links ]
57. Salvarani C, Cantini F, Boiardi L, Hunder GG. Polymyalgia rheumatica and giant-cell arteritis. N Engl J Med. 2002 Jul 25; 347(4):261-71. [ Links ]
58. Salvarani C, Macchioni PL, Tartoni PL, Rossi F, Baricchi R, Castri C, et al. Polymyalgia rheumatica and giant cell arteritis: a 5-year epidemiologic and clinical study in Reggio Emilia, Italy. Clin Exp Rheumatol. 1987 Jul-Sep; 5(3):205-15. [ Links ]
59. Proven A, Gabriel SE, Orces C, O'Fallon WM, Hunder GG. Glucocorticoid therapy in giant cell arteritis: duration and adverse outcomes. Arthritis Rheum. 2003 Oct 15; 49(5):703-8. [ Links ]
60. Torn GW. Clinical considerations in the use of corticosteroids. N Engl J Med. 1966 Apr 7; 274(14):775-81. [ Links ]
61. Axelrod L. Glucocorticoid therapy. Medicine (Baltimore). 1976 Jan; 55(1):39-65. [ Links ]
62. Fauci AS, Dale DC, Balow JE. Glucocorticosteroid therapy: mechanisms of action and clinical considerations. Ann Intern Med. 1976 Mar; 84(3):304-15. [ Links ]
63. Cupps T FA. Management and treatment of vasculitis. In the vasculitides. Major problems in Internal Medicine. Philadelphia: WB saunders company; 1981. [ Links ]
64. Dixon FJ, Vazquez JJ, Weigle WO, Cochrane CG. Pathogenesis of serum sickness. AMA Arch Pathol. 1958 Jan; 65(1):18-28. [ Links ]
65. Sokolof L, Mc CR, Bunim JJ. The vascularity of the early subcutaneous nodules of rheumatoid arthritis. Bull N Y Acad Med. 1953 Sep; 29(9):733-4. [ Links ]
66. Gocke DJ, Hsu K, Morgan C, Bombardieri S, Lockshin M, Christian CL. Association between polyarteritis and Australia antigen. Lancet. 1970 Dec 5; 2(7684):1149-53. [ Links ]
67. Howell SB, Epstein WV. Circulating immunoglobulin complexes in Wegener's granulomatosis. Am J Med. 1976 Feb; 60(2):259-68. [ Links ]
68. Yu DT, Clements PJ, Paulus HE, Peter JB, Levy J, Barnett EV. Human lymphocyte subpopulations. Efect of corticosteroids. J Clin Invest. 1974 Feb; 53(2):565-71. [ Links ]
69. Butler W T, Rossen RD. Efects of corticosteroids on immunity in man. I. Decreased serum IgG concentration caused by 3 or 5 days of high doses of methylprednisolone. J Clin Invest. 1973 Oct; 52(10):2629-40. [ Links ]
70. Bell PR, Briggs JD, Calman KC, Quin RO, Wood RF, Paton A, et al. The immunosuppressive efect of large doses of intravenous prednisolone in experimental heterotopic rat heart and human renal transplantation. Surgery. 1973 Jan; 73(1):147-52. [ Links ]
71. Feduska NJ, Turcotte JG, Gikas PW, Bacon GE, Penner JA. Reversal of renal allograft rejection with intravenous methylprednisolone "pulse" therapy. J Surg Res. 1972 Mar; 12(3):208-15. [ Links ]
72. Cathcart ES, Idelson BA, Scheinberg MA, Couser WG. Benefcial efects of methylprednisolone "pulse" therapy in difuse proliferative lupus nephritis. Lancet. 1976 Jan 24; 1(7952):163-6. [ Links ]
73. Neild GH, Lee HA. Methylprednisolone pulse therapy in the treatment of polyarteritis nodosa. Postgrad Med J. 1977 Jul; 53(621):382-7. [ Links ]
74. Mukhtyar C, Guillevin L, Cid MC, Dasgupta B, de Groot K, Gross W, et al. EULAR recommendations for the management of primary small and medium vessel vasculitis. Ann Rheum Dis. 2009 Mar; 68(3):310-7. [ Links ]
75. Bolton WK, Couser WG. Intravenous pulse methylprednisolone therapy of acute crescentic rapidly progressive glomerulonephritis. Am J Med. 1979 Mar; 66(3):495-502. [ Links ]
76. Harrison HL, Linshaw MA, Lindsley CB, Cuppage FE. Bolus corticosteroids and cyclophosphamide for initial treatment of Wegener's granulomatosis. JAMA. 1980 Oct 3; 244(14):1599-600. [ Links ]
77. Leavitt RY, Fauci AS. Pulmonary vasculitis. Am Rev Respir Dis. 1986 Jul; 134(1):149-66. [ Links ]
78. MacFadyen R, Tron V, Keshmiri M, Road JD. Allergic angiitis of Churg and Strauss syndrome. Response to pulse methylprednisolone. Chest. 1987 Apr; 91(4):629-31. [ Links ]
79. Swannell AJ. Polymyalgia rheumatica and temporal arteritis: diagnosis and management. Bmj. 1997 May 3; 314(7090):1329-32. [ Links ]
80. Sailler L, Carreiro M, Ollier S, Juchet H, Delobel P, Ferrand D, et al. Non-complicated Horton's disease: initial treatment with methylprednisolone 500 mg/day bolus for three days followed by 20 mg/day prednisone-equivalent. Evaluation of 15 patients. Rev Med Interne. 2001 Nov; 22(11):1032-8. [ Links ]
81. Chevalet P, Barrier JH, Pottier P, Magadur-Joly G, Pottier MA, Hamidou M, et al. A randomized, multicenter, controlled trial using intravenous pulses of methylprednisolone in the initial treatment of simple forms of giant cell arteritis: a one year followup study of 164 patients. J Rheumatol. 2000 Jun; 27(6):1484-91. [ Links ]
82. Liu NH, LaBree LD, Feldon SE, Rao NA. The epidemiology of giant cell arteritis: a 12-year retrospective study. Ophthalmology. 2001 Jun; 108(6):1145-9. [ Links ]
83. Foroozan R, Deramo VA, Buono LM, Jayamanne DG, Sergott RC, Danesh-Meyer H, et al. Recovery of visual function in patients with biopsyproven giant cell arteritis. Ophthalmology. 2003 Mar; 110(3):539-42. [ Links ]
84. Hayreh SS, Zimmerman B. Management of giant cell arteritis. Our 27-year clinical study: new light on old controversies. Ophthalmologica. 2003 Jul-Aug; 217(4):239-59. [ Links ]
85. Mazlumzadeh M, Hunder GG, Easley KA, Calamia KT, Matteson EL, Grifing WL, et al. Treatment of giant cell arteritis using induction therapy with high-dose glucocorticoids: a double-blind, placebo-controlled, randomized prospective clinical trial. Arthritis Rheum. 2006 Oct; 54(10):3310-8. [ Links ]
86. Iglesias- Gamarra A. Historia del tratamiento del Lupus. In: Pérez M, editor. Historia del Lupus. Bogotá: Editorial Panamericana.; 2004. p. 487-534. [ Links ]
87. Chasis H, Goldring W, Baldwin DS. The efect of nitrogen mustard on renal manifestations of human glomerulone-phritis. J Clin Invest. 1950 Jun; 29(6):804. [ Links ]
88. Haserick JR, Corcoran AC, Dustan H. ACTH and cortisone in the acute crisis of systemic lupus erythematosus. J Am Med Assoc. 1951 Jun 16; 146(7):643-5. [ Links ]
89. Dubois EL. Nitrogen mustard in treatment of systemic lupus erythematosus. AMA Arch Intern Med. 1954 May; 93(5):667-72. [ Links ]
90. Moncrieff MW, White RH, Oggs CS, Cameron JS. Cyclophosphamide therapy in the nephrotic syndrome in childhood. Br Med J. 1969 Mar 15; 1(5645):666-71. [ Links ]
91. Steinberg AD, Kaltreider HB, Staples PJ, Goetzl EJ, Talal N, Decker JL. Cyclophosphamide in lupus nephritis: a controlled trial. Ann Intern Med. 1971 Aug; 75(2):165-71. [ Links ]
92. Steinberg AD, Decker JL. A double-blind controlled trial comparing cyclophosphamide, azathioprine and placebo in the treatment of lupus glomerulonephritis. Arthritis Rheum. 1974 Nov-Dec; 17(6):923-37. [ Links ]
93. Decker JL, Klippel JH, Plotz PH, Steinberg AD. Cyclo-phosphamide or azathioprine in lupus glomerulonephritis. A controlled trial: results at 28 months. Ann Intern Med. 1975 Nov; 83(5):606-15. [ Links ]
94. Decker JL, Steinberg AD, Reinertsen JL, Plotz PH, Balow JE, Klippel JH. NIH conference. Systemic lupus erythematosus: evolving concepts. Ann Intern Med. 1979 Oct; 91(4):587-604. [ Links ]
95. Melam H, Patterson R. Periarteritis nodosa. A remission achieved with combined prednisone and azathioprine therapy. Am J Dis Child. 1971 May; 121(5):424-7. [ Links ]
96. Tuma S, Chaimovitz C, Szylman P, Gellei B, Better OS. Periarteritis nodosa in the kidney. Recovery following immunosuppressive therapy. JAMA. 1976 Jan 19; 235(3):280-1. [ Links ]
97. Glanz S, Bittner SJ, Berman MA, Dolan T F, Jr., Talner NS. Regression of coronary-artery aneurysms in infantile polyarteritis nodosa. N Engl J Med. 1976 Apr 22; 294(17):939-41. [ Links ]
98. Guillevin L, Jarrousse B, Lok C, Lhote F, Jais J P, Le Ti Huong Du D, et al. Longterm followup after treatment of polyarteritis nodosa and Churg-Strauss angiitis with comparison of steroids, plasma exchange and cyclophosphamide to steroids and plasma exchange. A prospective randomized trial of 71 patients. The Cooperative Study Group for Polyarteritis Nodosa. J Rheumatol. 1991 Apr; 18(4):567-74. [ Links ]
99. Colmegna I, Maldonado-Cocco JA. Polyarteritis nodosa revisited. Curr Rheumatol Rep. 2005 Aug; 7(4):288-96. [ Links ]
100. Walton E W. Giant-cell granuloma of the respiratory tract (Wegener's granulomatosis). Br Med J. 1958 Aug 2; 2(5091):265-70. [ Links ]
101. Sandler G, Mc GM. Pulmonary deterioration in Wegener's granulomatosis during steroid therapy. Postgrad Med J. 1963Aug; 39:485-8. [ Links ]
102. Fred HL, Lynch EC, Greenberg SD, González-Angulo A. A Patient with Wegener's Granulomatosis Exhibiting Unusual Clinical and Morphologic Features. Am J Med. 1964 Aug; 37:311-9. [ Links ]
103. Grahne B, Zechner G. Wegener's granulomatosis. Acta Otolaryngol. 1966 Oct-Nov; 62(4):362-72. [ Links ]
104. Fahey JL, Leonard E, Churg J, Godman G. Wegener's granulomatosis. Am J Med. 1954 Aug; 17(2):168-79. [ Links ]
105. Greenspan EM. Cyclophosphamide-Prednisone Terapy of Lethal Midline Granuloma. JAMA. 1965 Jul 5; 193:74-6. [ Links ]
106. McIlvanie SK. Wegener's granulomatosis. Successful treatment with chlorambucil. JAMA. 1966 Jul 11; 197(2):90-2. [ Links ]
107. Hollander D, Manning RT. The use of alkylating agents in the treatment of Wegener's granulomatosis. Ann Intern Med. 1967 Aug; 67(2):393-8. [ Links ]
108. Raitt J W. Wegener's granulomatosis: treatment with cytotoxic agents and adrenocorticoids. Ann Intern Med. 1971 Mar; 74(3):344-56. [ Links ]
109. Fauci AS, Doppman JL, Wolf SM. Cyclophosphamide-induced remissions in advanced polyarteritis nodosa. Am J Med. 1978 May; 64(5):890-4. [ Links ]
110. Fauci AS, Haynes B F, Katz P, Wolf SM. Wegener's granulomatosis: prospective clinical and therapeutic experience with 85 patients for 21 years. Ann Intern Med. 1983 Jan; 98(1):76-85. [ Links ]
111. Hellmich B, Lamprecht P, Gross WL. Advances in the therapy of Wegener's granulomatosis. Curr Opin Rheumatol. 2006 Jan; 18(1):25-32. [ Links ]
112. Jennette JC, Falk RJ, Andrassy K, Bacon PA, Churg J, Gross WL, et al. Nomenclature of systemic vasculitides. Proposal of an international consensus conference. Arthritis Rheum. 1994 Feb; 37(2):187-92. [ Links ]
113. De Groot K, Rasmussen N, Bacon PA, Tervaert JW, Feighery C, Gregorini G, et al. Randomized trial of cyclophosphamide versus methotrexate for induction of remission in early systemic antineutrophil cytoplasmic antibody-associated vasculitis. Arthritis Rheum. 2005 Aug; 52(8):2461-9. [ Links ]
114. Jayne D, Rasmussen N, Andrassy K, Bacon P, Tervaert J W, Dadoniene J, et al. A randomized trial of maintenance therapy for vasculitis associated with antineutrophil cytoplasmic autoantibodies. N Engl J Med. 2003 Jul 3; 349(1):36-44. [ Links ]
115. Hu W, Liu C, Xie H, Chen H, Liu Z, Li L. Mycophenolate mofetil versus cyclophosphamide for inducing remission of ANCA vasculitis with moderate renal involvement. Nephrol Dial Transplant. 2008 Apr; 23(4):1307-12. [ Links ]
116. Stassen PM, Tervaert JW, Stegeman CA. Induction of remission in active anti-neutrophil cytoplasmic antibody-associated vasculitis with mycophenolate mofetil in patients who cannot be treated with cyclophosphamide. Ann Rheum Dis. 2007 Jun; 66(6):798-802. [ Links ]
117. Fauci AS, Katz P, Haynes BF, Wolf SM. Cyclophosphamide therapy of severe systemic necrotizing vasculitis. N Engl J Med. 1979 Aug 2; 301(5):235-8. [ Links ]
118. Degesys GE, Mintzer RA, Vrla R F. Allergic granulomatosis: Churg-Strauss syndrome. AJR Am J Roentgenol. 1980 Dec; 135(6):1281-2. [ Links ]
119. Guillevin L, Fain O, Lhote F, Jarrousse B, Le Ti Huong D, Bussel A, et al. Lack of superiority of steroids plus plasma exchange to steroids alone in the treatment of polyarteritis nodosa and Churg-Strauss syndrome. A prospective, randomized trial in 78 patients. Arthritis Rheum. 1992 Feb; 35(2):208-15. [ Links ]
120. Gayraud M, Guillevin L, Cohen P, Lhote F, Cacoub P, Deblois P, et al. Treatment of good-prognosis polyarteritis nodosa and Churg-Strauss syndrome: comparison of steroids and oral or pulse cyclophosphamide in 25 patients. French Cooperative Study Group for Vasculitides. Br J Rheumatol. 1997 Dec; 36(12):1290-7. [ Links ]
121. Guillevin L, Lhote F, Gayraud M, Cohen P, Jarrousse B, Lortholary O, et al. Prognostic factors in polyarteritis nodosa and Churg-Strauss syndrome. A prospective study in 342 patients. Medicine (Baltimore). 1996 Jan; 75(1):17-28. [ Links ]
122. Shelhamer JH, Volkman DJ, Parrillo JE, Lawley TJ, Johnston MR, Fauci AS. Takayasu's arteritis and its therapy. Ann Intern Med. 1985 Jul; 103(1):121-6. [ Links ]
123. Houssiau FA, D'Cruz D P, Haga HJ, Hughes GR. Short course of weekly low-dose intravenous pulse cyclophosphamide in the treatment of lupus nephritis: a preliminary study. Lupus. 1991 Nov; 1(1):31-5. [ Links ]
124. Friedman G, Granot H, Koplovic Y, Friedlander M. 'Pulse' methylprednisolone and cyclophosphamide therapy in idiopathic rapidly progressive glomerulonephritis. Postgrad Med J. 1981 Jan; 57(663):54-6. [ Links ]
125. Gubner R, August S, Ginsberg V. Terapeutic suppression of tissue reactivity. II. Efect of aminopterin in rheumatoid arthritis and psoriasis. Am J Med Sci. 1951 Feb; 221(2):176-82. [ Links ]
126. Chow CC, Li EK, Lai FM. Allergic granulomatosis and angiitis (Churg-Strauss syndrome): response to 'pulse' intravenous cyclophosphamide. Ann Rheum Dis. 1989 Jul; 48(7):605-8. [ Links ]
127. Falk RJ, Hogan S, Carey TS, Jennette JC. Clinical course of anti-neutrophil cytoplasmic autoantibody-associated glomerulonephritis and systemic vasculitis. The Glomerular Disease Collaborative Network. Ann Intern Med. 1990 Nov 1; 113(9):656-63. [ Links ]
128. Reinhold-Keller E, Kekow J, Schnabel A, Schmitt WH, Heller M, Beigel A, et al. Influence of disease manifestation and antineutrophil cytoplasmic antibody titer on the response to pulse cyclophosphamide therapy in patients with Wegener's granulomatosis. Arthritis Rheum. 1994 Jun; 37(6):919-24. [ Links ]
129. Nachman PH JM, Melanie S, Hogan SL, Charles JJ, Falk RJ. Mycophenolate Mofetil (MMF): Preliminary results of a feasibility trial in relapsing ANCA small vessel vasculitis. Clin Exp Immunol. 2000; 72. [ Links ]
130. Martín-Suárez I, D'Cruz D, Mansoor M, Fernandes A P, Khamashta MA, Hughes GR. Immunosuppressive treatment in severe connective tissue diseases: efects of low dose intravenous cyclophosphamide. Ann Rheum Dis. 1997 Aug; 56(8):481-7. [ Links ]
131. Boki KA, Dafini U, Karpouzas GA, Papasteriades C, Drosos AA, Moutsopoulos HM. Necrotizing vasculitis in Greece: clinical, immunological and immunogenetic aspects. A study of 66 patients. Br J Rheumatol. 1997 Oct; 36(10):1059-66. [ Links ]
132. Adu D, Pall A, Luqmani RA, Richards NT, Howie AJ, Emery P, et al. Controlled trial of pulse versus continuous prednisolone and cyclophosphamide in the treatment of systemic vasculitis. Qjm. 1997 Jun; 90(6):401-9. [ Links ]
133. Guillevin L, Cordier J F, Lhote F, Cohen P, Jarrousse B, Royer I, et al. A prospective, multicenter, randomized trial comparing steroids and pulse cyclophosphamide versus steroids and oral cyclophosphamide in the treatment of generalized Wegener's granulomatosis. Arthritis Rheum. 1997 Dec; 40(12):2187-98. [ Links ]
134. Haubitz M, Schellong S, Gobel U, Schurek HJ, Schaumann D, Koch KM, et al. Intravenous pulse administration of cyclophosphamide versus daily oral treatment in patients with antineutrophil cytoplasmic antibody-associated vasculitis and renal involvement: a prospective, randomized study. Arthritis Rheum. 1998 Oct; 41(10):1835-44. [ Links ]
135. Wohlwill F. Veber die nur mikroskopisch erkennbare form der periarteritis nodosa. Virchows. Arch Path Anat Physiol Klin Med. 1923; 246:377-411. [ Links ]
136. Feehally J, Wheeler DC, Walls J, Jones S, Lockwood CM, Savage CO. A case of microscopic polyarteritis associated with antineutrophil cytoplasmic antibodies. Clin Nephrol. 1987 Apr; 27(4):214-5. [ Links ]
137. Jayne DR, Rasmussen N. Treatment of antineutrophil cytoplasm autoantibody-associated systemic vasculitis: initiatives of the European Community Systemic Vasculitis Clinical Trials Study Group. Mayo Clin. Proc. 1997 Aug; 72(8):737-47. [ Links ]
138. Hagen EC. Development and standardization of solid-phase assays for the detection of antineutrophil cytoplasmic antibodies (ANCA) for clinical application: report of a large clinical evaluation study. Clin Exp Immunol. 1995 Jul; 101 Suppl 1:29. [ Links ]
139. de Groot K, Harper L, Jayne DR, Flores Suárez L F, Gregorini G, Gross WL, et al. Pulse versus daily oral cyclo-phosphamide for induction of remission in antineutrophil cytoplasmic antibody-associated vasculitis: a randomized trial. Ann Intern Med. 2009 May 19; 150(10):670-80. [ Links ]
140. de Groot K, Adu D, Savage CO. The value of pulse cyclo-phosphamide in ANCA-associated vasculitis: meta-analysis and critical review. Nephrol Dial Transplant. 2001 Oct; 16(10):2018-27. [ Links ]
141. Allison JH, Bettley FR. Rheumatoid arthritis with chronic leg ulceration. Lancet. 1957 Feb 9; 272(6963):288-90. [ Links ]
142. Espinoza LR, Espinoza CG, Vasey FB, Germain B F. Oral methotrexate therapy for chronic rheumatoid arthritis ulcerations. J Am Acad Dermatol. 1986 Sep; 15(3):508-12. [ Links ]
143. Capizzi RL, Bertino JR. Methotrexate therapy of Wegener's granulomatosis. Ann Intern Med. 1971 Jan; 74(1):74-9. [ Links ]
144. Fraga A, Mintz G, Orozco J. Immunosuppressive therapy in connective tissue disease other than rheumatoid arthritis. J Rheumatol. 1974:1-374. [ Links ]
145. Tannenbaum H. Combined therapy with methotrexate and prednisone in polyarteritis nodosa. Can Med Assoc J. 1980 Nov 8; 123(9):893-4. [ Links ]
146. Guillevin L, Mahr A, Callard P, Godmer P, Pagnoux C, Leray E, et al. Hepatitis B virus-associated polyarteritis nodosa: clinical characteristics, outcome, and impact of treatment in 115 patients. Medicine (Baltimore). 2005 Sep; 84(5):313-22. [ Links ]
147. Boehm I, Bauer R. Low-dose methotrexate controls a severe form of polyarteritis nodosa. Arch Dermatol. 2000 Feb; 136(2):167-9. [ Links ]
148. Schartz NE, Alaoui S, Vignon-Pennamen MD, Cordoliani F, Fermand J P, Morel P, et al. Successful treatment in two cases of steroid-dependent cutaneous polyarteritis nodosa with low-dose methotrexate. Dermatology. 2001; 203(4):336-8. [ Links ]
149. Hofman GS, Leavitt RY, Kerr GS, Fauci AS. The treatment of Wegener's granulomatosis with glucocorticoids and methotrexate. Arthritis Rheum. 1992 Nov; 35(11):1322-9. [ Links ]
150. Sneller MC, Hofman GS, Talar-Williams C, Kerr GS, Hallahan CW, Fauci AS. An analysis of forty-two Wegener's granulomatosis patients treated with methotrexate and prednisone. Arthritis Rheum. 1995 May; 38(5):608-13. [ Links ]
151. de Groot K, Muhler M, Reinhold-Keller E, Paulsen J, Gross WL. Induction of remission in Wegener's granulomatosis with low dose methotrexate. J Rheumatol. 1998 Mar; 25(3):492-5. [ Links ]
152. Stone JH, Tun W, Hellman DB. Treatment of non-life threatening Wegener's granulomatosis with methotrexate and daily prednisone as the initial therapy of choice. J Rheumatol. 1999 May; 26(5):1134-9. [ Links ]
153. Metzler C, Hellmich B, Gause A, Gross WL, de Groot K. Churg Strauss syndrome--successful induction of remission with methotrexate and unexpected high cardiac and pulmonary relapse ratio during maintenance treatment. Clin Exp Rheumatol. 2004; 22(6 Suppl 36):S52-61. [ Links ]
154. Langford CA, Sneller MC, Hofman GS. Methotrexate use in systemic vasculitis. Rheum Dis Clin North Am. 1997 Nov; 23(4):841-53. [ Links ]
155. de Groot K, Reinhold-Keller E, Tatsis E, Paulsen J, Heller M, Nolle B, et al. Terapy for the maintenance of remission in sixty-five patients with generalized Wegener's granulomatosis. Methotrexate versus trimethoprim/sulfamethoxazole. Arthritis Rheum. 1996 Dec; 39(12):2052-61. [ Links ]
156. Langford CA, Talar-Williams C, Barron KS, Sneller MC. A staged approach to the treatment of Wegener's granulomatosis: induction of remission with glucocorticoids and daily cyclophosphamide switching to methotrexate for remission maintenance. Arthritis Rheum. 1999 Dec; 42(12):2666-73. [ Links ]
157. Langford CA, Talar-Williams C, Sneller MC. Use of methotrexate and glucocorticoids in the treatment of Wegener's granulomatosis. Long-term renal outcome in patients with glomerulonephritis. Arthritis Rheum. 2000 Aug; 43(8):1836-40. [ Links ]
158. Langford CA, Talar-Williams C, Barron KS, Sneller MC. Use of a cyclophosphamide-induction methotrexate-maintenance regimen for the treatment of Wegener's granulomatosis: extended follow-up and rate of relapse. Am J Med. 2003 Apr 15; 114(6):463-9. [ Links ]
159. Reinhold-Keller E, Fink CO, Herlyn K, Gross WL, De Groot K. High rate of renal relapse in 71 patients with Wegener's granulomatosis under maintenance of remission with low-dose methotrexate. Arthritis Rheum. 2002 Jun 15; 47(3):326-32. [ Links ]
160. Krall PL, Mazanec DJ, Wilke WS. Methotrexate for corticosteroid-resistant polymyalgia rheumatica and giant cell arteritis. Cleve Clin J Med. 1989 May; 56(3):253-7. [ Links ]
161. Hernández-García C, Soriano C, Morado C, Ramos P, Fernández-Gutiérrez B, Herrero M, et al. Methotrexate treatment in the management of giant cell arteritis. Scand J Rheumatol. 1994; 23(6):295-8. [ Links ]
162. van der Veen MJ, Dinant HJ, van Booma-Frankfort C, van Albada-Kuipers GA, Bijlsma JW. Can methotrexate be used as a steroid sparing agent in the treatment of polymyalgia rheumatica and giant cell arteritis?. Ann Rheum Dis. 1996 Apr; 55(4):218-23. [ Links ]
163. Spiera R F, Mitnick HJ, Kupersmith M, Richmond M, Spiera H, Peterson MG, et al. A prospective, double-blind, randomized, placebo controlled trial of methotrexate in the treatment of giant cell arteritis (GCA). Clin Exp Rheumatol. 2001 Sep-Oct; 19(5):495-501. [ Links ]
164. Jover JA, Hernández-García C, Morado IC, Vargas E, Banares A, Fernández-Gutiérrez B. Combined treatment of giant-cell arteritis with methotrexate and prednisone. a randomized, double-blind, placebo-controlled trial. Ann Intern Med. 2001 Jan 16; 134(2):106-14. [ Links ]
165. Hofman GS, Cid MC, Hellmann DB, Guillevin L, Stone JH, Schousboe J, et al. A multicenter, randomized, double-blind, placebo-controlled trial of adjuvant methotrexate treatment for giant cell arteritis. Arthritis Rheum. 2002 May; 46(5):1309-18. [ Links ]
166. Mahr AD, Jover JA, Spiera R F, Hernández-García C, Fernández-Gutiérrez B, Lavalley M P, et al. Adjunctive methotrexate for treatment of giant cell arteritis: an individual patient data meta-analysis. Arthritis Rheum. 2007 Aug; 56(8):2789-97. [ Links ]
167. Mukhtyar C, Guillevin L, Cid MC, Dasgupta B, de Groot K, Gross W, et al. EULAR recommendations for the management of large vessel vasculitis. Ann Rheum Dis. 2009 Mar; 68(3):318-23. [ Links ]
168. Liang GC, Nemickas R, Madayag M. Multiple percutaneous transluminal angioplasties and low dose pulse methotrexate for Takayasu's arteritis. J Rheumatol. 1989 Oct; 16(10):1370-3. [ Links ]
169. Mevorach D, Leibowitz G, Brezis M, Raz E. Induction of remission in a patient with Takayasu's arteritis by low dose pulses of methotrexate. Ann Rheum Dis. 1992 Jul; 51(7):904-5. [ Links ]
170. Hofman GS, Leavitt RY, Kerr GS, Rottem M, Sneller MC, Fauci AS. Treatment of glucocorticoid-resistant or relapsing Takayasu arteritis with methotrexate. Arthritis Rheum. 1994 Apr; 37(4):578-82. [ Links ]
171. Bouroncle BA, Smith EJ, Cuppage FE. Treatment of Wegener's granulomatosis with Imuran. Am J Med. 1967 Feb; 42(2):314-8. [ Links ]
172. Kaplan SR, Hayslett J P, Calabresi P. Treatment of advanced Wegener's granulomatosis with azathioprine and dua-zomycin A. N Engl J Med. 1968 Feb 1; 278(5):239-44. [ Links ]
173. Norton WL, Suki W, Strunk S. Combined corticosteroid and azathioprine therapy in 2 patients with Wegener's granulomatosis. Arch Intern Med. 1968 Jun; 121(6):554-60. [ Links ]
174. Elsner B, Harper FB. Disseminated Wegener's granulomatosis with breast involvement. Report of a case. Arch Pathol. 1969 May; 87(5):544-7. [ Links ]
175. Choy DS, Gould WJ, Gearhart R P, Sauer J. Remission in Wegener's granulomatosis treated with steroids and azathioprine. N Y State J Med. 1969 May 1; 69(9):1205-9. [ Links ]
176. Peermohamed AR, Shafar J. Sustained azathioprine-induced remission in Wegener's granulomatosis. Br Med J. 1969 Dec 6; 4(5683):600-1. [ Links ]
177. Cooper BJ, Bacal E, Patterson R. Allergic angiitis and granulomatosis. Prolonged remission induced by combined prednisone--azathioprine therapy. Arch Intern Med. 1978 Mar; 138(3):367-71. [ Links ]
178. Lanham JG, Elkon KB, Pusey CD, Hughes GR. Systemic vasculitis with asthma and eosinophilia: a clinical approach to the Churg-Strauss syndrome. Medicine (Baltimore). 1984 Mar; 63(2):65-81. [ Links ]
179. Parry R, Sherwin S, Fletcher V, Medcalf P. ANCA-associated vasculitis: diagnosis and treatment in the elderly. Postgrad Med J. 1996 Jul; 72(849):423-6. [ Links ]
180. Slot MC, Tervaert JW, Boomsma MM, Stegeman CA. Positive classic antineutrophil cytoplasmic antibody (C-ANCA) titer at switch to azathioprine therapy associated with relapse in proteinase 3-related vasculitis. Arthritis Rheum. 2004 Apr 15; 51(2):269-73. [ Links ]
181. Pagnoux C, Mahr A, Hamidou MA, Bofa JJ, Ruivard M, Ducroix J P, et al. Azathioprine or methotrexate maintenance for ANCA-associated vasculitis. N Engl J Med. 2008 Dec 25; 359(26):2790-803. [ Links ]
182. De Silva M, Hazleman BL. Azathioprine in giant cell arteritis/polymyalgia rheumatica: a double-blind study. Ann Rheum Dis. 1986 Feb; 45(2):136-8. [ Links ]
183. Kerr GS, Hallahan CW, Giordano J, Leavitt RY, Fauci AS, Rottem M, et al. Takayasu arteritis. Ann Intern Med. 1994 Jun 1; 120(11):919-29. [ Links ]
184. Cybulska I. [Takayasu's arteritis--course, diagnosis and long term results of treatment]. Pol Arch Med Wewn. 1994 Jun; 91(6):451-60. [ Links ]
185. Valsakumar AK, Valappil UC, Jorapur V, Garg N, Nityanand S, Sinha N. Role of immunosuppressive therapy on clinical, immunological, and angiographic outcome in active Takayasu's arteritis. J Rheumatol. 2003 Aug; 30(8):1793-8. [ Links ]
186. Weaver FA, Yellin AE. Surgical treatment of Takayasu arteritis. Heart Vessels Suppl. 1992; 7:154-8. [ Links ]
187. van der Woude FJ. Mycophenolate mofetil (RS 61443): nothing new under the sun or an important break-through in the feld of transplantation?. Nephrol Dial Transplant. 1995; 10(7):1112-5. [ Links ]
188. Allison AC, Eugui EM. Immunosuppressive and other efects of mycophenolic acid and an ester prodrug, myco-phenolate mofetil. Immunol Rev. 1993 Dec; 136:5-28. [ Links ]
189. Allison AC, Eugui EM. The design and development of an immunosuppressive drug, mycophenolate mofetil. Springer Semin Immunopathol. 1993; 14(4):353-80. [ Links ]
190. Placebo-controlled study of mycophenolate mofetil combined with cyclosporin and corticosteroids for prevention of acute rejection. European Mycophenolate Mofetil Cooperative Study Group. Lancet. 1995 May 27; 345(8961):1321-5. [ Links ]
191. Goldblum R. Terapy of rheumatoid arthritis with myco-phenolate mofetil. Clin Exp Rheumatol. 1993 Mar-Apr; 11 Suppl 8:S117-9. [ Links ]
192. Nowack R, Birck R, van der Woude FJ. Mycophenolate mofetil for systemic vasculitis and IgA nephropathy. Lan-cet. 1997 Mar 15; 349(9054):774. [ Links ]
193. Nowack R, Gobel U, Klooker P, Hergesell O, Andrassy K, van der Woude FJ. Mycophenolate mofetil for maintenance therapy of Wegener's granulomatosis and microscopic polyangiitis: a pilot study in 11 patients with renal involvement. J Am Soc Nephrol. 1999 Sep; 10(9):1965-71. [ Links ]
194. Haidinger M NI, Jager H, Grutzmacher H, Bayer P, Meisl F. Mycophenolate Mofetil (MMF) treatment of ANCA-associated small-vessel vasculitis: A pharmacokinetically controlled study. Proceedings of the 9th International ANCA Workshop 2000; Groningen, The Netherlands: Clin Exp Immunol; 2000. p. 12-5. [ Links ]
195. Le Hello C, Bonte I, Mora JJ, Verneuil L, Noel LH, Guillevin L. Pyoderma gangrenosum associated with Wegener's granulomatosis: partial response to mycophenolate mofetil. Rheumatology (Oxford). 2002 Feb; 41(2):236-7. [ Links ]
196. Haubitz M, de Groot K. Tolerance of mycophenolate mofetil in end-stage renal disease patients with ANCA-associated vasculitis. Clin Nephrol. 2002 Jun; 57(6):421-4. [ Links ]
197. Assaf C, Mewis G, Orfanos CE, Geilen CC. Churg-Strauss syndrome: successful treatment with mycophenolate mofetil. Br J Dermatol. 2004 Mar; 150(3):598-600. [ Links ]
198. Waiser J, Budde K, Braasch E, Neumayer HH. Treatment of acute c-ANCA-positive vasculitis with mycophenolate mofetil. Am J Kidney Dis. 1999 Sep; 34(3):e9. [ Links ]
199. Langford CA, Talar-Williams C, Sneller MC. Mycophenolate mofetil for remission maintenance in the treatment of Wegener's granulomatosis. Arthritis Rheum. 2004 Apr 15; 51(2):278-83. [ Links ]
200. Joy MS, Hogan SL, Jennette JC, Falk RJ, Nachman PH. A pilot study using mycophenolate mofetil in relapsing or resistant ANCA small vessel vasculitis. Nephrol Dial Transplant. 2005 Dec; 20(12):2725-32. [ Links ]
201. Koukoulaki M, Jayne DR. Mycophenolate mofetil in anti-neutrophil cytoplasm antibodies-associated systemic vasculitis. Nephron Clin Pract. 2006; 102(3-4):c100-7. [ Links ]
202. Hiemstra T F, Walsh M, Mahr A, Savage CO, de Groot K, Harper L, et al. Mycophenolate mofetil vs. azathioprine for remission maintenance in antineutrophil cytoplasmic antibody-associated vasculitis: a randomized controlled trial. JAMA. 2010 Dec 1; 304(21):2381-8. [ Links ]
203. Ahsan N, Holman MJ, Katz DA, Abendroth CS, Yang HC. Successful reversal of acute vascular rejection in a renal allograft with combined mycophenolate mofetil and tacrolimus as primary immunotherapy. Clin Transplant. 1997 Apr; 11(2):94-7. [ Links ]
204. Hu W, Liu Z, Chen H, Tang Z, Wang Q, Shen K, et al. Mycophenolate mofetil vs. cyclophosphamide therapy for patients with difuse proliferative lupus nephritis. Chin Med J (Engl). 2002 May; 115(5):705-9. [ Links ]
205. Hu WX TZ, Cheng, Z et al. Mycophenolate mofetil for type III crescentic glomerulonephritis. Chin J Nephrol Dial Transplant. 1999; 8:323-6. [ Links ]
206. Silva F, Specks U, Kalra S, Hogan MC, Leung N, Sethi S, et al. Mycophenolate mofetil for induction and maintenance of remission in microscopic polyangiitis with mild to moderate renal involvement--a prospective, open-label pilot trial. Clin J Am Soc Nephrol. 2010 Mar; 5(3):445-53. [ Links ]
207. D'Cruz D P. Mycophenolate mofetil in systemic vasculitis. Lupus. 2005; 14 Suppl 1:s55-7. [ Links ]
208. Woywodt A, Choi M, Schneider W, Kettritz R, Gobel U. Cytomegalovirus colitis during mycophenolate mofetil therapy for Wegener's granulomatosis. Am J Nephrol. 2000 Nov-Dec; 20(6):468-72. [ Links ]
209. Daina E, Schieppati A, Remuzzi G. Mycophenolate mofetil for the treatment of Takayasu arteritis: report of three cases. Ann Intern Med. 1999 Mar 2; 130(5):422-6. [ Links ]
210. Shinjo SK, Pereira RM, Tizziani VA, Radu AS, Levy-Neto M. Mycophenolate mofetil reduces disease activity and steroid dosage in Takayasu arteritis. Clin Rheumatol. 2007 Nov; 26(11):1871-5. [ Links ]
211. Goel R, Danda D, Mathew J, Edwin N. Mycophenolate mofetil in Takayasu's arteritis. Clin Rheumatol. 2010 Mar; 29(3):329-32. [ Links ]
212. Adler YD, Mansmann U, Zouboulis CC. Mycophenolate mofetil is inefective in the treatment of mucocutaneous Adamantiades-Behcet's disease. Dermatology. 2001; 203(4):322-4. [ Links ]
213. Worm M, Sterry W, Kolde G. Mycophenolate mofetil is efective for maintenance therapy of hypocomplementaemic urticarial vasculitis. Br J Dermatol. 2000 Dec; 143(6):1324. [ Links ]
214. Ramos-Casals M, Loustaud-Ratti V,. ZM. Hepatitits C virus and autoimmune diseases. Barcelona: Masson; 2005. [ Links ]
215. Di Bisceglie AM, McHutchison J, Rice CM. New therapeutic strategies for hepatitis C. Hepatology. 2002 Jan; 35(1):224-31. [ Links ]
216. Ramos-Casals M, Font J. Mycophenolate mofetil in patients with hepatitis C virus infection. Lupus. 2005; 14 Suppl 1:s64-72. [ Links ]
217. Ierardi E, Rendina M, Francavilla R, Barone M, Castellaneta A, Panella C, et al. Mycophenolate mofetil in the treatment of autoimmune HCV-associated haematological disorders showing steroid resistance or dependence. J Viral Hepat. 2003 Sep; 10(5):390-3. [ Links ]
218. Reed MJ, Alexander GJ, Tiru S, Smith KG. Hepatitis C-associated glomerulonephritis--a novel therapeutic approach. Nephrol Dial Transplant. 2001 Apr; 16(4):869-71. [ Links ]
219. Caponnetto C, Rossi E, Primavera A. Mycophenolate mofetil: a new immunosuppressive approach. Successful treatment in a case of myasthenia gravis associated with incomplete lupus erythematosus syndrome and hepatitis C virus infection. Eur Neurol. 2001; 46(1):53-4. [ Links ]
220. Keogh KA, Wylam ME, Stone JH, Specks U. Induction of remission by B lymphocyte depletion in eleven patients with refractory antineutrophil cytoplasmic antibody-associated vasculitis. Arthritis Rheum. 2005 Jan; 52(1):262-8. [ Links ]
221. Silverman GJ, Weisman S. Rituximab therapy and autoimmune disorders: prospects for anti-B cell therapy. Arthritis Rheum. 2003 Jun; 48(6):1484-92. [ Links ]
222. Specks U, Fervenza FC, McDonald TJ, Hogan MC. Response of Wegener's granulomatosis to anti-CD20 chimeric monoclonal antibody therapy. Arthritis Rheum. 2001 Dec; 44(12):2836-40. [ Links ]
223. Eriksson P. Short-term outcome and safety in 5 patients with ANCA-positive vasculitis treated with rituximab. [abstract]. 2003 Kidney Blood Press Res; 26:294. [ Links ]
224. Jayne D, Burns S, Smith K. B-cell depletion with rituximab for refractory vasculitis. Kidney Blood Press Res. 2003; 26:294. [ Links ]
225. Brihaye B, Aouba A, Pagnoux C, Cohen P, Lacassin F, Guillevin L. Adjunction of rituximab to steroids and immunosuppressants for refractory/relapsing Wegener's granulomatosis: a study on 8 patients. Clin Exp Rheumatol. 2007 Jan-Feb; 25(1 Suppl 44):S23-7. [ Links ]
226. Eriksson P. Nine patients with anti-neutrophil cytoplasmic antibody-positive vasculitis successfully treated with rituximab. J Intern Med. 2005 Jun; 257(6):540-8. [ Links ]
227. Stasi R, Stipa E, Del Poeta G, Amadori S, Newland AC, Provan D. Long-term observation of patients with anti-neutrophil cytoplasmic antibody-associated vasculitis treated with rituximab. Rheumatology (Oxford). 2006 Nov; 45(11):1432-6. [ Links ]
228. Keogh KA, Ytterberg SR, Fervenza FC, Carlson KA, Schroeder DR, Specks U. Rituximab for refractory Wegener's granulomatosis: report of a prospective, open-label pilot trial. Am J Respir Crit Care Med. 2006 Jan 15; 173(2):180-7. [ Links ]
229. Stone JH, Merkel PA, Spiera R, Seo P, Langford CA, Hofman GS, et al. Rituximab versus cyclophosphamide for ANCA-associated vasculitis. N Engl J Med. 2010 Jul 15; 363(3):221-32. [ Links ]
230. Cartin-Ceba R, Keogh KA, Specks U, Sethi S, Fervenza FC. Rituximab for the treatment of Churg-Strauss syndrome with renal involvement. Nephrol Dial Transplant. 2011 Sep; 26(9):2865-71. [ Links ]
231. Zaja F, De Vita S, Mazzaro C, Sacco S, Damiani D, De Marchi G, et al. Efcacy and safety of rituximab in type II mixed cryoglobulinemia. Blood. 2003 May 15; 101(10):3827-34. [ Links ]
232. Sansonno D, De Re V, Lauletta G, Tucci FA, Boiocchi M, Dammacco F. Monoclonal antibody treatment of mixed cryoglobulinemia resistant to interferon alpha with an anti-CD20. Blood. 2003 May 15; 101(10):3818-26. [ Links ]
233. Cacoub P, Delluc A, Saadoun D, Landau DA, Sene D. Anti-CD20 monoclonal antibody (rituximab) treatment for cryoglobulinemic vasculitis: where do we stand? Ann Rheum Dis. 2008 Mar; 67(3):283-7. [ Links ]
234. Hassard PV, Binder SW, Nelson V, Vasiliauskas EA. Antitumor necrosis factor monoclonal antibody therapy for gastrointestinal Behcet's disease: a case report. Gastroenterology. 2001 Mar; 120(4):995-9. [ Links ]
235. Robertson L P, Hickling P. Treatment of recalcitrant oro-genital ulceration of Behcet's syndrome with infiximab. Rheumatology (Oxford). 2001 Apr; 40(4):473-4. [ Links ]
236. Goossens PH, Verburg RJ, Breedveld FC. Remission of Behcet's syndrome with tumour necrosis factor alpha blocking therapy. Ann Rheum Dis. 2001 Jun; 60(6):637. [ Links ]
237. Stone JH, Uhlfelder ML, Hellmann DB, Crook S, Bedocs NM, Hofman GS. Etanercept combined with conventional treatment in Wegener's granulomatosis: a six-month open-label trial to evaluate safety. Arthritis Rheum. 2001 May; 44(5):1149-54. [ Links ]
238. Levine SM, Stone JH. New approaches to treatment in systemic vasculitis: biological therapies. Best Pract Res Clin Rheumatol. 2001 Jun; 15(2):315-33. [ Links ]
239. Booth AD, Jeferson HJ, Aylife W, Andrews PA, Jayne DR. Safety and efcacy of TNFalpha blockade in relapsing vasculitis. Ann Rheum Dis. 2002 Jun; 61(6):559. [ Links ]
240. Lamprecht P, Voswinkel J, Lilienthal T, Nolle B, Heller M, Gross WL, et al. Efectiveness of TNF-alpha blockade with infiximab in refractory Wegener's granulomatosis. Rheumatology (Oxford). 2002 Nov; 41(11):1303-7. [ Links ]
241. Arbach O, Gross WL, Gause A. Treatment of refractory Churg-Strauss-Syndrome (CSS) by TNF-alpha blockade. Immunobiology. 2002 Dec; 206(5):496-501. [ Links ]
242. Booth A, Harper L, Hammad T, Bacon P, Grifth M, Levy J, et al. Prospective study of TNFalpha blockade with infiximab in anti-neutrophil cytoplasmic antibody-associated systemic vasculitis. J Am Soc Nephrol. 2004 Mar; 15(3):717-21. [ Links ]
243. Chandesris MO, Gayet S, Schleinitz N, Doudier B, Harle JR, Kaplanski G. Infiximab in the treatment of refractory vasculitis secondary to hepatitis C-associated mixed cryoglobulinaemia. Rheumatology (Oxford). 2004 Apr; 43(4):532-3. [ Links ]
244. Hofman GS, Merkel PA, Brasington RD, Lenschow DJ, Liang P. Anti-tumor necrosis factor therapy in patients with difcult to treat Takayasu arteritis. Arthritis Rheum. 2004 Jul; 50(7):2296-304. [ Links ]
245. Group WsGETWR. Etanercept plus standard therapy for Wegener's granulomatosis. N Engl J Med. 2005 Jan 27; 352(4):351-61. [ Links ]
246. Sangle SR, Hughes GR, D'Cruz D P. Infiximab in patients with systemic vasculitis that is difcult to treat: poor outcome and signifcant adverse efects. Ann Rheum Dis. 2007 Apr; 66(4):564-5. [ Links ]
247. Huugen D, Tervaert JW, Heeringa P. TNF-alpha bioactivity-inhibiting therapy in ANCA-associated vasculitis: clinical and experimental considerations. Clin J Am Soc Nephrol. 2006 Sep; 1(5):1100-7. [ Links ]
248. Martínez-Taboada VM, Rodríguez-Valverde V, Carreño L, López-Longo J, Figueroa M, Belzunegui J, et al. A double-blind placebo controlled trial of etanercept in patients with giant cell arteritis and corticosteroid side efects. Ann Rheum Dis. 2008 May; 67(5):625-30. [ Links ]
249. Nishimoto N, Nakahara H, Yoshio-Hoshino N, Mima T. Successful treatment of a patient with Takayasu arteritis using a humanized anti-interleukin-6 receptor antibody. Arthritis Rheum. 2008 Apr; 58(4):1197-200. [ Links ]
250. Laurino S, Chaudhry A, Booth A, Conte G, Jayne D. Prospective study of TNFalpha blockade with adalimumab in ANCA-associated systemic vasculitis with renal involvement. Nephrol Dial Transplant. 2010 Oct; 25(10):3307-14. [ Links ]
251. Cantini F, Niccoli L, Salvarani C, Padula A, Olivieri I. Treatment of longstanding active giant cell arteritis with infiximab: report of four cases. Arthritis Rheum. 2001 Dec; 44(12):2933-5. [ Links ]
252. Tan AL, Holdsworth J, Pease C, Emery P, McGonagle D. Successful treatment of resistant giant cell arteritis with etanercept. Ann Rheum Dis. 2003 Apr; 62(4):373-4. [ Links ]
253. Hofman GS, Cid MC, Rendt-Zagar KE, Merkel PA, Weyand CM, Stone JH, et al. Infiximab for maintenance of glucocorticosteroid-induced remission of giant cell arteritis: a randomized trial. Ann Intern Med. 2007 May 1; 146(9):621-30. [ Links ]
254. Jayne DR, Gaskin G, Rasmussen N, Abramowicz D, Ferrario F, Guillevin L, et al. Randomized trial of plasma exchange or high-dosage methylprednisolone as adjunctive therapy for severe renal vasculitis. J Am Soc Nephrol. 2007 Jul; 18(7):2180-8. [ Links ]
255. Jones RB, Tervaert JW, Hauser T, Luqmani R, Morgan MD, Peh CA, et al. Rituximab versus cyclophosphamide in ANCA-associated renal vasculitis. N Engl J Med. 2010 Jul 15; 363(3):211-20. [ Links ]
256. Mima T, Nishimoto N. Clinical value of blocking IL-6 receptor. Curr Opin Rheumatol. 2009 May; 21(3):224-30. [ Links ]
257. Ogata A, Tanaka T. Tocilizumab for the treatment of rheumatoid arthritis and other systemic autoimmune diseases: current perspectives and future directions. Int J Rheumatol. 2012 946048. [ Links ]
258. Hernández-Rodríguez J, Segarra M, Vilardell C, Sánchez M, García-Martínez A, Esteban MJ, et al. Tissue production of pro-infammatory cytokines (IL-1beta, TNFalpha and IL-6) correlates with the intensity of the systemic infammatory response and with corticosteroid requirements in giant-cell arteritis. Rheumatology (Oxford). 2004 Mar; 43(3):294-301. [ Links ]
259. García-Martínez A, Hernández-Rodríguez J, Espigol-Frigole G, Prieto-González S, Butjosa M, Segarra M, et al. Clinical relevance of persistently elevated circulating cyto-kines (tumor necrosis factor alpha and interleukin-6) in the long-term followup of patients with giant cell arteritis. Arthritis Care Res (Hoboken). 2010 Jun; 62(6):835-41. [ Links ]
260. Park MC, Lee SW, Park YB, Lee SK. Serum cytokine profles and their correlations with disease activity in Takayasu's arteritis. Rheumatology (Oxford). 2006 May; 45(5):545-8. [ Links ]
261. Salvarani C, Magnani L, Catanoso MG, Pipitone N, Versari A, Dardani L, et al. Rescue treatment with tocilizumab for Takayasu arteritis resistant to TNF-alpha blockers. Clin Exp Rheumatol. 2012 Feb 27. [ Links ]
262. Vinit J, Bielefeld P, Muller G, Besancenot J F. Efcacy of tocilizumab in refractory giant cell arteritis. Joint Bone Spine. 2012 Jan 25. [ Links ]
263. Seitz M, Reichenbach S, Bonel HM, Adler S, Wermelinger F, Villiger PM. Rapid induction of remission in large vessel vasculitis by IL-6 blockade. A case series. Swiss Med Wkly. 2011; 141:w13156. [ Links ]
264. Salvarani C, Magnani L, Catanoso M, Pipitone N, Versari A, Dardani L, et al. Tocilizumab: a novel therapy for patients with large-vessel vasculitis. Rheumatology (Oxford). 2012 Jan; 51(1):151-6. [ Links ]
265. Schafer VS, Zwerina J. Biologic treatment of large-vessel vasculitides. Curr Opin Rheumatol. 2011 Jan; 24(1):31-7. [ Links ]
266. Rihova Z, Jancova E, Merta M, Zabka J, Rysava R, Bartunkova J, et al. Daily oral versus pulse intravenous cyclophosphamide in the therapy of ANCA-associated vasculitis--preliminary single center experience. Prague Med Rep. 2004; 105(1):64-8. [ Links ]
267. Cohen P, Pagnoux C, Mahr A, Arene J P, Mouthon L, Le Guern V, et al. Churg-Strauss syndrome with poor-prognosis factors: A prospective multicenter trial comparing glucocorticoids and six or twelve cyclophosphamide pulses in forty-eight patients. Arthritis Rheum. 2007 May 15; 57(4):686-93. [ Links ]
268. Metzler C, Miehle N, Manger K, Iking-Konert C, de Groot K, Hellmich B, et al. Elevated relapse rate under oral methotrexate versus lefunomide for maintenance of remission in Wegener's granulomatosis. Rheumatology (Oxford). 2007 Jul; 46(7):1087-91. [ Links ]
269. Hayreh SS, Zimmerman B, Kardon RH. Visual improvement with corticosteroid therapy in giant cell arteritis. Report of a large study and review of literature. Acta Ophthalmol Scand. 2002 Aug; 80(4):355-367. [ Links ]













