Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista Colombiana de Reumatología
Print version ISSN 0121-8123
Rev.Colomb.Reumatol. vol.19 no.4 Bogotá Oct./Dec. 2012
INVESTIGACIÓN ORIGINAL
Rituximab en población pediátrica: experiencia en el tratamiento de enfermedades reumatológicas, en un hospital infantil de Medellín, Colombia
Rituximab in pediatric population: Experience of rheumatic diseases treatment in a children's hospital in Medellín, Colombia
Carolina Muñoz Grajales1, Mónica Patricia Velásquez Mendez2
1Sección de Reumatología. Departamento de Medicina Interna. Hospital Universitario de San Vicente Fundación. Medellín. Colombia.
2Departamento de Pediatría. Sección de Reumatología. Hospital Infantil. Hospital Universitario de San Vicente Fundación. Medellín. Colombia
Correspondencia: Carolina Muñoz: carito_mg_sp@yahoo.com
Los autores declaran no presentar ningún conflicto de interés al momento de la redacción del manuscrito.
Recibido: 21 de octubre de 2012 Aceptado: 30 de noviembre de 2012
Resumen
Introducción: En niños, diferentes series han encontrado que rituximab es eficaz y seguro en trombocitopenia y anemia hemolítica autoinmunes; no obstante, los estudios en lupus eritematoso sistémico (LES) de inicio temprano, dermatomiositis juvenil (DMJ) y en vasculitis sistémicas son escasos.
Objetivo y métodos : Describir la respuesta clínica a rituximab en pacientes ≤18 años con enfermedad reumatológica, evaluados en un hospital infantil de Medellín, Colombia. Serie de casos en la que se revisó la historia clínica de pacientes con LES, síndrome antifosfolípido, DMJ y vasculitis sistémicas que recibieron rituximab entre enero de 2006 y julio de 2011.
Resultados: En el tiempo establecido 19 pacientes ≤18 años recibieron rituximab. La indicación más frecuente fue nefritis lúpica (NL) (47,4%), seguida por trombocitopenia autoinmune (26,3%). En pacientes con NL se lograron reducir los esteroides en 58% y el control de la proteinuria en la mayoría de los casos. En trombocitopenia o anemia hemolítica autoinmune se observó respuesta adecuada en el 83%. En los casos de vasculitis se encontró respuesta a la terapia pero la paciente con DMJ fue refractaria. No se presentaron eventos adversos.
Conclusiones: con rituximab se observó mejoría en anemia hemolítica asociada a LES y trombocitopenia asociada a LES o síndrome antifosfolípido, que no habían respondido a terapia de primera línea. Aunque en NL mostró efecto clínico favorable y permitió ahorro de dosis de esteroides, se requieren estudios prospectivos para evaluar la utilidad en pacientes con NL ≤18 años.
Palabras clave: Rituximab, niños, enfermedad reumatológica.
Summary
Introduction: Different series have found that rituximab is effective and safe in thrombocytopenia and autoimmune hemolytic anemia in children, however studies in early onset systemic lupus erythematosus (SLE), juvenile dermatomyositis and vasculitis are scarce.
Objective and Methods: Describe the clinical response to rituximab in patients ≤18 years with rheumatic disease, evaluated in a pediatric hospital in the city of Medellín, Colombia. Cross sectional study in which we reviewed the medical records of patients with SLE, antiphospholipid syndrome, vasculitis and juvenile dermatomyositis that receiving rituximab between january 2006 and july 2011.
Results:19 patients ≤18 years received rituximab. The most common indication was lupus nephritis (LN) (47.4%), followed by autoimmune thrombocytopenia (26.3%). In patients with LN steroids was reduced by 58% and control of proteinuria in most cases. In autoimmune hemolytic anemia and thrombocytopenia adequate response was observed in 83%. The case of vasculitis was found response to therapy and the patient with juvenile dermatomyositis was refractory. No adverse events were reported.
Conclusions: improvement was observed with rituximab in SLE-associated hemolytic anemia and thrombocytopenia associated with SLE and antiphospholipid syndrome, who had not responded to first-line therapy. Although LN showed favorable clinical effect and saving allowed dose steroids, prospective studies are required to evaluate utility in patients with LN ≤18.
Key words: Rituximab, children, rheumatic disease.
Introducción
El manejo de enfermedades autoinmunes graves y refractarias en niños representa un reto, no sólo por la morbilidad derivada de la enfermedad, sino también por la toxicidad a medicamentos y las infecciones a las que se ven expuestos los pacientes. Los linfocitos B tienen un papel central en el desarrollo de algunas enfermedades autoinmunes, ya que, además de ser productores de anticuerpos, funcionan como células presentadoras de antígeno y proporcionan coestimulación a los linfocitos T. La depleción de células B con el uso de rituximab ha surgido como opción terapéutica en enfermedades autoinmunes en los adultos, incluyendo artritis reumatoide, granulomatosis con poliangeítis, dermatomiositis, citopenias autoinmunes y LES. En niños se ha encontrado respuesta favorable a rituximab en citopenias autoinmunes, no obstante, la experiencia en población pediátrica con otras enfermedades autoinmunes es limitada. El objetivo del presente estudio fue describir cómo ha sido la respuesta a rituximab en pacientes menores de 18 años, en quienes se ha indicado la terapia anti-CD20 para el manejo de manifestaciones de enfermedades reumatológicas, en un hospital infantil de Medellín.
Métodos
Serie de casos en la que se revisaron las historias clínicas de los pacientes ≤18 años, con diagnóstico de enfermedad reumatológica, que de acuerdo con los registros de la consulta de reumatología pediátrica o la base de datos de farmacia, del Hospital Universitario de San Vicente Fundación, hubieran recibido rituximab; evaluados entre marzo de 2006 y julio de 2011. La recolección de los datos se hizo entre octubre y diciembre de 2011. Se incluyeron las historias clínicas de pacientes con diagnóstico de enfermedad reumatológica que hubieran recibido al menos una aplicación de rituximab y se excluyeron las historias clínicas mal codificadas y los registros con datos incompletos que dificultaran su interpretación. Los datos fueron consignados en un formulario sistematizado.
Se registraron las siguientes variables: edad, sexo, diagnóstico, tiempo de evolución de la enfermedad reumatológica, indicación de la aplicación de rituximab, dosis de glucocorticoides, en mg/Kg/día, antes de recibir rituximab, inmunosupresores utilizados antes de rituximab, así como dosis de esteroides posteriores a rituximab y terapia de mantenimiento. Creatinina, proteinuria en mg/m2/h, terapia de reemplazo renal, resultado de biopsia renal; para los pacientes con nefritis lúpica como indicación. Número de aplicaciones de rituximab y número de meses trascurridos entre éstas. Para las indicaciones diferentes a nefritis lúpica se registró la respuesta clínica y el comportamiento de los parámetros de laboratorios según la manifestación.
Los resultados se muestran como medidas de resumen y dispersión de acuerdo con la naturaleza de las variables. Los análisis se realizaron con el paquete estadístico SPSS (Statistical Product for Service Solutions) versión 18.
Resultados
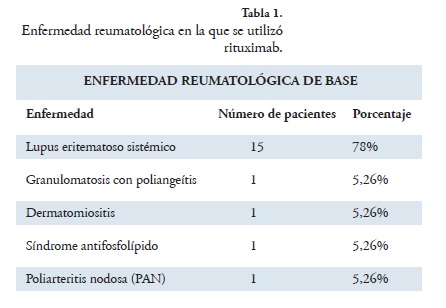
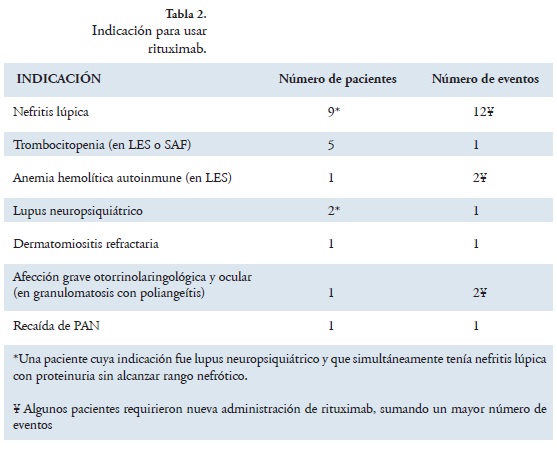
Entre marzo de 2006 y julio de 2011, en el Hospital Universitario de San Vicente Fundación de Medellín, Hospital Infantil, se administró rituximab a 19 pacientes menores de 18 años con enfermedad reumatológica; dos pacientes recibieron el medicamento tres veces y un paciente lo recibió dos veces, representando 24 eventos. Los pacientes tenían edades entre 7 y 17 años, con media de 12,8 ± 2,93 años. El 100% fue de sexo femenino. La enfermedad reumatológica de base y la indicación de la aplicación de rituximab se presenta en las tablas 1 y 2.
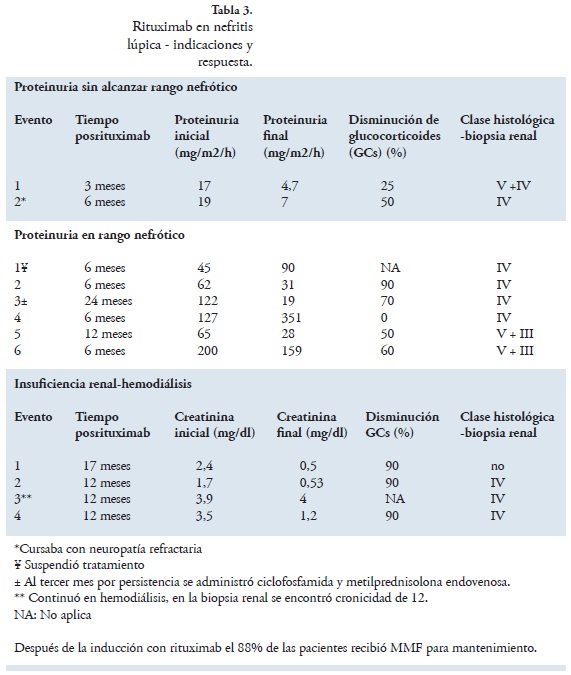
LES-nefritis lúpica: Las indicaciones para aplicación de rituximab en nefritis lúpica, se dividieron en: incremento de la proteinuria en rango nefrótico, incremento de la proteinuria sin alcanzar el rango nefrótico e insuficiencia renal aguda. Antes de rituximab se había intentado inducción de remisión con otros medicamentos: ciclofosfamida y esteroides en el 100% de las pacientes, micofenolato mofetil (MMF) en el 77% y azatioprina (AZA) en el 44,4%.
En NL, la indicación fue incremento de la proteinuria sin alcanzar el rango nefrótico en dos eventos, una de las pacientes con esta indicación cursaba con neuropatía de difícil control, en ella la principal indicación de rituximab fue la manifestación neuropsiquiátrica. Ambas respondieron satisfactoriamente con disminución de proteinuria (Tabla 3).
Por insuficiencia renal aguda con necesidad de terapia de reemplazo renal, se utilizó rituximab en cuatro oportunidades. Una de las pacientes continuó en hemodiálisis pero en la biopsia renal de esta paciente el índice de cronicidad era de 12 (Tabla 3).
Finalmente, por incremento de la proteinuria en rango nefrótico se utilizó rituximab seis veces. Con disminución de proteinuria a rango no nefrótico en el 50% de los casos (Tabla 3).
Como se presenta en la tabla 3, con el uso de rituximab se pudo disminuir la dosis de los glucocorticoides (dosis promedio a los seis meses posrituximab de 0,36 mg/Kg/día de prednisolona, con dosis promedio basal de 0,8 mg/Kg/día). En las pacientes con seguimiento ≥12 meses la dosis promedio de prednisolona disminuyó 83% (dosis promedio antes de rituximab: 1mg/Kg/día, y dosis promedio al año de haber administrado rituximab: 0,17 mg/Kg/día).
Trombocitopenia y anemia hemolítica autoinmune: cinco pacientes recibieron rituximab por trombocitopenia, cuatro con diagnóstico de LES y una con diagnóstico de síndrome antifosfolípido, con edades de 8, 10, 11, 12 y 16 años, y recuentos plaquetarios de 80.000, 46.000, 107.000, 92.000 y 27.000, respectivamente. Previamente habían utilizado esteroides el 100%, ciclofosfamida, gamaglobulina y anti D el 40%, danazol, AZA y MMF el 20%.
Cuatro pacientes lograron recuentos de plaquetas mayores de 150.000 a los 3 meses, la otra paciente no respondió. Al momento de recolectar la información tres pacientes completaban 12 meses posadministración de rituximab, manteniendo una adecuada respuesta (recuento de plaquetas mayores a 150.000 y posibilidad de disminuir el esteroide a dosis bajas).
Una paciente de 16 años con anemia hemolítica autoinmune y diagnóstico de LES, recibió rituximab con remisión de la hemólisis por 12 meses, requiriendo nueva aplicación al año y a los 24 meses.
Resultados en otras indicaciones: La paciente con neuropatía mejoró completamente con rituximab; una segunda paciente con lupus neuropsiquiátrico (convulsiones y psicosis, con refractariedad a esteroides y ciclofosfamida) no volvió a presentar manifestaciones neuropsiquátricas en 3 años de seguimiento.
La paciente con granulomatosis con poliangeítis, que previamente había recibido ciclofosfamida y esteroides, respondió muy bien los primeros 6 meses (mejoría notable de la sinusitis y control de la afección ocular); continuó mantenimiento con metotrexate, pero al noveno mes presentó recurrencia de síntomas, requiriendo incremento en la dosis de esteroides, y al año nueva administración de rituximab, con respuesta favorable (normalización de reactantes y disminución de síntomas).
La paciente con diagnóstico de PAN, había recibido inducción con ciclofosfamida y mantenimiento con MMF. Recibió rituximab a los 24 meses de diagnóstico por presencia de fiebre, anemia, livedo reticularis, nódulos y elevación de reactantes a pesar de continuar tratamiento. En el seguimiento de tres meses posadministración, se habían normalizado los reactantes y resuelto la anemia, asimismo, la dosis de esteroides se había logrado mantener estable y había experimentado control de manifestaciones clínicas.
Finalmente, la paciente con DMJ refractaria a esteroides, metotrexate y gamaglobulina, no mejoró con rituximab (persistió con debilidad muscular y elevación de enzimas musculares).
Discusión
El rituximab es un anticuerpo monoclonal quimérico (múrido/humano), obtenido por ingeniería genética, en el que las regiones constantes corresponden a IgG1 humana y la región variable de las cadenas ligeras y cadenas pesadas son múridas. Rituximab se une específicamente al antígeno CD20, una fosfoproteína transmembrana no-glucosilada, expresada en los linfocitos pre-B y B maduros y ausente en células madre hematopoyéticas, células pro-B y células plasmáticas normales. Agota las células B por citotoxicidad dependiente del complemento y citotoxicidad mediada por células dependientes de anticuerpos1-3.
Aunque la aplicación clínica inicial fue en pacientes con linfomas de células B, refractarios, la depleción de células B con el uso de rituximab ha surgido como opción terapéutica prometedora en enfermedades autoinmunes en los adultos, incluyendo artritis reumatoide, granulomatosis con poliangeítis, dermatomiositis, citopenias autoinmunes y LES4-7.
En niños, diferentes grupos han extendido el uso de rituximab a pacientes con citopenias autoinmunes refractarias, con resultados favorables8-14. Rao et al.8, elaboraron y publicaron en 2008 un estudio multicéntrico con rituximab en 29 pacientes con refractariedad (21 con púrpura trombocitopénica inmune-PTI- 6 con anemia hemolítica autoinmune -AHA-, 2 con síndrome de Evans y 1 con neutropenia) obteniendo una tasa de respuesta del 72% (50% completa y 22% parcial). Previamente se había reportado respuesta en 31% de los pacientes de un estudio que evaluó prospectivamente el anticuerpo monoclonal en niños con citopenias (no todos refractarios)9. Estudios retrospectivos más pequeños han descrito tasas de respuesta entre 25% y 78% en adultos y niños con PTI y del 100% en AHA10-16. En nuestra serie, 5 de los 6 pacientes que recibieron rituximab por hemocitopenias, presentaron respuesta favorable (recuentos plaquetarios ≤150.000 por más de 6 meses en trombocitopenia asociada a LES o SAF, y normalización de reticulocitos, deshidrogenasa láctica, bilirrubinas y hemoglobina, en el caso de anemia hemolítica).
Respecto a DMJ, en 2011 el grupo francés de uso de rituximab en enfermedades autoinmunes reportó respuesta completa en 3 de 6 pacientes tratados con rituximab (50%)17, previamente habían sido reportados en la literatura 12 casos, la mayoría refractarios a otras terapias, logrando remisión de la enfermedad con un primer curso de rituximab el 42%18-23. En nuestra serie se utilizó rituximab en una paciente que había sido refractaria a otras terapias, sin observar respuesta, sin embargo, por corresponder sólo a un paciente, no es posible concluir sobre su uso en esta enfermedad.
En niños, la experiencia con rituximab en vasculitis, se restringe a pocos reportes de caso individuales (en poliangeítis microscópica y granulomatosis con poliangeítis, principalmente)23, en los cuales, al igual que en nuestros pacientes, la respuesta ha sido favorable.
Finalmente en LES, en contraste con los adultos, el uso de rituximab ha sido reportado sólo en pequeñas series de casos. En adultos, pese a la respuesta favorable en estudios abiertos, los ensayos clínicos controlados más recientes no encontraron beneficio mayor con uso de rituximab24,25.
Como se mencionó previamente, los estudios en población pediátrica con LES son pocos26-31 y hasta donde llega nuestro conocimiento han sido publicados dos de tipo prospectivo: el realizado por Marks y colaboradores26,27,30 en el que reportaron siete pacientes refractarios a la terapia inicial, con diferentes indicaciones (falla orgánica múltiple con afección renal y en sistema nervioso central en dos pacientes, una paciente con afección cutánea, una con actividad hematológica, una con afección articular, una con enfermedad pulmonar y otro con hemorragia alveolar más afección del sistema nervioso central) en los cuales se logró disminuir el BILAG promedio de 22 a 6, reducir la dosis de glucocorticoides y en los pacientes con compromiso renal mejoría de la proteinuria y liberación de hemodiálisis. Así mismo, Willems31 y colaboradores estudiaron prospectivamente 11 pacientes con LES (ocho con NL clase IV y V, dos con citopenias autoinmunes y uno con anticuerpos antiprotrombina y sangrado grave) que recibieron rituximab, observando remisión hematológica en el 100%, respuesta renal parcial en el 50% y completa en el 25%. Similar a estos autores, nosotros encontramos que en los 15 pacientes con LES que recibieron rituximab, presentaron respuesta completa 5 de 6 pacientes en los cuales la indicación fue citopenia autoinmune, y de las pacientes con NL, tres que se encontraban en hemodiálisis pudieron abandonar la terapia de reemplazo renal, igualmente, en el grupo en general se observó disminución en proteinuria y reducción en la dosis de esteroides. No observamos incremento en la frecuencia de infecciones.
Dado el carácter retrospectivo de nuestro estudio no fue posible establecer índices de actividad basales y su respuesta posadministración de rituximab, asimismo, el comportamiento de otros laboratorios de interés como complemento y antiDNA no se pudo establecer en todos los pacientes. Finalmente, el hecho de que los pacientes tuvieran tiempos de seguimiento diferentes limita la posibilidad de hacer conclusiones a 12 meses en todos los pacientes.
Conclusiones
Pocos estudios han evaluado el uso de rituximab en población pediátrica con enfermedades autoinmunes. En éste y otros estudios se ha observado mejoría en trombocitopenia y anemia hemolítica de origen autoinmune con el uso de rituximab. Aunque en NL observamos efecto favorable, se requieren estudios prospectivos para evaluar eficacia y seguridad de rituximab en pacientes con LES ≤18 años.
Referencias
1. Borker A, Choudhary N. Rituximab. Indian Pediatr 2011;48:627-32. [ Links ]
2. Gürcan HM, Keskin DB, Stern JN, Nitzberg MA, Shekhani H, Ahmed AR. A review of the current use of rituximab in autoimmune diseases. Int Immunopharmacol 2009; 9:10-25. [ Links ]
3. Pescovitz MD. Rituximab, an anti-cd20 monoclonal antibody: history and mechanism of action. Am J Transplant 2006; 6:859-66. [ Links ]
4. Perosa F, Prete M, Racanelli V, Dammacco F. CD20- depleting therapy in autoimmune diseases: from basic research to the clinic. J Intern Med 2010; 267:260-77. [ Links ]
5. Pers JO, Daridon C, Bendaoud B, Devauchelle V, Berthou C, Saraux A, et al. B-cell depletion and repopulation in autoimmune diseases. Clin Rev Allergy Immunol 2008; 34:50-5. [ Links ]
6. Looney RJ. B cells as a therapeutic target in autoimmune diseases other than rheumatoid arthritis. Rheumatology (Oxford) 2005; 44 Suppl 2: ii13-ii17. [ Links ]
7. Guzmán Moreno R. B-cell depletion in autoimmune diseases. Advances in autoimmunity. Autoimmun Rev 2009; 8:585-90. [ Links ]
8. Rao A, Kelly M, Musselman M, Ramadas J, Wilson D, Grossman W, et al. Safety, eficacy, and immune reconstitution after rituximab therapy in pediatric patients with chronic or refractory hematologic autoimmune cytopenias. Pediatr Blood Cancer 2008; 50:822-5. [ Links ]
9. Wang J, Wiley J, Luddy R, et al. Chronic immune thrombocytopenic purpura in children: Assessment of rituximab treatment. J Pediatr 2005; 146:217-221. [ Links ]
10. Zecca M, Nobili B, Ramnghi U, et al. Rituximab for the treatment of refractory autoimmune hemolytic anemia in children. Blood 2003; 101:3857-3861. [ Links ]
11. Saleh M, Gutheil J, Moore M, et al. A pilot study of the anti-CD20 monoclonal antibody rituximab in patients with refractory autoimmune thrombocytopenia. Semin Oncol 2000; 27:99-103. [ Links ]
12. Parodi E, Nobili B, Perrotta S, et al. Rituximab (anti-CD20 monoclonal antibody) in children with chronic refractory symptomatic immune thrombocytopenic purpura: Eficacy and safety of treatment. Int J Hematol 2006; 84:48-53. [ Links ]
13. Bennett C, Rogers Z, Kinamon D, et al. Prospective phase 1/2 study of rituximab in childhood and adolescent chronic immune thrombocytopenic purpura. Blood 2006; 107:2639- 2642. [ Links ]
14. Quartier P, Brethon B, Phillip P, et al. Treatment of childhood autoimmune hemolytic anemia with rituximab. Lancet 2001; 358:1511-1513. [ Links ]
15. Stasi R, Stipa E, Forte V, et al. Variable patterns of response to rituximab treatment in adults with chronic idiopathic thrombocytopenic purpura. Blood 2002; 99:3872-3873. [ Links ]
16. Cooper N, Stasi R, Cunningham-Rundles S, et al. Te eficacy and safety of B cell depletion with anti-CD20 monoclonal antibody in adults with chronic immune thrombocytopenic purpura. Br J Haematol 2004; 125:232-239. [ Links ]
17. Bader-Meunier B, Decaluwe H, Barnerias C, Gherardi R, Quartier P, Faye A, et al. Safety and eficacy of rituximab in severe juvenile dermatomyositis: results from 9 patients from the French Autoimmunity and Rituximab registry. J Rheumatol 2001; 38:1436-40. [ Links ]
18. Chiu YE, Co DO. Juvenile dermatomyositis: immunopathogenesis, role of myositis-specific autoantibodies, and review of rituximab use. Pediatr Dermatol 2011; 28:357-67. [ Links ]
19. Chung L, Genovese MC, Fiorentino D F. A pilot trial of rituximab in the treatment of patients with dermatomyositis. Arch Dermatol 2007; 143:763-7. [ Links ]
20. Levine TD. Rituximab in the treatment of dermatomyositis: an open-label pilot study. Arthritis Rheum 2005; 52: 601-7. [ Links ]
21. Cooper MA, Willingham DL, Brown DE, et al. Rituximab for the treatment of juvenile dermatomyositis: a report of four pediatric patients. Arthritis Rheum 2007; 56:3107-11. [ Links ]
22. Dinh HV, McCormack C, Hall S, et al. Rituximab for the treatment of the skin manifestations of dermatomyositis: a report of 3 cases. J Am Acad Dermatol 2007; 56:148-53. [ Links ]
23. Tzaribachev N, Koetter I, Kuemmerle-Deschner JB, et al. Rituximab for the treatment of refractory pediatric autoimmune diseases: a case series. Cases J 2009; 2:1-8. [ Links ]
24. Rovin BH, Furie R, Latinis K, Looney RJ, Fervenza FC, Sánchez-Guerrero J, et al. Eficacy and safety of rituximab in patients with active proliferative lupus nephritis: Te lupus nephritis assessment with rituximab (LUNAR) study. Arthritis Rheum 2012; doi: 10.1002/art.34359. [ Links ]
25. Merrill JT, Neuwelt CM, Wallace DJ, Shanahan JC, Latinis KM, Oates JC, et al. Efficacy and safety of rituximab in moderately-to-severely active systemic lupus erythematosus: the randomized, double-blind, phase II/III systemic lupus erythematosus evaluation of rituximab trial. Arthritis Rheum 2010; 62:222-33. [ Links ]
26. Marks SD, Tullus K. Targeted B-cell depletion therapy in childhood-onset systemic lupus erythematosus: progress to date. Paediatr Drugs 2007; 9:371-8. [ Links ]
27. Marks SD, Patey S, Brogan PA, Hasson N, Pilkington C, Woo P, et al. B lymphocyte depletion therapy in children with refractory systemic lupus erythematosus. Arthritis Rheum 2005; 52:3168-74. [ Links ]
28. Nwobi O, Abitbol CL, Chandar J, Seeherunvong W, Zilleruelo G. Rituximab therapy for juvenile-onset systemic lupus erythematosus. Pediatr Nephrol 2008; 23:413-9. [ Links ]
29. Edelbauer M, Jungraithmayr T, Zimmerhackl LB. Rituximab in childhood systemic lupus erythematosus refractory to conventional immunosuppression: case report. Pediatr Nephrol 2005; 20:811-3. [ Links ]
30. Marks SD, Tullus K. Successful outcomes with rituximab therapy for refractory childhood systemic lupus erythematosus. Pediatr Nephrol 2006; 21:598-9. [ Links ]
31. Willems M, Haddad E, Niaudet P, Koné-Paut I, Bensman A, Cochat P, et al. Rituximab therapy for childhood-onset systemic lupus erythematosus. J Pediatr 2006; 148:623-627. [ Links ]