Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista Colombiana de Reumatología
Print version ISSN 0121-8123
Rev.Colomb.Reumatol. vol.20 no.3 Bogotá july/Sept. 2013
Artículo de revisión
El corazón en lupus eritematoso sistémico: revisión estructurada de la literatura
The heart in systemic lupus erythematosus: Structured literature review
Andrés Zapata-Cárdenasa, Luis Fernando Pinto Peñarandab, Clara Saldarriaga Giraldoc, Carlos Jaime Velásquez Francoa,b,* y Javier Darío Márquez Hernándezb
a Departamento de Medicina Interna, Facultad de Medicina, Escuela de Ciencias de la Salud, Universidad Pontificia Bolivariana, Hospital San Vicente Fundación, IPS Universitaria, Medellín, Colombia
b Unidad de Reumatología, Hospital Pablo Tobón Uribe, Medellín, Colombia
c Unidad de Cardiología, Clínica CardioVID, Medellín, Colombia
* Autor para correspondencia. Correo electrónico: carjaivel@hotmail.com (C.J. Velásquez Franco).
Recibido el 1 de marzo de 2013 Aceptado el 2 de agosto de 2013
Resumen
El lupus eritematoso sistémico es una enfermedad inflamatoria de origen autoinmune que puede comprometer múltiples órganos. La enfermedad cardiaca puede ocurrir en los pacientes con diagnóstico ya establecido y puede ser la manifestación inicial en algunos de ellos. La gravedad del compromiso cardiaco, en esta enfermedad, puede variar hasta producir condiciones amenazantes para la vida y puede afectar cualquier estructura o tejido del corazón. Adicionalmente, la inflamación sistémica presente en esta entidad se asocia a aterosclerosis acelerada, que puede llevar a enfermedad cardiaca isquémica de presentación temprana, incrementando significativamente el riesgo de enfermedad cardiovascular cuando se compara con la población general. Las principales características de las manifestaciones cardiacas en el lupus eritematoso sistémico se discuten a continuación, así como su pronóstico y tratamiento.
Palabras clave: Corazón, Lupus eritematoso sistémico, Autoinmunidad, Autoanticuerpos, Miocarditis, Falla cardiaca.
Abstract
Systemic lupus erythematosus is an inflammatory disorder of autoimmune origin that can involve multiple organs. Cardiac compromise can occur in patients with established disease, or it can be the initial manifestation in some of these patients. The heart commitment in this disorder can vary in their severity until producing life-threatening conditions, and it can affect any structure or heart tissue. Additionally, the systemic inflammation present is associated to accelerated atherosclerosis that can evolve to early ischemic heart disease, increasing the risk of cardiovascular illness significantly when it is compared with general population. The main characteristics of heart manifestations in systemic lupus erythematosus are discussed, as well as their diagnosis and treatment.
Keywords: Heart, Lupus erythematosus systemic, Autoimmunity, Autoantibodies, Myocarditis, Heart failure.
Introducción
El lupus eritematoso sistémico (LES), es una enfermedad inflamatoria sistémica de origen autoinmune, que se asocia con la producción de autoanticuerpos que llevan al depósito de complejos inmunes y a la activación del complemento, responsables de la injuria tisular. La expresión de la actividad inflamatoria/autoinmune se ve reflejada en un amplio rango de manifestaciones clínicas y de laboratorio, como son: artritis, glomerulonefritis, rash, serositis, síntomas neurológicos, anemia, trombocitopenia, leucopenia, anticuerpos antinucleares (ANAs), entre otros. Se estima que su prevalencia varía entre 15-50 por cada 100.000 personas en Estados Unidos, afectando predominantemente a las mujeres, con una relación 9:1 respecto a los hombres, generalmente de raza negra y jóvenes, aunque puede aparecer en cualquier edad.
Actualmente, se reconoce un patrón bimodal de mortalidad en LES, que fue descrito en 1976 por Urowitz et al.1, de acuerdo con esto, los pacientes que mueren tempranamente en el curso de la enfermedad (durante los primeros cinco años) es por los efectos directos de la actividad lúpica sobre diversos órganos vitales, fundamentalmente el riñón; además, estos pacientes están recibiendo grandes dosis de esteroides y tienen un alto riesgo de infecciones. Por otro lado, los pacientes que fallecen en forma tardía (8 a 10 años de evolución de la enfermedad), mueren sin evidencia clínica de enfermedad activa, asociada a largos periodos de uso de esteroides en dosis más bajas y se relaciona con una alta incidencia de infarto agudo al miocardio, precipitados por una enfermedad coronaria aterosclerótica de curso acelerado. Este carácter bimodal de mortalidad en LES ha sido confirmado en reportes epidemiológicos actuales, en los que se ha documentado un riesgo global de enfermedad coronaria cinco a ocho veces mayor en las mujeres con LES, que en los controles sanos2.
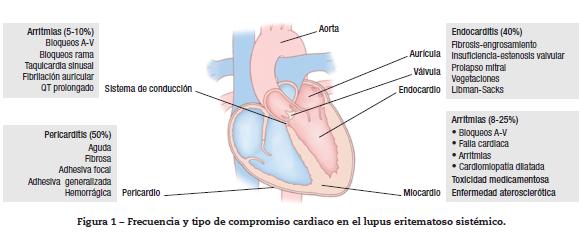
El compromiso cardiaco en LES es frecuente; la primera descripción de este tópico fue realizada por William Osler en 18953,4. La prevalencia actual varía según la población estudiada, pudiendo llegar a ser mayor de 50%. Dicho compromiso puede ser el resultado del daño directo de la actividad de la enfermedad sobre cualquier estructura cardiaca (pericardio, miocardio, endocardio, válvulas, tejido de conducción y las arterias coronarias) (fig. 1), o debido al riesgo incrementado de trombosis en algunas condiciones asociadas, como el síndrome antifosfolípido y la aterosclerosis acelerada5,6.
En general, las enfermedades cardiovasculares ocupan el primer lugar entre las causas de morbilidad y mortalidad en el mundo; su incidencia está en incremento, debido, en parte, a su aparición en etapas más tempranas de la vida. A diferencia de lo que se pensaba, anteriormente, en las últimas décadas ha crecido la evidencia del papel de la autoinmunidad en la fisiopatología de muchos desórdenes cardiovasculares7. Si se tiene en cuenta que la enfermedad coronaria aterosclerótica es progresiva y multifactorial, que inicia en la infancia, y que para provocar secuelas clínicas requiere una amplia proliferación de células de músculo liso dentro de la capa íntima de la arteria afectada, es claro, entonces, que su fisiopatología es compleja y va más allá de la acumulación de lípidos en la pared vascular. Múltiples investigaciones en animales y en humanos han permitido determinar una estrecha relación entre las enfermedades reumatológicas (entre ellas LES) y la aparición más temprana de aterosclerosis en relación con procesos inflamatorios, tanto sistémicos como locales, y la presencia de disfunción endotelial8.
Materiales y métodos
Se realizó una revisión narrativa no sistemática de la literatura desarrollada en idiomas inglés y español, limitada a los últimos 40 años, para información referenciada en bases de datos primarias, como: PubMed, Embase y Lilacs. Se utilizaron las siguientes palabras en inglés: Heart; Lupus Erythematosus, Systemic; Autoimmunity; Myocarditis; Autoantibodies; Heart Failure. Para la búsqueda en español, se emplearon las palabras: Corazón; Lupus Eritematoso Sistémico; Autoinmunidad; Miocarditis; Antoanticuerpos; Falla Cardiaca. Tanto la búsqueda como la selección de los artículos se realizaron de forma independiente por los diferentes autores y cada uno realizó lectura, análisis, asociación de nuevas referencias y construcción literaria para, posteriormente, ser analizada, validada por el grupo de autores y corregida bajo el mejor estilo literario.
La investigación realizada se desarrolló con los siguientes descriptores booleanos, con restricción a los tópicos mayores MeSH: «Heart»[Majr] AND/OR «Lupus Erythematosus; Systemic»[Majr] AND/OR «Autoimmunity»[Majr] AND/OR «Myocarditis»[Majr] AND/OR «Autoantibodies»[Majr] AND/ OR «Heart Failure»[Majr]. Así se obtuvieron 250 resúmenes, encontrando que 45 de ellos brindaban información de los tópicos necesarios para realizar la revisión. Se realizó la lectura de cada artículo y se seleccionaron los relacionados con el tema en cuestión.
El tejido cardiaco como blanco de la autoinmunidad
En general, el término «carditis autoinmune» hace referencia al resultado del compromiso cardiaco de algunas enfermedades reumáticas autoinmunes como LES o representa un fenómeno primario como parte de la fisiopatología de enfermedades cardiovasculares idiopáticas, entre ellas la cardiomiopatía dilatada9. De esta forma, el tejido cardiaco puede actuar en un momento dado como blanco de la autoinmunidad en algunas enfermedades sistémicas y, en otras circunstancias, puede ser el origen de la autoinmunidad.
Los diferentes componentes del corazón pueden llegar a ser, en un momento determinado, blanco de la autoinmunidad, bien sea en forma directa o indirecta. La autoinmunidad cardiaca, usualmente, es causada por fenómenos de mimetismo molecular, en los cuales luego de un proceso infeccioso, ciertos antígenos microbianos pueden actuar como auto-antígenos similares al tejido cardiaco y desencadenar la activación de células T autorreactivas, que normalmente están en reposo contra dichas estructuras10. Otra forma de desencadenar la autoinmunidad cardiaca se presenta, en algunos pacientes, luego del daño directo de la membrana celular miocárdica (ej. infarto miocárdico, trauma cardiaco), con la posterior liberación de diversos componentes intracelulares que funcionan como auto-antígenos para la producción de anticuerpos anticardiacos.
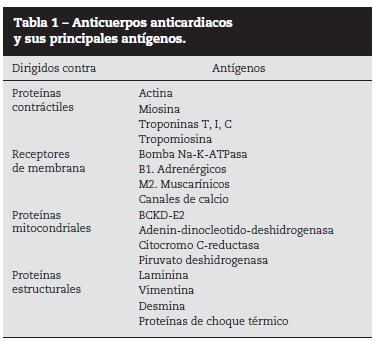
Se han descrito anticuerpos específicos contra diferentes antígenos cardiacos, como las proteínas mitocondriales y el sarcolema, contra proteínas estructurales, intracelulares, contráctiles y contra los receptores de los cardiomiocitos11 (tabla 1). El principal componente antigénico del corazón está representado por las proteínas contráctiles, como: actina, miosina, troponinas y tropomiosina, siendo la miosina la de mayor poder antigénico. Ambas cadenas de la miosina actúan como auto-antígenos; las cadenas pesadas beta no son específicas del miocardio, ya que también se expresan en el músculo esquelético. Por su parte, las cadenas alfa son específicas del miocardio, por lo que los anticuerpos dirigidos contra esta molécula actúan como auto-anticuerpos cardiacos órgano-específicos. Los anticuerpos contra las troponinas cardiacas (T, I, C) van dirigidos, principalmente, contra la troponina I y se han asociado con inflamación y dilatación miocárdica graves. En el caso de la actina, los anticuerpos humanos van dirigidos contra ambas fracciones (G y F actinas). Todos estos antígenos cardiacos tienen en común su ubicación intracelular, lo cual implica al daño de la membrana celular como un primer paso para la generación de estos auto-anticuerpos.
Por otro lado, se han detectado anticuerpos contra proteínas de la membrana de los cardiomiocitos, como la bomba Na-K-ATPasa y los receptores B1 adrenérgicos y M2 muscarínicos12. Los anticuerpos que activan los receptores B1 adrenérgicos se asocian con depresión de la función miocárdica y falla cardiaca crónica, mientras que los anticuerpos contra receptores M2 pueden llevar a fibrilación auricular. Estos antígenos presentes en la membrana celular, a diferencia de los antígenos intracelulares, están expuestos constantemente al sistema inmune.
El compromiso cardiaco en LES puede llegar a ser precipitado por cualquiera de los mecanismos anteriormente descritos. Sin embargo, hay evidencia clínica e histológica del daño cardiaco inducido por diferentes anticuerpos que aparecen con relativa frecuencia en los pacientes con LES y que van dirigidos contra diferentes estructuras cardiacas13. La presencia de anticuerpos antifosfolípidos (AFL) se ha asociado con un riesgo tres veces mayor de compromiso endocárdico y valvular, en comparación con los pacientes sin estos anticuerpos; específicamente, el anticoagulante lúpico, con un OR de 5.9 (95% CI 2.9-11.8) y los anticuerpos anticardiolipinas IgG, con un OR de 5.6 (95% CI 3.5-9.0), confieren el mayor riesgo de enfermedad valvular en estos sujetos14. Se ha sugerido, en estudios retrospectivos, una relación entre la presencia de anticuerpos contra la ribonucleoproteína nuclear (anti-RNP) y la aparición de miocarditis clínicamente evidente en forma concomitante al compromiso del músculo esquelético (miositis), lo cual sugiere que dichos anticuerpos tienen actividad autoinmune contra el músculo estriado en general; sin embargo, no se ha demostrado aún un vínculo causal directo15. Los anticuerpos anti-Ro/SSA y anti-La/SSB tienen un papel patogénico importante al unirse a las células miocárdicas, induciendo su opsonización y posterior eliminación. Adicionalmente, se ha demostrado que la presencia de anticuerpos anti-Ro/SSA y anti La/SSB inhiben la depuración de algunas células apoptósicas, generando su acumulación y promoviendo procesos inflamatorios16,17. Estos anticuerpos tienden a comprometer los cardiomiocitos modificados que conforman el tejido de conducción y atraviesan fácilmente la barrera placentaria, ocasionando, como resultado, la aparición de bloqueos cardiacos congénitos18.
El depósito de complejos inmunes, así como el depósito de complemento en la pared vascular y en el tejido perivascular de los vasos sanguíneos miocárdicos, se ha demostrado en estudios de inmunofluorescencia19, lo cual sugiere que la miocarditis lúpica es, fundamentalmente, un proceso de daño vascular mediado por complejos inmunes, más que un compromiso directo de las miofibrillas (miositis).
Compromiso estructural específico
Endocardio/válvulas
Aproximadamente, 40-60% de los pacientes con LES tienen alteraciones valvulares cardiacas demostradas por eco-cardiografía, mientras que en los estudios de autopsias la frecuencia varía entre 13-74%19. Las lesiones valvulares cardiacas son reportadas con frecuencia en los pacientes con síndrome antifosfolípido, independiente de la presencia o no de LES. Las lesiones valvulares afectan con más frecuencia las válvulas del lado izquierdo (aórtica y mitral) y consisten en engrosamientos de las valvas, estenosis e insuficiencia, así como la formación de vegetaciones de diversos tamaños que contribuyen a la alteración funcional del aparato valvular20. La endocarditis de Libman-Sacks, descrita en 1924, corresponde a la formación de grandes vegetaciones estériles, que afectan, principalmente, la válvula mitral y se han asociado a una larga duración de la enfermedad, a una mayor actividad del LES y a la presencia de síndrome antifosfolípido21. Desde el punto de vista clínico, estas lesiones son usualmente asintomáticas y en pocos casos generan soplos audibles; sin embargo, por su ubicación, preferencial, en los bordes libres de las valvas tienen un riesgo incrementado de generar émbolos al sistema nervioso central y predisponen a la aparición de endocarditis infecciosa19-21. Histológicamente, en las válvulas deformadas de estos pacientes, se han encontrado depósitos lineales subendoteliales de anticardiolipinas y de anti-beta 2 glicoproteína 1, así como depósitos granulares de factores del complemento (C3,C4,C1q). Las vegetaciones consisten en acúmulos de detritos celulares, plaquetas, productos de degradación de la sangre, fibroblastos y neovascularización22. El tratamiento de las lesiones valvulares y del endocardio puede requerir cirugía en caso de un compromiso hemodinámico significativo, que ocurre en menos del 3% de los individuos. El tratamiento con corticosteroides sistémicos no previene la aparición de las lesiones, pero la mayor frecuencia de su uso en las últimas décadas ha permitido disminuir la prevalencia de la endocarditis de Libman-Sacks en forma indirecta.
Miocardio
El compromiso miocárdico en LES es multifactorial, pudiendo ser explicado por un efecto directo de la enfermedad, por toxicidad asociada a los medicamentos o por el compromiso isquémico asociado a la aterosclerosis acelerada23. La miocarditis es una forma característica de compromiso cardiaco en LES, actualmente con una prevalencia de 8-25%, de acuerdo con la población estudiada24. Dado que la mayoría de los pacientes cursan con una miocarditis asintomática, la sospecha clínica determinará el diagnóstico y tratamiento tempranos. En los pacientes sintomáticos (7-10%) se puede encontrar taquicardia sinusal, fiebre, palpitaciones, dolor torácico y hallazgos propios de falla cardiaca, como: edemas, disnea, ortopnea, ritmo de galope, soplos, cardiomegalia, entre otros25. En el electrocardiograma es frecuente encontrar alteraciones de la repolarización, con cambios inespecíficos del segmento ST y de la onda T, latidos ventriculares prematuros, bloqueos cardiacos y, en los casos de derrame pericárdico asociado, se puede ver un trazo electrocardiográfico de bajo voltaje26. La ecocardiografía, si bien no hace el diagnóstico de miocarditis, sugiere su presencia cuando se encuentran anormalidades en el movimiento sistólico o diastólico de las paredes cardiacas en forma difusa, con disminución de la fracción de eyección y dilatación de cavidades27,28. Los marcadores séricos, como las troponinas, pueden encontrarse elevados, pero su ausencia no descarta el diagnóstico y su presencia es inespecífica, dado que son indicadores de injuria miocárdica en general. La realización de una biopsia endomiocárdica no debe retardar el inicio del tratamiento cuando la sospecha clínica está bien fundamentada; sin embargo, en los pacientes con LES y una mala función cardiaca podría realizarse este procedimiento, una vez se haya excluido la enfermedad coronaria como causa del compromiso miocárdico. Los hallazgos histológicos son inespecíficos, pero es frecuente encontrar una distribución en parches de infiltrados mononucleares, con depósito de complejos inmunes perivasculares, necrosis y fibrosis, que puede llevar a miocarditis crónica con falla cardiaca dilatada29,30. En los pacientes que utilizan cloroquina o hidroxicloroquina, la cardiotoxicidad por estos medicamentos es un diagnóstico diferencial a tener en cuenta; en estos casos, el estudio histológico demuestra agrandamiento de las fibras miocárdicas, fibrosis endocárdica y, de forma característica, la vacuolización de los miocitos30. El tratamiento requiere el inicio temprano de pulsos de esteroides y ciclofosfamida para evitar la progresión de la enfermedad.
Tejido de conducción
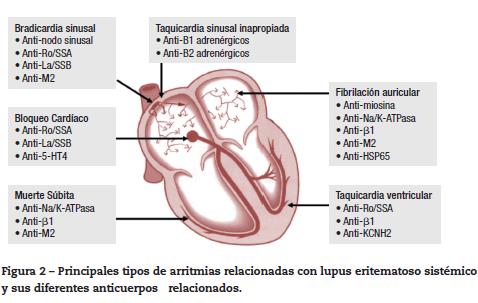
Las arritmias cardiacas y las alteraciones en el sistema de conducción se presentan hasta en el 10% de los pacientes con LES31. Sin embargo, con frecuencia, éstas ocurren en forma concomitante con miopericarditis y enfermedad coronaria activa. En general, es común encontrar alteraciones electrocardiográficas (ECG) en los pacientes con enfermedades autoinmunes, con reportes de hasta el 60% cuando se les realizan estudios de monitoreo con ECG de 24 horas31,32. El LES puede predisponer a la aparición, tanto de taquiarritmias como a bradiarritmias, siendo las más frecuentes: taquicardia sinusal, contracciones auriculares prematuras, fibrilación auricular, bloqueos cardiacos (A-V de cualquier grado y de rama) y la prolongación del intervalo QTc, respectivamente33. Menos frecuente es la aparición de arritmias ventriculares graves y la muerte súbita cardiaca. Los mecanismos exactos que explican la aparición de arritmias cardiacas y el daño en el sistema de conducción no están completamente dilucidados; pero, más allá de los factores mecánicos, estructurales y eléctricos, comunes en estos pacientes, se han detectado autoanticuerpos específicos contra diferentes receptores autonómicos con propiedades arritmogénicas (fig. 2), así como el compromiso directo del tejido de conducción por fenómenos inflamatorios que llevan a fibrosis31.
La mayoría de los bloqueos cardiacos completos (60-90%) que se detectan in utero y en el periodo neonatal se asocian a la presencia de anticuerpos de tipo Ig Ganti-Ro/SSA y anti-La/ SSB en la madre34. Sin embargo, el riesgo de aparición de bloqueo cardiaco congénito, cuando una madre tiene anticuerpos anti-Ro/SSA positivos, se estima en 2-3%. La exposición crónica a estos anticuerpos resulta en la internalización de los canales de calcio tipo L y, posteriormente, promueven la destrucción progresiva del nodo A-V, llevando a su fibrosis y calcificación. Existen dos tipos de antígeno Ro (52 Kd y 60Kd), ambos asociados con la injuria sobre el sistema de conducción; los anticuerpos anti-Ro de 52 Kd son más frecuentes en las pacientes con síndrome de Sjögren y atraviesan más fácilmente la placenta. De forma característica, el bloqueo cardiaco congénito completo, a diferencia de los demás componentes de los síndromes de lupus neonatal, es irreversible35. Además, se ha observado la progresión posnatal en los casos de bloqueo A-V incompleto, a pesar de la depuración de los anticuerpos maternos.
Actualmente, se recomienda que toda mujer con una enfermedad autoinmune conocida debe tamizarse para la presencia de anticuerpos anti-Ro y anti-La, en el primer trimestre del embarazo; si se determina su presencia, éstas deberían considerarse en alto riesgo para bloqueo cardiaco congénito en el feto y, en consecuencia, se debe monitorear el intervalo PR con ecocardiografía fetal semanal, entre las semanas 16 y 26 de gestación, y quincenalmente, entre las semanas 26 y 3235. El uso de esteroides fluorinados (dexametasona, betametasona) no ha demostrado retardar la progresión del daño sobre el nodo A-V, no mejora la mortalidad, la prematurez, ni la necesidad de usar marcapasos36,37.
Por otro lado, algunos estudios han encontrado una relación importante entre la frecuencia cardiaca y la actividad del LES, sugiriendo que hasta el 50% de los pacientes con LES activo tiene taquicardia sinusal38. Este hallazgo ha sido correlacionado con otros marcadores de actividad de la enfermedad reconocidos, como: la eritrosedimentación, las alteraciones hematológicas, los niveles séricos de C3 y C4 y los títulos de anti-DNA nativo. Adicionalmente, Kojuri J. et al.32 han encontrado que la prolongación del intervalo QTc puede ser un método simple para la detección temprana del compromiso cardiaco subclínico, en los pacientes con alta actividad de la enfermedad.
Pericardio
La pericarditis es la manifestación cardiovascular más común en los pacientes con LES, con una frecuencia que oscila entre 40 y 80%, aunque, con frecuencia, se detectan más las secuelas que la pericarditis clínicamente evidente39. El pericardio se puede ver afectado por procesos inflamatorios agudos o crónicos asociados al depósito granular de complejos inmunes y C3, demostrado por inmunofluorescencia. El compromiso pericárdico parece ser más frecuente en el inicio del LES o durante las recaídas y se puede presentar de forma aislada o como ataques recurrentes. La pericarditis clínica ocurre en 25% de los pacientes y se caracteriza por dolor torácico subesternal o dolor precordial típico, disnea, fiebre, taquicardia, ruidos cardiacos alejados o un frote pericárdico. El ECG puede mostrar depresión del segmento PR y elevación difusa del segmento ST40. El derrame pericárdico se puede detectar a través de una radiografía de tórax, pero la ecocardiografía es el método de elección para su estudio. Los anticuerpos antinucleares (ANAs), niveles de complemento y las células LE se pueden detectar en el líquido pericárdico, pero su medición en forma rutinaria no está indicada. Histológicamente, la presencia de cuerpos hematoxilínicos puede ser el único hallazgo específico de una pericarditis lúpica, aunque es frecuente encontrar pericarditis fibrosa, con engrosamiento del pericardio que, posteriormente, puede producir la adhesión de las capas parietal y visceral en forma focal o difusa41. Las complicaciones de la pericarditis, como el taponamiento cardiaco y la pericarditis constrictiva, son infrecuentes. En pocos casos, se ha demostrado la presencia de pericarditis purulenta (frecuentemente por Staphylococcus aureus) en pacientes con LES; sin embargo, se debe tener en cuenta como diagnóstico diferencial, dada su alta mortalidad. Los AINES y los corticosteroides son los medicamentos de elección en el manejo de la pericarditis lúpica en casos leves, pero en los casos más graves se requiere el uso de bolos de esteroides, azatioprina o micofenolato mofetil42.
Enfermedad coronaria aterosclerótica
Los pacientes con LES tienen un riesgo incrementado de presentar eventos coronarios agudos que son el resultado de la aterosclerosis acelerada y de los fenómenos trombóticos43. Actualmente, se acepta que el LES es un factor de riesgo independiente para la enfermedad coronaria, y que las mujeres con LES entre los 35 y 44 años de edad tienen un riesgo 50 veces mayor de sufrir un evento coronario agudo, al compararlas con mujeres sanas equiparadas para la edad44. En estudios de autopsias, se ha encontrado que hasta el 52% de los pacientes con LES tiene evidencia de aterosclerosis difusa al momento de su muerte. Los pacientes con LES, con frecuencia, tienen factores de riesgo tradicionales para aterosclerosis, como son: edad, sexo, historia familiar, dislipidemia, hipertensión arterial, diabetes, tabaquismo, sedentarismo, entre otros. Sin embargo, en esta población se suma la presencia de factores de riesgo no tradicionales propios de la enfermedad, como: el uso de corticosteroides, niveles elevados de proteína C reactiva (PCR), activación del complemento, los anticuerpos antifosfolípidos incluyendo la beta 2 glicoproteína 1, anticuerpos contra la LDL oxidada, entre otros45. El concepto actual de aterosclerosis implica una enfermedad inflamatoria activa mediada por diferentes componentes del sistema inmune; de esta forma, el papel de la autoinmunidad en el desarrollo y progresión de las lesiones ateroscleróticas cada vez es mejor comprendido46. En el LES hay un incremento en el depósito de colesterol en las células musculares lisas mediado por la presencia de complejos inmunes cargados de colesterol LDL. Adicionalmente, los complejos inmunes inhiben la enzima colesterol 27-hidroxilasa, disminuyendo la remoción del colesterol de la pared vascular. Por otro lado, la inhibición de la lipoproteína lipasa (LPL) mediada por IL-6 y anticuerpos anti-LPL confieren un perfil lipídico claramente aterogénico, con elevación de colesterol LDL, VLDL, triglicéridos y disminución del colesterol HDL47. Con base en estos hallazgos, se ha propuesto el uso de medicamentos inhibidores de la HMG-CoA reductasa por sus efectos pleiotrópicos antiinflamatorios y antitrombóticos48; sin embargo, la recomendación actual es iniciar el manejo con estatinas de acuerdo con las recomendaciones estándar de las diferentes guías de manejo de dislipidemias49. La hidroxicloroquina puede tener efectos benéficos sobre el perfil lipídico de los pacientes con LES y debería preferirse su uso cuando sea posible50.
Conflicto de intereses
Los autores declaran no tener ningún conflicto de intereses.
Bibliografía
1. Urowitz MB, Bookman AA, Koehler BE, Smythe HA, Gordon DA, Ogryzlo MA. The bimodal mortality pattern of systemic lupus erythematosus. Am J Med. 1976;60:221-5. [ Links ]
2. Bruce, IN. Atherogenesis and autoimmune disease: the model of lupus. Lupus 2005;14:687-90. [ Links ]
3. Appenzeller S, Pineau CA, Clarke AE. Acute lupus myocarditis: Clinical features and outcome. Lupus 2011;20:981-8. [ Links ]
4. Ashrafi R, Garg P, McKay E, Gosney J, Chuah S, Davis G. Aggressive cardiac involvement in systemic lupus erythematosus: a case report and a comprehensive literature review. Cardiology Res Pract 2011:578390. [ Links ]
5. Baba A, Yoshikawa T, Chino M, Murayama A, Mitani K, Nakagawa S., et al. Characterization of anti-myocardial autoantibodies in Japanese patients with dilated cardiomyopathy. Japanese Circul J 2011;65:867-73. [ Links ]
6. Bijl M, Brouwer J, Kallenberg G. Cardiac abnormalities in SLE: pancarditis. Lupus 2000;9:236-40. [ Links ]
7. Abou-Raya A, Abou-Raya S. Inflammation: a pivotal link between autoimmune diseases and atherosclerosis. Autoimmun Rev 2006;5:331-7. [ Links ]
8. Blank M, Aron-Maor A, Shoenfeld Y. From rheumatic fever to Libman-Sacks endocarditis: is there any possible pathogenetic link? Lupus 2005;14:697-701. [ Links ]
9. Caforio A, Brucato A, Doria A, Brambilla G, Angelini A, Ghirardello A, et al. Anti-heart and anti-intercalated disk autoantibodies: evidence for autoimmunity in idiopathic recurrent acute pericarditis. Heart 2010;96:779-84. [ Links ]
10. Caforio A, Daliento L, Angelini A, Bottaro S, Vinci A, Dequal G, et al. Autoimmune myocarditis and dilated cardiomyopathy: focus on cardiac autoantibodies. Lupus 2005;14:652-5. [ Links ]
11. Caforio A, Tona F, Bottaro S, Vinci A, Dequal G, Daliento L, et al. Clinical implications of anti-heart autoantibodies in myocarditis and dilated cardiomyopathy. Autoimmunity 2008;41:35-45. [ Links ]
12. Caforio A, Vinci A, Iliceto S. Anti-heart autoantibodies in familial dilated cardiomyopathy. Autoimmunity 2008;41:462-9. [ Links ]
13. Chockalingam A, Prabhakar D, Gnanavelu G, Chockalingam V. Pancarditis as initial presentation of systemic lupus erythematosus. Int J Cardiol 2003;87:111-4. [ Links ]
14. Zuily S, Regnault V, Selton-Suty C, Eschwège V, Bruntz J.F, Bode-Dotto E, et al. Increased risk for heart valve disease associated with antiphospholipid antibodies in patients with systemic lupus erythematosus: meta-analysis of echocardiographic studies. Circulation 2011;124:215-24. [ Links ]
15. Borenstein DG, Fye WB, Arnett FC, Stevens MB. The myocarditis of systemic lupus erythematosus: association with myositis. Ann Intern Med 1978;89:619. [ Links ]
16. Doria A, Laccarino L, Sarzi-Puttini P, Atzeni F, Turriel M, Petri M. Cardiac involvement in systemic lupus erythematosus. Lupus 2005;14:683-6. [ Links ]
17. Fairweather D, Rose NR. Inflammatory heart disease: a role for cytokines. Lupus 2005;14:646-51. [ Links ]
18. Izmirly PM, Rivera TL, Buyon JP. Neonatal lupus syndromes. Rheum Dis Clin North Am. 2007;33:267-85. [ Links ]
19. Jain D, Halushka MK. Cardiac pathology of systemic lupus erythematosus. J Clin Pathol. 2009;62:584-92. [ Links ]
20. Kaya Z, Leib C, Katus H. Autoantibodies in heart failure and cardiac dysfunction. Circulation Res. 2012;110:145-58. [ Links ]
21. Gómez-León Mandujano A, Amezcua-Guerra LM. Cardiovascular manifestations of systemic lupus erythematosus. Arch Cardiol Mex. 2008;78:421-30. [ Links ]
22. Plazak W, Gryga K, Milewski M, Podolec M, Kostkiewicz M, Podolec P, et al. Association of heart structure and function abnormalities with laboratory findings in patients with systemic lupus erythematosus. Lupus 2011;20:936-44. [ Links ]
23. Lv H, Lipes M. Role of impaired central tolerance to a-Myosin in inflammatory heart disease. Trends Cardiovasc Med. 2012;22:113-7. [ Links ]
24. Marchant DJ, Boyd JH, Lin DC, Granville DJ, Garmaroudi FS, McManus BM. Inflammation in myocardial diseases. Circulation Res. 2012;110:126-44. [ Links ]
25. Miller TD, Henry D, Azelaar T. Cardiac involvement in systemic lupus erythematosus. Mayo Clin Proc. 1999;74:275-84. [ Links ]
26. Nussinovitch U, Shoenfeld Y. Anti-troponin autoantibodies and the cardiovascular system. Heart. 2010;96:1518-24. [ Links ]
27. Owlia MB, Mostafavi Pour Manshadi, S, Naderi N. Cardiac manifestations of rheumatological conditions: a narrative review. ISRN Rheumatol. 2012;2012:463-620. [ Links ]
28. Tincani A, Biasini-Rebaioli C, Cattaneo R, Riboldi P. Nonorgan specific autoantibodies and heart damage. Lupus. 2005;14:656-9. [ Links ]
29. Sagar S, Liu PP, Cooper LT. Myocarditis. Lancet. 2012;379:738-47. [ Links ]
30. Wijetunga M, Rockson S. Myocarditis in systemic lupus erythematosus. Am J Med. 2002;113:419-23. [ Links ]
31. Lee HC, Huang K, Wang X, Shen W. Autoantibodies and cardiac arrhythmias. Heart Rhythm. 2011;8:1788-95. [ Links ]
32. Kojuri J, Nazarinia MA, Ghahartars M, Mahmoody Y, Rezaian GR, Liaghat L. QT dispersion in patients with systemic lupus erythematosus: the impact of disease activity. BMC Cardiovasc Dis. 2012;12:11. [ Links ]
33. Lazzerini PE, Capecchi PL, Guideri F, Acampa M, Selvi E, Bisogno S, et al. Autoantibody-mediated cardiac arrhythmias: mechanisms and clinical implications. Basic Research Cardiol. 2008;103:1-11. [ Links ]
34. Capone C, Buyon JP, Friedman DM, Frishman WH. Cardiac manifestations of neonatal lupus: a review of autoantibody-associated congenital heart block and its impact in an adult population. Cardiol Rev. 2012;20:72-6. [ Links ]
35. Clancy RM, Buyon JP, Ikeda K, Nozawa K, Argyle D, Friedman DM, et al. Maternal antibody responses to the 52-kdSSA/ RO p200 peptide and the development of fetal conduction defects. Arthritis Rheum. 2005;52:3079-86. [ Links ]
36. Bourré-Tessier J, Clarke AE, Huynh T, Bernatsky S, Joseph L, Belisle P, et al. Prolonged corrected QT interval in anti-Ro/ SSA-positive adults with systemic lupus erythematosus. Arthritis Care Res. 2011;63:1031-7. [ Links ]
37. Izmirly PM, Buyon JP, Saxena A. Neonatal lupus: advances in understanding pathogenesis and identifying treatments of cardiac disease. Curr Opin Rheumatol. 2012;24:466-72. [ Links ]
38. Eisen A, Arnson Y, Dovrish Z, Hadary R, Amital H. Arrhythmias and conduction defects in rheumatological diseases-a comprehensive review. Seminars Arthritis Rheum. 2009;39:145-56. [ Links ]
39. Pauschinger M, Noutsias M, Lassner D, Schultheiss H, Kuehl U. Inflammation, ECG changes and pericardial effusion: whom to biopsy in suspected myocarditis? Clinical Res Cardiol. 2006;95:569-83. [ Links ]
40. Sarzi-Puttini P, Atzeni F, Gerli R, Bartoloni E, Doria A, Barskova T, et al. Cardiac involvement in systemic rheumatic diseases: An update. Autoimmun Rev. 2010;9:849-52. [ Links ]
41. Tincani A, Rebaioli C. B, Taglietti M, Shoenfeld Y. Heart involvement in systemic lupus erythematosus, anti-phospholipid syndrome and neonatal lupus. Rheumatology. 2006;45:iv8-13. [ Links ]
42. Villa-Forte A, Mandell BF. Cardiovascular disorders and rheumatic disease. Rev Esp Cardiol (Engl Ed). 2011;64:809-17. [ Links ]
43. Pyrpasopoulou A, Chatzimichailidou S, Aslanidis S. Vascular disease in systemic lupus erythematosus. Autoimmun Dis. 2012;2012:876456. [ Links ]
44. Sherer Y, Zinger H, Shoenfeld Y. Atherosclerosis in systemic lupus erythematosus. Autoimmunity. 2010;43:98-102. [ Links ]
45. Turiel M, Sarzi-Puttini P, Atzeni F, De Gennaro Colonna V, Gianturco L, Tomasoni L. Cardiovascular injury in systemic autoimmune diseases: an update. Int Emerg Med. 2011;6:99-102. [ Links ]
46. Wehlou C, Delanghe JR. Detection of antibodies in cardiac autoimmunity. Clin Chim Acta. 2009;408:114-22. [ Links ]
47. Fairweather D, Rose N. Inflammatory heart disease: a role for cytokines. Lupus. 2005;14:646-51. [ Links ]
48. Reichmann JP. Letter to editor. Int J Womens Health. 2013;5:35. [ Links ]
49. Riboldi P, Gerosa M, Meroni PL. Statins and autoimmune diseases. Lupus. 2005;14:765. [ Links ]
50. Bruce IN. 'Not only...but also': factors that contribute to accelerated atherosclerosis and premature coronary heart disease in systemic lupus erythematosus. Rheumatology. 2005;44:1492. [ Links ]