Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista Colombiana de Reumatología
Print version ISSN 0121-8123
Rev.Colomb.Reumatol. vol.20 no.3 Bogotá july/Sept. 2013
Reporte de caso
Pioderma gangrenoso refractario: utilidad de la terapia combinada. Enfoque en beneficio de la terapia hiperbárica en su tratamiento
Refractory pyoderma gangrenosum: Utility of combined therapy. Focus on benefits of hyperbaric therapy in its treatment
Juan Sebastián Segura Charry*, Diego Alejandro Jaimes y John Darío Londoño
Sección de Reumatología, Departamento de Medicina Interna, Universidad de la Sabana, Hospital Militar Central, Bogotá, Colombia
* Autor para correspondencia. Correo electrónico: spitfire3006@hotmail.com (J.S. Segura Charry).
Recibido el 7 de marzo de 2013 Aceptado el 9 de julio de 2013
Resumen
El Pioderma Gangrenoso (PG) es un tipo de dermatosis neutrofílica que tiene un componente idiopático, o puede tener asociación con patologías subyacentes sistémicas. Es el resultado de una respuesta exagerada contra estímulos específicos y no específicos. Su primera línea de terapia son los GC; sin embargo, en algunos pacientes, no se logra control de su patología con éste tratamiento (local o sistémico), y se debe recurrir al uso de medicamentos inmunomoduladores, agentes biológicos Anti-TNFα, y en casos refractarios, esquemas no convencionales, como el uso de la terapia hiperbárica con oxígeno (THBO). En el caso actual, un varón de 42 años de edad previamente sano, debuta con lesión ulcerada en extremidad inferior derecha, manejado inicialmente con GC con mala respuesta. Requirió cambio de manera secuencial a múltiples inmunomoduladores sintéticos sin eficacia terapéutica. Se opta por inicio de terapia Anti-TNFα con fracaso terapéutico al uso de etanercept, infliximab y adalimumab en esquema regular. Finalmente, se modifica la temporalidad de adalimumab a uso semanal sin respuesta favorable; se adiciona: mofetilmicofenolato, y cincuenta sesiones de THBO, con control exitoso de la patología.
Palabras clave: Pioderma gangrenoso, Piel y enfermedades del tejido conectivo, Terapia hiperbárica, Adalimumab, Etanercept, Infliximab.
Abstract
Pyoderma gangrenosum is a type of neutrophilic dermatosis that has an idiopathic component, or can be associated with other underlying systemic pathologies. It is the result of an exaggerated response against specific and non specific stimuli. The first line of therapy are glucocorticoids (GC); however, in some patients, control of the pathology is not achieve with this treatment (local or systemic), and it is needed a step-up therapy going through several immuno-modulating treatments, biologic agents Anti - TNFα, and in refractory cases, the use of non conventional therapies such as Hyperbaric Oxygen Therapy (THBO). In this case, a previously healthy 42 year old man, debuts with an ulcerated lesion in his right lower limb, and he is initially treated with GC with poor response. He then required the use of several synthetic immune modulators without therapeutic efficacy. We opted to iniciate Anti-TNFα therapy obtaining therapeutic failure with the use of etanercept, infliximab, and adalimumab given in regular drug regimens. Finally, it is modify the frecuency of adalimumab to one dose per week without appropriate response; it is then added micofenolate mofetil, and fifty sessions of THBO, achieving successful control of this pathology.
Keywords: Pyoderma gangrenosum, Skin and connective tissue diseases, Hyperbaric oxygen therapy, Adalimumab, Etanercept, Infliximab.
Introducción
El pioderma gangrenoso (PG) es una enfermedad inflamatoria de etiología incierta, caracterizada por la infiltración neutrofílica de la dermis y destrucción tisular amplia1. Fue descrita en 1916 por Brocq et al., como «phagedenisme geometrique» y, posteriormente, Brunsting et al., la denominaron PG2, e indicaron que dicha enfermedad se desencadenaba por la diseminación de un foco infeccioso a distancia (intestino en pacientes con enfermedad inflamatoria intestinal, o pulmones en pacientes con empiema)3. Actualmente, el PG es considerado una dermatosis inflamatoria reactiva y hace parte del espectro de las dermatosis neutrofílicas4.
Esta condición tiene una forma idiopática. Algunos pacientes tienen patologías subyacentes de base, como la enfermedad inflamatoria intestinal (EII), artritis reumatoide (AR), enfermedades hematológicas, síndromes de inmunodeficiencia humana y tumores sólidos5,6. Sin embargo, también existen algunas formas asociadas con reacciones adversas a medicamentos7.
La lesión clásica cutánea del PG, usualmente, inicia con una pústula central o como nódulos fluctuantes con un halo inflamatorio, que se expande periféricamente hasta formar una úlcera con borde levantado violáceo4. Las lesiones típicamente afectan extremidades inferiores y tronco7. La aparición tan variada de dichas úlceras ha llevado a proponer una clasificación clínica, que incluye cuatro variantes: ulcerativa, pustular, bulosa y vegetativa. Las últimas tres raramente tienen asociación sistémica, y entre ellas pueden variar hasta convertirse en formas ulcerativas7,8. El diagnóstico es clínico, no depende de los hallazgos en la biopsia, y puede ser un reto en sus fases tempranas. La aproximación histológica se realiza para excluir otras causas que puedan comportarse de manera similar y requieran otros enfoques, como las diferentes dermatosis neutrofílicas conocidas. Adicionalmente, se debe tener precaución con la realización de biopsias, por el fenómeno de «patergia» que puede empeorar la reacción local de la enfermedad7. Esta patología alcanza una mortalidad de hasta 30%, existen algunos predictores de mal pronóstico como son: sexo masculino, edad avanzada y la variedad de PG buloso (relacionado más con malignidad hematológica)8.
El tratamiento se basa en el uso de medicamentos tópicos y sistémicos, dentro de los cuales sobresalen los glucocorticoides (GC) y los inmunomoduladores. Recientemente, se ha utilizado la terapia biológica anti-TNFa, con buena respuesta. Existe un porcentaje de enfermos que es refractario a estas medidas terapéuticas y en el cual se recurre al uso de terapias alternativas como la hiperbárica con oxígeno (THBO).
El uso de la THBO, ha llamado la atención en el tratamiento de los pacientes con fenómenos refractarios, gracias a sus efectos de proliferación y diferenciación fibroblástica, formación de colágeno, aumentando la neovascularización y estimulación de la acción linfocitaria9-11. En la literatura se han reportado algunos casos exitosos con su uso y que han sido refractarios a las terapias convencionales12-20. En nuestro caso, se trata de un paciente que cursó con múltiples tratamientos y con la THBO tuvo una respuesta tanto rápida como favorable.
Presentación del caso
Paciente masculino de 36 años de edad, sin antecedentes previos de importancia, quien presenta una lesión ulcerada en miembro inferior, de una semana de evolución, de aproximadamente 3x3 cm, asociada a dolor y secreción serosa por la herida, sin fiebre o compromiso sistémico. Evaluado inicialmente por dermatología quienes, consideran tomar biopsia de piel y continuar seguimiento ambulatorio, con la administración de antibiótico oral. El informe de la biopsia de piel describe: hiperqueratosis focal, ulceración con polimorfonucleares (PMN) neutrófilos y detritus celulares, dermis superficial con edema e infiltrado PMN neutrófilo, mezclado con áreas de necrosis y hemorragia, más trombo focal de pequeño calibre, compatible con PG.
Inicialmente, recibió tratamiento con prednisolona 1 mg/ kg/día, sin respuesta. Se hospitalizó para ampliar estudios y buscar alternativas de tratamiento. Se descartó infección sistémica (hemocultivos negativos, ELISA VIH negativa, hepatitis B negativa, hepatitis C negativa, PPD negativa, cultivo de secreción negativo). El resultado de los exámenes inmunológicos estuvo dentro de los parámetros normales (ANAS 1/80, ENAS negativos, complemento no consumido, ANCAS negativos, antiDNA negativo). Una colonoscopia total fue considerada normal descartando EII. Los marcadores tumorales, electroforesis de proteínas (con medición de fracciones Kappa y Lambda libres en suero y orina) y TAC toracoabdominal fueron normales, descartando patología tumoral. Se adicionó al tratamiento ciclosporina A, dosis que se aumentó progresivamente hasta alcanzar 300 mg día, sin eficacia terapéutica. Fue valorado por reumatología, indicando el cambio del inmunomodulador por metotrexate (MTX) a dosis de 15 mg semanales por vía oral, sin respuesta y con la aparición de intolerancia gastrointestinal. Se suspendió el MTX y se inició azatioprina 100 mg diarios, por espacio de 6 meses sin obtener buenos resultados. Ante lo refractario del cuadro clínico se inició tratamiento con infliximab a dosis de 5 mg/ kg cada seis semanas, con respuesta favorable y remisión del cuadro clínico por aproximadamente siete meses, al cabo de los cuales reaparecen las lesiones en piel sin que existan factores desencadenantes. Se cambió el agente anti-TNFa por etanercept a dosis de 50 mg semanales. Al igual que con su predecesor, se alcanzó la remisión por 20 meses, después de los cuales presenta nueva recaída, que justificó el cambio a adalimumab 40 mg cada dos semanas, con el cual se obtiene buena respuesta por espacio de seis meses.
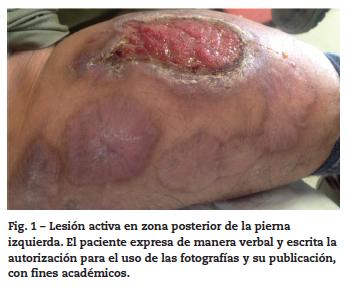
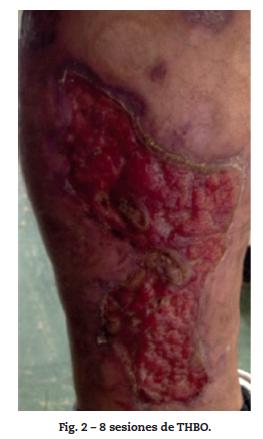
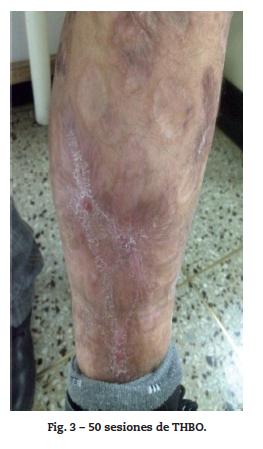
Por reaparición de las lesiones del PG (fig. 1); se aumentó la frecuencia de administración a 40 mg semanales, con pobre respuesta. Luego de 12 semanas de tratamiento, se adicionó mofetilmicofenolato un gramo diario y se inició THBO, entre 3 y 5 veces por semana, con rápida respuesta (fig. 2). Posterior a las primeras ocho sesiones de THBO se observa disminución de las lesiones, de la secreción y del dolor. Se logra la remisión completa de la enfermedad luego de 50 sesiones de THBO (fig. 3). Se disminuye paulatinamente la dosis de adalimumab hasta suspenderlo. Actualmente, recibe tratamiento con mofetilmicofenolato 500 mg por vía oral diarios, sin recaída de la enfermedad en 14 meses de seguimiento, no ha requerido nuevas sesiones de THBO.
Discusión
El tratamiento del PG es uno de los grandes retos al que se enfrentan las especialidades relacionadas con su manejo. En ausencia de ensayos clínicos que permitan determinar de manera definitiva cuál es el tratamiento de elección en esta enfermedad, se debe considerar, en el manejo de estos pacientes, la instauración de terapias tanto locales como sistémicas de manera concomitante.
El tratamiento de esta condición va desde el manejo tópico con GC intralesionales (aunque se evitan por el riesgo de patergia), ácido 5 aminosalicílico, benzoil peróxido, cromoglicato de sodio, ciclosporina intralesional, y nitrógeno21-27. En la mayoría de pacientes, los tratamientos sistémicos son de elección, entre los cuales se prefiere el uso de corticosteroides, en especial en la fase aguda y rápidamente progresiva del PG28. Inicialmente, se requieren dosis altas de prednisolona, en combinación con medicamentos inmunomoduladores, favoreciendo el ahorro de GC y promoviendo el efecto de curación sostenida29. Los GC han demostrado mayor efectividad y parecen ser la mejor opción de tratamiento, sin embargo, otros inmunomoduladores han mostrado buenos resultados en los pacientes que fallan a monoterapia con glucocorticoides.
Inicialmente, se emplearon las sulfas sin adecuada respuesta: sulfasalazina, sulfapiridina, sulfametoxi-piridazina y dapsona29-31. Posteriormente, se han descrito múltiples medicamentos entre los cuales se destacan: la clofazimina, fármaco utilizado en el manejo de la lepra, con reportes aislados de éxito terapéutico en el PG29-32 y la minociclina, por su efecto antimicrobiano e inhibidor de quimiotaxis33. Entre otras terapias utilizadas se encuentran: azatioprina, 6-mercaptopurina, ciclofosfamida, clorambucilo, colchicina, daunorrubicina29,34-36, las cuales tienen poca eficacia y alto riesgo de efectos adversos. Recientemente, se ha administrado la ciclosporina como medicamento coadyuvante, sin embargo, sus efectos tóxico, hematológico y renal, limitan su uso37. El mofetilmicofenolato ha demostrado ser efectivo en el tratamiento asociado con GC y ciclosporina38,39.
Últimamente, la terapia biológica anti-TNFa se ha utilizado con muy buenos resultados en los pacientes con enfermedad refractaria a los medicamentos anteriormente mencionados o con cuadros clínicos muy severos y rápidamente progresivos. Reportes de series de casos con la administración de infliximab describen buena respuesta, incluso con la aplicación tópica40-42. El uso de adalimumab ha demostrado ser efectivo en casos sin respuesta al infliximab, asociados con producción aumentada de anticuerpos contra el medicamento43. El etanercept, administrado a pacientes con falla a los tratamientos convencionales, mostró mejoría en el 73% de los pacientes en los cuales se usó44. Un porcentaje bajo de pacientes requiere la instauración de terapias más avanzadas como agentes biológicos anti-TNFa con respuesta favorable.
Es rara la presencia de no respuesta a los anti-TNFa, y la aplicación de otras terapias adyuvantes, como la THBO, han demostrado su utilidad recientemente, ganando progresivamente más protagonismo en el tratamiento de esta entidad y otros tipo de lesiones dérmicas como úlceras isquémicas, lesiones traumáticas e implantación de injertos cutáneos9-11,45,46.
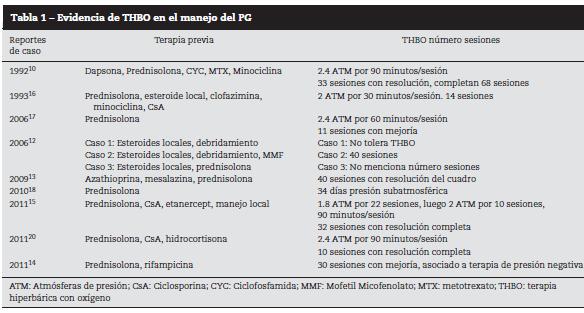
En este caso, con resistencia a las terapias sistémicas instauradas previamente, la mejoría fue rápida con la instauración de THBO. Este reporte se suma a los 9 existentes en la literatura, lo cual obliga a considerar su administración en los casos de PG refractario, rápidamente progresivos o con factores de mal pronóstico. Hasta el momento la THBO debe ser asociada al tratamiento sistémico, mas no debe ser considerada como sustituto del mismo. La THBO produce una respuesta rápida de las lesiones dérmicas a las pocas sesiones de su instauración, mientras que las terapias sistémicas convencionales, incluyendo el mofetilmicofenolato, parecen favorecer la remisión a largo plazo10,45,46 (tabla 1).
Así mismo, la THBO tiene pocos efectos adversos, demostrado en varios estudios, dando mención que su mayor efecto está relacionado con la sensación de claustrofobia y cuadros de ansiedad, que se resuelven de manera rápida en la medida en que se realizan las sesiones. Entre otros efectos documentados se menciona que hasta el 17% de los pacientes puede presentar disconfort ótico, con 3.8% de los casos con baro-trauma demostrado como trauma y ruptura timpánica, y mucho más rara es la presencia de toxicidad en el sistema nervioso central (SNC) asociada al uso de la misma y manifestada por convulsiones, sin secuelas ni recurrencias posteriores al uso de la THBO (< 0.5% de los casos)47,48.
Se podría concluir, que la adición de la THBO al tratamiento sistémico con inmunomoduladores, puede tener un efecto benéfico importante, especialmente cuando se ponderan los pocos efectos adversos que puede producir, a diferencia de los tratamientos inmunosupresores tradicionales. Sin embargo, se deberá acumular más experiencia y estudios aleatorizados para establecer su eficacia de manera definitiva.
Es importante mencionar que la disponibilidad de este mecanismo terapéutico es limitada, en nuestro caso en Bogotá, se cuenta sólo con el servicio de THBO en el Hospital Militar Central, donde existen 6 cámaras individuales, de marca Galeazzi, y Colaminas, con ejecución de la THBO entre 1.5 y 3 atmósferas de presión, entre 60 y 90 minutos, según el tipo de patología.
Bibliografía
1. Powell FC, Hackett BC, Wallach D. Pyoderma gangrenosum. En: Wolff K, Katz SL, Gilchrist BA, Paller AS, Leffell DJ, editores. Fitzpatrick's dermatology in general medicine. Nueva York: McGraw-Hill Companies; 2007. p. 296-302. [ Links ]
2. Bhat RM, Nandakishore B, Sequeira FF, Sukumar D, Kamath GH, Martis J, et al. Pyoderma gangrenosum: an Indian perspective. Clin Exp Dermatol. 2011;36(3):242-7. [ Links ]
3. Ruocco E, Sangiuliano S, Gravina AG, Miranda A, Nicoletti G. Pyoderma gangrenosum: an updated review. J Eur Acad Dermatol Venereol. 2009;23:1008-17. [ Links ]
4. Su WP, Davis MD, Weenig RH, Powell FC, Perry HO. Pyoderma gangrenosum: clinicopathologic correlation and proposed diagnostic criteria. Int J Dermatol 2004;43:790-800. [ Links ]
5. Powell FC, Schroeter AL, Su WP, Perry HO. Pyoderma gangrenosum: a review of 86 patients. Q J Med. 1985;55:173-86. [ Links ]
6. Rafael MR, Fernandes CM, Machado JM, Rodrigues PA, Cardoso OJ, Afonso A, et al. Pyoderma gangrenosum or leukaemia cutis? J Eur Acad Dermatol Venereol. 2003;17:449-51. [ Links ]
7. Crowson AN, Mihm MC, Jr., Magro C. Pyoderma gangrenosum: a review. J Cutan Pathol. 2003;30:97-107. [ Links ]
8. Russell B. Phagedenic and gangrenous ulceration of the skin complicating ulcerative colitis (Phagedena Geometricum). Br J Dermatol. 1950;62:114-24. [ Links ]
9. Heng MC. Hyperbaric oxygen therapy for pyoderma gangrenosum. Aust N Z J Med. 1984;14:618-21. [ Links ]
10. Wasserteil V, Bruce S, Sessoms SL, Guntupalli KK. Pyoderma gangrenosum treated with hyperbaric oxygen therapy. Int J Dermatol. 1992;31:594-6. [ Links ]
11. Niinikoski JH. Clinical hyperbaric oxygen therapy, wound perfusion, and transcutaneous oximetry. World J Surg. 2004;28:307-11. [ Links ]
12. Eulufi MA, Calderon OW, Pineros BJ, Silva CM, Cuadra CA, Leniz MP, et al. Pyoderma gangrenosum: report of three cases in plastic surgery. Rev Med Chil. 2006;134:339-44. [ Links ]
13. Herfarth AE, Martinez-Ramos D, Nomdedeu-Guinot J, Salvador-Sanchis JL. Hyperbaric oxygen therapyas an adjuvant treatment for pyoderma gangrenosum. Cir Esp. 2009;85:319-21. [ Links ]
14. Hill DS, O'Neill JK, Toms A, Watts AM. Pyoderma gangrenosum: a report of a rare complication after knee arthroplasty requiring muscle flap cover supplemented by negative pressure therapy and hyperbaric oxygen. J Plast Reconstr Aesthet Surg. 2011;64:1528-32. [ Links ]
15. Mazokopakis EE, Kofteridis DP, Pateromihelaki AT, Vytiniotis SD, Karastergiou PG. Improvement of ulcerative pyoderma gangrenosum with hyperbaric oxygen therapy. Dermatol Ther. 2011;24:134-6. [ Links ]
16. Newman WD, Frank HJ. Pyoderma gangrenosum of the orbit. Eye (Lond). 1993;7(Pt 1):89-94. [ Links ]
17. Niezgoda JA, Cabigas EB, Allen HK, Simanonok JP, Kindwall EP, Krumenauer J. Managing pyoderma gangrenosum: a synergistic approach combining surgical debridement, vacuum-assisted closure, and hyperbaric oxygen therapy. Plast Reconstr Surg. 2006;117:24e-28e. [ Links ]
18. Schoemann MB, Zenn MR. Pyoderma gangrenosum following free transverse rectus abdominis myocutaneous breast reconstruction: a case report. Ann Plast Surg. 2010;64:151-4. [ Links ]
19. Tutrone WD, Green K, Weinberg JM, Caglar S, Clarke D. Pyoderma gangrenosum: dermatologic application of hyperbaric oxygen therapy. J Drugs Dermatol. 2007;6:1214-9. [ Links ]
20. Vieira WA, Barbosa LR, Martin LM. Hyperbaric oxygen therapy as an adjuvant treatment for pyoderma gangrenosum. An Bras Dermatol. 2011;86:1193-6. [ Links ]
21. Jennings JL. Pyoderma gangrenosum: successful treatment with intralesional steroids. J Am Acad Dermatol. 1983;9:575-80. [ Links ]
22. Ko CB, Walton S, Wyatt EH. Pyoderma gangrenosum: associations revisited. Int J Dermatol. 1992;31:574-7. [ Links ]
23. Sanders CJ, Hulsmans RF. Successful treatment of pyoderma gangrenosum with topical 5-aminosalicylic acid. Cutis. 1993;51:262-4. [ Links ]
24. Nguyen LQ, Weiner J. Treatment of pyoderma gangrenosum with benzoyl peroxide. Cutis. 1977;19:842-4. [ Links ]
25. De Cock KM, Thorne MG. The treatment of pyoderma gangrenosum with sodium cromoglycate. Br J Dermatol. 1980;102:231-3. [ Links ]
26. Mrowietz U, Christophers E. Clearing of pyoderma gangrenosum by intralesional cyclosporin A. Br J Dermatol. 1991;125:499. [ Links ]
27. Tsele E, Yu RC, Chu AC. Pyoderma gangrenosum-response to topical nitrogen mustard. Clin Exp Dermatol. 1992;17:437-40. [ Links ]
28. Holt PJ, Davies MG, Saunders KC, Nuki G. Pyoderma gangrenosum: clinical and laboratory findings in 15 patients with special reference to polyarthritis. Medicine (Baltimore). 1980;59:114-33. [ Links ]
29. Perry HO. Pyoderma gangrenosum. Australas J Dermatol. 1982;23:53-61. [ Links ]
30. Altman J, Mopper C. Pyoderma gangrenosum treated with sulfone drugs. Minn Med. 1966;49:22-6. [ Links ]
31. Zhu YI, Stiller MJ. Dapsone and sulfones in dermatology: overview and update. J Am Acad Dermatol. 2001;45:420-34. [ Links ]
32. Kaplan B, Trau H, Sofer E, Feinstein A, Schewach-Millet M. Treatment of pyoderma gangrenosum with clofazimine. Int J Dermatol. 1992;31:591-3. [ Links ]
33. Lynch WS, Bergfeld WF. Pyoderma gangrenosum responsive to minocycline hydrochloride. Cutis. 1978;21:535-8. [ Links ]
34. Powell FC, Su WP, Perry HO. Pyoderma gangrenosum: classification and management. J Am Acad Dermatol. 1996;34:395-409; quiz 410-2. [ Links ]
35. Newell LM, Malkinson FD. Pyoderma gangrenosum. Response to cyclophosphamide therapy. Arch Dermatol. 1983;119:495-7. [ Links ]
36. Zonana-Nacach A, Jimenez-Balderas FJ, Martinez-Osuna P, Mintz G. Intravenous cyclophosphamide pulses in the treatment of pyoderma gangrenosum associated with rheumatoid arthritis: report of 2 cases and review of the literature. J Rheumatol. 1994;21:1352-6. [ Links ]
37. Elgart G, et al. Treatment of pyoderma gangrenosum with cyclosporine: results in seven patients. J Am Acad Dermatol. 1991;24:83-6. [ Links ]
38. Liu V, Mackool BT. Mycophenolate in dermatology. J Dermatolog Treat. 2003;14:203-11. [ Links ]
39. Michel S, Hohenleutner U, Mohr V, Landthaler M. Therapy-resistant pyoderma gangrenosum-treatment with mycophenolate mofetil and cyclosporine A. Hautarzt. 1999;50:428-31. [ Links ]
40. Regueiro M, Valentine J, Plevy S, Fleisher MR, Lichtenstein GR. Infliximab for treatment of pyoderma gangrenosum associated with inflammatory bowel disease. Am J Gastroenterol. 2003;98:1821-6. [ Links ]
41. Romero-Gómez M, Sánchez-Muñoz D. Infliximab induces remission of pyoderma gangrenosum. Eur J Gastroenterol Hepatol. 2002;14:907. [ Links ]
42. Streit M, Beleznay Z, Braathen LR. Topical application of the tumour necrosis factor-alpha antibody infliximab improves healing of chronic wounds. Int Wound J. 2006;3:171-9. [ Links ]
43. Jacob SE, Weisman RS, Kerdel FA. Pyoderma gangrenosum- rebel without a cure? Int J Dermatol. 2008;47:192-4. [ Links ]
44. Charles CA, Leon A, Banta MR, Kirsner RS. Etanercept for the treatment of refractory pyoderma gangrenosum: a brief series. Int J Dermatol. 2007;46:1095-9. [ Links ]
45. Feldmeier JJ, Hampson NB. A systematic review of the literature reporting the application of hyperbaric oxygen prevention and treatment of delayed radiation injuries: an evidence based approach. Undersea Hyperb Med. 2002;29:4-30. [ Links ]
46. Mortensen CR. Hyperbaric oxygen therapy. Curr Anaesth Crit Care. 2008;19:333-7. [ Links ]
47. Ambiru S, Furuyama N, Aono M, Otsuka H, Suzuki T, Miyazaki M. Analysis of risk factors associated with complications of hyperbaric oxygen therapy. J Crit Care. 2008;23:295-300. [ Links ]
48. Plafki C, Peters P, Almeling M, Welslau W, Busch R. Complications and side effects of hyperbaric oxygen therapy. Aviat Space Environ Med. 2000;71:119-24. [ Links ]