Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista Colombiana de Reumatología
Print version ISSN 0121-8123
Rev.Colomb.Reumatol. vol.20 no.4 Bogotá Oct./Dec. 2013
Investigación original
Efecto del alendronato sobre el perfil de citoquinas y metaloproteinasas 2 y 9 en un modelo múrido de artritis experimental
Alendronate effects on cytokines and metalloproteases 2 and 9 profiles in an experimental arthritis murine model
Emilio De Simonea, Nicolás Caggianoa, Magalí Pollia, Jesica Rolandoa, Yael Lastraa, Federico Gullaceb, Elisabet Ritaccoc, Verónica De Luca Sarobéa y Angelina Chiappe Barbaráa,*
aCátedra de Fisiología Animal, Facultad de Ciencias Veterinarias, Universidad de Buenos Aires, Buenos Aires, Argentina
bBioterio Central, Facultad de Ciencias Veterinarias, Universidad de Buenos Aires, Buenos Aires, Argentina
cCátedra de Endodoncia, Facultad de Odontología, Universidad de Buenos Aires, Buenos Aires, Argentina
* Autor para correspondencia. Correo electrónico: mach@fvet.uba.ar (A. Chiappe Barbará).
Historia del artículo: Recibido el 11 de julio de 2013 Aceptado el 13 de enero de 2014
Resumen
Introducción: La artritis es una de las artropatías más frecuentes, se caracteriza por el daño que produce en el cartílago articular y la resorción ósea subcondral. El diagnóstico temprano es de crucial importancia para instaurar una terapia preventiva, ya que, en ocasiones, la enfermedad es diagnosticada al presentarse lesiones óseas de difícil resolución.
Objetivos: Caracterizar, en un modelo múrido de artritis experimental producida por adyuvante, el perfil de distintos biomarcadores articulares, interleuquinas (IL-4, IL-6 y TNF-a) y metaloproteasas (MMP-2 y MMP-9), que permitan seguir la evolución de la enfermedad y analizar sus diferencias, al aplicar el tratamiento con alendronato en forma preventiva o curativa.
Materiales y métodos: El alendronato, en forma preventiva, se aplicó el día 0 y de manera curativa a los dos meses posadyuvante. Se realizó un puntaje de los síntomas clínicos; al sacrificio, se determinaron los marcadores articulares y se realizaron los estudios histopatológicos y radiográficos.
Resultados: Lo más destacable fue que el grupo que recibió el alendronato, de manera preventiva, alcanzó un puntaje clínico normal de manera más temprana que el grupo control con adyuvante. Asimismo, los animales tratados con alendronato presentaron valores significativamente más bajos de metaloproteasas.
Conclusiones: Nuestros resultados sugieren que, aparentemente, el alendronato disminuye la actividad de proteasas vinculadas a la fisiopatología de la enfermedad articular, lo cual podría resultar sumamente beneficioso para la terapéutica a instaurar.
Palabras clave: Alendronato, Artritis, Metaloproteasas, Interleuquinas.
Abstract
Introduction: Arthritis is one of the most common arthropathies, characterized by cartilage damage associated with subchondral bone resorption. Early diagnosis is crucial for the prevention of subchondral bone lesions.
Objectives: To use an experimental adjuvant arthritis rat model, to measure joint biomarkers, interleukins (IL-4, IL-6 and TNF-a), and metalloproteases (MMP-2 and MMP-9) to follow the progression of the disease and to analyze the possible changes in the different treatment groups, with preventive or curative alendronate.
Materials and methods: Preventive alendronate was applied on day 0, and a curative regimen 2 months post-adjuvant. A clinical scale score was used for characterizing clinical symptoms, and, at sacrifice, joint biomarkers and histopathological and radiographic studies were determined.
Results: The most notable result was that the group that received preventive alendronate reached a normal clinical score faster than control adjuvant group. All alendronate groups showed significantly lower MMPs levels.
Conclusions: Alendronate apparently decreases proteases activity linked to the pathophysiology of joint disease, this could be extremely beneficial for the clinical outcome of arthritis.
Keywords: Alendronate, Arthritis, Metalloproteases, Interleukins.
Introducción
Las artritis son una de las artropatías más comunes en medicina humana y veterinaria, especialmente en los equinos deportivos. Pueden tener diferentes etiologías; generalmente cursan con dolor y se presentan de forma aguda o crónica. Reducen la capacidad deportiva y la calidad de vida de los individuos enfermos1.
En general, las artritis están asociadas a un grado variable de sinovitis y se caracterizan por el daño que producen en el cartílago articular, que puede también involucrar al hueso subcondral2. En muchos casos, esta enfermedad cursa con períodos tempranos de actividad y luego evoluciona hacia una asociación de procesos degenerativos e inflamatorios crónicos, con periodos de remisión cada vez más escasos.
Ciertas artritis pueden diagnosticarse mediante el uso de técnicas por imágenes. Sin embargo, este tipo de diagnóstico es generalmente tardío, por lo que la enfermedad, por lo general, se encuentra en un grado avanzado al ser diagnosticada. Por esto, es fundamental detectar las artritis en las primeras fases de la enfermedad, con el fin de implementar tratamientos que no sólo limiten su progresión sino que también permitan impedir el deterioro de la función articular. Algunos métodos de diagnóstico por imágenes, como la resonancia magnética, podrían ser de utilidad para identificar lesiones precoces3; pero es una técnica costosa y difícil de practicar en medicina de animales deportivos. Por tal motivo, el estudio de biomarcadores podría ser de interés para el diagnóstico precoz de la enfermedad articular. Entre los principales biomarcadores de las artritis se encuentran: las citoquinas, las metaloproteasas de matriz (MMPs), las prostaglandinas y el óxido nítrico4.
Las citoquinas juegan un rol importante en el proceso inflamatorio, siendo ampliamente estudiadas por su papel de biomarcadores en la enfermedad ósea en medicina humana5 y veterinaria6. Las principales citoquinas proinflamatorias implicadas son: IL-1, IL-6 y TNF-α. Asimismo, en el marco de la secuencia de inflamación y destrucción que se produce, también participan las metaloproteasas7, agrecanasas8 y óxido nítrico9, entre otros.
Las MMPs son una familia de enzimas proteolíticas que participan en el remodelado tisular, en situaciones fisiológicas y patológicas. La acción de las mismas está altamente involucrada en la patogénesis del daño articular, produciendo una degradación irreversible del cartílago10. Diversos estudios muestran una regulación alta de diversas metaloproteinasas en procesos artríticos.
Los bifosfonatos (BPs) son análogos sintéticos del pirofosfato. Entre ellos, los aminobifosfonatos cuentan con un grupo amino que les brinda mayor potencia de acción respecto de los BPs de primera generación. El alendronato es uno de los aminobifosfonatos más estudiados en el tratamiento de la osteoporosis posmenopáusica, debido a su efecto inhibitorio de la actividad osteoclástica, sin efectos fragilizantes asociados a su actividad antirresortiva. Otras indicaciones terapéuticas de los BPs son: el tratamiento de patologías oncológicas que presentan afección ósea, la enfermedad de Paget y la osteogénesis imperfecta, entre otras11. Los BPs, debido a su avidez por cationes de dos valencias, son capturados por el calcio del hueso en intensa actividad resortiva y, una vez unidos a la hidroxiapatita, inhiben la acción de los osteoclastos e indirectamente la resorción ósea12. También se les reconoce acción anabólica sobre osteoblastos y osteocitos.
Actualmente, se está evaluando el uso de los BPs en problemas no metabólicos como pueden ser ciertas artritis. Los BPs actuarían en el hueso mediante mecanismos que involucran la inducción de apoptosis en osteoclastos12, la prevención de la degradación extracelular y la disminución de citoquinas proinflamatorias13. En medicina veterinaria, los BPs han sido utilizados para aliviar signos de osteoartritis en equinos y en modelos experimentales14,15; sin embargo, su rol en el perfil inflamatorio aún no ha sido evaluado. Asimismo, se ha observado, en un modelo canino de sección de ligamento cruzado, que los BPs mejoraron los cambios estructurales y los síntomas de osteoartritis16.
Respecto al sistema inmune, es conocida la respuesta de fase aguda que se observa en algunos pacientes tratados con BPs. Esta respuesta está mediada por la liberación de IL-6 y, en algunos casos, es considerada un efecto adverso que ocurre posdosificación por vía endovenosa al momento de la primera aplicación de BPs17,18. Algunos autores han descrito que la administración de aminobifosfonatos produce una reacción inflamatoria con fiebre y aumento de citoquinas tales como: IL-1, IL-6 y TNF-α, dando lugar a una respuesta de fase aguda con aumento de proteína C reactiva y amiloide A sérico durante 72 horas17,19. Esta liberación de citoquinas inflamatorias ocurriría por el estímulo de los aminobifosfonatos sobre monocitos, macrófagos y linfocitos T gamma delta. Casi todos los aminobifosfonatos pueden inducir una fase aguda inflamatoria; sin embargo, hay variación respecto de las citoquinas inducidas por cada aminobifosfonato17.
En la actualidad, hay controversias y poca información en cuanto al efecto preventivo, curativo o deletéreo de los BPs en el tratamiento de ciertos tipos de artritis. Por este motivo se analizaron los efectos del alendronato en un modelo de artritis experimental en ratas. Se utilizó el modelo de artritis inducida por adyuvante, ya que es un modelo aceptado para artritis reumatoide y presenta niveles altos de biomarcadores moleculares para probar la acción de los bifosfonatos sobre el perfil inflamatorio. Asimismo, se pretendió evaluar si dos diferentes tratamientos con bifosfonatos modifican el perfil y la expresión de citoquinas inflamatorias, como IL-6 y TNF-a, ya que ambas se encuentran elevadas en diferentes tipos de artritis20,21. Además, se determinaron los niveles de IL-4, una citoquina antiinflamatoria de uso terapéutico en artritis de diversa etiología22. También se evaluó la actividad de MMPs involucradas en el daño articular como la MMP-2 y la MMP-923 y se realizaron evaluaciones clínica, histopatológica y radiológica de las articulaciones en los diferentes tratamientos.
Materiales y métodos
Animales y modelo experimental
Se trabajó con un modelo múrido de artritis inducida por adyuvante24. Las ratas, cepa Sprague Dawley (Bioterio Facultad de Ciencias Veterinarias, Universidad de Buenos Aires), tenían 10 semanas de edad al comienzo de la experiencia y se mantuvieron en condiciones estándar de ambiente y nutrición. La artritis se indujo por la administración de adyuvante completo de Freund (Sigma, USA) subplantar, a una dosis de 0,3mL/kg peso corporal. El diseño consistió en 5 grupos de 5 animales cada uno: basal, alendronato control (75 mg/kg SC 2/sem), adyuvante (CFA 100 ml subplantar día 0), alendronato preventivo (CFA + alendronato a partir del día 0) y alendronato tardío (CFA + alendronato a partir del día 60 y hasta el día 90). En este estudio utilizamos, como alternativa terapéutica no tradicional para la artritis, BPs en dos modalidades de dosis terapéuticas distintas, una preventiva del daño y otra curativa. Los tratamientos a partir del día 0 y 60 buscaron evaluar los efectos del alendronato preventivo y curativo, respectivamente. A los 90 días se sacrificaron en cámara de dióxido de carbono. El diseño experimental y las condiciones de trabajo fueron aprobados por el Comité Institucional de Cuidado y Uso de Animales de Experimentación de la Facultad de Ciencias Veterinarias de la Universidad de Buenos Aires.
Puntaje clínico
Se definió un puntaje de 0 a 4 según el grado de gravedad de la claudicación: 0 representa ausencia de claudicación; 1: claudicación apenas perceptible; 2: claudicación moderada; 3: claudicación muy marcada en la que, en ocasiones, el animal sustrae al apoyo el miembro y 4: se presenta con sustracción al apoyo la mayor parte del tiempo. La observación de los síntomas se realizó dos veces por semana.
Estudios histopatológicos
Una vez finalizada la experiencia se procedió a la eutanasia de las ratas en cámara de dióxido de carbono y se extrajeron las articulaciones: tibiotarsiana y femorotibiorrotuliana, para evaluación histopatológica. Las muestras se fijaron en formol al 10% y se realizó un proceso estándar de descalcificación para muestras óseas. Los cortes se tiñeron con hematoxilina eosina. Las muestras observadas se clasificaron de 0 a 5 según el grado de infiltración celular y resorción ósea del hueso subyacente25.
Zimografías
La actividad de MMP-2 y MMP-9 se analizó mediante zimografía en geles de poliacrilamida con el agregado de gelatina26. La muestra consistió en lisados articulares que se realizaron disecando la articulación femorotibiorrotuliana para trituración en homogenizador; las muestras se recuperaron en PBS 1 mL/gr de tejido. Al producto obtenido se le determinó la concentración de proteínas utilizando un kit comercial (Wiener Lab.; Argentina). Alícuotas de 100 ug se mezclaron con el buffer muestra en el SDS-PAGE 10% con 0,2% de gelatina. Luego, los geles fueron lavados con 50 mM Tris-HCl pH 7.5 con el agregado de 2.5% de Triton X-100 durante 45 minutos, seguido de lavado con 50 mM Tris-HCl 5 mM CaCl 1 uMZnCl2 pH7.5 con el agregado de 2.5% de Triton X-100 pH7.5 durante 45 minutos. A continuación se incubaron con 50 mM Tris-HCl, 10 mM CaCl2, 200 mM NaCl pH7.5 a 37º por 24 horas. Finalmente, se tiñeron con 0.5% Coomassie Brilliant Blue R-250 por dos horas y posteriormente fueron desteñidos con solución decolorante (25%v/v isopropanol 10%v/v ácido acético). La actividad gelatinolítica generó bandas claras, realizándose un estudio densitométrico de las bandas por medio del G image software. La actividad zimográfica fue expresada como porcentaje (%) respecto al basal. Los datos correspondientes a diferentes geles fueron normalizados.
Estudios radiográficos
Se realizaron estudios radiográficos de la articulación femorotibiorrotuliana en incidencias frontocaudal y laterolateral, con equipo de rayos X con radiovisiógrafo digital (Kodak), especial para muestras de animales de laboratorio. Se analizaron mediante puntaje radiográfico, de acuerdo con lo descrito previamente por otros autores27, con ligeras modificaciones. Brevemente, se aplicó una escala de valoración para inflamación de tejidos blandos (0-2), estrechamiento del espacio articular (0-2) y daño del contorno articular (0-2), siendo el rango total de 0 a 6.
ELISA de IL-4, IL-6 y TNF-α
La concentración de citoquinas (IL-4, IL-6, TNF-a) en los sobrenadantes de los lisados articulares, preparados al igual que lo descrito en el ítem de zimografías, fue determinada mediante ELISA de captura comercial BD OptEIA (BD, Biosciences, San Diego, CA, USA), siguiendo las recomendaciones del fabricante. Las concentraciones se determinaron mediante curva patrón realizada con la respectiva citoquina recombinante suministrada en el kit. Se leyeron las muestras en lector de microplacas Rayto 2100 (China).
Análisis estadísticos
Los análisis estadísticos y los gráficos se realizaron utilizando el software Instat3 y el GraphPad Prism (Graph Pad Software Inc. San Diego, CA, USA). Se aplicó ANOVA para establecer si existían diferencias significativas entre los distintos grupos en estudio (p≤0.05) y luego el test de Tukey de comparaciones múltiples.
Resultados
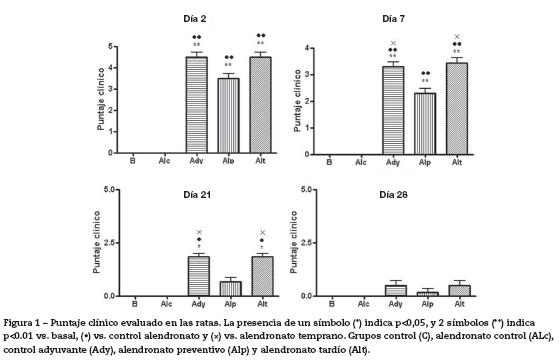
Puntaje clínico. Las ratas que recibieron adyuvante presentaron signos clínicos agudos de artritis a las 48 horas de aplicación, con diferencias significativas (p<0,01) respecto de los grupos basal y control alendronato. Al día 7 el grupo alendronato preventivo, que se usó para evaluar los efectos tempranos del alendronato, presentó diferencias significativas respecto del grupo adyuvante control y alendronato tardío, para evaluar efectos curativos (p<0,05). Este grupo aún no había recibido tratamiento con alendronato, ya que éste se inició el día 60; es decir, en este momento, este grupo se comportaba como el adyuvante control.
Estas diferencias se mantuvieron hasta el día 21, momento en el cual el grupo alendronato preventivo no presentaba diferencias significativas respecto al grupo basal y control alendronato (p>0,05), pero sí respecto a los grupos adyuvante y alendronato tardío (p<0,05). A partir del día 28 no hubo diferencias significativas entre los grupos (fig. 1).
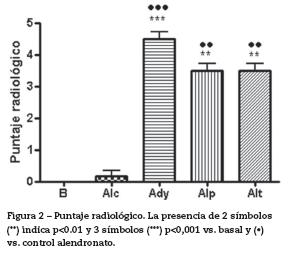
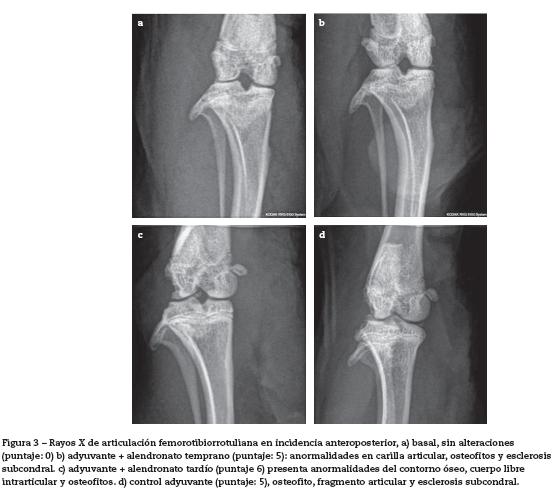
Puntaje radiológico: Las ratas que recibieron adyuvante presentaron, al día de la eutanasia, signos clínicos agudos de artritis con lesiones radiológicas manifiestas con compromiso subcondral. Las lesiones observadas fueron: pérdida de interlínea con disminución del espacio articular, deformación del cartílago articular y liberación de fragmentos articulares en todos los animales que recibieron adyuvante, tanto los grupos tratados como los controles. Además, se observó esclerosis y ligera osteofitosis (figs. 2 y 3).
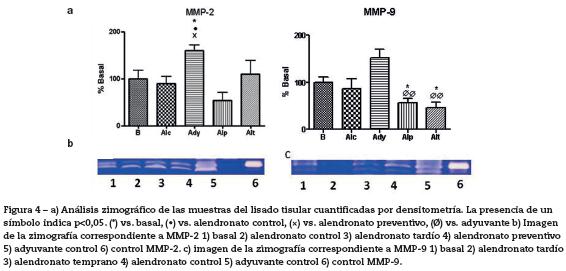
Determinación de MMPs. Se midieron MMPs por densitometría de la zimografía (% vs. basal). Respecto a MMP-2, se observaron diferencias significativas (p<0,05) entre los grupos control y alendronato preventivo (fig. 4). Y respecto a MMP-9, el grupo alendronato tardío presentó diferencias significativas con el basal (p<0,05) y con el grupo adyuvante (p<0,01) (fig. 4). El alendronato temprano presentó diferencias significativas respecto del adyuvante (p<0,01).
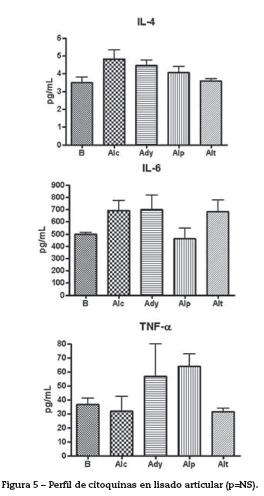
Determinación de citoquinas. La determinación de citoquinas proinflamatorias (IL-6 y TNF-α) no presentó diferencias entre los grupos (fig. 5). Al medir la actividad de la IL-4, citoquina que predomina en las respuestas de tipo Th2 con función antiinflamatoria y moduladora de la actividad del TNF-α, no se encontraron diferencias significativas entre los diferentes grupos al momento de la eutanasia.
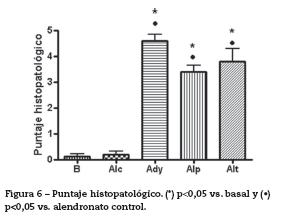
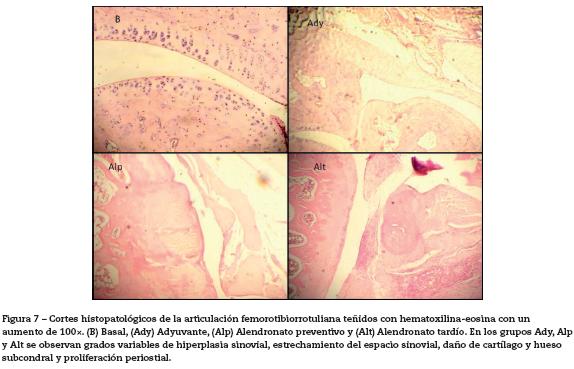
Puntaje histopatológico. La observación histopatológica de las muestras indicó que había diferencias significativas entre el grupo basal respecto a los grupos adyuvante control y alendronato preventivo y tardío (p<0,05). También se encontraron diferencias significativas entre el grupo alendronato control y los grupos adyuvante control (p<0,05) y alendronato preventivo y tardío (p<0,05) (fig. 6). Entre las lesiones más observadas en los animales que recibieron adyuvante se encontraron: infiltración de células inflamatorias en el tejido sinovial y subsinovial, hiperplasia sinovial, estrechamiento del espacio sinovial, daño de cartílago y hueso subcondral y proliferación periostial (fig. 7).
Discusión
En este estudio de artritis experimental con adyuvante, el uso de alendronato en dos formas de dosificación: preventiva y curativa o tardía, tuvo como objeto en el primer caso atenuar el daño del hueso subcondral, fortaleciéndolo, por su efecto sobre osteoblastos y osteocitos, y en el segundo caso actuar sobre el hueso ya erosionado por la actividad del adyuvante aumentando la apoptosis de los osteoclastos28. Si bien las artritis son enfermedades primarias del cartílago con degradación focalizada, la misma está acompañada por marcados cambios en el hueso subcondral y periarticular subyacente que incluyen: esclerosis, formaciones quísticas y osteofitos29. Existe debate sobre la importancia de los cambios óseos en la iniciación y progresión de las artritis. Se ha sugerido que la alteración arquitectónica del hueso subcondral reduciría su habilidad para disipar las fuerzas y distribuir el impacto generado sobre la articulación. Esto aumentaría el pico máximo de fuerzas biomecánicas dinámicas y estáticas que el cartílago subyacente recibe, acelerando el daño de las dos fases huesos-cartílago a lo largo del tiempo30.
El análisis clínico de los animales con artritis inducida por adyuvante ha tenido como objeto valorar el grado de claudicación, que depende de la inflamación y del dolor en las articulaciones de los miembros posteriores. En esta experiencia se observó que las ratas a las cuales se les indujo la artritis presentaban un grado de inflamación bastante grave respecto de las basales y de las controles alendronato. Sin embargo, aquellas con tratamiento preventivo con alendronato fueron las que primero se recuperaron e igualaron el valor del grado de claudicación de las ratas controles en el día 20 (p<0,05 respecto al grupo basal). Esto podría estar mediado, en parte, por los efectos analgésicos y moduladores del dolor que poseen los aminobifosfonatos sobre el tejido óseo, lo cual ha sido estudiado en referencia a su uso en las metástasis óseas en procesos oncológicos31,32.
Los resultados radiográficos mostraron que todos los animales a los cuales se les indujo la artritis con adyuvante, desarrollaron signos graves independientes de los tratamientos con bifosfonatos. Por rayos X se pudo observar: inflamación de tejidos blandos, pérdida del contorno articular, formación de osteofitos, estrechamiento de la luz articular y fragmentos articulares. Estas lesiones coinciden con las lesiones radiográficas e histológicas descritas previamente en este modelo de artritis33,34.
Respecto a la determinación de citoquinas, la evaluación de marcadores inflamatorios como IL-6 y TNF-α, no permitió establecer que existiera diferencia significativa entre los grupos. Esto se explicaría por el hecho que éstas fueron evaluadas al momento de la finalización de la experiencia (tres meses posteriores a la aplicación del adyuvante). Es decir, que los animales que presentaban la artritis experimental ya habían pasado por la fase aguda de la inflamación en la cual, probablemente, predominarían estas dos citoquinas. Diferentes trabajos indican que el momento máximo de inflamación, en la artritis inducida por adyuvante, es a las tres semanas de producirse la inoculación. A partir de ese momento la inflamación declina, si bien la lesión permanece35. Previamente Szekanecz et al., evaluaron niveles de citoquinas en este modelo y encontraron los valores máximos hacia el día 4036. Si bien a los tres meses de inducida la artritis, IL-6 se encontró en valores basales en todos los grupos, su acción temprana pudo haber desencadenado el aumento de resorción ósea subcondral y deformación articular, quedando daño manifiesto al momento de la eutanasia. El TNF-α, por su parte, estaría involucrado en la inflamación, la pérdida ósea y la destrucción del tejido conectivo. Como puede verse en nuestro trabajo al momento final del estudio (90 días), al igual de lo que ocurrió con IL-6, no hay diferencias significativas, no descartándose niveles altos en momentos más tempranos y encontrándose daños que persisten y perduran más tardíamente. Otros autores han observado que en cierto tipo de artritis los niveles de citoquinas, IL-6 y TNF-a, guardarían relación con el grado de resorción ósea37 y que la evaluación de citoquinas monocitarias en pacientes que recibieron pamidronato tampoco mostró diferencias significativas de IL-6 y TNF-α38.
Respecto a las MMPs involucradas en la inflamación y daño óseo, MMP-2 se encuentra de manera constitutiva y MMP-9 se induce en la inflamación, originando degradación de la matriz extracelular, siendo la responsable de gran parte del daño óseo evidente. En el presente trabajo se vio que MMP-2 se encontraba significativamente más elevada en los animales con artritis inducida que no recibieron tratamiento. La MMP-2 incrementa sus valores en artritis, lo que podría tener un valor diagnóstico importante39. En este trabajo, los resultados respecto a las MMPs permitieron observar que, cuando se recibe un tratamiento con alendronato, ya sea en la modalidad preventiva o curativa, los niveles de MMP-2 no se elevan significativamente. Asimismo, se vio una reducción significativa de los niveles de MMP-9, en los animales tratados respecto de los no tratados. De esta manera, se puede afirmar que el tratamiento con alendronato, en sus dos versiones, parecería disminuir significativamente el nivel de MMP-9, lo cual podría verse reflejado en una mejor preservación del hueso subcondral, altamente afectado en los procesos artríticos. De esta manera, la administración de alendronato podría tener un efecto beneficioso, disminuyendo los procesos de proteólisis que se auto perpetúan, estimulando el avance del daño articular y la evolución hacia la cronicidad del cuadro clínico.
Conclusión
El tratamiento temprano o preventivo con alendronato produce efectos favorables en el animal con artritis inducida por adyuvante, lo que se refleja no sólo en una mejoría clínica, observada con el tratamiento preventivo, sino también en los niveles de MMP. La disminución de los niveles de MMPs se observó en los animales con ambos tipos de tratamiento. Esto último podría sugerir que el alendronato puede ser tenido en cuenta para disminuir los niveles exacerbados de proteasas en procesos osteoartríticos. Es importante destacar la utilidad de este modelo animal como modelo experimental para realizar inferencias sobre el desarrollo y evolución de las artritis en humanos y en otras especies animales.
Fuente de financiación
El trabajo fue financiado con el proyecto UBACyT 2010-2012 Nº 20020090100123.
Conflicto de intereses
Los autores declaran no tener ningún conflicto de intereses.
Bibliografía
1. Hunter DJ, McDougall JJ, Keefe FJ. The symptoms of osteoarthritis and the genesis of pain. Rheum Dis Clin North Am. 2008;34:623-43. [ Links ]
2. Kwan TS, Lajeunesse D, Pelletier JP, Martel-Pelletier J. Targeting subchondral bone or treating osteoarthritis: what is the evidence? Best Pract Res Clin Rheumatol. 2010;24:51-70. [ Links ]
3. Narváez JA, Narváez J, De Lama E, De Albert M. MR Imaging of Early Rheumatoid Arthritis. RadioGraphics. 2010;30:143-63. [ Links ]
4. De Grauw JC, van de Lest CHA, van Weeren PR. Inflammatory mediators and cartilage biomarkers in synovial fluid after a single inflammatory insult: a longitudinal experimental study. Arthritis Res Ther. 2009;11:R35. [ Links ]
5. Benito MJ, Veale DJ, FitzGerald O, van den Berg WB, Bresnihan B. Synovial tissue inflammation in early and late osteoarthritis. Ann Rheum Dis. 2005;64:1263-7. [ Links ]
6. Mc Ilwraith C. W. Use of synovial fluid and serum biomarkers in equine bone and joint disease: a review. Equine vet. J. 2005;37:473-82. [ Links ]
7. Tetlow LC, Adlam DJ, Woolley DE. Matrix metalloproteinase and proinflammatory cytokine production by chondrocytes of human osteoarthritic cartilage: associations with degenerative changes. Arthritis Rheum. 2001;44:585-94. [ Links ]
8. Huang K, Wu LD. Aggrecanase and aggrecan degradation in osteoarthritis: a review. J Int Med Res. 2008;36:1149-60. [ Links ]
9. Studer R, Jaffurs D, Stefanovic-Racic M, Robbins PD, Evans CH. Nitric oxide in osteoarthritis. Osteoarthr Cart. 1999;7:377-9. [ Links ]
10. Murphy G, Lee MH. What are the roles of metalloproteinases in cartilage and bone damage? Ann Rheum Dis. 2005;64:44-7. [ Links ]
11. Russell RG. Bisphosphonates: the first 40 years. Bone. 2011;49:2-19. [ Links ]
12. Roelofs AJ, Thompson K, Gordon S, Rogers MJ. Molecular mechanisms of action of bisphosphonates: current status. Clin Cancer Res. 2006;12:6222s-30s. [ Links ]
13. Monkkonen J, Simila J, Rogers MJ. Effects of tiludronate and ibandronate on the secretion of proinflammatory cytokines and nitric oxide from macrophages in vitro. Life Sci. 1998;62:PL95-102. [ Links ]
14. Gough MR, Thibaud D, Smith RK. Tiludronate infusion in the treatment of bone spavin: a double blind placebo-controlled trial. Equine Vet J. 2010;42:381-7. [ Links ]
15. Hayami T, Pickarski M, Wesolowski GA, Mclane J, Bone A, Destefano J et al. The role of subchondral bone remodeling in osteoarthritis: Reduction of cartilage degeneration and prevention of osteophyte formation by alendronate in the rat anterior cruciate ligament transection model. Arthritis Rheum. 2004;50:1193-206. [ Links ]
16. Moreau M, Rialland P, Pelletier JP, Martel-Pelletier J, Lajeunesse D, Boileau C, et al. Tiludronate treatment improves structural changes and symptoms of osteoarthritis in the canine anterior cruciate ligament model. Arthritis Res Ther. 2011;13:R98. [ Links ]
17. Olson K, Van Poznak C. Significance and impact of bisphosphonate induced acute phase responses. J Oncol Pharm Practice. 2007;13:223-9. [ Links ]
18. Anastasilakis AD, Polyzos SA, Makras P, Sakellariou GT, Bisbinas I, Gkiomisi A, et al. Acute phase response following intravenous zoledronate in postmenopausal women with low bone mass. Bone. 2012;50:5 1130-4. [ Links ]
19. Adami S, Bhalla AK, Dorizzi R, Montesanti F, Rosini S, Salvagno G, et al. The acute-phase response after bisphosphonate administration. Calcif Tissue Int. 1987;41:326-31. [ Links ]
20. Stolina M, Bolon B, Middleton S, Dwyer D, Brown H, Duryea D, et al. The evolving systemic and local biomarker milieu at different stages of disease progression in rat adjuvant-induced arthritis. J clin Immunol. 2009;29:158-74. [ Links ]
21. Chizzolini C, Dayer JM, Miossec P. Cytokines in chronic rheumatic diseases: is everything lack of homeostatic balance? Arthritis Res Ther. 2009;11:246. [ Links ]
22. Lubberts E, Joosten LA, Chabaud M, van Den Bersselaar L, Oppers B, Coenen-De Roo CJ, et al. IL-4 gene therapy for collagen arthritis suppresses synovial IL-17 and osteoprotegerin ligand and prevents bone erosion. J Clin Invest. 2000;105:1697-710. [ Links ]
23. Fotopoulos VC, Tzinia A, Tzurbakis M, Kalfakakou V, Levidiotou-Stefanou S, Georgoulis A. Expression levels of matrix metalloproteinase (MMP)-9 and its specific inhibitor TIMP-1, in septic and aseptic arthritis of the knee. Knee Surg Sports Traumatol Arthrosc. 2012;20:1159-67. [ Links ]
24. Whiteley, PE. Dalrymple, S A. 2001. Models of Inflammation: Adjuvant-Induced Arthritis in the Rat. Current Protoc Pharmacol 13:5.5.1-5.5.5. [ Links ]
25. Bendele A, Mc Comb J, Gould TY, Mc Abee T, Sennello G, Chlipala E, et al. Animal Models of Arthritis: Relevance to Human Disease. Toxicol Pathol. 1999;27:134-42. [ Links ]
26. Gruber BL, Sorbi D, French DL, Marchese MJ, Nuovo GJ, Kew RR, et al. Markedly elevated serum MMP-9 (gelatinase B) levels in rheumatoid arthritis: a potentially useful laboratory marker. Clin Immunol Immunopathol. 1996;78:161-71. [ Links ]
27. Bush KA, Farmer KM, Walker JS, Kirkham BW. Reduction of joint inflammation and bone erosion in rat adjuvant arthritis by treatment with interleukin-17 receptor IgG1 Fc fusion protein. Arthritis Rheum. 2002,46:802-5. [ Links ]
28. Plotkin LI, Manolagas SC, Bellido T. Dissociation of the pro-apoptotic effects of bisphosphonates on osteoclasts from their anti-apoptotic effects on osteoblasts/osteocytes with novel analogs. Bone. 2006;39:443-52. [ Links ]
29. Burr DB. The importance of subchondral bone in osteoarthrosis. Curr Opin Rheumatol. 1998;10:256-62. [ Links ]
30. Burr DB, Schaffler MB. The involvement of subchondral mineralizedtissues in osteoarthrosis: quantitative microscopic evidence. Microsc Res Tech. 1997;37:343-57. [ Links ]
31. Costa L., Major PP. Effect of bisphosphonates on pain and quality of life in patients with bone metastases. Nat Rev Clin Oncol. 2009;6:163-74. [ Links ]
32. Lipton A. Treatment of Bone Metastases and Bone Pain with Bisphosphonates. Support Canc Ther. 2007;4:92-100. [ Links ]
33. Martel RR, Klicius J, Metcalf G, Rona GA. Comparative effects of long term treatment with etodolac, naproxen and ibuprofen on articular and bone changes associated with adjuvant arthritis in rats. Agents Actions. 1984;15:403-12. [ Links ]
34. Connor JR, Manning PT, Settle SL, Moore WM, Jerome GM, Webber RK, et al. Suppression of adjuvant-induced arthritis by selective inhibition of inducible nitric oxide synthase. Eur. J. Pharmacol. 1995;273:15-24. [ Links ]
35. Van Eden W, Wagenaar-Hilbers JP, Wauben MH. Adjuvant arthritis in the rat. In: Curr Protoc Immunol. 2001;15:15.4. [ Links ]
36. Szekanecz Z, Halloran MM, Volin MV, Woods JM,.Strieter RM, Haines GKIII, et al. Temporal expression of inflammatory cytokines and chemokines in rat adjuvant-induced arthritis. Arthritis Rheum. 2000;43:1266-77. [ Links ]
37. Górska A, Kowal-Bielecka O, Urban M, Pietrewicz E. Interleukin-6 and tumor necrosis factor alpha levels in the serum and synovial fluid in relation to bone mineral density and turnover in children with juvenile idiopathic arthritis. Centr Eur J Immunol. 2008;33:216-9. [ Links ]
38. Van Offel JF, Schuerwegh AJ, Bridts CH, Bracke PG, Stevens WJ, De Clerck LS. Influence of cyclic intravenous pamidronate on proinflammatory monocytic cytokine profiles and bone density in rheumatoid arthritis treated with low dose prednisolone and methotrexate. Clin Exp Rheumatol. 2001;19:13-20. [ Links ]
39. Zrimšek P, Kadunc Kos V, Mrkun J, Kosec M. Diagnostic Value of MMP-2 and MMP-9 in Synovial Fluid for Identifying Osteoarthritis in the Distal Interphalangeal Joint in Horses. Acta Vet. Brno. 2007;76:87-95. [ Links ]