Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista Colombiana de Reumatología
Print version ISSN 0121-8123
Rev.Colomb.Reumatol. vol.21 no.2 Bogotá Apr./June 2014
Editorial
Nuevos medicamentos en el "Pipeline" para las enfermedades autoinmunes: nuevas opciones y nuevos retos
New drugs in the pipeline for autoimmune diseases. New options and new challenges
José A. Gómez-Puertaa,* y Gerardo Quintana L.b
aDivision of Rheumatology, Brigham and Women's Hospital, Boston, MA, Estados Unidos
bDepartamento de Medicina Interna, Facultad de Medicina, Universidad Nacional de Colombia, Bogotá, D.C., Colombia
* Autor para correspondencia. Correo electrónico: jgomezpuerta@mail.harvard.edu (J.A.Gómez Puerta).
La aparición constante de nuevos medicamentos en nuestro arsenal terapéutico no solo nos obliga a estar actualizados y abiertos a la llegada de nuevas terapias sino también nos cuestiona, y lo decimos a título personal pero sabemos que también es el sentimiento de otros colegas reumatólogos, si disponemos de más tratamientos que pacientes susceptibles de recibir dichas terapias.
La aparición de nuevas dianas terapéuticas y de fármacos biológicos biosimilares ha generado la propuesta, por algunos expertos, de una nueva terminología en la clasificación de los fármacos modificadores de la enfermedad en la artritis reumatoide1 (AR). La nueva propuesta de nomenclatura divide los FAMES en FAMES sintéticos convencionales, FAMES sintéticos contra dianas específicas, FAMES biológicos originales y FAMES biológicos biosimilares.
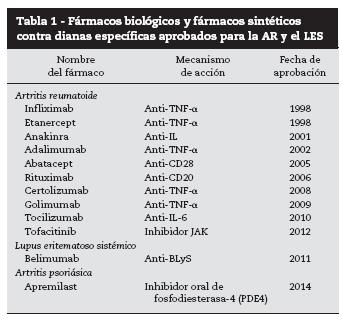
Durante los últimos 15 años se han aprobado por la FDA nuevas moléculas para el tratamiento de las enfermedades reumáticas autoinmunes y más concretamente para la AR, la artritis psoriática (APs), las espondiloartropatías y el lupus eritematoso sistémico (LES) (tabla 1). En marzo del 2011, la FDA, por primera vez en los últimos 50 años, aprobó un medicamento específicamente desarrollado para el LES. El belimumab (Benlysta©) fue aprobado para el tratamiento de pacientes con LES activo a pesar del tratamiento previo con inmunosupresores, antimaláricos o corticosteroides. En noviembre de 2012, la FDA aprobó la utilización del tofacitinib (Xeljanz©) para el tratamiento de la AR activa moderada a severa con una respuesta insuficiente o intolerancia al metotrexate (MTX). Si bien, a finales de 2013 se aprobó por la FDA la utilización del certolizumab (Cimzia©) para pacientes con espondilitis anquilosante y la APs, el certolizumab (Cimzia©) era un tratamiento ya conocido y aprobado en el 2008 para el tratamiento de los pacientes con AR activa.
Nuevos medicamentos aprobados por la FDA en el 2013
Un tercio de las nuevas medicaciones aprobadas en el 2013 (9 de 27) fueron identificadas por la FDA como medicamentos de primera clase, lo cual significa que tienen un mecanismo de acción único y novedoso para tratar ciertas condiciones médicas2.
Dichos medicamentos incluyen nuevas terapias para los tumores sólidos (dafrafenib, trametinib, afatinib), las neoplasias hematológicas (pomalidomida), terapias antivirales (dolutegravir, simeprevir y sofosbuvir), tratamientos para la EPOC (umeclidinium y vilanterol), la hipertensión arterial pulmonar (riociguat y macitentan), la diabetes mellitus tipo 2 (alogliptin y canagliflozina), tratamientos antidepresivos, contra la epilepsia (eslicarbazepina acetato), la esclerosis múltiple (dimetilfumarato) e hipolipemiantes (mipomersen), entre otros2.
De los 27 nuevos medicamentos, sólo 2 podrían, y seguramente de forma condicional, tener utilidad en nuestros pacientes con enfermedades autoinmunes, y más específicamente en el campo de la hipertensión pulmonar arterial. Dichos medicamentos son el macitentan (Opsumit©) y el riociguat (Adempas©).
Otro medicamento aprobado durante el 2013 con interés en reumatología y de utilidad en el campo de la osteoporosis posmenopáusica, es el bazedoxifeno (Duavee©), el cual es un modulador selectivo del receptor del estrógeno. Los resultados de los ensayos clínicos publicados recientemente3,4 y su interpretación están fuera del alcance del presente manuscrito.
El macitentan es un antagonista de la endotelina 1, el cual se une con gran afinidad a los 2 subtipos de receptores de endotelina (ET A y ET B). El macintentan se desarrolló con el objetivo de modificar la estructura del bosentan con el fin de hacer un bloqueo dual de los receptores de endotelina, mejorar la tolerancia y quizás la eficacia en comparación con otros antagonistas de receptores de endotelina5.
A fecha de hoy solo existen datos en modelos "in vitro" sobre el posible beneficio del macitentan en el proceso de fibrosis cutánea asociado a la esclerosis sistémica6 (ES). No obstante, se encuentran en marcha en la actualidad 2 ensayos clínicos diseñados para evaluar la utilidad del macitentan en la ES. El estudio DUAL-1 (ClinicalTrials.gov Identifier: NCT01474109) y el estudio DUAL-2 (ClinicalTrials.gov Identifier: NCT01474122) son estudios multicéntricos, doble ciego con un primer período fijo de 16 semanas seguido de un segundo período de duración variable. Los objetivos de los ensayos DUAL-1 y DUAL-2 son demostrar el efecto del macitentan sobre la reducción del número de úlceras digitales en pacientes con ES con úlceras digitales persistentes.
El riociguat es miembro de una nueva clase terapéutica, llamada estimulantes de la guanilato ciclasa soluble (sGC). La sGC es una enzima que ayuda a incrementar los niveles de cGMP (guanosin monofosfato cíclico), fundamental en el fenómeno de relajación del las células musculares lisas vasculares, incrementando así los efectos del óxido nítrico7. El riociguat tiene un modo de acción dual, estimulando de forma directa la sGC independientemente del óxido nítrico y aumentando la sensibilidad de la sGC al óxido nítrico8.
El riociguat tiene diferentes ensayos en la hipertensión pulmonar crónica asociado al tromboembolismo9, pero no dispone de datos en hipertensión pulmonar asociada a ES u otras enfermedades autoinmunes. Está en marcha un ensayo clínico de fase 2, el estudio DIGIT [Digital Flow Enhancement in Raynaud's Phenomenon With an sGC (Soluble Guanylate Cyclase) Stimulator, ClinicalTrials.gov Identifier: NCT01926847] que pretende evaluar la eficacia y la seguridad vs. el placebo del riociguat en pacientes con fenómeno de Raynaud de más de 1 año de evolución.
Nuevos tratamientos en el "pipeline"
Como es de esperar, el desarrollo de nuevas moléculas para el tratamiento de las enfermedades autoinmunes es constante y se encuentran en marcha diversos ensayos clínicos de fase 2 y 3 en el tratamiento del LES, la AR, la ES, las vasculitis y las espondiloartropatías incluyendo la APs. Las diferentes moléculas que están en el "pipeline" se resumen en la tabla 2.
Artritis reumatoide
El mavrilimumab es un anticuerpo monoclonal contra el receptor alfa del estimulador de colonias de granulocitos-macrófagos (GM-CSF) el cual modula la activación leucocitaria y atenúa la respuesta autoinmune. Recientemente, Burmester et al.10 evaluaron la eficacia y seguridad de la terapia con mavrilimumab (en 4 diferentes dosis) vs. placebo en 239 pacientes con respuesta inadecuada al MTX. Tras 12 semanas de tratamiento, los pacientes que recibieron mavrilimumab a dosis altas (100 mg cada 2 semanas) presentaron mejoría en los índices DAS-28 y en las respuestas ACR 20, ACR 50 y ACR 70. En los pacientes expuestos al mavrilimumab no se presentaron tasas significativas más elevadas de leucopenia respecto a los pacientes que recibieron placebo.
El tabalumab es un anticuerpo monoclonal humanizado anti-BAFF que neutraliza tanto la fracción unida a la membrana como la fracción soluble del BAFF (también conocida como el BLyS). El BAFF es una citocina de la familia del TNF que se requiere para la supervivencia de las células B. Genovese et al.11 publicaron recientemente un ensayo doble ciego controlado con placebo en 158 pacientes con AR activa a pesar del tratamiento con MTX. Los pacientes fueron asignados a recibir durante 24 semanas tratamiento con tabalumab de forma subcutánea cada 4 semanas o placebo. A las 12 y 24 semanas de tratamiento, los pacientes que recibieron tratamiento con tabalumab a dosis altas (120 mg) alcanzaron mejores tasas de respuesta que el placebo, tanto en los índices ACR 20 y ACR 50.
A pesar de estos primeros resultados prometedores del tabalumab en AR, su casa farmacéutica12 decidió suspender los ensayos de fase II no por falta de seguridad sino debido a falla en la eficacia tras un análisis interino de los resultados. Sin embargo, existe en marcha un ensayo con tabalumab en pacientes con LES.
El clazakizumab es un anticuerpo monoclonal subcutáneo anti-IL-6, el cual ha mostrado eficacia en monoterapia o en combinación con MTX en pacientes con AR, con actividad moderada-grave de acuerdo con un estudio de fase 2b recientemente presentado en el Congreso del ACR13. En dicho estudio los pacientes fueron asignados de forma aleatorizada para recibir placebo o clazakizumab 25 mg, 100 mg o 200 mg con MTX o adalimumab 40 mg cada 2 semanas más MTX (brazo activo). A la semana 12, las respuestas ACR 20 de los pacientes que recibieron clazakizumab 25 mg más MTX fueron del 78%, en los pacientes del brazo de 100 mg del 71%, del 60% en los que recibieron 200 mg y del 55% en los que recibieron clazakizumab en monoterapia. La respuesta ACR 20 fue del 76% en el brazo del adalimumab. A la semana 24 las tasas ACR 20 oscilaron entre el 58% y el 73% en los brazos que recibieron clazakizumab, del 39% en el placebo y del 68% en el brazo activo. Las tasas de remisión por DAS-28 PCR y por índices SDAI y CDAI fueron superiores en los pacientes que recibieron clazakizumab más MTX en comparación con los pacientes que recibieron adalimumab más MTX. Las tasas de efectos adversos fueron similares en los pacientes expuestos al clazakizumab y al adalimumab.
Ciertamente, los FAMES sintéticos contra dianas específicas y concretamente los inhibidores de tirosin quinasa constituyen una nueva opción en el arsenal terapéutico para las enfermedades autoinmunes y en especial para la AR14. Los resultados a corto plazo de los estudios pivotales, en especial del tofacitinib15,16, han demostrado que los inhibidores de la tirosin quinasa tienen tasas de respuesta similares a las terapias biológicas en términos de control de la actividad de la enfermedad.
El baricitinib conocido como LY3009104 (INCB28050) es un inhibidor de JAK1 y JAK2 con diversos ensayos en marcha para el tratamiento de la AR y la psoriasis17. Los autores informaron en EULAR 2013 los datos de eficacia y seguridad de baricitinib procedentes del estudio fase 2b JADA, estudio de extensión a 52 semanas abierto y a largo plazo, en pacientes con AR activa. Entre los pacientes que completaron la extensión del estudio, se observó que las mejorías clínicas obtenidas en la semana 24 se mantuvieron hasta el final de las 52 semanas. La extensión a largo plazo del estudio JADA evaluó la eficacia y seguridad de baricitinib en 201 pacientes que tomaban 4 mg (n=108) o 8 mg (n=93) una vez al día durante un máximo de 52 semanas. Las dosis pudieron aumentarse a 8 mg diarios a las 28 o 32 semanas a discreción del investigador, cuando el paciente presentaba más de 6 articulaciones dolorosas o inflamadas. Los resultados a las 12 semanas ya se habían publicado y en ellos se vio que baricitinib presentaba mejoras estadísticas en los signos y síntomas de AR comparado con placebo, manteniéndose o mejorando estas respuestas durante 12 semanas más de tratamiento en la parte del estudio ciego. En la extensión, a largo plazo, las mejorías clínicas observadas en la semana 24 se mantuvieron a lo largo de 52 semanas en pacientes con AR18.
El estudio CARAT-219 buscó evaluar un antagonista oral del receptor 1 de quimocina C-C (CCR1) de macrófagos, regulador de CCL3, CCL5 y CCL15, las cuales se han encontrado elevadas en pacientes con AR. Luego de que en CARAT-1 se hubiera demostrado la seguridad y tolerabilidad del CCX354-C, una molécula antagonista de CCR1, la cual logra inhibir su señalización, incluyendo la quimiotaxis, se realizó esta fase 2 para conocer la efectividad y seguridad en AR moderada a severa y dosis estables de MTX hasta 25 mg semanales. Fue un estudio aleatorizado, doble enmascarado y controlado con placebo. Los grupos probandos fueron sometidos a 12 semanas de CCX354-C 100 mg, 2 veces al día o 200 mg una vez al día. En relación a la seguridad, los 3 grupos mostraron resultados similares sin tener datos significativos en relación a algún dato individual. Para la respuesta ACR 20, 39% lo lograron en el grupo placebo en la semana 12, 43% en el grupo de 100 mg 2 veces diarias (p=0.62) y 52% en el grupo de 200 mg una vez al día (p=0.17) en el análisis por intención a tratar. Cuando se evaluaron en los grupos asignados al inicio del estudio, 30% en el grupo placebo, 44% en el grupo de 100 mg 2 veces al día (p=0.17) y 56% en el grupo de 200 mg una vez al día (p=0.01) lograron esta meta.
El secukinumab es un anticuerpo monoclonal anti-IL-17A, completamente humanizado y de alta afinidad que se une selectivamente y neutraliza la IL-17A, la cual está asociada con una potente actividad inflamatoria y destrucción articular derivada de la estimulación de la IL-1 y TNF producida por macrófagos20, de la inducción de IL-6 e IL-8 de fibroblastos sinoviales21 y la sobre-regulación de RANKL, lo cual promueve la osteoclastogénesis22 y, por ende, contribuye a las erosiones óseas. En una fase preclínica se evidenció una significante mejoría de signos y síntomas en pacientes con AR comparado con placebo (CAIN45742101). En un estudio fase II23 se evaluaron 237 pacientes con inadecuada respuesta a MTX que fueron asignados aleatoriamente a recibir placebo o secukinumab 25 mg, 75 mg, 150 mg, 300 mg de manera subcutánea y mensualmente. El desenlace primario fue un ACR 20 en la semana 16 y el DAS-28 como secundario. La proporción de respondedores ACR 20 con secukinumab 25-300 mg fue de 36.0 a 53.7% y de 34% en placebo (p no significante). El DAS-28-PCR redujo de manera clínicamente relevante con secukinumab en el rango de 75-300 mg en comparación al placebo y se esperan los resultados de su extensión a la semana 52 para conocer su potencial terapéutico en AR.
Recientemente, fue realizado un estudio fase 2a y 2b, multicéntrico, aleatorizado y de doble enmascaramiento (NCT00718718) para estudiar la seguridad y efectividad de sirukumab, un anticuerpo monoclonal anti IL-6 de su ligando (a diferencia del tocilizumab que se une al receptor), en individuos con AR activos a pesar de MTX. En la parte A, 36 pacientes fueron aleatorizados a placebo o sirukumab subcutáneo 100 mg, cada 2 semanas, a través de 10 semanas con un intercambio de terapia durante las semanas 11 a 22. En la parte B, 151 pacientes fueron aleatorizados a sirukumab (100 mg cada 2 semanas, o 100, 50 o 25 mg cada 4 semanas) a través de 24 semanas, o placebo a través de 10 semanas con cambio a sirukumab 100 mg cada 2 semanas (semana 12-24). Los desenlaces estudiados fueron ACR-50 y DAS-28-PCR y la seguridad del fármaco, la cual fue evaluada hasta la semana 38 en ambas partes. El ACR-50 en la semana 12 en la parte B fue logrado solo con sirukumab 100 mg cada 2 semanas vs. placebo (26.7% vs. 3.3%; p=0.026). Una mejoría importante en el promedio del DAS-28-PCR en la semana 12 fue observada con sirukumab 100 mg cada 2 semanas vs. placebo en la parte A (2.1 vs. 0.6; p<0.001) y B (2.2 vs. 1.1; p<0.001). La incidencia de efectos adversos fue similar para los pacientes tratados con sirukumab y placebo hasta la semana 12 en la parte A (70.6% y 63.2%, respectivamente) y en la parte B24 (67.8% y 66.7%, respectivamente).
Lupus eritematoso sistémico
El epratuzumab es un anticuerpo monoclonal humanizado contra el CD22, el cual es una sialoglicoproteína transmembrana de las células B maduras la cual influye sobre su proceso de migración y activación. Si bien no se conoce exactamente el mecanismo de acción del epratuzumab, se cree que modifica de forma selectiva la función y activación de las células B25.
Los primeros estudios con epratuzumab en LES incluyeron 2 ensayos pequeños (ALLEVIATE-1 y ALLEVIATE-2) los cuales incluyeron 2 brazos con tratamiento con epratuzumab (360 o 720 mg/m2) y un brazo placebo. A pesar que tras 12 semanas de tratamiento aquellos pacientes que habían recibido tratamiento con epratuzumab 360 mg/m2 habían mejorado en los índices BILAG, dichos ensayos fueron interrumpidos de forma prematura por falta de suministro del medicamento26,27.
Recientemente, se ha publicado el ensayo EMBLEM, un ensayo de fase IIb que incluyó 227 pacientes con LES los cuales fueron asignados a 6 diferentes brazos, 1 brazo placebo y 5 brazos con diferentes dosis de epratuzumab28. Los resultados del estudio EMBLEM (respuestas BILAG tras 12 semanas de tratamiento) sugieren que el epratuzumab podría ser eficaz en el tratamiento del LES, por tal razón están en marcha dos ensayos de fase III (ClinicalTrials.gov Identifier: NCT01261793; NCT01262365).
La mayoría de pacientes con LES presentan una expresión espontánea de los genes inducidos por el interferón (IFN) de tipo 1, los cuales juegan un papel en la patogénesis de la enfermedad mediante la activación sostenida de células T y B autorreactivas, las cuales son necesarias en la producción de autoanticuerpos. Se están desarrollando diversas terapias que bloquean el IFN ya sea mediante anticuerpos monoclonales contra el IFN-a o contra el receptor del INF-a.
El ensayo ROSE (Efficacy and Safety of Rontalizumab (Anti-Interferon Alpha) in SLE Subjects with Restricted Immunosuppressant Use: Results of A Randomized, Double-Blind, Placebo-Controlled Phase 2 Study) es un ensayo de fase 2 que evaluó la eficacia y seguridad de la terapia con rontalizumab (un anticuerpo IgG1 humanizado contra todas las isoformas del IFN-a) por vía endovenosa o vía subcutánea vs. el placebo en adultos con LES con enfermedad no renal moderada o grave29.
El estudio incluyó 159 pacientes que recibieron rontalizumab (81 endovenosa y 78 por vía subcutánea) y 79 pacientes que recibieron placebo. De forma global, las tasas de respuesta BILAG y el índice de respuesta del LES (SRI) fueron similares en los grupos que recibieron rontalizumab vs. Placebo30.
El lupuzor es un péptido (IPP-201101) con un mecanismo de acción que no ha sido dilucidado claramente pero que, a través de modelos murinos y usando células mononucleares de sangre periférica de pacientes con LES, ha mostrado efectos telarogénicos e inmunomoduladores llevando a la inhibición de células T reactivas con auto-péptidos presentados por el Complejo Mayor de Histocompatibilidad31-36. En un estudio abierto previo el lupuzor mostró una mejoría en SLEDAI y fue bien tolerado37. En este estudio se incluyeron pacientes quienes cumplieron al menos 4 criterios del ACR, con un puntaje de SLEDAI de al menos 6 y no tuvieran un score A en el BILAG-2004. Se incluyeron 149 pacientes con intención a tratar, asignados de manera aleatoria a recibir lupuzor 200 mg, subcutáneamente cada 4 semanas (n=49; grupo 1) o cada 2 semanas (n=51; grupo 2) o placebo (n=49; grupo 3) en adición al cuidado estándar. En el grupo de intención a tratar, 53.1% en el grupo 1 (p=0.048), 45.1% en el grupo 2 (p=0.18) y 36.2% en el grupo placebo lograron un índice de respuesta en la semana 12. En el grupo general las tasas de respuestas fueron 61.9% en el grupo 1 (p=0.016), 48.0% en el grupo 2 (p=0.18) y 38.6% en el grupo de placebo. El efecto adverso más común fue un eritema leve en el sitio de inyección38.
Artritis psoriásica
Recientemente, el apremilast fue aprobado por la FDA para el tratamiento de la APs y la psoriasis cutánea39. Adicionalmente, se encuentran en marcha ensayos de fase III en la AR y la espondilitis anquilosante. El apremilast es un inhibidor oral de fosfodiesterasa-4 (PDE4) el cual acentúa la respuesta inflamatoria de una serie de citocinas (factor de necrosis tumoral alfa, IL-12, IL-23 y el interferón gamma), y quimocinas. Recientemente, en el Congreso Americano de Reumatología, celebrado en San Diego, se presentaron los resultados de 3 diferentes ensayos de fase III (PALACE 1, PALACE 2 y PALACE 3), los cuales compararon la eficacia del apremilast frente al placebo en pacientes con APs que habían sido tratados previamente con terapia biológica o FAMES tradicionales40. En el estudio PALACE 2 (Efficacy and Safety Study of Apremilast to Treat Active Psoriatic Arthritis) se permitió que los pacientes continuaran la terapia con FAMES de fondo incluyendo la sulfasalazina, la leflunomida o la combinación de ellas41. El estudio incluyó 3 diferentes brazos, 159 pacientes recibieron tratamiento con placebo, 163 pacientes recibieron 20 mg 2 veces (bid) al día y 162 pacientes recibieron 30 mg bid. Tras 16 semanas del tratamiento, los pacientes que recibieron placebo fueron aleatorizados a los brazos activos del estudio. Tras 1 año de seguimiento, 49% y 59% de los pacientes que recibieron tratamiento con apremilast 20 mg bid y 30 mg bid, respectivamente, alcanzaron una respuesta PASI 50/75 (Psoriasis Area and Severity Index). La gran mayoría de los efectos adversos fueron leves y no obligaron a la suspensión del tratamiento. Solo ocurrieron efectos adversos graves en 5% de los pacientes.
En el estudio PALACE 4 (ClinicalTrials.gov Identifier: NCT01307423), tras 16 semanas de tratamiento, la respuesta ACR 20 fue alcanzada en 29%, 32% y 17% de los pacientes que recibieron apremilast 20 mg bid, apremilast 30 mg bid y placebo, respectivamente. Tras 52 semanas de tratamiento, la respuesta ACR 20 fue del 53% y 59% en los pacientes de los brazos activos con apremilast 20 mg bid y 30 mg bid, respectivamente.
El ustekinumab es un anticuerpo monoclonal completamente humanizado que se une a la subunidad p40 compartida por las interleuquinas 12 y 23. Su eficacia en las placas de psoriasis y perfil de seguridad han sido mostrados en diferentes pruebas fase 342-44 (PHOENIX 1 y 2, y ACCEPT) y el medicamento está aprobado para el tratamiento de placas de psoriasis moderada a severa. Recientemente, se desarrolló una segunda fase para APs del medicamento con significante mejoría de síntomas y signos de APs y mejoría de la calidad de vida comparada con placebo45. El PSUMMIT 1 (Efficacy and safety of ustekinumab in patients with active psoriatic arthritis: 1 year results of the phase 3, multicentre, double-blind, placebo-controlled) es una tercera fase en la cual se busca valorar adicionalmente el ustekinumab en APs activo44. Los investigadores evaluaron 3 grupos de tratamiento con el medicamento a dosis de 45 mg o 90 mg subcutáneos y placebo en el inicio, semana 4 y cada 12 semanas posteriormente hasta 52 semanas. En la semana 16, los pacientes con menos de 5% de respuesta en articulaciones inflamadas o dolorosas fueron reasignados a 45 mg del biológico, si se encontraban en el grupo placebo y a 90 mg si estaban en el grupo de 45 mg. En la semana 24, todos los pacientes restantes del grupo placebo fueron asignados al grupo de 45 mg. Los pacientes venían de al menos 3 meses de tratamiento con FARMEs o al menos 4 semanas de AINES, o ambos, o intolerancia a estos tratamientos. 42.4% y 49.5% de los pacientes tratados con 45 y 90 mg, respectivamente, del grupo ustekinumab lograron ACR20, en comparación con el grupo placebo (22.8%) a la semana 24 (p<0.0001 para ambas comparaciones) y las respuestas fueron mantenidas hasta la semana 52. En la semana 16, la presencia de eventos adversos fue similar para los grupos de ustekinumab y placebo. En la actualidad se está desarrollando una segunda parte de la tercera fase (PSUMMIT 2) en la cual se incorporan evaluación radiográfica y datos de pacientes tratados con biológicos previamente (ClinicalTrials. gov Identifier: NCT01077362).
Conflicto de intereses
Los autores declaran no tener ningún conflicto de intereses. JGP recibe apoyo de la Fundación Alfonso Martín Escudero.
Bibliografía
1. Smolen JS, van der Heijde D, Machold KP, Aletaha D, Landewe R. Proposal for a new nomenclature of disease-modifying antirheumatic drugs. Ann Rheum Dis. 2014;73:3-5. [ Links ]
2. Novel New Drugs 2013 [consultado 4 May 2014]. Disponible en: http://www.fda.gov/downloads/Drugs/DevelopmentApprovalProcess/DrugInnovation/UCM381803.pdf#page=3. [ Links ]
3. Pinkerton JV, Harvey JA, Lindsay R, Pan K, Chines AA, Mirkin S, et al.; SMART-5 Investigators. Effects of bazedoxifene/conjugated estrogens on the endometrium and bone: a randomized trial. J Clin Endocrinol Metab. 2014;99:E189-98. [ Links ]
4. Kim K, Svedbom A, Luo X, Sutradhar S, Kanis JA. Comparative cost-effectiveness of bazedoxifene and raloxifene in the treatment of postmenopausal osteoporosis in Europe, using the FRAX algorithm. Osteoporos Int. 2014;25:325-37. [ Links ]
5. Patel T, McKeage K. Macitentan: first global approval. Drugs. 2014;74:127-33. [ Links ]
6. Corallo C, Pecetti G, Iglarz M, Volpi N, Franci D, Montella A, et al. Macitentan slows down the dermal fibrotic process in systemic sclerosis: in vitro findings. J Biol Regul Homeost Agents. 2013;27:455-62. [ Links ]
7. Grimminger F, Weimann G, Frey R, Voswinckel R, Thamm M, Bölkow D, et al. First acute haemodynamic study of soluble guanylate cyclase stimulator riociguat in pulmonary hypertension. Eur Respir J. 2009;33:785-92. [ Links ]
8. Lim GB. Hypertension: Riociguat therapy for pulmonary hypertension. Nat Rev Cardiol. 2013;10:549. [ Links ]
9. Ghofrani HA, D'Armini AM, Grimminger F, Hoeper MM, Jansa P, Kim NH, et al. Riociguat for the treatment of chronic thromboembolic pulmonary hypertension. N Engl J Med. 2013;369:319-29. [ Links ]
10. Burmester GR, Weinblatt ME, McInnes IB, Porter D, Barbarash O, Vatutin M, et al.; EARTH Study Group. Efficacy and safety of mavrilimumab in subjects with rheumatoid arthritis. Ann Rheum Dis. 2013;72:1445-52. [ Links ]
11. Genovese MC, Lee E, Satterwhite J, Veehuizen M, Disch D, Berclaz PY, et al. A phase 2 dose-ranging study of subcutaneous tabalumab for the treatment of patients with active rheumatoid arthritis and an inadequate response to methotrexate. Ann Rheum Dis. 2013;72:1453-60. [ Links ]
12. Company ELa. 2013. ReleaseID=738769 [consultado 7 May 2014]. Disponible en: https://investor.lilly.com/releasedetail.cfm?releaseid=738769. [ Links ]
13. Weinblatt M, Mysler E, Mysler E, Takeuchi T, Drescher E, Berman A et al. A phase IIb study of the efficacy and safety of subcutaneous clazakizumab (anti-IL-6 monoclonal antibody) with or without methotrexate in adults with moderate-to-severe active rheumatoid arthritis and an inadequate response to methotrexate. Arthritis Rheum. 2013;65 Suppl 10:1735. doi:10.1002/art.2013.65.issue-s10. [ Links ]
14. Gómez-Puerta JA, Mocsai A. Tyrosine kinase inhibitors for the treatment of rheumatoid arthritis. Curr Top Med Chem. 2013;13:760-73. [ Links ]
15. Fleischmann R, Kremer J, Cush J, Schulze-Koops H, Connell CA, Bradley JD, et al.; ORAL Solo Investigators. Placebo-controlled trial of tofacitinib monotherapy in rheumatoid arthritis. N Engl J Med. 2013;367:495-507. [ Links ]
16. Van Vollenhoven RF, Fleischmann R, Cohen S, Lee EB, García Meijide JA, Wagner S, et al.; ORAL Standard Investigators. Tofacitinib or adalimumab versus placebo in rheumatoid arthritis. N Engl J Med. 2013;367:508-19. [ Links ]
17. Keystone E, Taylor P, Genovese M, Schlichting D, Beattie SCG. 12-week results of a Phase 2b dose-ranging study of LY3009104 (INCB028050), an oral JAK1/JAK2 inhibitor, in combination with traditional DMARDS in patients with rheumatoid arthritis. Ann Rheum Dis. 2012;Suppl 3(71):152. [ Links ]
18. Taylor P, Genovese M, Keystone E, Schlichting D, Beattie S, Macias W. A1.72 Baricitinib, an oral janus kinase inhibitor, in the treatment of rheumatoid arthritis: safety and efficacy in an open-label, long-term extension study. Ann Rheum Dis. 2014;73:A31. doi:10.1136/annrheumdis-2013-205124.71. [ Links ]
19. Tak PP, Balanescu A, Tseluyko V, Bojin S, Drescher E, Dairaghi D, et al. Chemokine receptor CCR1 antagonist CCX354-C treatment for rheumatoid arthritis: CARAT-2, a randomised, placebo controlled clinical trial. Ann Rheum Dis. 2013;72:337-44. [ Links ]
20. Jovanovic DV, Di Battista JA, Martel-Pelletier J, Jolicoeur FC, He Y, Zhang M, et al. IL-17 stimulates the production and expression of proinflammatory cytokines, IL-beta and TNF-alpha, by human macrophages. J Immunol. 1998;160:3513-21. [ Links ]
21. Fossiez F, Djossou O, Chomarat P, Flores-Romo L, Ait-Yahia S, Maat C, et al. T cell interleukin-17 induces stromal cells to produce proinflammatory and hematopoietic cytokines. J Exp Med. 1996;183:2593-603. [ Links ]
22. Kotake S, Udagawa N, Takahashi N, Matsuzaki K, Itoh K, Ishiyama S, et al. IL-17 in synovial fluids from patients with rheumatoid arthritis is a potent stimulator of osteoclastogenesis. J Clin Invest. 1999;103:1345-52. [ Links ]
23. Genovese M, Durez P, Richards HB, Supronik J, Dokoupilova E, Mazurov V, et al. Efficacy and safety of secukinumab in patients with rheumatoid arthritis: a phase II, dose-finding, double-blind, randomised, placebo controlled study. Ann Rheum Dis. 2013;72:863-9. [ Links ]
24. Smolen JS, Weinblatt ME, Sheng S, Zhuang Y, Hsu B. Sirukumab, a human anti-interleukin-6 monoclonal antibody: a randomised, 2-part (proof-of-concept and dose-finding), phase II study in patients with active rheumatoid arthritis despite methotrexate therapy. Ann Rheum Dis. 2014. doi:10.1136/annrheumdis-2013-205137. [ Links ]
25. Jacobi AM, Goldenberg DM, Hiepe F, Radbruch A, Burmester GR, Dörner T. Differential effects of epratuzumab on peripheral blood B cells of patients with systemic lupus erythematosus versus normal controls. Ann Rheum Dis. 2008;67:450-7. [ Links ]
26. Petri M, Hobbs K, Gordon C, Strand V, Wallace D, Kelley L, et al. Clinically meaningful improvements with epratuzumab (anti-CD22 mab targeting b-cells) in patients (pts) with moderate/severe systemic lupus erythematosus (SLE) flares: results from 2 randomized controlled trials. Arthritis Rheum. 2008;57(Suppl):108. [ Links ]
27. Wallace D. Epratuzumab (anti-CD22 mAb targeting B cells) provides clinically meaningful reductions in corticosteroids (CS) use with a favourable safety profile in patients with moderate/severe flaring SLE: results from randomised controlled trials (RCTs). Arthritis Rheum. 2008;57(Suppl):1088. [ Links ]
28. Wallace DJ, Kalunian K, Petri MA, Strand V, Houssiau FA, Pike M, et al. Efficacy and safety of epratuzumab in patients with moderate/severe active systemic lupus erythematosus: results from EMBLEM, a phase IIb, randomised, double-blind, placebo-controlled, multicentre study. Ann Rheum Dis. 2014;73:183-90. [ Links ]
29. Kalunian K, Merill JT, Maciuca R, Ouyang W, McBride JM, Townsend MJ, et al. Efficacy and safety of rontalizumab (anti-interferon alpha) in SLE subjects with restricted immunosuppressant use: Results of a randomized, doubleblind, placebo-controlled phase 2 study. Arthritis Rheum. 2012;64 Suppl 10:2622. doi:10.1002/art.40353. [ Links ]
30. McBride JM, Jiang J, Abbas AR, Morimoto A, Li J, Maciuca R, et al. Safety and pharmacodynamics of rontalizumab in patients with systemic lupus erythematosus: results of a phase I, placebo-controlled, double-blind, doseescalation study. Arthritis Rheum. 2012;64:3666-76. [ Links ]
31. Monneaux F, Lozano JM, Patarroyo ME, Briand JP, Muller S. T cell recognition and therapeutic effect of a phosphorylated synthetic peptide of the 70K snRNP protein administered in MR/lpr mice. Eur J Immunol 2003;33:287-96. [ Links ]
32. Monneaux F, Parietti V, Briand JP, Muller S. Intramolecular T cell spreading in unprimed MRL/lpr mice: importance of the U1-70K protein sequence 131-151. Arthritis Rheum. 2004;50:3232-8. [ Links ]
33. Monneaux F, Hoebeke J, Sordet C, Nonn C, Briand JP, Maillère B, et al. Selective modulation of CD4+ T cells from lupus patients by a promiscuous, protective peptide analogue. J Immunol. 2005;175:5839-47. [ Links ]
34. Monneaux F, Parietti V, Briand JP, Muller S. Importance of spliceosomal RNP1 motif for intermolecular T-B cell spreading and tolerance restoration in lupus. Arthritis Res Ther. 2007;9:R111. [ Links ]
35. Page N, Schall N, Strub JM, Quinternet M, Chaloin O, Décossas M, et al. The spliceosomal phosphopeptide P140 controls the lupus disease by interacting with the HSC70 protein and via a mechanism mediated by gd T cells. PLoS One. 2009;4:e5273. [ Links ]
36. Page N, Gros F, Schall N, Décossas M, Bagnard D, Briand JP, et al. HSC70 blockade by the therapeutic peptide P140 affects autophagic processes and endogenous MHCII presentation in murine lupus. Ann Rheum Dis. 2011;70:837-43. [ Links ]
37. Muller S, Monneaux F, Schall N, Rashkov RK, Oparanov BA, Wiesel P, et al. Spliceosomal peptide P140 for immunotherapy of systemic lupus erythematosus: results of an early phase II clinical trial. Arthritis Rheum. 2008;58:3873-3. [ Links ]
38. Zimmer R, Scherbarth HR, Rillo OL, Gomez-Reino JJ, Muller S. Lupuzor/P140 peptide in patients with systemic lupus erythematosus: a randomised, double-blind, placebo-controlled phase IIb clinical trial. Ann Rheum Dis. 2013;72:1830-5. [ Links ]
39. Taylor P. Celgene lifted by apremilast data in psoriatic arthritis. 2013 [consultado 1 Jul 2014]. Disponible en: http://www.fda.gov/newsevents/newsroom/pressannouncements/ucm390091.htm. [ Links ]
40. Cutolo M, Mease PJ, Gladman DD, Kavanaugh A, Adewale O, Gomez-Reino JJ, et al. Apremilast, an oral phosphodiesterase 4 inhibitor, is associated with long-term (52-week) improvement in tender and swollen joint counts in patients with psoriatic arthritis: results from three phase 3, randomized, controlled trials. Arthritis Rheum. 2013;65:Abstract S135. [ Links ]
41. Cutolo M, Myerson GE, Fleischmann RM, Liote F, Diaz-Gonzalez F, Van Den Bosch F, et al. Long-term (52-week) results of a phase 3, randomized, controlled trial of apremilast, an oral phosphodiesterase 4 inhibitor, in patients with psoriatic arthritis (PALACE 2). Arthritis Rheum. 2013;65:Abstract S346. [ Links ]
42. Leonardi CL, Kimball AB, Papp KA, Yeilding N, Guzzo C, Wang Y, et al.; PHOENIX 1 study investigators. Efficacy and safety of ustekinumab, a human interleukin-12/23 monoclonal antibody, in patients with psoriasis: 76-week results from a randomised, double-blind, placebo-controlled trial (PHOENIX 1). Lancet. 2008;371:1665-74. [ Links ]
43. Griffiths CE, Strober BE, van de Kerkhof P, Ho V, Fidelus-Gort R, Yeilding N, et al., ACCEPT Study Group. Comparison of ustekinumab and etanercept for moderate-to-severe psoriasis. N Engl J Med. 2010;362:118-28. [ Links ]
44. McInnes IB, Kavanaugh A, Gottlieb AB, Puig L, Rahman P, Ritchlin C, et al. Efficacy and safety of ustekinumab in patients with active psoriatic arthritis: 1 year results of the phase 3, multicentre, double-blind, placebo-controlled PSUMMIT 1 trial. Lancet. 2013;382:780-9. [ Links ]
45. Gottlieb A, Menter A, Mendelsohn A, Shen YK, Li S, Guzzo C, et al. Ustekinumab, a human interleukin 12/23 monoclonal antibody, for psoriatic arthritis: randomised, double-blind, placebo-controlled, crossover trial. Lancet. 2009;373:633-40. [ Links ]