Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares en
SciELO
Similares en
SciELO -
 Similares en Google
Similares en Google
Compartir
Revista Colombiana de Reumatología
versión impresa ISSN 0121-8123
Rev.Colomb.Reumatol. vol.21 no.2 Bogotá abr./jun. 2014
Artículo de revisión
El papel de los anticuerpos anti-cromatina, antiC1q y las fracciones del complemento unidas a células en el diagnóstico precoz de actividad lúpica
Role of Anti-chromatin, anti-C1q and cell bound complement activation products in the early diagnosis of Systemic Lupus Erythematosus disease activity
Claudia Moraa, Ana Milena Arbeláeza, Jorge Enrique Medinaa, Ana Isabel Ospinab, Consuelo Romero Sánchezb, Paula Andrea Valencia Toroa, Diego Alejandro Jaimesa, Rafael Valle Oñateb, Ana María Santos G.a y John Londoñoa,*
aDepartamento de Reumatología, Universidad de La Sabana, Chía, Cundinamarca, Colombia
bServicio de Reumatología, Hospital Militar Central – Universidad Militar Nueva Granada, Bogotá D.C., Colombia
*Autor para correspondencia. Correo electrónico: John.londono@unisabana.edu.co (J. Londoño).
Historia del artículo: Recibido el 10 de septiembre de 2013 Aceptado el 6 de mayo de 2014
Resumen
Actualmente se percibe una necesidad apremiante en la identificación y validación de biomarcadores que reflejen tempranamente el inicio de actividad lúpica o que se conviertan en predictores de la misma. La actividad clínica del lupus eritematoso sistémico (LES) es ondulante a lo largo del tiempo y la actividad subyacente persistente lleva a daño tisular. Este daño es reflejo de cambios irreversibles en la función y estructura orgánica, por lo que la prevención, más que el tratamiento, debería ser la meta de cualquier terapia en LES y así lograr disminuir la morbimortalidad y los costos directos e indirectos causados por la enfermedad. Es necesario encontrar biomarcadores no invasivos de actividad lúpica que no solo permitan tomar de forma oportuna decisiones terapéuticas, sino que también se correlacionen con los desenlaces clínicos y sean útiles en los ensayos clínicos, permitiendo acortar el tiempo del desarrollo de estos estudios. Este artículo pretende buscar la evidencia que se tiene con respecto a los nuevos biomarcadores existentes para actividad de la enfermedad en LES y su utilidad actual y futura, enfatizando en la necesidad de buscar nuevas moléculas que permitan un diagnóstico más precoz de la actividad de la enfermedad.
Palabras clave: Lupus eritematoso sistémico, Marcadores biológicos, Anticuerpos, Complemento C4d, Complemento C1q, Nucleosomas.
Abstract
There is a need for the identification and validation of biomarkers that reflect the early onset of lupus activity or may be predictors of this. The clinical activity of systemic lupus erythematosus (SLE) fluctuates over time and the underlying activity leads to persistent tissue damage. This damage is a reflection of irreversible changes in the function and organic structure, so prevention, rather than treatment, should be the goal of any therapy in SLE.This will reduce morbidity, mortality, direct and indirect costs caused by the disease. It is necessary to find biomarkers of lupus activity that not only allow making treatment decisions in the short term, but also to correlate with clinical outcomes. These could also be useful in clinical trials and may shorten the duration of these studies. This article aims to find evidence on new biomarkers for SLE disease activity, and their current and future use. Emphasis will be made on the need to find new molecules for an early diagnosis of disease activity.
Keywords: Lupus erythematosus, Systemic Biological markers, Antibodies, Complement C4d, Complement C1q, Nucleosomes.
Introducción
El lupus eritematoso sistémico (LES), es una enfermedad autoinmune compleja y crónica con períodos de exacerbación y de remisión. Se caracteriza por su gran diversidad en manifestaciones clínicas y serológicas, y un curso no siempre predecible que puede ir desde síntomas inespecíficos y vagos hasta falla orgánica multisistémica. Se trata de una enfermedad con más de 100 autoanticuerpos, depósito de complejos inmunes en los tejidos y excesiva activación del complemento dentro del marco de una regulación inadecuada del sistema inmune1, responsable de la actividad clínica con patrón de exacerbación y remisión a lo largo del tiempo.
La tasa de sobrevida ha mejorado, pasando de una mortalidad, en los primeros 10 años de evolución, del 50% a mediados del siglo pasado, a una sobrevida de 92-98% en la actualidad. Este descenso es secundario a la mejor clasificación de la enfermedad, el diagnóstico temprano, el tratamiento oportuno y adecuado de las comorbilidades asociadas como la hipertensión arterial, infecciones e insuficiencia renal crónica avanzada2. Sin embargo, los pacientes con LES aún presentan de 2 a 5 veces más riesgo de muerte, comparados con la población general3. El daño y la mortalidad en los primeros 2 años del diagnóstico están relacionados, principalmente, con la actividad de la enfermedad. Más tardíamente cobran importancia complicaciones como la arterioesclerosis, infecciones y malignidad4.
La morbilidad y mortalidad del LES van de la mano del daño acumulado en los diferentes sistemas que compromete y este daño es producto de la lesión tisular que tiene lugar durante los períodos de actividad5. La enfermedad se asocia con una carga económica importante relacionada con la utilización de recursos invertidos en el cuidado de la salud y en la pérdida de productividad del paciente y del cuidador6. En promedio el costo directo derivado de la atención de pacientes con LES puede oscilar entre USD $2,056 y USD $3,049 al año, con valores que alcanzan los USD$13,000 en el caso del LES con compromiso neuropsiquiátrico7. El cuidado intrahospitalario explica más del 50% del valor de los costos directos y está demostrado que las exacerbaciones de la enfermedad elevan tanto los costos directos como los indirectos comparados con pacientes sin recaídas. Las actividades multiorgánica, renal o neuropsiquiátrica, se correlacionan con mayor costo, que compromisos de un solo órgano o manifestaciones menores8. En general, factores como la alteración en la salud mental o física, menor edad, mayores índices de actividad y de daño acumulado, se asocian con un aumento de los costos directos.
A diferencia del daño acumulado, durante los episodios de actividad la lesión tisular es reversible, por lo que gran parte del esfuerzo médico está dirigido al diagnóstico y tratamiento temprano de la reactivación del LES. Sin embargo, la detección temprana de la actividad lúpica no es sencilla dada la heterogeneidad de manifestaciones y la ausencia de parámetros clínicos y paraclínicos certeros y específicos.
Actualmente, se realizan de forma rutinaria la medición de los niveles de complemento (C3 y C4) y de anti-DNA de doble cadena (antiDNAds), pero, desafortunadamente, la fluctuación de los valores medidos no se correlaciona siempre con la predicción de una recaída, el grado de actividad de la enfermedad ni con la respuesta al tratamiento9.
Igualmente, con base en estos parámetros se aplican instrumentos que buscan estratificar la actividad de la enfermedad de forma global y órgano específico, como el SLEDAI-2000 (Systemic Lupus Erythematosus Disease Activity Index), el SLAM (Systemic Lupus Activity Measurement) y el BILAG-2004 (British Isles Lupus Assessment Group). Estos índices, en el seguimiento de los pacientes, reflejan cambios longitudinales en la actividad y pueden predecir el daño y la mortalidad, pero desafortunadamente no son adecuados predictores de actividad y no hay evidencia que soporte su utilidad para la determinación de su eficacia terapéutica. Adicionalmente, su aplicación, análisis e interpretación requieren de un entrenamiento y disponibilidad de tiempo10.
Dada la importancia de la detección oportuna de actividad lúpica, es fundamental la búsqueda de herramientas que predigan o detecten tempranamente las recaídas.
El objetivo de este estudio fue conducir una revisión estructurada de la literatura de algunos de los principales biomarcadores séricos que, hasta el momento, se han identificado y propuesto dentro del ejercicio predictor y detector de actividad lúpica, específicamente las fracciones de complemento unido a células y los autoanticuerpos anticromatina y anti-C1q.
Materiales y métodos
Búsqueda de la bibliografía
Se realizó una búsqueda estructurada de la literatura usando las bases de datos científicas de: PubMed, Medline, Embase, Cochrane y Lilacs, entre enero de 2000 hasta septiembre de 2013, en el idioma inglés. Se incluyeron diferentes combinaciones de los siguientes encabezamientos de temas médicos (MeSH, por sus siglas en inglés): Lupus Erythematosus, Systemic; Biological Markers; Antibodies; Complement C4d; Complement C1q; Nucleosomes. Todos los autores realizaron las búsquedas iniciales de forma independiente, luego se combinaron los resultados de sus búsquedas en una base de datos única y se retiraron los artículos duplicados. Se tuvieron en cuenta trabajos originales, meta-análisis, revisiones de la literatura realizadas en adultos, así como estudios que aparecieran citados en los artículos seleccionados y resúmenes de congresos.
Definición de biomarcador
Un biomarcador se define como un cambio molecular (genético, biológico o bioquímico) cuyos niveles o alteraciones se correlacionan con la patogénesis o manifestaciones de una enfermedad y son susceptibles de evaluación cuantitativa o cualitativa en el laboratorio.
El grupo de trabajo de definiciones de biomarcadores del Instituto Nacional de Salud (NIH, por sus siglas en inglés), de Estados Unidos de Norteamérica ha definido un biomarcador como: "Una característica que es objetivamente medida y evaluada como un indicador de un proceso biológico normal, un proceso patológico o una respuesta farmacológica a una intervención terapéutica11". Metodológicamente se deben cumplir diferentes criterios para que una prueba pueda considerarse como biomarcador: debe ser relevante desde el punto de vista biológico y fisiopatológico, debe ser simple y susceptible de utilizar en la práctica clínica y debe ser sensible al cambio de actividad de la enfermedad que explora12.
Biomarcadores en lupus
La búsqueda de mejores herramientas diagnósticas, terapéuticas y pronósticas en LES, ha generado gran cantidad de biomarcadores13, muchos de los cuales han sido sujeto de revisiones recientes en la literatura14; sin embargo, pocos de estos marcadores han mostrado utilidad en la clínica. La validación de estos parámetros se ha realizado de manera transversal comparando el valor del biomarcador con una escala clínica de actividad de la enfermedad, y de manera prospectiva en el seguimiento del comportamiento de la enfermedad (siendo esta última metodología de mayor utilidad diagnóstica)15.
En LES no hay un biomarcador único, por el contrario hay diferentes categorías: Se investigan biomarcadores de diagnóstico que faciliten la temprana y certera identificación de sujetos con la enfermedad, biomarcadores que evalúen respuesta al tratamiento16, predictores del desarrollo de la enfermedad en personas propensas al desarrollo de la enfermedad17,18 o a compromiso específico de un órgano durante el curso de la enfermedad, biomarcadores pronósticos que muestren pacientes en riesgo de enfermedad severa y biomarcadores de monitoreo de progresión de la patología o de la actividad de la enfermedad19,20. Las mediciones se han realizado tanto en suero como orina y aire exhalado4.
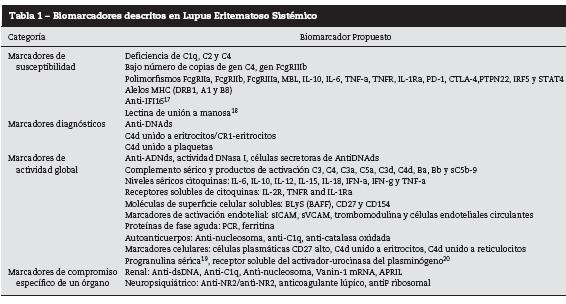
En la tabla 1 se puede apreciar un resumen general de los biomarcadores más importantes que hasta el momento se han descrito en suero de pacientes con LES. Vale la pena anotar que muchos se han reportado en grupos pequeños de pacientes y falta aún bastante evidencia que permita determinar con certeza su papel y utilidad en la práctica clínica rutinaria.
Fracciones del complemento unidas a células como biomarcadores de actividad
Desde hace muchos años se ha reconocido que los complejos inmunes antígeno-anticuerpo que llevan a la activación del sistema del complemento tienen un papel decisorio en la patogénesis del LES21. La activación del complemento puede realizarse a través de la vía clásica respondiendo a complejos inmunes, a través de la vía alterna por generación espontánea de componentes del complemento, respondiendo a superficies de organismos extraños o propios y a través de la vía de la lectina unida a la manosa y a polisacáridos de superficie de microorganismos. Producto de esta activación se generan fragmentos proteolíticos como C3a, C4a y C5a que son anafilotoxinas y quimioatrayentes llevando a la liberación de numerosos mediadores inflamatorios. C3 es la proteína más abundante del complemento y es indispensable en las 3 vías. C4 es la segunda más abundante y es fundamental en la vía clásica y de la lectina. Tanto C3 como C4 son sintetizadas en el hígado. Desde hace varios años se sabe que la patogénesis del LES involucra alteraciones en la activación del complemento y en la depuración de complejos inmunes por los eritrocitos21.
Se ha demostrado que la incubación de eritrocitos de pacientes con LES, a diferencia de controles sanos, lleva al depósito de fragmentos de C4d en la superficie celular y que estos glóbulos rojos (GR) presentan como consecuencia disminución significativa de la capacidad de cambios en la forma de su membrana con alteraciones de la fosforilación de proteínas del citoesqueleto que, finalmente, llevan a la producción de óxido nítrico. Este fenómeno afecta la entrega tisular de oxígeno22.
Así mismo, durante los estados inflamatorios que presenten activación de complemento las proteínas de este sistema se consumen de forma proporcional a la actividad de la enfermedad, por lo que la medición de la activación del complemento puede ser útil para el diagnóstico, evaluación del estadio clínico y determinación de respuesta a tratamiento de la enfermedad23.
Es por esto que en la práctica clínica la medición de C3 y C4 es rutinaria como parte del seguimiento de los pacientes. Basados en la fisiopatología del LES se espera que el consumo de proteínas sea proporcional a la actividad de la enfermedad y por tanto la disminución en los niveles de C3 y C4 serían sinónimo de recaída. Sin embargo, la medición de C3 y C4 no puede considerarse como estándar de oro por diferentes razones: se miden los niveles de la proteína intacta y no los productos de activación, existe una amplio rango de variación en los niveles en individuos sanos y durante procesos inflamatorios como parte de las respuestas de fase aguda hay un incremento en la síntesis de C3 y C4 lo cual puede compensar el consumo de los mismos. Adicionalmente, el déficit parcial de C4 es común en la población general y en pacientes con LES por lo que el nivel bajo de la proteína estaría dado por disminución de la síntesis y no por mayor consumo. Además algunos grupos de estudios han encontrado que los niveles de CH50, C3 y C4 bajos se correlacionan con actividad renal y, en otros casos, sistémica de la enfermedad24,25, pero otros no han obtenido los mismos resultados26,27.
Por estas razones se han enfocado estudios en la medición de productos de activación del complemento (CAP). En los laboratorios de inmunología clínica pueden medirse productos de activación resultantes de la vía clásica (C1rs-complejo C1 inhibidor, C4a y C4d), de la vía alterna (Bb y C3bBbP), de la vía de la lectina (C4a y C4d) y productos comunes a todas las vías (C3a, iC3b, C3d, C5a y sC5b-9)28.
Los CAP solubles son fácilmente hidrolizados y por tanto tienen un tiempo de vida muy corto. Dado que las proteínas del complemento son abundantes en la circulación permanentemente interactúan con las células sanguíneas circulantes. Los CAP tienen la capacidad de unirse de forma covalente a los componentes de superficie celular acompañándolas durante todo el ciclo de vida de la célula y así persistir por más tiempo que los CAP solubles en plasma y ser detectables con mayor facilidad. Los eritrocitos y las plaquetas son las células circulantes más abundantes por lo que son blancos potenciales de unión de proteínas del complemento generadas de forma local o sistémica. Se ha demostrado que C4d está presente en la superficie de eritrocitos normales29,30.
Diferentes estudios han evaluado la medición de CAP unidos a células (CB-CAP) como biomarcadores en LES y han observado niveles de C4d unido a eritrocitos (E-C4d), a reticulocitos (R-C4d), a plaquetas (P-C4d) y a linfocitos T y B (T-C4d y B-C4d) significativamente mayores en pacientes con LES comparados con otras enfermedades y con pacientes sanos. E-C4d ha demostrado mínima fluctuación en individuos sanos a lo largo del tiempo y los niveles elevados tienen una sensibilidad y especificidad de 81% y 91% respectivamente comparados con individuos sanos y de 72% y 79% respectivamente comparados con pacientes con otras enfermedades. En años recientes, el grupo de Manzi y otros autores han investigado el papel de los CB-CAP diferentes a la serie eritroide, enfocándose en la serie linfoide31, encontrando que el C4d unido a linfocitos T (T C4d) y a linfocitos B (B-C4d) tiene mayor sensibilidad para el diagnóstico de LES en la consulta clínica, comparado con el anti DNA nativo, y que la determinación conjunta de los tres brinda la mayor sensibilidad y especificidad para el diagnóstico de la enfermedad.
Similarmente, el estudio del C4d unido a plaquetas (P-C4d) mostró una especificidad del 100% para el diagnóstico de LES comparado con voluntarios sanos, y del 98% para pacientes con otras enfermedades autoinmunes (P < 0.0001). Además, existió una clara asociación con positividad para anticoagulante lúpico, anticardiolipinas (inmunoglobulinas M y G), el índice de actividad de la enfermedad para LES medido por SLEDAI y valor de E-C4d32.
Basados en el hecho que los eritrocitos tienen una vida media de 120 días, tiempo en el que se unen a C4d de forma permanente E-C4d es un resultado de la activación del complemento y, por tanto, de la actividad de la enfermedad en los 120 días previos. Los reticulocitos en cambio, si son liberados a la circulación durante episodios de actividad de LES se exponen inmediatamente al C4d generado y serían un reflejo más "actualizado" de la actividad. Algunos autores han demostrado niveles de reticulocitos (R)-C4d significativamente mayores en pacientes con LES, comparados con otras enfermedades y con individuos sanos. Igualmente, se ha observado que los niveles de R-C4d fluctúan en el tiempo y se correlacionan con índices de actividad medidos por SLEDAI y SLAM33.
Recientemente, se reportó la asociación entre la presencia de C4d en placentas de pacientes lúpicas con la presencia de retardo de crecimiento intrauterino (RCIU), postulando que el C4d podría ser un posible biomarcador predictor del riesgo de RCIU34.
Todo lo expuesto sugiere que los CB-CAP pueden tener un papel en el diagnóstico y posiblemente en el seguimiento del LES35.
Auto-anticuerpos como biomarcadores de actividad: anticromatina y anti-C1q
Los auto-anticuerpos dirigidos contra componentes nucleares son un rasgo característico del LES. La cromatina, el complejo ADN-histona, se encuentra en el núcleo de las células eucariotas y se organiza en una serie repetida de nucleosomas. Dado que los anticuerpos contra el ADN nativo de doble cadena (Anti ADNds) se encuentran en casi todos los pacientes con LES activo, se han considerado marcadores serológicos de la enfermedad. Sin embargo, el DNA no es inmunogénico por sí mismo; solo cuando se une a proteínas (histonas – proteínas virales) puede generar respuesta antinuclesoma o anti ADN. Los anticuerpos antinuclesoma (o anticromatina) reaccionan con la porción de las histonas expuesta en la cromatina, con la estructura del ADN presente en la cromatina, o con un epítope formado por el complejo de ADN e histonas36. Estudios recientes han demostrado que el nucleosoma es el autoantígeno principal de las células T y B en LES37. El nucleosoma, un auto-antígeno importante, se libera en pacientes con LES como resultado de una alteración en la apoptosis o un aclaramiento insuficiente de los desechos apoptóticos. Durante la apoptosis el nucleosoma se modifica, creando así más epítopes inmunogénicos. Subsecuentemente la propagación del epítope dará lugar a la formación de auto-anticuerpos contra los componentes de la cromatina no modificados38.
Los complejos inmunes anti-cromatina pueden unirse a la membrana basal glomerular in vivo y en LES se ha descrito la existencia de un aclaramiento defectuoso de los nucleosomas apoptóticos, lo que se cree conduce al depósito de fragmentos de cromatina dentro de las membranas glomerulares, donde se ha demostrado que se unen con una alta afinidad, convirtiéndose en un antígeno para los linfocitos B y T de los pacientes con LES39,40. Dado que los anticuerpos anti ADNds y nucleosomas forman complejos en mayor cantidad en la circulación, el suero se convierte en el compartimento biológico más relevante para realizar las actuales investigaciones en torno a este tópico41.
Los autoanticuerpos anticromatina/anti-nucleosoma se encuentran en la mayoría de los pacientes con LES (70-100%) y se han asociado con actividad de la enfermedad y con exacerbaciones de nefritis lúpica (NL)42,43. En diferentes estudios44-46, se ha evidenciado que los anticuerpos anticromatina, además de su sensibilidad y especificidad para LES, se han correlacionado con la presencia de glomerulonefritis, llegando a tener una sensibilidad similar a los Anti ADNds (alrededor de 85%) para algunos investigadores, pero con una especificidad mayor47.
Burlingame realiza una revisión de la evidencia, reuniendo 1.356 pacientes con LES y 1.807 pacientes con otras enfermedades autoinmunes, demostrando que la sensibilidad promedio para la presencia de autoanticuerpos anticromatina/ anti-nucleosoma en LES es del 63%, mientras que la especificidad promedio para controles con otras enfermedades reumáticas es del 95% y la especificidad para controles sanos es del 100%48.
Los anticuerpos anti-C1q están dirigidos contra el primer componente de la vía clásica del complemento. La molécula de C1q se conforma por una porción de colágeno unida a una porción globular de varias cabezas. La porción de colágeno es la que ha mostrado mayor inmunogenicidad, dando cabida a la hipótesis de que esta porción expresa neoepítopes que darían inicio al daño autoinmune pero solo cuando el C1q se encuentra en fase sólida (cuando el C1q se ha unido a estructuras sólidas)49.
Los anticuerpos anti-C1q pueden ser detectados en una pequeña proporción de individuos sanos (2%-8%), pero son más comunes en los pacientes con trastornos autoinmunes, como la urticaria vasculítica hipo-complementémica y en LES50. Estos anticuerpos son, en su mayoría, del subtipo IgG predominantemente IgG1 e IgG2 y se han encontrado en el 30% a 60% de los pacientes con LES51,52 demostrando una fuerte correlación entre su presencia y el compromiso renal en estos pacientes53.
Marto, mediante un estudio transversal en 151 pacientes con LES evidenció una mayor prevalencia de anticuerpos anti-C1q en pacientes con NL activa que en aquellos sin compromiso renal (74% vs. 32%), los niveles de anti-C1q fueron mayores en pacientes con nefritis que en aquellos sin nefritis. Curiosamente, también se demostró que los anticuerpos anti-C1q pueden ser detectados en 33 de los 83 pacientes con LES sin antecedentes de enfermedad renal y que 9 (27%) de los pacientes desarrollaron NL en un intervalo de tiempo medio de 9 meses54. De hecho, ha sido reportado que la ausencia de anticuerpos anti-C1q excluye el diagnóstico de NL y un aumento de anticuerpos anti-C1q se ha sugerido como predictor de exacerbación o recaídas renales con un valor predictivo positivo y valor predictivo negativo para NL de 58% y 100% respectivamente55. Algunos autores han sugerido que los anticuerpos anti-C1q pudieran ser indicativos de recaídas56. Sinico y su grupo observaron que 60% de su cohorte de pacientes con NL tenían anti-C1q, comparado con 14% de pacientes con LES sin compromiso renal; además, durante un episodio de nefritis activa, el 89% de los pacientes dieron positivos para anti-C1q, mientras que ninguno de los pacientes con LES sin actividad renal dio positivo para el examen57. Por su parte, en el estudio de Trendelemburg, 97,2% de pacientes con NL activa mostraron anti-C1q, comparado con 35% de pacientes con nefritis no activa58. Marto, encontró que el 75% de pacientes con NL tenía anti-C1q, comparado con 53% de pacientes con nefritis no activa56. Sin embargo, algunos estudios en pacientes orientales no han mostrado una correlación apropiada entre anti-C1q y actividad de NL59.
Tomando todos los datos anteriores, se concluye que los anticuerpos anti-C1q están presentes en la NL proliferativa difusa y se asocian de manera fuerte con actividad de la enfermedad o predictor de exacerbación renal.
Conclusiones
Las herramientas actuales de monitoreo de actividad como medición de los niveles de complemento (C3 y C4) y de anti ADNds no se correlacionan siempre con la predicción de una recaída, el grado de actividad de la enfermedad ni la respuesta al tratamiento28. Sin embargo, de los biomarcadores en desarrollo propuestos por diferentes autores, ninguno es útil de forma aislada en la predicción o diagnóstico temprano de LES. La evidencia actual confirma que múltiples vías de señalización celular están implicadas en la fisiopatología de esta heterogénea entidad clínica y que utilizar una combinación de biomarcadores nuevos y tradicionales aumenta la rentabilidad diagnóstica en el seguimiento y predicción de recaídas16. Por otro lado, se desconocen estudios de costo y beneficio que permitan aclarar el rendimiento de estos nuevos biomarcadores al compararlos con marcadores clásicos como el Anti ADN de doble cadena o las fracciones del complemento C3 y C4.
Dada la fisiopatología del LES la medición de anti-cromatina, anti-C1q y CB-CAP constituyen una alternativa interesante que debe explorarse. Se necesitan estudios que permitan determinar si estos biomarcadores resultan fácilmente medibles y reproducibles en nuestra población y si ajustados a nuestro sistema de salud permiten evaluar de forma certera y temprana la actividad lúpica y, a su vez, la respuesta terapéutica.
Financiación
– Asociación Colombiana de Reumatología
– Universidad de la Sabana
– Hospital Militar Central
Conflicto de intereses
Los autores declaran no tener ningún conflicto de intereses.
Bibliografía
1. Liu CC, Ahearn JM. The search for lupus biomarkers. Best Pract Clin Rheumatol. 2009;23:507-23. [ Links ]
2. Pons-Estel GJ, Alarcón GS, Scofield L, Reinlib L, Cooper GS. Understanding the epidemiology and progression of systemic lupus erythematosus. Semin Arthritis Rhe. 2010;39:257-68. [ Links ]
3. Ippolito A, Petri M. An update on mortality in systemic lupus erythematosus. Clin Exp Rheumatol. 2008;26(5 Suppl 51):S72-9. [ Links ]
4. Bertsias GK, Salmon JE, Boumpas DT. Therapeutic opportunities in systemic lupus erythematosus: state of the art and prospects for the new decade. Ann Rheum Dis. 2010;69:1603-11. [ Links ]
5. Pamuk ON, Akbay FG, Dönmez S, Yilmaz N, Calayir GB, Yavuz S. The clinical manifestations and survival of systemic lupus erythematosus patients in Turkey: report from two centers. Lupus. 2013;22:1416-24. [ Links ]
6. Meacock R, Dale N, Harrison MJ. The humanistic and economic burden of systemic lupus erythematosus: a systematic review. PharmacoEconomics. 2013;31:49-61. [ Links ]
7. Huscher D, Merkesdal S, Thiele K, Zeidler H, Schneider M, Zink A; German Collaborative Arthritis Centres. Cost of illness in rheumatoid arthritis, ankylosing spondylitis, psoriatic arthritis and systemic lupus erythematosus in Germany. Ann Rheum Dis. 2006;65:1175-83. [ Links ]
8. Zhu TY, Tam LS, Lee VW, Lee KK, Li EK. Systemic lupus erythematosus with neuropsychiatric manifestation incurs high disease costs: a cost-of-illness study in Hong Kong. Rheumatology. 2009;48:564-8. [ Links ]
9. Illei GG, Tackey E, Lapteva L, Lipsky PE. Biomarkers in systemic lupus erythematosus: II. Markers of disease activity. Arthritis Rheum. 2004;50:2048-65. [ Links ]
10. Yee CS, Isenberg DA, Prabu A, Sokoll K, Teh LS, Rahman A, Bruce IN, Griffiths B, Akil M, McHugh N, D'Cruz D, Khamashta MA, Maddison P, Zoma A, Gordon C. BILAG-2004 index captures systemic lupus erythematosus disease activity better than SLEDAI-2000. Ann Rheum Dis. 2008;67:873-6. [ Links ]
11. Biomarkers Definitions Working Group. Biomarkers and surrogate endpoints: preferred definitions and conceptual framework. Clin Pharmacol Ther. 2001;69:89-95. [ Links ]
12. Illei GG, Tackey E, Lapteva L, Lipsky PE. Biomarkers in systemic lupus erythematosus. I. General overview of biomarkers and their applicability. Arthritis Rheum. 2004;50:1709-20. [ Links ]
13. Li Y, Fang X, Li QZ. Biomarker profiling for lupus nephritis. Genomics Proteomics Bioinformatics. 2013;11:158-65. [ Links ]
14. Tektonidou M, Ward M. Validation of new biomarkers in systemic autoimmune diseases. Nat Rev Rheumatol. 2011;7:708-17. [ Links ]
15. Tektonidou MG, Ward M. Validity of clinical associations of biomarkers in translational research studies: the case of systemic autoimmune diseases. Arthritis Res Ther. 2010;12:R179. [ Links ]
16. Herbst R, Liu Z, Jallal B, Yao Y. Biomarkers for systemic lupus erythematosus. Int J Rheum Dis. 2012;15:433-44. [ Links ]
17. Caneparo V, Cena T, De Andrea M, Dell'oste V, Stratta P, Quaglia M, Tincani A, Andreoli L, Ceffa S, Taraborelli M, Magnani C, Landolfo S, Gariglio M. Anti-IFI16 antibodies and their relation to disease characteristics in systemic lupus erythematosus. Lupus. 2013;22:607-13. [ Links ]
18. Pradhan V, Surve P, Ghosh K. Mannose binding lectin (MBL) in autoimmunity and its role in systemic lupus erythematosus (SLE). J Assoc Physicians India. 2010;58:688-90. [ Links ]
19. Tanaka A, Tsukamoto H, Mitoma H, Kiyohara C, Ueda N, Ayano M, et al. Serum progranulin levels are elevated in patients with systemic lupus erythematosus, reflecting disease activity. Arthritis Res Ther. 2012;14:R244. [ Links ]
20. Toldi G, Szalay B, Bekő G, Bocskai M, Deák M, Kovács L, et al. Plasma soluble urokinase plasminogen activator receptor (suPAR) levels in systemic lupus erythematosus. Biomarkers. 2012;17:758-63. [ Links ]
21. Liu CC, Manzi S, Kao AH, Navratil JS, Ahearn JM. Cell-bound complement biomarkers for systemic lupus erythematosus: from benchtop to bedside. Rheum Dis Clin North Am. 2010;36:161-72. [ Links ]
22. Ghiran IC, Zeidel ML, Shevkoplyas SS, Burns JM, Tsokos GC, Kyttaris VC. Systemic lupus erythematosus serum deposits C4d on red blood cells, decreases red blood cell membrane deformability, and promotes nitric oxide production. Arthritis Rheum. 2011;63:503-12. [ Links ]
23. Liu CC, Manzi S, Danchenko N, Ahearn JM. New advances in measurement of complement activation: lessons of systemic lupus erythematosus. Curr Rheumatol Rep. 2004;6:375-81. [ Links ]
24. Valentijn RM, van Overhagen H, Hazevoet HM, Hermans J, Cats A, Daha MR, van ES LA. The value of complement and immune complex determinations in monitoring disease activity in patients with systemic lupus erythematosus. Arthritis Rheum. 1985;28:904-13. [ Links ]
25. Ricker DM, Hebert LA, Rohde R, Sedmak DD, Lewis EJ, Clough JD. Serum C3 levels are diagnostically more sensitive and specific for systemic lupus erythematosus activity than are serum C4 levels. The Lupus Nephritis Collaborative Study Group. Am J Kidney Dis. 1991;18:678-85. [ Links ]
26. Morrow WJ, Isenberg DA, Todd-Pokropek A, Parry HF, Snaith ML. Useful laboratory measurements in the management of systemic lupus erythematosus. Q J Med. 1982;51:125-38. [ Links ]
27. Esdaile JM, Joseph L, Abrahamowicz M, Li Y, Danoff D, Clarke AE. Routine immunologic tests in systemic lupus erythematosus: is there a need for more studies? J Rheumatol. 1996;23:1891-6. [ Links ]
28. Calvo-Alén J, Bastian HM, Straaton KV, Burgard SL, Mikhail IS, Alarcón GS. Identification of patient subsets among those presumptively diagnosed with, referred, and/or followed up for systemic lupus erythematosus at a large tertiary care center. Arthritis Rheum. 1995;38:1475-84. [ Links ]
29. Tilley CA, Romans DG, Crookston MC. Localisation of Chido and Rodgers determinants to the C4d fragment of human C4. Nature. 1978;276:713-5. [ Links ]
30. Atkinson JP, Chan AC, Karp DR, Killion CC, Brown R, Spinella D, et al. Origin of the fourth component of complement related Chido and Rodgers blood group antigens. Complement. 1988;5:65-76. [ Links ]
31. Liu CC, Kao A, Hawkins D, Manzi S, Sattar A, Wilson N, et al. Lymphocyte-bound complement activation products as biomarkers for diagnosis of systemic lupus erythematosus. Clin Transl Sci. 2009;2:300-8. [ Links ]
32. Navratil J, Manzi S, Kao A, Krishnaswami S, Liu C-C, Ruffing M, et al. Platelet C4d is highly specific for systemic lupus erythematosus. Arthritis Rheum. 2006;54:670-4. [ Links ]
33. Batal I, Liang K, Bastacky S, Kiss LP, McHale T, Wilson NL, et al. Prospective assessment of C4d deposits on circulating cells and renal tissues in lupus nephritis: a pilot study. Lupus. 2012;21:13-26. [ Links ]
34. Minamiguchi S, Mikami Y, Nakajima N, Salah A, Kondoh E, Tatsumi K, Konishi I, Haga H. Complement split product C4d deposition in placenta in systemic lupus erythematosus and pregnancy-induced hypertension. Pathol Int. 2013;63:150-7. [ Links ]
35. Kao AH, Navratil JS, Ruffing MJ, Liu CC, Hawkins D, McKinnon KM, Danchenko N, Ahearn JM, Manzi S. Erythrocyte C3d and C4d for monitoring disease activity in systemic lupus erythematosus. Arthritis Rheum. 2010;62:837-44. [ Links ]
36. Burlingame RW. Recent Advances in understanding the clinical utility and underlying cause of antinucleosome (antichromatin) autoantibodies. Clin Appl Immunol Rev. 2004;4:351-66. [ Links ]
37. Mohan C, Adams S, Stanik V, Datta SK. Nucleosome: a major immunogen for pathogenic autoantibody-inducing T cells of lupus. J Exp Med. 1993;177:1367-81. [ Links ]
38. Casandra C. van Bavel JW, et al. Lupus-derived monoclonal autoantibodies against apoptotic chromatin recognize acetylated conformational epitopes. Mol Immunol. 2010;48:248-56. [ Links ]
39. Amoura Z, Piette JC, Bach JF, Koutouzov S. The key role of nucleosomes in lupus. Arthritis Rheum. 1999;42:833-43. [ Links ]
40. Bruns A, Bläss S, Hausdorf G, Burmester GR, Hiepe F. Nucleosomes are major T and B cell autoantigens in systemic lupus erythematosus. Arthritis Rheum. 2000;43:2307-15. [ Links ]
41. Liou LB, Chao WJ. Changing cytokine patterns in systemic lupus: a prospective longitudinal study. J Microbiol Immunol Infect. 2010;43:18-25. [ Links ]
42. Burlingame RW, Cervera R. Anti-chromatin (anti-nucleosome) autoantibodies. Autoimmun Rev. 2002;1:321-8. [ Links ]
43. Gómez-Puerta JA, Burlingame RW, Cervera R. Anti-chromatin (anti-nucleosome) antibodies: diagnostic and clinical value. Autoimmun Rev. 2008;7:606-11. [ Links ]
44. Tikly M, Gould T, Wadee A, van der Westhuizen E, Mokgethwa B. Clinical and serological correlates of antinucleosome antibodies in South Africans with systemic lupus erythematosus. Clin Rheumatol. 2007;26:2121-5. [ Links ]
45. Horák P, Scudla V, Hermanovó Z, Pospisil Z, Faltýnek L, Budiková M, et al. Clinical utility of selected disease activity markers in patients with systemic lupus erythematosus. Clin Rheumatol. 2001;20:337-44. [ Links ]
46. Ravirajan C, Rowse L, MacGowan J, Isenberg D. An analysis of clinical disease activity and nephritis-associated serum autoantibody profiles in patients with systemic lupus erythematosus: a cross-sectional study. Rheumatology. 2001;40:1405-12. [ Links ]
47. Amoura Z, Koutouzov S, Chabre H, Cacoub P, Amoura I, Musset L, et al. Presence of antinucleosome autoantibodies in a restricted set of connective tissue diseases: antinucleosome antibodies of the IgG3 subclass are markers of renal pathogenicity in systemic lupus erythematosus. Arthritis Rheum. 2000;43:76-84. [ Links ]
48. Burlingame RW. Recent advances in understanding the clinical utility and underlying cause of antinucleosome (antichromatin) autoantibodies. Clin Appl Immunol Rev. 2004;4:351-66. [ Links ]
49. Sinico RA, Rimoldi L, Radice A, Bianchi L, Gallelli B, Moroni G. Anti-C1q autoantibodies in lupus nephritis. Ann N Y Acad Sci. 2009;1173:47-51. [ Links ]
50. Potlukova E, Kralikova P. Complement component c1q and anti-c1q antibodies in theory and in clinical practice. Scand J Immunol. 2008;67:423 30. [ Links ]
51. Seelen MA, Trouw LA, Daha MR. Diagnostic and prognostic significance of anti-C1q antibodies in systemic lupus erythematosus. Curr Opin Nephrol Hypertens. 2003;12:619-24. [ Links ]
52. Min DJ, Kim SJ, Park SH, Seo YI, Kang HJ, Kim WU, Cho CS, Kim HY. Anti-nucleosome antibody: significance in lupus patients lacking anti-double-stranded DNA antibody. Clin Exp Rheumatol. 2002;20:13-8. [ Links ]
53. Mok CC. Biomarkers for lupus nephritis: a critical appraisal. J Biomed Biotechnol. 2010;2010:638413. doi:10.1155/2010/638413. Epub 2010 Apr 19. [ Links ]
54. Marto NBM, Calabuig E, Hughes GR, Khamashta MA. Anti-C1q antibodies in nephritis: correlation between titres and renal disease activity and positive predictive value in systemic lupus erythematosus. Ann Rheum Dis. 2005;64:444-8. [ Links ]
55. Horváth L, Czirják L, Fekete B, Jakab L, Pozsonyi T, Kalabay L, Romics L, Miklós K, Varga L, Prohászka Z, Szakács A, Nagy E, Daha MR, Füst G. High levels of antibodies against Clq are associated with disease activity and nephritis but not with other organ manifestations in SLE patients. Clin Exp Rheumatol. 2001;19:667-72. [ Links ]
56. Marto N, Bertolaccini M, Calabuig E, Hughes G, Khamashta M. Anti-C1q antibodies in nephritis: correlation between titres and renal disease activity and positive predictive value in systemic lupus erythematosus. Ann Rheum Dis. 2005;64:444-8. [ Links ]
57. Sinico R, Radice A, Ikehata M, Giammarresi G, Corace C, Arrigo G, et al. Anti-C1q autoantibodies in lupus nephritis: prevalence and clinical significance. Ann N Y Acad Sci. 2005;1050:193-200. [ Links ]
58. Trendelenburg M, López-Trascasa M, Potlukova E, Moll S, Regenass S, Frémeaux-Bacchi V, et al. High prevalence of anti-C1q antibodies in biopsy-proven active lupus nephritis. Nephrol Dial Transplant. 2006;21:3115-21. [ Links ]
59. Katsumata Y, Miyake K, Kawaguchi Y, Okamoto Y, Kawamoto M, Gono T, et al. Anti-C1q antibodies are associated with systemic lupus erythematosus global activity but not specifically with nephritis: a controlled study of 126 consecutive patients. Arthritis Rheum. 2011;63:2436-44. [ Links ]