Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Acessos
Acessos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares em
SciELO
Similares em
SciELO -
 Similares em Google
Similares em Google
Compartilhar
Revista Colombiana de Reumatología
versão impressa ISSN 0121-8123
Rev.Colomb.Reumatol. vol.21 no.3 Bogotá jul./dez. 2014
Artículo de revisión
Osteoartritis, obesidad y síndrome metabólico
Osteoarthritis, obesity and the metabolic syndrome
Julio César Sánchez Naranjo*, Diego Fernando López Zapata y Oscar Alonso Pinzón Duque
Facultad Ciencias de la Salud, Universidad Tecnológica de Pereira, La Julita, Pereira, Risaralda, Colombia
* Autor para correspondencia.
Correo electrónico: jcsanchez@utp.edu.co (J.C. Sánchez Naranjo).
Historia del artículo: Recibido el 10 de diciembre de 2013 Aceptado el 2 de junio de 2014
Resumen
La osteoartritis (OA) es una enfermedad crónica e incapacitante cuya prevalencia es elevada; su tratamiento continúa siendo paliativo debido al desconocimiento de los factores que inician la enfermedad. Se ha establecido una asociación epidemiológica con la obesidad y el síndrome metabólico, importantes pandemias mundiales, pero las razones que la explican continúan en estudio. Se postulan los factores biomecánico y metabólico como desencadenantes de la enfermedad en relación con la obesidad, y aunque ambos factores inducen eventos bioquímicos generadores de actividad proinflamatoria, que a su vez alteran el metabolismo de la matriz, el metabólico es caracterizado por la liberación de citocinas que median la respuesta en el contexto de la obesidad y el síndrome metabólico como un todo, o con varios de sus componentes en forma individual como hiperglicemia, dislipidemia o hipertensión. El cartílago articular también puede producir algunos factores protectores, los cuales están disminuidos en la OA, que pueden ser utilizados para el manejo de la dolencia. En todo caso, el balance entre los mediadores proinflamatorios y antiinflamatorios es el factor determinante tanto en la aparición de la OA como de su progresión y gravedad. La investigación sobre la asociación entre síndrome metabólico, obesidad y OA debe ser exhaustiva para poder traducir este conocimiento en estrategias terapéuticas más efectivas.
Palabras clave: Osteoartritis, Obesidad, Adipocinas, Síndrome, metabólico.
Abstract
Osteoarthritis is a chronic and disabling disease with a high prevalence. Its treatment continues to be palliative due to the lack of knowledge of the factors that initiate the disease. An epidemiological association with obesity and the metabolic syndrome has been established, but the reasons that explain that association are unclear. Both metabolic and biomechanical factors have been found to be related to the onset of osteoarthritis in obese patients. Although both factors induce biochemical events that generate proinflammatory activity, which alters matrix metabolism, the metabolic factor is characterized by release of cytokines related to obesity and the metabolic syndrome, or to each one of its components such as, hyperglycemia, dyslipidemia, or hypertension. Articular cartilage may also produce some protective agents, which are decreased in osteoarthritis, and could be used for treatment. The balance between proinflammatory and anti-inflammatory mediators is the key factor in the onset, progression, and severity of osteoarthritis. Further research on the association between osteoarthritis, obesity, and the metabolic syndrome must be exhaustive in order to translate this knowledge into more effective therapeutic strategies.
Keywords: Osteoarthritis, Obesity, Adipokines, Metabolic, syndrome.
Introducción
La osteoartritis (OA) es una enfermedad crónica discapacitante de elevada prevalencia mundial, la cual va en aumento tanto por la mayor esperanza de vida actual como por estilos de vida poco saludables1-4. El cuadro de OA puede progresar hasta impedir la realización de las labores cotidianas, debido al dolor y a la disminución de la funcionalidad, lo que pone en riesgo la autosuficiencia del individuo y genera un alto grado de dependencia a los sistemas de salud4. Las estrategias de prevención y las medidas terapéuticas empleadas hasta el momento para la OA se han enfocado en evitar lesiones mecánicas, en mejorar el dolor y en limitar modestamente el avance de la enfermedad, pero no existe una terapia dirigida al control de los factores desencadenantes, ya que estos aún no se conocen a cabalidad, lo que se traduce en malos pronósticos, pérdida de independencia funcional y altos costos para los servicios de salud. Estas limitaciones terapéuticas se presentan, principalmente, por ser este un problema multifactorial y por el distanciamiento básico-clínico que obliga a que los avances sean fragmentados y poco aplicables tanto en un campo como en el otro.
La OA tiene etiología múltiple y compleja5; en el curso de la enfermedad se generan alteraciones de la fisiología normal del cartílago y de la única célula responsable del metabolismo de la matriz extracelular: el condrocito articular6,7. Sin embargo, cuando la patología ya se encuentra avanzada suele existir homogeneización de los daños y mecanismos comunes de perpetuación del cuadro. Cuando la OA es causada por alteraciones anatómicas o por la degeneración de las articulaciones sin una causa aparente, es conocida como OA primaria. La OA secundaria se debe al daño articular causado por envejecimiento y asociado a obesidad, diabetes, síndrome metabólico (SM) y enfermedades crónicas e inflamatorias8; en estas dolencias, las alteraciones de la articulación no son causadas solo por factores mecánicos, sino también por mediadores humorales9. Algunas clasificaciones intentan anteponer el origen del cuadro de OA10,11, por ser este determinante de las estrategias terapéuticas y de la evolución clínica, pero no siempre puede establecerse con claridad la etiología, sobre todo porque en muchas ocasiones existen situaciones concurrentes. Sin embargo, la denominación de OA metabólica en el contexto de la asociación de esta enfermedad articular con el desequilibrio en el cual está inmerso el paciente obeso es una tendencia en los últimos años, dada la evidencia encontrada.
Metodología
El objetivo de este artículo es realizar una revisión amplia y conceptual de los factores que pueden explicar la asociación entre OA, obesidad y SM. Para realizarla, se utilizó una estrategia de búsqueda en PubMed usando los términos Mesh "osteoarthritis AND metabolic síndrome X", "osteoarthritis AND obesity", "osteoarthritis AND adipokines", "osteoarthritis AND cytokines", "osteoarthritis AND pathophysiology", "osteoarthritis AND adipokines" y "osteoarthritis AND mechanics"; además, se llevó a cabo la búsqueda utilizando también "chondrocytes" en conjunto con los términos anteriormente descritos. De los resultados arrojados se seleccionaron los artículos pertinentes.
Asociación epidemiológica entre osteoartritis, obesidad y síndrome metabólico
La asociación de OA de rodilla y cadera con obesidad ha sido claramente establecida a través de estudios epidemiológicos12-16 . En pacientes con sobrepeso, se ha encontrado prevalencia elevada de cambios de OA detectada por resonancia nuclear magnética en rodillas, donde no había hallazgos radiológicos de OA en personas con o sin dolor en esta articulación; en este mismo estudio, la prevalencia de características de OA aumentaba en directa proporción a la edad, aunque no se pudieron determinar diferencias significativas asociando el índice de masa corporal (IMC) con las lesiones características de OA17. Sin embargo, otros estudios de cohortes, prospectivos y con seguimiento de varios años han encontrado que existe asociación entre IMC y OA en rodilla18,19, asociación de obesidad con OA de rodilla y manos pero no con OA de cadera15, y mayor probabilidad de desarrollar OA de rodilla en personas obesas20.
Factores biomecánicos
El cartílago articular está diseñado para sobrellevar los cambios que se dan en las articulaciones debido al movimiento y a la carga mecánica que debe soportar, pero la aplicación de fuerzas estáticas prolongadas en la articulaciones, o de fuerzas cíclicas constantes, genera alteraciones en la producción de matriz y aumento del catabolismo, hallazgos característicos de la OA21. Dado que las articulaciones de miembros inferiores soportan una gran cantidad del peso corporal cotidianamente y, por tanto, están sometidas a una carga de presión permanente, el incremento del estrés mecánico ejercido por el exceso de peso corporal es la primera y más obvia razón para la inducción del proceso degenerativo en las grandes articulaciones de miembros inferiores.
Los mecanismos biomecánicos implicados en OA por fuera del contexto de su asociación con el peso corporal incluyen, en el caso de OA de rodilla, aumento de la laxitud de la articulación en el plano frontal y disminución de la agudeza propioceptiva, lo cual puede contribuir a inestabilidad articular e incrementar la sobrecarga del cartílago articular22, debilidad muscular como factor independiente asociado a degeneración articular23 y el valor de base del momento de aducción en la rodilla, que refleja la carga dinámica en el compartimiento medial y que puede predecir la progresión radiológica de la OA24; en el caso de OA de tobillo, la relación con el trauma repetido ha sido bien establecida25. Estos mecanismos pueden estar magnificados cuando el sobrepeso incrementa la carga de las articulaciones lo que aceleraría el proceso que conduce a OA en pacientes obesos.
El hecho de que el incremento de la carga sobre cartílago articular in vitro induzca la liberación de mediadores proinflamatorios e inductores de la degradación de este tejido26-28 podría ser parte del mecanismo que explique este proceso, pues los condrocitos perciben los eventos mecánicos y responden ante ellos, convirtiéndolos en eventos bioquímicos que aumentan la actividad proinflamatoria en caso de alta magnitud de tensión cíclica sobre las células o promueven la actividad antiinflamatoria en respuesta a tensión cíclica de baja magnitud29; estos hallazgos se complementan con un estudio realizado en bovinos donde se determinó que la degradación de la matriz extracelular inducida por interleucina (IL)-1β requiere de una carga mecánica crítica30. Los cambios mecánicos sobre las células generan también variaciones en los mecanismos de transporte mediados por canales mecanosensibles e interacciones con componentes asociados al citoesqueleto31 y afectan al transporte de H+ y, por ende, a la regulación del pH intracelular32. Adicionalmente, la presión incrementada sobre el hueso circundante puede inducir la liberación de mediadores bioquímicos desde osteoblastos, que promueven la degradación del cartílago33.
Factores humorales y metabólicos
El estrés mecánico incrementado no puede explicar completamente la asociación de la obesidad y la OA, pues la obesidad también se asocia a un incremento del riesgo de desarrollar OA en articulaciones de la mano que no soportan carga34. Además, múltiples evidencias sustentan que muchos de los mediadores hormonales y bioquímicos que están alterados en la obesidad y el SM se asocian con OA y pueden tener efectos en el funcionamiento del condrocito articular y el metabolismo de la matriz35.
Asociación con el síndrome metabólico
La obesidad es un estado de desequilibrio metabólico, en el cual se desencadena un proceso inflamatorio crónico, determinado por un desbalance de adipocitocinas que afectan las respuestas metabólicas a todo nivel36, perpetúan la acumulación de grasa, generan un proceso inflamatorio crónico37 e inducen complicaciones en varios sistemas que pueden conducir a un SM, condición caracterizada por una combinación de situaciones en la cual la dislipidemia, la hipertensión arterial y la diabetes mellitus tipo 2 (DM2) son las más dele téreas38. La presencia de SM se asocia al aumento de incidencia de OA de rodilla, explicado, principalmente, por el aumento del IMC39; sin embargo, al incrementar el número de componentes del SM se incrementa significativamente el riesgo tanto de la aparición como de la progresión de OA de rodilla, con mayor efecto sobre la ocurrencia que sobre la progresión40.
En otro sentido, la prevalencia del SM está incrementada en pacientes con OA, incluso después del ajuste por edad e IMC41. En mujeres, la obesidad en concurrencia con al menos 2 de los otros componentes del SM se asocia con un riesgo elevado de OA de rodilla42. Aún más, la hipertensión y la DM2 tienen un efecto aditivo para incrementar el riesgo de OA de mano43. Según el estudio NHANESIII, un incremento de 1 punto en el índice HOMA-IR (Homeostatic Model Assessment - Insulin Resistance), el cual se basa en parámetros clínicos y de laboratorio determinantes de la resistencia a la insulina, está asociado con un incremento del riesgo de OA de rodilla en un 18% en hombres no obesos y en un 34% en hombres obesos, aunque en mujeres, este índice no afectó al riesgo de OA44. Adicionalmente, en el estudio ROAD, la intolerancia a la glucosa se asoció al desarrollo y severidad de OA de rodilla45, y en un estudio longitudinal reciente que hizo seguimiento por más de 20 años a cerca de 1.000 pacientes, la DM2 se constituyó en un factor de riesgo para OA severa, con independencia de la edad y el IMC46.
Si se considera solo la hipertensión, esta se asocia con OA de rodilla después de ajustar por IMC y edad47, tal como también demostró el estudio ROAD40; además, la hipertensión incrementa el riesgo de OA de mano cuando se asocia a obesidad43. El colesterol sérico elevado, por otro lado, también se asocia a OA de rodilla y mano, independientemente del IMC47-49. La aterosclerosis en sí misma también está asociada a OA: aterosclerosis carotídea o calcificaciones coronarias se asocian a mayor severidad de OA de mano50, y el grosor de la pared arterial poplítea es mayor en pacientes con OA generalizada comparados con pacientes sin OA51. Todas estas asociaciones independientes entre OA y los diversos componentes del SM demuestran que no es la obesidad o el IMC el único factor determinante de una OA de origen metabólico.
La evidencia apunta a que en condiciones como la DM2, la obesidad y el SM, el cual abarca las condiciones anteriores, la homeostasis del cartílago está alterada, probablemente por la acción de las consecuencias del desequilibrio metabólico en sí mismo, o de agentes inflamatorios y hormonas reguladoras del metabolismo que están alteradas en estas enfermedades52.
Una de las condiciones metabólicas que se presentan en la DM2 es la hiperglicemia crónica; la exposición prolongada a concentraciones extracelulares elevadas de glucosa induce una expresión disminuida de GLUT-1, el principal transportador de glucosa, en condrocitos normales, lo cual es un mecanismo protector para evitar sobrecargas de glucosa; sin embargo, los condrocitos procedentes de articulaciones osteoartríticas no responden de la misma manera y capturan una mayor cantidad de glucosa, generando mayores cantidades de radicales libres de oxígeno, los cuales promueven la degradación de la matriz por activación de metaloproteinasas de la matriz (MMP) y pueden llevar a la muerte celular53,54. La hiperglicemia, además, induce reacciones de glicosilación no enzimática, las cuales se asocian con un incremento del estrés oxidativo55, proceso conocido como glicoxidación, y con reacciones generadoras de advanced glycation end products (AGE)56, moléculas que pueden interactuar con una diversidad de proteínas y unirse a receptores de membrana, para causar efectos deletéreos en las células. Los AGE se acumulan en el cartílago de articulaciones osteoartríticas y su concentración se correlaciona negativamente con la síntesis de matriz57. Los AGE también alteran las características biomecánicas del cartílago articular incrementando su rigidez y haciéndolo más susceptible a la lesión mecánica58; además, aumentan la producción de citocinas proinflamatorias, prostaglandina E2 (PGE2) y proteasas desde el condrocito y activan la vía de la mitogen-activated protein kinase (MAPK) en estas células, la cual disminuye su actividad anabólica59-61. Con respecto a las hiperlipidemias, recientemente se demostró en ratones que alteraciones de las high density lipoprotein cholesterol (HDL) predisponen al desarrollo de OA62; además, niveles elevados de ácidos grasos en condrocitos se asocian a una mayor severidad de la OA63.
Factores inflamatorios
El proceso inflamatorio crónico de la obesidad y el SM se caracteriza por un predominio de la liberación de factores proinflamatorios, tales como factor de necrosis tumoral-a (TNFα), IL-1β e IL-6, entre otros, los cuales alcanzan niveles elevados en el cartílago, tal vez por la permeabilidad alterada de la membrana sinovial y una mayor facilidad para alcanzar las células64. Estudios recientes demuestran la presencia de IL-7 e interferón g (INFγ) en cartílago osteoartrítico65,66 y exploran las posibilidades terapéuticas de la IL-10 y la IL-18, como factores antiinflamatorios articulares67,68.
Las citocinas proinflamatorias están asociadas al proceso fisiopatológico en OA, ya que activan MMP, inducen la liberación de radicales libres, aumentan la producción de prostaglandinas y disminuyen la expresión de genes de colágeno tipo II y de agrecanos66,69. Todo lo anterior lo logran a través de cascadas de señalización que involucran MAPK, extracellular-signal-regulated kinase, c-Jun N-Terminal kinase y nuclear factor kappa-light-chain-enhancer of activated B cells70,71. La activación de MMP y de agrecanasas, por diferentes sustancias inflamatorias, induce la destrucción de las fibras de colágeno, de los proteoglicanos y de los fragmentos de fibronectina resultantes de su digestión enzimática, que a su vez tienen efectos potenciadores del catabolismo de la matriz72. La destrucción de los proteoglicanos implica la desaparición de las cargas negativas de los mismos, por lo cual se altera la distribución iónica propia del cartílago, así como el potencial de membrana del condrocito, afectando aún más a sus funciones y empeorando la situación del tejido71,73. Las respuestas electrofisiológicas y de regulación del volumen intracelular a los cambios de osmolaridad también pueden estar alteradas por causa de la IL-1β74; este hecho es inductor de cascadas apoptóticas en el condrocito, y además entorpece la respuesta celular a los cambios dinámicos de la articulación, provocándose un círculo vicioso que empeora el proceso fisiopatológico75. La IL-1β, además, afecta a la regulación del pH intracelular en condrocitos articulares bovinos76, y el pH afecta a la dinámica de la síntesis de matriz.
Los sinoviocitos producen péptidos que contrarrestan la actividad inflamatoria de estas citocinas, especialmente la IL-4 y el antagonista del receptor de la IL-1 (IL-1RA)77, lo cual puede constituirse en un factor de defensa de la articulación frente al proceso inflamatorio. Es importante destacar que la activación de factores de transcripción antiinflamatorios como el peroxisome proliferator activated receptor gamma (PPARγ) son blanco para el desarrollo de terapias contra la OA, ya que posee efectos antiinflamatorios y estimulantes de la supervivencia del condrocito y de la síntesis de matriz, pero nuevamente la IL-1β actúa sobre este, inhibiéndolo78.
Factores endocrinos
La actividad de los condrocitos es regulada por el sistema endocrino; múltiples hormonas poseen receptores en los condrocitos y a esta regulación no escapan aquellas hormonas implicadas en la regulación metabólica general. Por ejemplo, múltiples factores de crecimiento son responsables de la regulación de la condrogénesis73. El factor de crecimiento similar a la insulina I desempeña una importante función en la maduración y supervivencia de los condrocitos y en la inducción de síntesis de matriz; limita el catabolismo al antagonizar sustancias proinflamatorias como la IL-1β79. El factor transformante del crecimiento beta es otro factor de crecimiento que se encuentra normalmente en bajas concentraciones, que se requiere para la síntesis de matriz y protege el catabolismo de la misma al contrarrestar los efectos deletéreos causados por sustancias proinflamatorias que activan MMP-1 y MMP-9; paradójicamente, también posee efectos proinflamatorios y puede activar MMP-13 y agrecanasas8,71. Las proteínas morfogenéticas del hueso son condroprotectoras, condrogénicas e inducen la síntesis de matriz80, y sus acciones son antagonizadas por algunas proteínas de la matriz como la folistatina y la noguina, las cuales se unen a las proteínas morfogenéticas del hueso e impiden su unión a receptores81. Otros factores de crecimiento presentes en el cartílago son el factor de crecimiento hepático, el factor de crecimiento del tejido conectivo y el factor de crecimiento fibroblástico; todos estimulan la condrogénesis y la síntesis de matriz, aunque este último está involucrado también en su catabolismo73,82. Esta regulación por diferentes factores humorales indica que los condrocitos articulares requieren de un balance hormonal para responder ante las exigencias funcionales a las que ellos son sometidos continuamente.
Las adipocinas, mediadores liberados principalmente por tejido adiposo, y alterados en la obesidad y el SM, tienen acciones aún mal caracterizadas sobre el cartílago y, por ende, los reportes sobre este tema son a veces contradictorios83. Diversos estudios han encontrado relación estadística entre los niveles plasmáticos e intraarticulares de adipocinas y la OA; la causa del aumento de adipocinas sinoviales no es clara, sin embargo se atribuye a factores como la mayor permeabilidad de la membrana sinovial, a la producción de agentes inflamatorios por sinoviocitos y a la síntesis de adipocinas en la grasa infrapatelar, en el caso de la OA de rodilla64,84,85.
La asociación mejor documentada se presenta con la leptina86,87, hormona que posee efectos reguladores del crecimiento, del metabolismo, del sistema inmune y de los depósitos energéticos corporales88, y que posee receptores en condrocitos89, cuya expresión está incrementada en cartílago osteoartrítico80. Su concentración está elevada en plasma y líquido sinovial de pacientes con OA, situación que es diferencial y contradictoria con respecto al género90,91. Niveles altos de leptina se asocian con mayor degeneración articular y con dolor articular severo92; asimismo, el aumento en los niveles del receptor de leptina soluble está asociado a mayor degeneración articular en OA93. A bajas dosis, la leptina promueve la expresión de marcadores de formación ósea y posee efectos estimulantes del crecimiento, de la proliferación de condrocitos y de la producción de matriz80,94, pero a concentraciones más altas, como las que se presentan en la obesidad, se comporta como un factor proinflamatorio, destruyendo la matriz extracelular, mediante la activación de MMP, la inducción de radicales libres y la alteración del metabolismo del condrocito9,95. Asimismo, la leptina induce la producción de IL-8 en condrocitos humanos96.
La adiponectina, cuya disminución es característica en obesidad y SM97, presenta efectos antiinflamatorios y sensibilizadores a la insulina en muchos tejidos, pero en el condrocito y el cartílago muestra efectos deletéreos para la matriz al activar MMP e inducir liberación de radicales libres98. Sin embargo, otras investigaciones sugieren que puede activar inhibidores de MMP, e inhibir la liberación de citocinas proinflamatorias99. El incremento de la concentración de adiponectina se asocia a la severidad de la OA de rodilla100 y a la degradación de agrecanos, y se encue ntra vinculada con la producción de IL-1β, MMP y radicales libres101-103. Algunos estudios no han encontrado relación entre niveles de adiponectina y el grado de daño en OA de mano92,104, pero otros trabajos han presentado evidencia que sugiere que la disminución de los niveles de adiponectina se asocia al grado de daño articular, y que la disminución de la proporción leptina/adiponectina se asocia con retraso en la progresión de la enfermedad y disminución del dolor asociado a esta105,106.
La resistina, la cual se incrementa en obesidad y SM y es inductora de resistencia a la insulina107, tiene efectos proinflamatorios e induce además la expresión de citocinas proinflamatorias, quimiocinas, MMP y radicales libres108, además de favorecer la destrucción de matriz. Esta hormona se ha asociado también con una mayor progresión de la enfermedad y potenciación del proceso inflamatorio109 .
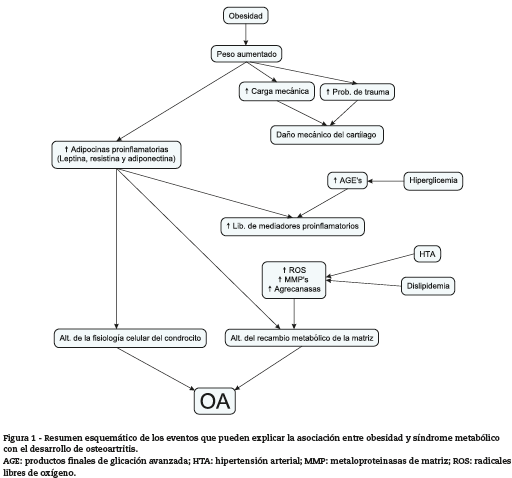
Adipocinas de reciente descripción como apelina y visfatina no han sido estudiadas exhaustivamente, pero algunos trabajos experimentales demuestran que la apelina, tanto in vitro como in vivo, induce síntesis de ARN mensajero de MMP-1, 3 y 9, y de IL-1β, además de reducir la síntesis de ARN mensajero de colágeno tipo II; adicionalmente, induce proliferación de condrocitos, síntesis de ARN mensajero de a disintegrin and metalloproteinase with a thrombospondin type 1 motif, member 4 (ADAMTS4) y 5 y destrucción de proteoglicanos110,111. Por otra parte, altas dosis de visfatina en cartílago articular y meniscos de porcino inducen actividad de MMP y producción de radicales libres112. En la figura 1 se presenta un resumen de las posibles interacciones que pueden relacionar el SM y la obesidad con la OA.
Conclusión
Es, pues, de suma importancia promover la investigación que continúe aportando al conocimiento en esta área, pues es necesaria para una mejor comprensión de una etiología metabólica en OA. Esto puede redundar en estrategias terapéuticas efectivas para los pacientes obesos o con SM, ya que estamos ante una epidemia mundial de estas patologías y se hace necesario intervenir en todas sus posibles asociaciones por las consecuencias que estas pueden tener en la calidad de vida de los pacientes. No en vano, la OA ha sido planteada como un elemento adicional para el SM, y algunos incluso recomiendan incluirla entre sus criterios diagnósticos52.
Conflicto de intereses
Los autores declaran que no existe ningún conflicto de intereses.
Bibliografía
1. Litwic A, Edwards MH, Dennison EM, Cooper C. Epidemiology and burden of osteoarthritis. Br Med Bull. 2013;105:185-99. [ Links ]
2. Busija L, Bridgett L, Williams SR, Osborne RH, Buchbinder R, March L, et al. Osteoarthritis. Best Pract Res Clin Rheumatol. 2010;24:757-68. [ Links ]
3. Van der Kraan PM, Van den Berg WB. Osteoarthritis in the context of ageing and evolution. Loss of chondrocyte differentiation block during ageing. Ageing Res Rev. 2008;7:106-13. [ Links ]
4. Oliviero F, Ramonda R, Punzi L. New horizons in osteoarthritis. Swiss Med Wkly. 2010;140:w13098. [ Links ]
5. Herrero-Beaumont G, Roman-Blas JA, Castañeda S, Jiménez SA. Primary osteoarthritis no longer primary: three subsets with distinct etiological, clinical, and therapeutic characteristics. Semin Arthritis Rheum. 2009;39:71-80. [ Links ]
6. Sánchez JC. Fisiología del condrocito articular. Rev Colomb Reumatol. 2008;15:21-33. [ Links ]
7. Sánchez JC, López-Zapata DF. Fisiopatología celular de la osteoartritis: el condrocito articular como protagonista. IATREIA. 2010;24:167-78. [ Links ]
8. Martel-Pelletier J, Boileau C, Pelletier JP, Roughley PJ. Cartilage in normal and osteoarthritis conditions. Best Pract Res Clin Rheumatol. 2008;22:351-84. [ Links ]
9. Dumond H, Presle N, Terlain B, Mainard D, Loeuille D, Netter P, et al. Evidence for a key role of leptin in osteoarthritis. Arthritis Rheum. 2003;48:3118-29. [ Links ]
10. Bijlsma JW, Berenbaum F, Lafeber FP. Osteoarthritis: an update with relevance for clinic al practice. Lancet. 2011;377:2115-26. [ Links ]
11. Sellam J, Berenbaum F. Is osteoarthritis a metabolic disease? Joint Bone Spine. 2013;80: 568-73. [ Links ]
12. Felson DT, Anderson JJ, Naimark A, Walker AM, Meenan RF. Obesity and knee osteoarthritis. The Framingham Study. Ann Intern Med. 1988;109:18-24. [ Links ]
13. Cooper C, Inskip H, Croft P, Campbell L, Smith G, McLaren M, et al. Individual risk factors for hip osteoarthritis: obesity, hip injury, and physical activity. Am J Epidemiol. 1998;147:516-22. [ Links ]
14. Cooper C, Snow S, McAlindon TE, Kellingray S, Stuart B, Coggon D, et al. Risk factors for the incidence and progression of radiographic knee osteoarthritis. Arthritis Rheum.2000;43:995-1000. [ Links ]
15. Grotle M, Hagen KB, Natvig B, Dahl FA, Kvien TK. Obesity and osteoarthritis in knee, hip and/or hand: an epidemiological study in the general population with 10 years follow-up. BMC Musculoskelet Disord. 2008;9:132. [ Links ]
16. Lohmander LS, Gerhardsson de Verdier M, Rollof J, Nilsson PM, Engström G. Incidence of severe knee and hip osteoarthritis in relation to different measures of body mass: a population-based prospective cohort study. Ann Rheum Dis. 2009;68:490-6. [ Links ]
17. Guermazi A, Niu J, Hayashi D, Roemer FW, Englund M, Neogi T, et al. Prevalence of abnorma lities in knees detected by MRI in adults without knee osteoarthritis: population based observational study (Framingham Osteoarthritis Study). BMJ. 2012;345:e5339. [ Links ]
18. Brennan SL, Cicuttini FM, Pasco JA, Henry MJ, Wang Y, Kotowicz MA, et al. Does an increase in body mass index over 10 years affect knee structure in a population-based cohort study of adult women? Arthritis Res Ther. 2010;12:R139. [ Links ]
19. Wills AK, Black S, Cooper R, Coppack RJ, Hardy R, Martin KR, et al. Life course body mass index and risk of knee osteoarthritis at the age of 53 years: evidence from the 1946 British birth cohort study. Ann Rheum Dis. 2012;71:655-60. [ Links ]
20. Ackerman IN, Osborne RH. Obesity and increased burden of hip and knee joint disease in Australia: results from a national survey. BMC Musculoskelet Disord. 2012;13:254. [ Links ]
21. Hardmeier R, Redl H, Marlovits S. Effects of mechanical loading on collagen propeptides processing in cartilage repair. J Tissue Eng Regen Med. 2010;4:1-11. [ Links ]
22. Cammarata ML, Dhaher YY. Associations between frontal plane joint stiffness and proprioceptive acuity in knee osteoarthritis. Arthritis Care Res (Hoboken). 2012;64:735-43. [ Links ]
23. Herzog W, Longino D. The role of muscles in joint degeneration and osteoarthritis. J Biomech. 2007;40 Suppl 1:S54-63. Fe de erratas en: J Biomech. 2008;41:2332-5. [ Links ]
24. Miyazaki T, Wada M, Kawahara H, Sato M, Baba H, Shimada S. Dynamic load at baseline can predict radiographic disease progression in medial compartment knee osteoarthritis. Ann Rheum Dis. 2002;61:617-22. [ Links ]
25. Valderrabano V, Horisberger M, Russell I, Dougall H, Hintermann B. Etiology of ankle osteoarthritis. Clin Orthop Relat Res. 2009;467:1800-6. [ Links ]
26. Chauffier K, Laiguillon MC, Bougault C, Gosset M, Priam S, Salvat C, et al. Induction of the chemokine IL-8/Kc by the articular cartilage: possible influence on osteoarthritis. Joint Bone Spine. 2012;79:604-9. [ Links ]
27. Gosset M, Berenbaum F, Levy A, Pigenet A, Thirion S, Cavadias S, et al. Mechanical stress and prostaglandin E2 synthesis in cartilage. Biorheology. 2008;45:301-20. Fe de erratas en: Biorheology. 2012;49:299. [ Links ]
28. Gosset M, Berenbaum F, Levy A, Pigenet A, Thirion S, Saffar JL, et al. Prostaglandin E2 synthesis in cartilage explants under compression: mPGES-1 is a mechanosensitive gene. Arthritis Res Ther. 2006;8:R135. [ Links ]
29. Agarwal S, Deschner J, Long P, Verma A, Hofman C, Evans CH, et al. Role of NF‐kB transcription factors in antiinflammatory and proinflammatory actions of mechanical signals. Arthritis Rheum. 2004;50:3541-8. [ Links ]
30. Torzilli PA, Bhargava M, Park S, Chen CT. Mechanical load inhibits IL-1 induced matrix degradation in articular cartilage. Osteoarthritis Cartilage. 2010;18:97-105. [ Links ]
31. Mobasheri A, Carter SD, Martín-Vasallo P, Shakibaei M. Integrins and stretch activated ion channels; putative components of functional cell surface mechanoreceptors in articular chondrocytes. Cell Biol Int. 2002;26:1-18. [ Links ]
32. Browning JA, Walker RE, Hall AC, Wilkins RJ. Modulation of Na+ x H+ exchange by hydrostatic pressure in isolated bovine articular chondrocytes. Acta Physiol Scand. 1999;166:39-45. [ Links ]
33. Priam S, Bougault C, Houard X, Gosset M, Salvat C, Berenbaum F, et al. Identification of soluble 14-3-3« as a novel subchondral bone mediator involved in cartilage degradation in osteoarthritis. Arthritis Rheum. 2013;65:1831-42. [ Links ]
34. Yusuf E, Nelissen RG, Ioan-Facsinay A, Stojanovic-Susulic V, DeGroot J, Van Osch G, et al. Association between weight or body mass index and hand osteoarthritis: a systematic review. Ann Rheum Dis. 2010;69:761-5. [ Links ]
35. Eaton CB. Obesity as a risk factor for osteoarthritis: mechanical versus metabolic. Med Health R I. 2004;87:201-4. [ Links ]
36. Harwood HJ Jr. The adipocyte as an endocrine organ in the regulation of metabolic homeostasis. Neuropharmacology. 2012;63:57-75. [ Links ]
37. Trayhurn P, Wood IS. Adipokines: inflammation and the pleiotropic role of white adipose tissue. Br J Nutr. 2004;92:347-55. [ Links ]
38. Duvnjak L, Duvnjak M. The metabolic syndrome - an ongoing story. J Physiol Pharmacol. 2009;6 0 Suppl 7:19-24. [ Links ]
39. Engström G, Gerhardsson de Verdier M, Rollof J, Nilsson PM, Lohmander LS. C-reactive protein, metabolic syndrome and incidence of severe hip and knee osteoarthritis. A population-based cohort study. Osteoarthritis Cartilage. 2009;17:168-73. [ Links ]
40. Yoshimura N, Muraki S, Oka H, Tanaka S, Kawaguchi H, Nakamura K, et al. Accumulation of metabolic risk factors such as overweight, hypertension, dyslipidaemia, and impaired glucose tolerance raises the risk of occurrence and progression of knee osteoarthritis: a 3-year follow-up of the ROAD Study. Osteoarthritis Cartilage. 2012;20:1217-26. [ Links ]
41. Puenpatom RA, Victor TW. Increased prevalence of metabolic syndrome in individuals with osteoarthritis: an analysis of NHANES III data. Postgrad Med. 2009;121:9-20. [ Links ]
42. Sowers M, Karvonen-Gutiérrez CA, Palmieri-Smith R, Jacobson JA, Jiang Y, Ashton-Miller JA. Knee osteoarthritis in obese women with cardiometabolic clustering. Arthritis Rheum. 2009;61:1328-36. [ Links ]
43. Dahaghin S, Bierma-Zeinstra SM, Koes BW, Hazes JM, Pols HA. Do metabolic factors add to the effect of overweight on hand osteoarthritis? The Rotterdam Study. Ann Rheum Dis. 2007;66:916-20. [ Links ]
44. Huffman KM, Kraus WE. Osteoarthritis and the metabolic syndrome: more evidence that the etiology of OA is different in men and women. Osteoarthritis Cartilage. 2012;20:603-4. [ Links ]
45. Yoshimura N, Muraki S, Oka H, Kawaguchi H, Nakamura K, Akune T. Association of knee osteoarthritis with the accumulation of metabolic risk factors such as overweight, hypertension, dyslipidemia, and impaired glucose tolerance in Japanese men and women: the ROAD Study. J Rheumatol. 2011;38:921-30. [ Links ]
46. Schett G, Kleyer A, Perricone C, Sahinbegovic E, Iagnocco A, Zwerina J, et al. Diabetes is an independent predictor for severe osteoarthritis: results from a longitudinal cohort study. Diabetes Care. 2013;36:403-9. [ Links ]
47. Hart DJ, Doyle DV, Spector TD. Association between metabolic factors and knee osteoarthritis in women: the Chingford Study. J Rheumatol. 1995;22:1118-23. [ Links ]
48. Al-Arfaj AS. Radiographic osteoarthritis and serum cholesterol. Saudi Med J. 2003;24:745-7. [ Links ]
49. Stürmer T, Sun Y, Sauerland S, Zeissig I, Günther KP, Puhl W, et al. Serum cholesterol and osteoarthritis. The baseline examination of the Ulm Osteoarthritis Study. J Rheumatol. 1998;25:1827-32. [ Links ]
50. Jonsson H, Helgadottir GP, Aspelund T, Eiriksdottir G, Sigurdsson S, Ingvarsson T, et al. Hand osteoarthritis in older women is associated with carotid and coronary atherosclerosis: the AGES Reykjavik Study. Ann Rheum Dis. 2009;68:1696-700. [ Links ]
51. Kornaat PR, Sharma R, Van der Geest RJ, Lamb HJ, Kloppenburg M, Hellio le Graverand MP, et al. Positive association between increased popliteal artery vessel wall thickness and generalized osteoarthritis: is OA also part of the metabolic syndrome? Skeletal Radiol. 2009;38:1147-51. [ Links ]
52. Zhuo Q, Yang W, Chen J, Wang Y. Metabolic syndrome meets osteoarthritis. Nat Rev Rheumatol. 2012 ;8:729-37. [ Links ]
53. Rosa SC, Gonçalves J, Judas F, Mobasheri A, Lopes C, Mendes AF. Impaired glucose transporter-1 degradation and increased glucose transport and oxidative stress in response to high glucose in chondrocytes from osteoarthritic versus normal human cartilage. Arthritis Res Ther. 2009;11:R80. [ Links ]
54. Rosa SC, Rufino AT, Judas FM, Tenreiro CM, Lopes MC, Mendes AF. Role of glucose as a modulator of anabolic and catabolic gene expression in normal and osteoarthritic human chondrocytes. J Cell Biochem. 2011;112:2813-24. [ Links ]
55. Gillery P. Oxidative stress and protein glycation in diabetes mellitus. Ann Biol Clin (Paris). 2006;64:309-14. [ Links ]
56. Verzijl N, Bank RA, TeKoppele JM, DeGroot J. AGEing and osteoarthritis: a different perspective. Curr Opin Rheumatol. 2003;15:616-22. [ Links ]
57. Verzijl N, DeGroot J, Bank RA, Bayliss MT, Bijlsma JW, Lafeber FP, et al. Age-related accumulation of the advanced glycation endproduct pentosidine in human articular cartilage aggrecan: the use of pentosidine levels as a quantitative measure of protein turnover. Matrix Biol. 2001;20:409-17. [ Links ]
58. Verzijl N, DeGroot J, Ben ZC, Brau‐Benjamin O, Maroudas A, Bank RA, et al. Crosslinking by advanc ed glycation end products increases the stiffness of the collagen network in human articular cartilage: a possible mechanism through which age is a risk factor for osteoarthritis. Arthritis Rheum. 2002;46:114-23. [ Links ]
59. Nah SS, Choi IY, Lee CK, Oh JS, Kim YG, Moon HB, et al. Effects of advanced glycation end products on the expression of COX-2, PGE2 and NO in human osteoarthritic chondrocytes. Rheumatology (Oxford). 2008;47:425-31. [ Links ]
60. Nah SS, Choi IY, Yoo B, Kim YG, Moon HB, Lee CK. Advanced glycation end products increases matrix metalloproteinase-1, -3, and -13, and TNF-alpha in human osteoarthritic chondrocytes. FEBS Lett. 2007;581:1928-32. [ Links ]
61. Rasheed Z, Akhtar N, Haqqi TM. Advanced glycation end products induce the expression of interleukin-6 and interleukin-8 by receptor for advanced glycation end product-mediated activation of mitogen-activated protein kinases and nuclear factor-kB in human osteoarthritis chondrocytes. Rheumatology (Oxford). 2011;50:838-51. [ Links ]
62. Triantaphyllidou IE, Kalyvioti E, Karavia E, Lilis I, Kypreos KE, Papachristou DJ. Perturbations in the HDL metabolic pathway predispose to the development of osteoarthritis in mice following long-term exposure to western-type diet. Osteoarthritis Cartilage. 2013;21:322-30. [ Links ]
63. Lippiello L, Walsh T, Fienhold M. The association of lipid abnormalities with tissue pathology in human osteoarthritic articular cartilage. Metabolism. 1991;40:571-6. [ Links ]
64. Hwang J, Bae WC, Shieu W, Lewis CW, Bugbee WD, Sah RL. Increased hydraulic conductance of human articular cartilage and subchondral bone plate with progression of osteoarthritis. Arthritis Rheum. 2008;58:3831-42. [ Links ]
65. Long D, Blake S, Song XY, Lark M, Loeser RF. Human articular chondrocytes produce IL-7 and respond to IL-7 with increased production of matrix metalloproteinase-13. Arthritis Res Ther. 2008;10:R23. [ Links ]
66. Schuerwegh AJ, Dombrecht EJ, Stevens WJ, Van Offel JF, Bridts CH, De Clerck LS. Influence of pro-inflammatory (IL-1 alpha, IL-6, TNF-alpha, IFN-gamma) and anti-inflammatory (IL-4) cytokines on chondrocyte function. Osteoarthritis Cartilage. 2003;11:681-7. [ Links ]
67. Cornish J, Gillespie MT, Callon KE, Horwood NJ, Moseley JM, Reid IR. Interleukin-18 is a novel mitogen of osteogenic and chondrogenic cells. Endocrinology. 2003;144:1194-201. [ Links ]
68. Wang Y, Lou S. Direct protective effect of interleukin-10 on articular chondrocytes in vitro. Chin Med J (Engl). 2001;114:723-5. [ Links ]
69. Kojima F, Naraba H, Miyamoto S, Beppu M, Aoki H, Kawai. S Membrane-associated prostaglandin E synthase-1 is upregulated by proinflammatory cytokines in chondrocytes from patients with osteoarthritis. Arthritis Res Ther. 2004;6:R355-65. [ Links ]
70. Fan Z, Söder S, Oehler S, Fundel K, Aigner T. Activation of interleukin-1 signaling cascades in normal and osteoarthritic articular cartilage. Am J Pathol. 2007;171:938-46. [ Links ]
71. Roman-Blas JA, Stokes DG, Jiménez SA. Modulation of TGF-beta signaling by proinflammatory cytokines in articular chondrocytes. Osteoarthritis Cartilage. 2007;15:1367-77. [ Links ]
72. Yasuda T. Comparison of hyaluronan effects among normal, osteoarthritis, and rheumatoid arthritis cartilages stimulated with fibronectin fragment. Biomed Res. 2010;31:63-9. [ Links ]
73. Shi S, Mercer S, Eckert GJ, Trippel SB. Growth factor regulation of growth factors in articular chondrocytes. J Biol Chem. 2009;284:6697-704. [ Links ]
74. Pritchard S, Guilak F. Effects of interleukin-1 on calcium signaling and the increase of filamentous actin in isolated and in situ articular chondrocytes. Arthritis Rheum. 2006;54:2164-74. [ Links ]
75. Racz B, Reglodi D, Fodor B, Gasz B, Lubics A, Gallyas F Jr, et al. Hyperosmotic stress-induced apoptotic signaling pathways in chondrocytes. Bone. 2007;40:1536-43. [ Links ]
76. Tattersall AL, Browning JA, Wilkins RJ. Modulation of H+ transport mechanisms by interleukin-1 in isolated bovine articular chondrocytes. Cell Physiol Biochem. 2005;16:43-50. [ Links ]
77. Doi H, Nishida K, Yorimitsu M, Komiyama T, Kadota Y, Tetsunaga T, et al. Interleukin-4 downregulates the cyclic tensile stress-induced matrix metalloproteinases-13 and cathepsin B expression by rat normal chondrocytes. Acta Med Okayama. 2008;62:119-26. [ Links ]
78. Afif H, Benderdour M, Mfuna-Endam L, Martel-Pelletier J, Pelletier JP, Duval N, et al. Peroxisome proliferator-activated receptor gamma1 expression is diminished in human osteoarthritic cartilage and is downregulated by interleukin-1βeta in articular chondrocytes. Arthritis Res Ther. 2007;9:R31. [ Links ]
79. Ekenstedt KJ, Sonntag WE, Loeser RF, Lindgren BR, Carlson CS. Effects of chronic growth hormone and insulin-like growth factor 1 deficiency on osteoarthritis severity in rat knee joints. Arthritis Rheum. 2006;54:3850-8. [ Links ]
80. Simopoulou T, Malizos KN, Iliopoulos D, Stefanou N, Papatheodorou L, Ioannou M, et al. Differential expression of leptin and leptin's receptor isoform (Ob-Rb) mRNA between advanced and minimally affected osteoarthritic cartilage; effect on cartilage metabolism. Osteoarthritis Cartilage. 2007;15:872-83. [ Links ]
81. Tardif G, Hum D, Pelletier JP, Boileau C, Ranger P, Martel-Pelletier J. Differential gene expression and regulation of the bone morphogenetic protein antagonists follistatin and gremlin in normal and osteoarthritic human chondrocytes and synovial fibroblasts. Arthritis Rheum. 2004;50:2521-30. [ Links ]
82. Gaissmaier C, Koh JL, Weise K. Growth and differentiation factors for cartilage healing and repair. Injury. 2008;39 Suppl 1:S88-96. [ Links ]
83. Scotece M, Conde J, Gómez R, López V, Lago F, Gómez-Reino JJ, et al. Beyond fat mass: exploring the role of adipokines in rheumatic diseases. Scientific World Journal. 2011;11:1932-47. [ Links ]
84. Ushiyama T, Chano T, Inoue K, Matsusue Y. Cytokine production in the infrapatellar fat pad: another source of cytokines in knee synovial fluids. Ann Rheum Dis. 2003;62:108-12. [ Links ]
85. Witoński D,Wągrowska-Danilewicz M, Kęska R, Raczyńska-Witońska G, Stasikowska-Kanicka O. Increased interleukin 6 and tumour necrosis factor a expression in the infrapatellar fat pad of the knee joint with the anterior knee pain syndrome: a preliminary report. Pol J Pathol. 2010;61:213-8. [ Links ]
86. Gualillo O. Further evidence for leptin involvement in cartilage homeostases. Osteoarthritis Cartilage. 2007;15:857-60. [ Links ]
87. Issa RI, Griffin TM. Pathobiology of obesity and osteoarthritis: integrating biomechanics and inflammation. Pathobiol Aging Age Relat Dis. 2012;2. pii: 17470. [ Links ]
88. Ahima RS, Flier JS. Leptin. Annu Rev Physiol. 2000;62:413-37. [ Links ]
89. Figenschau Y, Knutsen G, Shahazeydi S, Johansen O, Sveinbjörnsson B. Human articular chondrocytes express functional leptin receptors. Biochem Biophys Res Commun. 2001;287:190-7. [ Links ]
90. Teich tahl AJ, Wluka AE, Proietto J, Cicuttini FM. Obesity and the female sex, risk factors for knee osteoarthritis that may be attributable to systemic or local leptin biosynthesis and its cellular effects. Med Hypotheses. 2005;65:312-5. [ Links ]
91. Stannus OP, Jones G, Quinn SJ, Cicuttini FM, Dore D, Ding C. The association between leptin, interleukin-6, and hip radiographic osteoarthritis in older people: a cross-sectional study. Arthritis Res Ther. 2010;12:R95. [ Links ]
92. Massengale M, Lu B, Pan JJ, Katz JN, Solomon DH. Adipokine hormones and hand osteoarthritis: radiographic severity and pain. PLoS One. 2012;7:e47860. [ Links ]
93. Berry PA, Jones SW, Cicuttini FM, Wluka AE, Maciewicz RA. Temporal relationship between serum adipokines, biomarkers of bone and cartilage turnover, and cartilage volume loss in a population with clinical knee osteoarthritis. Arthritis Rheum. 2011;63:700-7. [ Links ]
94. Koskinen A, Vuolteenaho K, Nieminen R, Moilanen T, Moilanen E. Leptin enhances MMP-1, MMP-3 and MMP-13 production in human osteoarthritic cartilage and correlates with MMP-1 and MMP-3 in synovial fluid from OA patients. Clin Exp Rheumatol. 2011;29:57-64. [ Links ]
95. Otero M, Lago R, Gómez R, Lago F, Gómez-Reino JJ, Gualillo O. Phosphatidylinositol 3-kinase, MEK-1 and p38 mediate leptin/interferon-gamma synergistic NOS type II induction in chondrocytes. Life Sci. 2007;81:1452-60. [ Links ]
96. Gómez R, Scotece M, Conde J, Gómez-Reino JJ, Lago F, Gualillo O. Adiponectin and leptin increase IL-8 production in human chondrocytes. Ann Rheum Dis. 2011;70:2052-4. [ Links ]
97. Kadowaki T, Yamauchi T. Adiponectin and adiponectin receptors. Endocr Rev. 2005;26:439-51. [ Links ]
98. Lago R, Gómez R, Otero M, Lago F, Gallego R, Diéguez C, et al. A new player in cartilage homeostasis: adiponectin induces nitric oxide synthase type II and pro-inflammatory cytokines in chondrocytes. Osteoarthritis Cartilage. 2008;16:1101-9. [ Links ]
99. Chen TH, Chen L, Hsieh MS, Chang CP, Chou DT, Tsai SH. Evidence for a protective role for adiponectin in osteoarthritis. Biochim Biophys Acta. 2006;1762:711-8. [ Links ]
100. Honsawek S, Chayanupatkul M. Correlation of plasma and synovial fluid adiponectin with knee osteoarthritis severity. Arch Med Res. 2010;41:593-8. [ Links ]
101. De Boer TN, Van Spil WE, Huisman AM, Polak AA, Bijlsma JW, Lafeber FP, et al. Serum adipokines in osteoarthritis; comparison with controls and relationship with local parameters of synovial inflammation and cartilage damage. Osteoarthritis Cartilage. 2012;20:846-53. [ Links ]
102. Hao D, Li M, Wu Z, Duan Y, Li D, Qiu G. Synovial fluid level of adiponectin correlated with levels of aggrecan degradation markers in osteoarthritis. Rheumatol Int. 2011;31:1433-7. [ Links ]
103. Lee YA, Choi HM, Lee SH, Yang HI, Yoo MC, Hong SJ, et al. Synergy between adiponectin and interleukin-1β on the expression of interleukin-6, interleukin-8, and cyclooxygenase-2 in fibroblast-like synoviocytes. Exp Mol Med. 2012;44:440-7. [ Links ]
104. Massengale M, Reichmann WM, Losina E, Solomon DH, Katz JN. The relationship between hand osteoarthritis and serum leptin concentration in participants of the Third National Health and Nutrition Examination Survey. Arthritis Res Ther. 2012;14:R132. [ Links ]
105. Gandhi R, Takahashi M, Smith H, Rizek R, Mahomed NN. The synovial fluid adiponectin-leptin ratio predicts pain with knee osteoarthritis. Clin Rheumatol. 2010;29:1223-8. [ Links ]
106. Miller GD, Jenks MZ, Vendela M, Norris JL, Muday GK. Influence of weight loss, body composition, and lifestyle behaviors on plasma adipokines: a randomized weight loss trial in older men and women with symptomatic knee osteoarthritis. J Obes. 2012;2012:708505. [ Links ]
107. Bo S, Gambino R, Pagani A, Guidi S, Gentile L, Cassader M, et al. Relationships between human serum resistin, inflammatory markers and insulin resistance. Int J Obes (Lond). 2005;29:1315-20. [ Links ]
108. Zhang M, Wang JJ, Chen YJ. Effects of mechanical pressure on intracellular calcium release channel and cytoskeletal structure in rabbit mandibular condylar chondrocytes. Life Sci. 2006;78:2480-87. [ Links ]
109. Choe JY, Bae J, Jung HY, Park SH, Lee HJ, Kim SK. Serum resistin level is associated with radiographic changes in hand osteoarthritis: cross-sectional study. Joint Bone Spine. 2012;79:160-5. [ Links ]
110. Hu PF, Chen WP, Tang JL, Bao JP, Wu LD. Apelin plays a catabolic role on articular cartilage: in vivo and in vitro studies. Int J Mol Med. 2010;26:357-63. [ Links ]
111. Hu PF, Tang JL, Chen WP, Bao JP, Wu LD. Increased apelin serum levels and expression in human chondrocytes in osteoarthritic patients. Int Orthop. 2011;35:1421-6. [ Links ]
112. McNulty AL, Miller MR, O'Connor SK, Guilak F. The effects of adipokines on cartilage and meniscus catabolism. Connect Tissue Res. 2011;52:523-33. [ Links ]