Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista Colombiana de Reumatología
Print version ISSN 0121-8123
Rev.Colomb.Reumatol. vol.21 no.3 Bogotá July/Dec. 2014
Informe de caso
Necrosis cutánea extensa secundaria a síndrome antifosfolípido en un paciente con infección por el virus de la inmunodeficiencia humana: reporte de caso
Extensive skin necrosis secondary to antiphospholipid syndrome in an HIV infected patient: A case report
Cristian Iván García Rincóna, Nathalie Morales Restrepob, Carolina Muñoz-Grajalesc,*, Sergio Leonardo Cardozo Avendañod, Juliana Calleb, Carlos Jaime Velásquez Francoc,e, Javier Márquez Hernándezc y Luis Fernando Pinto Peñarandac
a Departamento de Medicina Interna, Hospital Pablo Tobón Uribe, Medellín, Colombia
b Departamento de Dermatología, Clínica CES, Medellín, Colombia
c Sección de Reumatología, Departamento de Medicina Interna, Hospital Pablo Tobón Uribe, Medellín, Colombia
d Departamento de Medicina Interna, Hospital San José del Guaviare, Guaviare, Colombia
e Facultad de Medicina, Escuela de Ciencias de la Salud, Universidad Pontificia Bolivariana, Medellín, Colombia
*Autor para correspondencia. Correo electrónico: carito_mg_sp@yahoo.com.(C. Muñoz-Grajales).
Historia del artículo:Recibido el 21 de noviembre de 2013 Aceptado el 16 de mayo de 2014
Resumen
Aunque un alto porcentaje de pacientes con infección por el virus de la inmunodeficiencia humana tienen anticuerpos antifosfolípidos, la expresión clínica como síndrome antifosfolípido es poco frecuente. La necrosis cutánea extensa es una de las principales características del síndrome antifosfolípido asociado a esta infección; la piedra angular de su tratamiento consiste en anticoagulación; en casos refractarios, se ha utilizado rituximab y plasmaféresis. Se presenta el caso de un paciente con infección por el virus de la inmunodeficiencia humana quien presentó necrosis cutánea extensa refractaria a múltiples terapias, en el contexto de un síndrome antifosfolípido.
Palabras clave: Necrosis, Piel, Síndrome antifosfolípido, VIH.
Abstract
Although a high percentage of patients infected with human immunodeficiency virus have antiphospholipid antibodies, clinical expression as antiphospholipid syndrome is rare. Extensive skin necrosis is one of the main features of antiphospholipid syndrome associated with this infection.The basis of the treatment is anticoagulation, with rituximab and plasmapheresis has being used inrefractory cases. A case is presented on a patient with human immunodeficiency virus infection, who, in the context of antiphospholipid syndrome, presented with extensive skin necrosis refractory to multiple therapies.
Keywords: Necrosis, Skin Antiphospholipid, Syndrome, HIV.
Introducción
El síndrome antifosfolípido (SAF) es un trastorno autoinmune multisistémico, caracterizado por trombosis recurrente, morbilidad obstétrica y la presencia de anticuerpos antifosfolípidos (aPL), incluyendo: anticuerpos anticardiolipina (aCL), anti-b2-glicoproteína I (ab2GPI) o anticoagulante lúpico (AL)1. Desde la primera descripción del SAF, en 1983, una amplia variedad de manifestaciones dermatológicas han sido reportadas. Aunque ninguna de esas manifestaciones es patognomónica de SAF, algunas pueden ser útiles a la hora de sugerir la posibilidad diagnóstica2. Desde el descubrimiento del virus de la inmunodeficiencia humana (VIH) se han descrito manifestaciones hematológicas asociadas a esta infección, siendo algunas de ellas: trombocitopenia, púrpura trombocitopénica trombótica y anormalidades que predisponen a un estado de hipercoagulabilidad3; aunque un porcentaje significativo de pacientes con infección por VIH tienen aPL, el SAF en ellos es infrecuente.
Se presenta el caso de un paciente masculino, de 37 años, con infección por VIH, que presentó necrosis cutánea extensa, refractaria a diferentes tratamientos, como manifestación de SAF.
Caso clínico
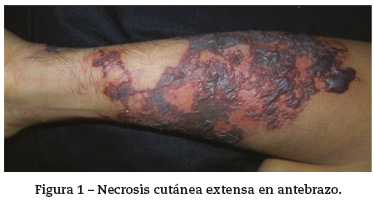
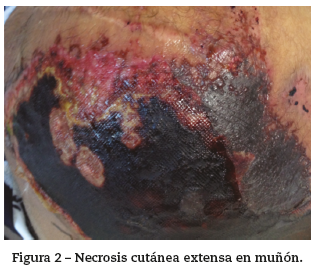
Hombre de 37 años con antecedente personal de VIH estadio B2 diagnosticado en 2008, en manejo con terapia antirretroviral. En 2009, presentó trombosis venosa profunda en miembro inferior derecho requiriendo anticoagulación con warfarina, la cual fue suspendida tras la aparición de lesiones necróticas en piel, con la impresión diagnóstica de necrosis por warfarina. En 2011, presentó trombosis venosa profunda y flegmasía cerúlea dolens en miembro inferior izquierdo, requiriendo desarticulación de la extremidad y reinicio de anticoagulación. Recibió heparina de bajo peso molecular hasta septiembre de 2012 cuando, por voluntad propia, suspendió los medicamentos; 20 días después, presentó reaparición de lesiones necróticas. En la evaluación inicial por dermatología se demostraron múltiples lesiones cicatriciales en extremidad inferior derecha, tronco y miembros superiores y necrosis extensa de la piel con áreas de púrpura retiforme en el muñón izquierdo (figs. 1 y 2).
Con estos hallazgos en piel y con el antecedente de trombosis a repetición, se consideró el diagnóstico de trombofilia adquirida y, como primera posibilidad, un SAF secundario o asociado a VIH.
Se tomó biopsia de piel de la púrpura retiforme, la cual reportó epidermis con necrosis y fenómeno trombótico en vasos de mediano y pequeño calibre, sin infiltrado inflamatorio asociado.
Se solicitaron paraclínicos: carga viral menor de 20 copias/mL, CD4 580 células por microlitro, creatinina 0,5 mg/dL, citoquímico de orina sin proteinuria, anticuerpos antinucleares, aCLs IgM e IgG, ab2GPI, virus de hepatitis B y C y crioglobulinas: negativos. Con AL positivo (relación 1:5). Recibió manejo con enoxaparina en dosis de anticoagulación, aspirina e hidroxicloroquina, pero no mostró mejoría de las lesiones, por lo que se adicionaron esteroides orales (prednisolona 20 mg/día), con cicatrización de las lesiones 3 semanas más tarde; sin embargo, a los 2 meses, presentó reaparición de lesiones necróticas en piel; por lo anterior, se remitió a un hospital universitario de cuarto nivel de complejidad y centro de referencia para ser evaluado por reumatología.
A las 12 semanas, se confirmó la positividad persistente del AL; el resto de aPL continuaron negativos. Los anticuerpos antinucleares, los antígenos extractables del núcleo, los anticuerpos contra el citoplasma de neutrófilo y las nuevas crioglobulinas resultaron negativos, al igual que la serología para hongos y la prueba de tuberculina.
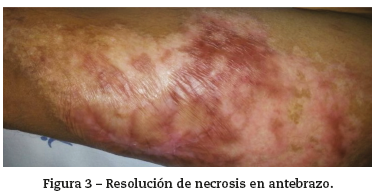
Ante la falta de respuesta con anticoagulación, aspirina, hidroxicloroquina y esteroides sistémicos, se decidió administrar rituximab (1 g/15 días por 2 aplicaciones). Inicialmente, la progresión de las lesiones se detuvo, pero, a las pocas semanas, empeoraron, requiriendo inicio de recambio plasmático, con igual respuesta: estabilidad inicial pero recurrencia posterior; por ello, se consideró inicio de ciclofosfamida que debió ser contemporizada por infección intercurrente (infección de tejidos blandos); en tanto se resolvía el proceso infeccioso, se administró inmunoglobulina (400 mg/kg/día por 5 días) y, una vez resuelto este, se aplicó ciclofosfamida (500 miligramos intravenosos mensualmente), con buena respuesta (resolución de lesiones cutáneas) hasta el último seguimiento (3 meses) (fig.3).
Discusión
El significado clínico de las manifestaciones cutáneas del SAF es altamente variable y su manejo depende de la agresividad clínica y de la presencia de otras manifestaciones de SAF. Estas se presentan en el 49% de los pacientes con SAF y pueden constituir la manifestación inicial del mismo hasta en el 30,5% de los casos, siendo, en orden de frecuencia, las siguientes: livedo reticularis (26%), necrosis digital (8%), hemorragias en astilla (8%), trombosis venosa superficial (5%), úlceras posflebíticas (5%), necrosis cutánea circunscrita (4%), púrpura cutánea por trombocitopenia (4%), pseudovasculitis (3%), necrosis cutánea extensa (2%) y anetoderma (1%)1,4.
Es habitual la aparición de aPL en el curso de ciertas infecciones, presentándose de forma transitoria y desapareciendo en un promedio de 12 semanas. Estos anticuerpos, usualmente no están relacionados con fenómenos trombóticos. Aunque un porcentaje significativo de pacientes con infección por VIH tiene aPL, la expresión clínica del SAF en este grupo es extremadamente rara. Las aCL han sido reportadas en pacientes con VIH, con una prevalencia de 7 a 94%; sin embargo, no hay una clara asociación entre dichos anticuerpos en VIH y el desarrollo de eventos trombóticos. La literatura reporta una mayor frecuencia de aCLIgG (41-94%) en pacientes con VIH, mientras que aCLIgM solo se presenta en el 7%. Los aCL descritos en pacientes VIH positivos son de ambos tipos: patogénicos (dependientes del cofactor ab2GPI) e infecciosos (independientes del cofactor ab2GPI)5.
En 1986, Bloom et al. documentaron, por primera vez, la presencia de AL en pacientes con síndrome de inmunodeficiencia humana (sida) y en 43% de los pacientes infectados con el VIH, asintomáticos; actualmente, la incidencia de AL en pacientes con VIH oscila entre 0 y 72% y, al igual que con las aCL, con este tampoco hay una clara correlación con eventos trombóticos. Los ab2GPI se encuentran tan solo en el 5% de estos sujetos. Aunque la presencia de estos anticuerpos en pacientes infectados con VIH no parece estar relacionada con las complicaciones del SAF, hay algunos reportes de pacientes que presentan fenómenos trombóticos3,6.
Los mecanismos por los cuales se presentan complicaciones trombóticas en pacientes con VIH y aPL no están claramente establecidos. En VIH hay un incremento en la tasa de apoptosis espontánea en los linfocitos en sangre periférica y se ha encontrado un defecto estructural en el contenido de cardiolipinas en la membrana mitocondrial de los linfocitos infectados. Los fosfolípidos de membrana estructural-mente alterados son transportados por un mecanismo de flipasa/translocasa hacia la superficie celular, permitiendo ser expuestos y actuar como neoantígenos que inducen una respuesta inmune humoral, permitiendo la activación policlonal de las células B y sirviendo como receptor "dinámico" de la b2GPI 7. De esta forma, los aPL, encontrados con frecuencia en pacientes con infección por VIH, pueden estar relacionados con la apoptosis de linfocitos inducida por el VIH, y pueden reflejar la pérdida de la funcionalidad de células B en el curso de la enfermedad3,6.
En un estudio descriptivo publicado en 2004, Ramos-Casals et al.8 documentaron que las principales características clínicas relacionadas con SAF en pacientes infectados con VIH fueron las necrosis óseas avasculares y cutáneas, sugiriendo, además, que el VIH podría comportarse como un agente disparador crónico capaz de inducir una presentación heterogénea y atípica del SAF.
Los pocos reportes de eventos trombóticos en pacientes con aPL e infección por VIH son principalmente relacionados con causas extrínsecas, como infecciones oportunistas o trastornos metabólicos derivados de la terapia antirretroviral. Otros factores, como la disminución de los niveles funcionales de proteína C o la deficiencia adquirida de proteína S, también han sido implicados, revelando un origen multifactorial de trombosis relacionada con VIH. A partir del estudio de Ramos-Casals et al., se ha caracterizado la población de pacientes con SAF asociado a VIH, incluyendo un predominio de pacientes hombres, con un promedio de edad de 30 años, y con una presentación clínica más heterogénea que la observada en la población general, demostrándose, además, en comparación con pacientes infectados con el virus de la hepatitis C, una mayor frecuencia de compromisos: óseo y cutáneo, y una menor frecuencia de trastornos cardíacos o abdominales8.
La necrosis cutánea extensa ha sido reportada en asociación con una serie de procesos patológicos, incluyendo: bacteriemia meningocócica, deficiencias de proteínas: C y S de la coagulación, calcifilaxis (síndrome de necrosis cutánea/ calcificación vascular), crioglobulinemia o criofibrinogenemia, además de medicamentos como: warfarina, vasopresina, interferones o sustancias como la cocaína2. Nuestro paciente, en el momento de la aparición de las lesiones, no recibía medicamentos relacionados, negaba el uso de cocaína o sustancias vasoconstrictoras y tanto el factor reumatoide como las crioglobulinas resultaron negativas.
Este tipo de necrosis ocurre en, aproximadamente, el 2% de los pacientes con SAF; el inicio es con frecuencia agudo, con púrpura extensa dolorosa, seguida por placas necróticas oscuras con un borde purpúrico activo. Puede también vincularse con ulceración y riesgo de infección secundaria. Cuando es extensa, entraña un pobre pronóstico, derivado este de los efectos de la dimensión del infarto cutáneo, así como de la patología subyacente. La asociación con un patrón retiforme es altamente sugestivo de lesiones oclusivas microvasculares. En estas mismas áreas se pueden formar ampollas necróticas. La necrosis está localizada usualmente en extremidades, cabeza y región glútea. La histopatología de las lesiones purpúricas tempranas de necrosis cutánea extensa revela trombosis difusa de los vasos de la piel1. Los pacientes con lesiones en piel que comprometan más del 40% del área de superficie corporal tendrán mayor probabilidad de desarrollar otras complicaciones trombóticas durante el curso de su enfermedad, pudiendo resultar en necrosis: cerebral, cardíaca, renal, pulmonar, adrenal, hepática, intestinal o periférica9.
Hasta donde se sabe, muy pocos casos de necrosis cutánea extensa secundaria a SAF han sido publicados. Perelló-Alzamora et al.10, en un reporte de caso publicado en 2012, hacen referencia a que, hasta entonces, solo se habían reportado en la literatura 23 casos de necrosis cutánea extensa en el contexto de SAF. El número de casos en pacientes que cursan de manera concomitante con infección por VIH es mucho menor. En 1995, Soweid et al.11 reportaron el caso de una mujer de raza negra de 38 años con sida y niveles elevados de aPL que presentó lesiones necróticas en ambos muslos e histología compatible. En 2001, Leder et al. reportaron el caso de un hombre de 24 años que presentó lesiones necróticas en extremidades inferiores, trombosis testicular y títulos altos de aCL, asociados con una infección aguda por VIH4. En 2004, Hassoun et al. describieron el caso de un hombre de 25 años que es evaluado por lesiones necróticas en piel como manifestación clínica inicial de la infección por VIH, en el contexto de un SAF3. En 2010, Felipe-Díaz et al., en Colombia, publicaron el caso de un paciente masculino, de 47 años, con diagnóstico reciente de infección por VIH, que presentó SAF manifestado por lesiones necróticas en piel de miembros inferiores y altos niveles de aCLIgG6.
La necrosis cutánea extensa y la gangrena digital son eventos trombóticos mayores que requieren manejo inicial con anticoagulación plena con heparina. Si las lesiones continúan avanzando a pesar de la anticoagulación, algunos autores han reportado resultados favorables con: iloprost, activador del plasminógeno tisular recombinante, rituximab o plasmaféresis12-14, pero no hay, hasta donde llega nuestro conocimiento, reportes con el uso de ciclofosfamida.
A pesar de la ausencia de ensayos clínicos controlados, prospectivos, que evalúen su rol en el tratamiento de pacientes con SAF, rituximab solo o en combinación con inmunosupresores, ha sido exitoso en el tratamiento de numerosas manifestaciones del SAF: trombocitopenia, hemólisis, eventos tromboembólicos venosos o arteriales recurrentes. La dosis más comúnmente usada es la de 375 mg/m2 semanalmente, por 4 semanas. Su empleo ha sido evaluado en el estudio RITAPS (RITuximab en APS), un estudio piloto, no aleatorizado, no controlado, publicado en 2013, el cual sugiere que es seguro en pacientes con aPL positivos, y que, a pesar de no generar un cambio sustancial en el perfil de aPL, puede ser efectivo a la hora de controlar algunas -pero no todas- manifestaciones no criterio de SAF; las lesiones cutáneas se resolvieron de manera favorable15,16. En 2010, Costa et al.13 reportaron el caso de un paciente caucásico, de sexo masculino, con una historia de SAF, tromboembolia venosa re currente, además de lesiones necróticas en piel en miembros superior e inferior derechos, en quien la refractariedad a la anticoagulación condujo al uso de plasmaféresis diaria y a la administración de 1.000 mg intravenosos de rituximab en los días 1 y 15, con mejoría ostensible de sus lesiones durante el seguimiento.
Nuestro paciente fue refractario a anticoagulación, antiagregación, antimaláricos y esteroides orales, requiriendo aplicación de rituximab y recambio plasmático y, posteriormente, de ciclofosfamida.
Conclusión
Los aPL se encuentran con frecuencia en los pacientes infectados con el VIH, sin que ello signifique, necesariamente, el desarrollo clínico de un SAF. La necrosis cutánea extensa es una manifestación rara de este síndrome (2% de los pacientes) y es, en conjunto con la necrosis ósea avascular, una de las principales manifestaciones clínicas de este síndrome cuando se asocia a infección por VIH. La piedra angular de su tratamiento consiste en el uso de anticoagulación; en casos refractarios, puede ser útil la adición de plasmaféresis e inmunosupresores o inmunomodulares como rituximab; en el presente caso fue útil la adición de ciclofosfamida.
Responsabilidades éticas
Protección de personas y animales. Los autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datos. Los autores declaran que han seguido los protocolos de su centro de trabajo sobre la publicación de datos de pacientes.
Derecho a la privacidad y consentimiento informado. Los autores han obtenido el consentimiento informado de los pacientes y/o sujetos referidos en el artículo. Este documento obra en poder del autor de correspondencia.
Financiación
Recursos propios.
Conflicto de intereses
Ninguno de los autores ha recibido incentivo por parte de compañías farmacéuticas u otros patrocinadores.
Agradecimientos
Al Hospital Pablo Tobón Uribe.
Bibliografía
1. Francès C. Dermatological manifestations of Hughes antiphospholipid antibody syndrome. Lupus. 2010;19:1071-7. [ Links ]
2. Creamer D, Hunt BJ, Black MM. Widespread cutaneous necrosis occurring in association with the antiphospholipid syndrome: a report of two cases. Br J Dermatol. 2000;142:1199-203. [ Links ]
3. Hassoun A, Al-Kadhimi Z, Cervia J. HIV infection and antiphospholipid antibody: literature review and link to the antiphospholipid syndrome. AIDS Patient Care STDS. 2004;18:333-40. [ Links ]
4. Francès C, Niang S, Laffitte E, Pelletier Fl, Costedoat N, Piette JC. Dermatologic manifestations of the antiphospholipid syndrome: two hundred consecutive cases. Arthritis Rheum. 2005;52:1785-93. [ Links ]
5. Leder AN, Flansbaum B, Zandman-Goddard G, Asherson R, Shoenfeld Y. Antiphospholipid syndrome induced by HIV. Lupus. 2001;10:370-4. [ Links ]
6. Felipe-Díaz OJ, Gaviria M, Trujillo MC, Rivas AM. Síndrome antifosfolípido e infección por VIH. Rev Colomb Reumatol. 2010;17:191-5. [ Links ]
7. Cervera R, Asherson RA, Acevedo ML, Gómez-Puerta JA, Espinosa G, De La Red G, et al. Antiphospholipid syndrome associated with infections: clinical and microbiological characteristics of 100 patients. Ann Rheum Dis. 2004;63:1312-7. [ Links ]
8. Ramos-Casals M, Cervera R, Lagrutta M, Medina F, García-Carrasco M, De La Red G, et al; Hispanoamerican Study Group of Autoimmune Manifestations of Chronic Viral Disease (HISPAMEC). Clinical features related to antiphospholipid syndrome in patients with chronic viral infections (hepatitis C Virus/HIV infection): description of 82 cases. Clin Infect Dis. 2004;38:1009-16. [ Links ]
9. DiFrancesco LM, Burkart P, Hoehn JG. A cutaneous manifestation of antiphospholipid antibody syndrome. Ann Plast Surg. 2003;51:517-22. [ Links ]
10. Perelló-Alzamora MR, Santos-Durán JC, Santos-Briz A, Unamuno P. Widespread cutaneous necrosis as the first clinical manifestation of secondary antiphospholipid syndrome. Actas Dermosifiliogr. 2012;103:832-3. [ Links ]
11. Soweid AM, Hajjar RR, Hewan-Lowe KO, González EB. Skin necrosis indicating antiphospholipid syndrome in patient with AIDS. South Med J. 1995;88:786-8. [ Links ]
12. Srinivasan SK, Pittelkow MR, Cooper LT Jr. Recombinant tissue plasminogen activator for the treatment of cutaneous infarctions in antiphospholipid antibody syndrome: a case report. Angiology. 2001;52:635-9. [ Links ]
13. Costa R, Fazal S, Kaplan RB, Spero J, Costa R. Successful plasma exchange combined with rituximab therapy in aggressive APS-related cutaneous necrosis. Clin Rheumatol. 2013;32 Suppl 1:S79-82. [ Links ]
14. De Sá EB, Da Silva Passos A, Cecconi M, Barbo ML, Martínez JE, Novaes GS. Gangrene of the auricle as the first sign of antiphospholipid antibody syndrome. Rev Bras Reumatol. 2011;51:658-61. [ Links ]
15. Khattri S, Zandman-Goddard G, Peeva E. B-cell directed therapies in antiphospholipid antibody syndrome-new directions based on murine and human data. Autoimmun Rev. 2012;11:717-22. [ Links ]
16. Erkan D, Vega J, Ramón G, Kozora E, Lockshin MD. A pilot open-label phase II trial of rituximab for non-criteria manifestations of antiphospholipid syndrome. Arthritis Rheum. 2013;65:464-71. [ Links ]