Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista Colombiana de Reumatología
Print version ISSN 0121-8123
Rev.Colomb.Reumatol. vol.21 no.4 Bogotá Oct./Dec. 2014
https://doi.org/10.1016/j.rcreu.2014.10.002
http://dx.doi.org/10.1016/j.rcreu.2014.10.002
Investigación original
Ciento quince pacientes con lupus eritematoso sistémico: características clínicas e inmunológicas
A series of 115 patients with systemic lupus erythematosus: Clinical and immunological characteristics
David Moisés Severiche Maurya,b,*, Mauricio Restrepo Escobarb, Luis Alonso González Naranjob, Adriana Lucía Vanegas Garcíab,c, Carlos Horacio Muñoz Vahosb,c y Gloria María Vásquez Duquea,b
a Grupo de Inmunología Celular e Inmunogenética, Sede de investigación universitaria, Instituto de Investigaciones Médicas, Facultad de Medicina, Universidad de Antioquia, Medellín, Colombia
b Grupo de Reumatología, Departamento de Medicina Interna, Facultad de Medicina, Universidad de Antioquia, Medellín, Colombia
c Sección de Reumatología, Hospital Universitario San Vicente Fundación, Medellín, Colombia
* Autor para correspondencia. Correo electrónico: glomavas@gmail.com (D.M. Severiche Maury).
Historia del artículo: Recibido el 25 de julio de 2014 Aceptado el 9 de octubre de 2014 On-line el 15 de noviembre de 2014
Resumen
Introducción: El lupus eritematoso sistémico es una enfermedad autoinmune, multisistémica de etiología desconocida, que afecta principalmente a mujeres en edad reproductiva. Dentro de las manifestaciones más frecuentes se encuentran los compromisos renal e inmunológico; el primero es el responsable de gran parte de la morbimortalidad de los pacientes y el segundo está fuertemente asociado a múltiples manifestaciones clínicas.
Objetivo: Analizar la prevalencia y características de las principales manifestaciones clínicas e inmunológicas de 115 pacientes con diagnóstico de lupus eritematoso sistémico del Hospital Universitario San Vicente Fundación y establecer la asociación entre los anticuerpos específicos y el compromiso de órgano. Materiales y métodos: Los pacientes fueron vistos por el Grupo de Reumatología de la Universidad de Antioquia entre 2008 y 2012. Los datos clínicos e inmunológicos se recolectaron del archivo o sistema electrónico de historias clínicas del hospital, en un formato previamente protocolizado.
Resultados y conclusiones: Similar a lo informado por otros estudios, se encontró asociación entre hipocomplementemia y compromiso renal, y mayor alteración de las pruebas de función renal como creatinina, nitrógeno ureico en sangre, depuración de creatinina y proteinuria en 24 h. La frecuencia de anticuerpos anti-ADN de doble cadena fue del 79,1% y estos se encontraron asociados con compromiso renal y puntuaciones más altas de «Systemic Lupus Erythematosus Disease Activity Index». Se observó también asociación entre anticuerpos anti-Sm con serositis y lupus discoide.
Palabras clave: Nefritis lúpica, Autoanticuerpos, Serositis, Complemento C3, Complemento C4, Anticuerpos antinucleares.
Abstract
Introduction: Systemic lupus erythematosus is an autoimmune disease. The etiology is unknown, and it primarily affects women of reproductive age. Among the most common manifestations are the renal and immune system involvement; the first one is responsible for the majority of the morbidity and mortality of patients, and the second strongly associated with multiple clinical manifestations.
Objective: To analyze the prevalence and characteristics of the main clinical and immunological manifestations of 115 patients diagnosed with systemic lupus erythematosus in the Hospital Universitario San Vicente Fundación, and to determine the association between autoantibodies and organ involvement.
Materials and methods: Patients were seen by the Rheumatology Group, University of Antioquia, between 2008 and 2012. Clinical and immunological data were collected from the files or electronic medical records using a previously designed format.
Results and conclusions: The study found an association between hypocomplementemia and renal involvement, similar to other studies. Nephritis was found in patients with active lupus, as well as a greater impairment of renal function tests such as, creatinine, blood urea nitrogen, creatinine clearance, and proteinuria. The percentage of patients with antidsDNA was 79.1%, and these antibodies were associated with renal involvement, as well as higher Systemic Lupus Erythematosus Disease Activity Index scores; anti-Sm antibodies was associated with serositis and discoid lupus.
Keywords: Lupus nephritis, Autoantibodies, Serositis, Complement C3, Complement C4, Antinuclear antibodies.
Introducción
El lupus eritematoso sistémico (LES) es una enfermedad auto-inmune crónica, multisistémica, de causa desconocida, con gran heterogeneidad clínica y pronóstico variable; suele afectar a mujeres en edad reproductiva, con una relación de 9 mujeres por cada hombre afectado. Es más frecuente y grave en individuos afrodescendientes, mestizos latinoamericanos y asiáticos, comparados con caucásicos1,2.
La nefritis lúpica (NL) es una causa importante de morbimortalidad, puede estar presente hasta en un 65% de los pacientes3 y es más frecuente y grave en hispanos, afrodescendientes y asiáticos4. Según los resultados obtenidos por la cohorte del Grupo Latinoamericano de Estudio del Lupus (GLADEL), la prevalencia de esta manifestación clínica fue significativamente más alta en mestizos (53,3%) y afrodescendientes (50,7%) que en caucásicos (36,7%)5. En la cohorte de LUpus in MInorities: NAture versus nurture (LUMINA), la afectación renal fue más frecuente y tuvo tendencia a ocurrir más temprano en el curso de la enfermedad en pacientes afrodescendientes (58,3%) e hispanos de Texas (55,1%) que en hispanos de Puerto Rico (28,4%) y caucásicos (17,1%)4.
Existen múltiples hallazgos clínicos en los pacientes con NL, de los cuales, la proteinuria es el más frecuente, pudiéndose encontrar casi en 100% de los afectados; dicha proteinuria, progresa a síndrome nefrótico en 30% a 65% de los pacientes. Otros hallazgos clínicos frecuentes en pacientes con NL son: la hematuria microscópica, la hipertensión arterial, los cilindros urinarios, entre otros3,6,7.
Los autoanticuerpos representan una de las características más importantes del LES y pueden proporcionar datos acerca de los mecanismos de daño en varios de los órganos afectados en esta enfermedad; por esto, en los últimos años, se ha prestado gran atención acerca de la relación existente entre los diferentes autoanticuerpos y las múltiples manifestaciones8–12.
La prevalencia de los anticuerpos anti-ADN de doble cadena en pacientes con LES varía entre 60-83%; títulos altos se asocian no solo con actividad clínica de la enfermedad y nefritis, sino también con compromiso del sistema nervioso central y vasculitis y, menos frecuentemente, con trastornos hematológicos, como anemia y leucopenia13–16.
La gran heterogeneidad clínica y las asociaciones de manifestaciones con los diferentes anticuerpos hacen pensar que el LES puede ser dividido en diferentes subgrupos con gran importancia en la patogénesis, terapia y pronóstico de la enfermedad. Sin embargo, la caracterización de los múltiples patrones de LES es compleja, principalmente cuando se analizan pequeños grupos de pacientes con alta heterogeneidad étnica.
El objetivo de este estudio fue analizar la prevalencia y características de las principales manifestaciones clínicas e inmunológicas en 115 pacientes con diagnóstico de LES, del Hospital Universitario San Vicente Fundación, así como determinar la afectación de órganos/sistemas y su relación con el tipo de anticuerpo específico presente.
Metodología
Selección de pacientes
Se realizó un estudio de corte transversal, en el cual se seleccionaron al azar 115 pacientes con diagnóstico de LES, admitidos en los servicios de hospitalización o consulta externa del Hospital Universitario San Vicente Fundación, entre 2008 y 2012; esta institución corresponde a un cuarto nivel de complejidad, que atiende población cotizante, beneficiaria y subsidiada del área urbana y rural del departamento de Antioquia (en su mayoría Medellín) y, en menor proporción, poblaciones del departamento de Chocó y departamentos limítrofes de la costa Caribe como Sucre y Córdoba. Todos los pacientes cumplían con los criterios diagnósticos del Colegio Americano de Reumatología17,18. Los datos se recolectaron del archivo o sistema electrónico de historias clínicas del hospital, en un formato previamente protocolizado en el Grupo de Inmunología Celular e Inmunogenética (GICIG) de la Universidad de Antioquia. Las principales características del formato incluían: 1) datos personales: edad, fecha de diagnóstico, identificación, sexo y grupo étnico. La etnia fue determinada según el origen étnico autorreportado y el lugar de nacimiento de los 4 abuelos según las siguientes reglas, previamente establecidas5,19: caucásicos (individuos con todos sus ancestros europeos), mestizos (individuos nacidos en Colombia que tienen ancestros amerindios y europeos) y afrodescendientes (individuos nacidos en Colombia con al menos un ancestro africano independiente de si otros ancestros son europeos o amerindios). 2) criterios de clasificación del Colegio Americano de Reumatología de 1982 modificados en el 1997 para LES; 3) índice de actividad de la enfermedad (SLEDAI, por sus siglas en inglés Systemic Lupus Erythematosus Disease Activity Index); y 4) estudios de laboratorio.
Estudios de laboratorio
Se evaluaron todos aquellos estudios necesarios para establecer compromiso de órgano, incluyendo los niveles de complemento.
Los diferentes anticuerpos se detectaron mediante las técnicas estandarizadas en el Hospital Universitario San Vicente Fundación.
a) Anticuerpos anti-ADN: fueron detectados mediante la técnica de inmunofluorescencia indirecta usando Crithidia lucillae, con el kit de Orgentec Diagnostika GmbH, Alemania. Se tomaron como valores positivos diluciones ≥ 1:20.
b) Anticuerpos anti-Sm, anti-RNP, anti-Ro y anti-La: fueron detectados por ELISA con el kit de Orgentec Diagnostika GmbH, Alemania. Se tomaron como valores positivos ≥ 20 U/ml.
c) Anticuerpos antinucleares: fueron detectados mediante inmunofluorescencia indirecta usando células Hep-2, con el kit de Orgentec Diagnostika GmbH, Alemania. Se tomaron como valores positivos diluciones ≥ 1:40.
Análisis estadístico
Se utilizaron las pruebas de Chi-cuadrado y exacta de Fisher para analizar las diferencias cualitativas; la significación estadística entre 2 grupos se determinó usando la prueba de Mann-Whitney; se consideraron valores de p < 0,05 como estadísticamente significativos. Los resultados de los análisis de variables continuas se expresaron como media ± error están-dar de la media, y mediana y rango intercuartílico. El análisis estadístico se realizó con el programa Prisma versión 4.
Resultados
Características generales
Se incluyeron 115 pacientes: 103 (89,6%) mujeres y 12 (10,4%) hombres (relación mujer:hombre 8,6:1); la mediana de edad fue 31 años (22-43). La mayoría, 101 (87,8%), se encontraba en el rango de edad entre 16 a 49 años (relación mujer:hombre 9,1:1), solo 3 (2,6%) de los individuos tenían 15 años de edad o menos (relación mujer:hombre, 2:0) y 11 (9,6%) de ellos más de50 años (relación mujer:hombre 4,5:1).
En cuanto a la etnia de los pacientes ingresados en el estudio, 94 (81,7%) eran mestizos, 12 (10,4%) afrodescendientes y 5 (4,4%) caucásicos. En 4 (3,5%) pacientes no se pudo establecer el grupo étnico.
Según el SLEDAI, 34 (29,6%) de los pacientes tenían actividad con SLEDAI < 4; 17 (14,8%) tenían actividad con SLEDAI entre 4 y 7, y 64 (55,6%) tenían actividad con SLEDAI ≥ 8.
La prevalencia de las principales manifestaciones clínicas y de laboratorio, acumuladas desde el inicio de la enfermedad hasta el ingreso al estudio, se resume en la tabla 1. Las principales manifestaciones encontradas en los pacientes fueron: 1) alteraciones inmunológicas en 110 (95,6%); 2) anticuerpos antinucleares en 109 (94,8%); 3) enfermedad hematológica en 82 (71,3%); y 4) enfermedad renal en 79 (68,7%) y artritis en 79 (68,7%).
La frecuencia de los diferentes autoanticuerpos en los pacientes, en algún momento de la enfermedad, fue: 1) anticuerpos anti-ADN en 91 (79,1%); 2) anti-RNP en 45 (39,1%); 3) anti-Sm en 44 (38,3%); 4) anti-Ro en 43 (37,4%); y por último, 5) anticuerpos anti-La en 17 (14,8%).
Caracterización del compromiso renal
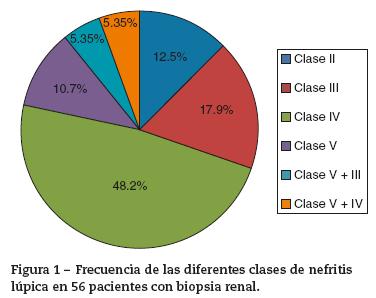
De los 79 (68,7%) pacientes que presentaron NL, solo 56 tenían informe de biopsia renal en la historia clínica. La NL más frecuente fue NL clase iv en 27 (48,2%) pacientes; las frecuencias de los tipos de NL se resumen en la figura 1.
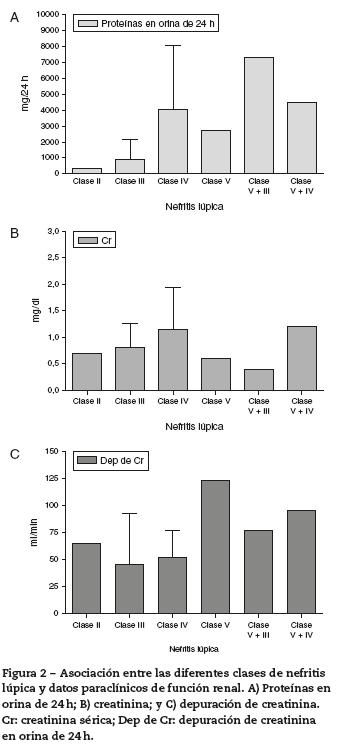
Se realizaron asociaciones entre las clases de NL y diferentes datos paraclínicos de función renal, como: proteínas en orina de 24 h, creatinina sérica y depuración de creatinina; los datos se muestran en la figura 2. Se encontró que la proteinuria en orina de 24 h era mayor en pacientes con NL combinada (clase v+ iii y clase v+ iv) (media: 7,2 g/24 h, desviación están-dar [DE] 8,6 g/24 h y 4,6 g/24 h, DE 1,1 g/24 h, respectivamente) y con NL clase iv(media: 5,6 g/24 h, DE 4,3 g/24 h); los pacientes con NL clase v, clase iii y clase ii tenían proteinuria en orina de 24 h< 3 g/día.
Con respecto a la creatinina sérica, esta se incrementó en los pacientes con NL clase iv (media: 1,4 mg/dl, DE 0,8 mg/dl) y NL combinada clase v + iv (media: 2 mg/dl, DE 1,9 mg/dl); los pacientes con NL clase iii tuvieron valores dentro de los límites normales (media: 0,9 mg/dl, DE 0,3 mg/dl), pero mayores que los de los pacientes con NL clase ii y clase v (media: 0,6 mg/dl, DE 0,1 mg/dl, para ambas).
En todos los pacientes con NL se observó una caída en la depuración de creatinina, exceptuando aquellos con NL clase v, los cuales mostraron valores normales (media: 122,9 ml/min, DE 49 ml/min).
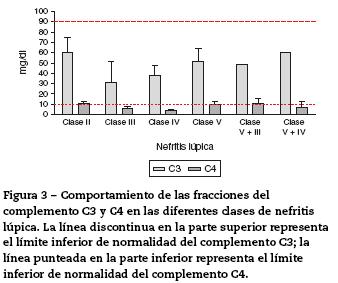
Se analizó el comportamiento de las fracciones C3 y C4 del complemento en las diferentes clases de NL; los datos se muestran en la figura 3. En todos los pacientes con NL se encontró disminución en la fracción del complemento C3, la cual era mayor en aquellos con diagnóstico de NL clase iii (media: 36 mg/dl, DE 17,62 mg/dl), seguidos de los pacientes con NL clase iv (media: 40,5 mg/dl, DE 20,04 mg/dl). La fracción del complemento C4 se encontró disminuida principalmente en pacientes con NL clase iv (media: 4,4 mg/dl, DE 2,45 mg/dl), seguidos de los pacientes con NL clase iii (media: 5,7 mg/dl, DE 4,65 mg/dl); se hallaron valores mayores del complemento C4 en los pacientes con NL clase ii (media: 10,4 mg/dl, DE 4,9 mg/dl) y clase v (media: 9,6 mg/dl, DE 5,9 mg/dl).
Asociación entre autoanticuerpos y manifestaciones de lupus eritematoso sistémico
Índice de actividad de la enfermedad y autoanticuerpos
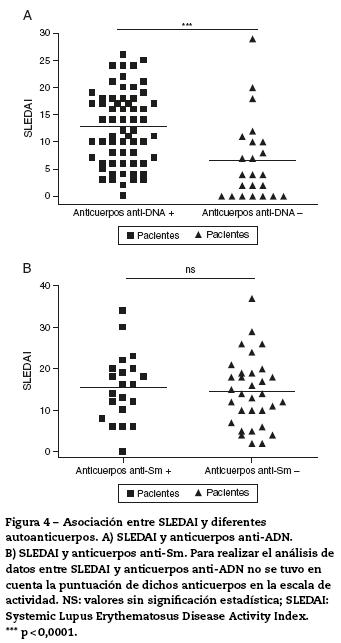
Los datos en la figura 4 muestran la asociación entre SLEDAI y anticuerpos anti-ADN y anticuerpos anti-Sm. Se encontró que los pacientes con anticuerpos anti-ADN positivos presentaban mayor índice de SLEDAI (p < 0,0001); no se encontró asociación entre anticuerpos anti-Sm y SLEDAI. Para realizar el análisis de datos entre SLEDAI y anticuerpos anti-ADN, no se tuvo en cuenta la puntuación de dichos anticuerpos en la escala de actividad.
Anticuerpos anti-ADN
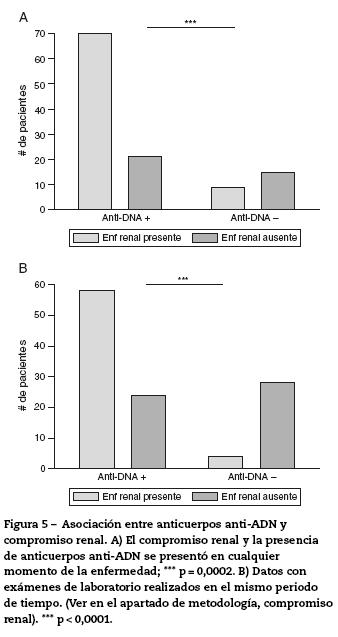
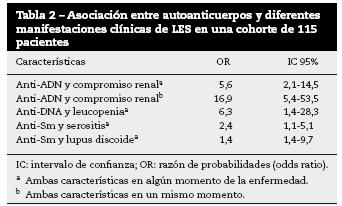
Se analizó la asociación entre los anticuerpos anti-ADN y compromiso renal, en 2 momentos: 1) presencia de ambas en algún momento de la enfermedad; y 2) ambas en un mismo momento. Los resultados se muestran en la figura 5 y en la tabla 2.
De los 91 (79,1%) pacientes con anti-ADN positivo en algún momento de la enfermedad, 70 (76,9%) de ellos tenían compromiso renal. Veinticuatro (20,9%) pacientes no habían tenido anti-ADN positivo durante el transcurso de la enfermedad, de los cuales 9 (37,5%) habían tenido compromiso renal y 15 (62,5%) no. Al analizar estos resultados, se encontró asociación significativa entre las 2 variables estudiadas: anti-ADN y compromiso renal (p = 0,0002).
Aunque la muestra se redujo a 114, el análisis de ambas variables positivas en el mismo momento mostró que 82 (71,9%) pacientes tenían anti-ADN positivo, 58 (70,7%) con compromiso renal concomitante y 24 (29,3%) sin él. De los 32 (28,1%) pacientes con anti-ADN negativo, 4 (12,5%) presentaban compromiso renal concomitante y 28 (87,5%) no tenían dicho compromiso. Lo anterior mostró nuevamente asociación significativa entre anti-ADN y compromiso renal, la cual incluso fue mayor (p < 0,0001).
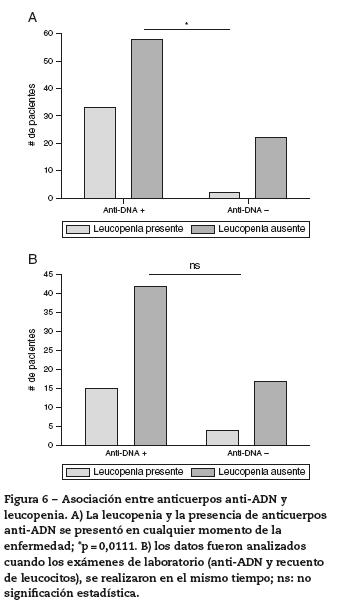
De igual forma, se buscó asociación entre anti-ADN y los diferentes compromisos hematológicos (ver el apartado de metodología); los resultados se muestran en la figura 6. De los 115 pacientes, 35 (30,4%) de ellos habían presentado leucopenia en algún momento de la enfermedad; de estos, 33 (94,3%) habían tenido anti-ADN positivo en algún momento durante el curso de la enfermedad. De los 115 pacientes, 80 (69,6%) no habían presentado leucopenia en el transcurso de la enfermedad, de los cuales 58 (72,5%) habían tenido anti- ADN positivo en algún momento y 22 (27,5%) no. Al analizar los resultados, se encontró asociación entre anticuerpos anti- ADN y leucopenia cuando ambas manifestaciones se habían presentado en algún momento de la enfermedad (p = 0,0111) (tabla 2).
Cuando ambos (leucopenia y anti-ADN) fueron positivos al mismo tiempo, la muestra se redujo a 78 pacientes. Se encontraron 19 (24,4%) pacientes con leucopenia; de estos, 15 (78,9%) tenían anti-ADN positivo concomitantemente y 4 (21,1%) no tenían títulos positivos de dicho anticuerpo. Estos datos no mostraron asociación entre las 2 variables estudiadas (p = 0,5688).
Se buscó asociación entre anti-ADN y otras manifestaciones hematológicas (linfopenia y trombocitopenia) en algún momento de la enfermedad y con ambas variables positivas en el mismo momento (anti-ADN y recuento de linfocitos y plaquetas); sin embargo, no se encontró diferencia estadísticamente significativa en ninguno de los casos (p > 0,05) (datos no mostrados).
Anticuerpos anti-Sm
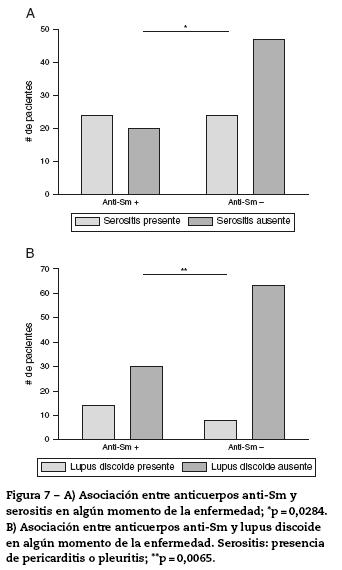
Con respecto a los anticuerpos anti-Sm, de los 115 pacientes, 44 (38,3%) habían presentado títulos positivos en el transcurso de su enfermedad; 24 (54,6%) de estos habían tenido serositis y 20 (45,4%) no habían presentado dicha manifestación. De los 71 (61,7%) pacientes que no habían presentado anti-Sm durante su enfermedad, 24 (33,8%) habían presentado serositis en algún momento. Lo anterior sugiere asociación entre anti-Sm y serositis en algún momento de la enfermedad (p = 0,0284). Los datos se resumen en la figura 7A y en la tabla 2.
Con respecto a las manifestaciones en la piel, 22 (19,1%) pacientes tuvieron lupus discoide; de estos, 14 (63,6%) presentaron anticuerpos anti-Sm positivos en algún momento. (p = 0,0065) (fig. 7B y tabla 2).
Se analizaron otras manifestaciones de la enfermedad con anticuerpos anti-Sm: anti-Sm y compromiso renal (p = 0,4630), anti-Sm y compromiso neurológico (p = 0,1584), anti-Sm y eritema malar (p = 0,1169), y anti-Sm y artritis (p = 0,1184); sin embargo, no se encontró asociación con ninguna de ellas.
Otros anticuerpos
No se halló asociación estadísticamente significativa entre anticuerpos anti-Ro, anti-RNP, anti-La y manifestaciones comoartritis, serositis, fotosensibilidad, eritema malar y lupus discoide.
Discusión
Este estudio analizó la prevalencia y las características de diferentes manifestaciones clínicas e inmunológicas en 115 pacientes con diagnóstico de LES, admitidos en el Hospital Universitario San Vicente Fundación.
La mayoría de los pacientes con diagnóstico de LES eran mestizos (81,7%) y mujeres (89,6%; relación mujer:hombre de 8,6:1), similar a lo reportado en otros estudios5,15,20–24. El 70,4% de los pacientes presentaba actividad de la enfermedad (SLEDAI ≥ 4).
La manifestación clínica más frecuente fue el compromiso hematológico (71,3%), seguido del renal (68,7%) y articular (68,7%) (tabla 1); estos hallazgos clínicos han sido reportados como las manifestaciones más frecuentes en pacientes con LES en otras regiones del mundo5,21–25. Los compromisos renal y hematológico tuvieron una alta prevalencia, apoyando el hecho de que estas manifestaciones suelen ser más frecuentes en mestizos e hispanos5,19,21,22,25,26. Incluso se observó que el compromiso renal de este grupo de pacientes (68,7%) era superior al reportado en hispanos de Texas, de la cohorte LUMINA (62%), en mestizos de la cohorte GLADEL (58,3%) y en una cohorte de pacientes colombianos con LES publicada por Anaya et al. (51%), pero ligeramente menor a la observada en pacientes afrodescendientes de la cohorte de lupus de Hopkins (75%) y similar a lo observado en afrodescendientes de la cohorte LUMINA (68,9%) y en estudios con pacientes asiáticos como el de Tang et al. (73,2%)5,15,19,22,23,27,28.
La frecuencia de los hallazgos inmunológicos también fue similar a reportes previos5,16,19,20,22â24,27,29 (tabla 1). Se encontraron títulos positivos de anticuerpos anti-ADN en el 79,1%; esta frecuencia es mayor que la reportada por Anaya et al. (57%) y superior a lo reportado en caucásicos, afrodescendientes e hispanos o mestizos de las cohortes GLADEL y LUMINA, (67,2 y 21,1%; 40,9 y 69,5%; 44,3 y 76,4% respectivamente)5,19,23,26,27,29,30. De igual forma, el porcentaje de pacientes con anti-ADN positivo también fue ligeramente mayor a lo informado en cohortes asiáticas como la de Tang et al. (79,1 vs. 75,6% respectivamente)15.
Similar a lo reportado por otros autores16,30,31, encontramos asociación significativa entre anticuerpos anti-ADN y puntuaciones más altas en la actividad de la enfermedad medidas por SLEDAI, lo que demuestra la asociación de este anticuerpo con enfermedad más grave32. Por otro lado, varios estudios han encontrado asociación entre actividad de la enfermedad y anticuerpos anti-Sm; incluso se ha descrito que estos anticuerpos aumentan el riesgo de muerte en pacientes con LES16,33; sin embargo, en este grupo de pacientes no se encontró asociación significativa entre puntuaciones altas de SLEDAI y anticuerpos anti-Sm (fig. 4).
Solo el 30% de los pacientes (23 de 79) con compromiso renal no tenía biopsia renal. Las diferentes clases de NL en este grupo de enfermos tienen una distribución similar a la reportada en la literatura3,7,34,35, siendo la NL clase iv la más frecuente (48,2%). Al igual que en otros estudios30,34,laproteinuria en orina de 24 h era mayor en la nefritis proliferativa difusa (clase iv) y en la nefritis combinada (clase v+ iiiy v+ iv); la depuración de creatinina se encontró más frecuentemente alterada en pacientes con nefritis proliferativa (clase iii o iv), mientras que la creatinina sérica mostró valores anormales principalmente en pacientes con NL clase iv34 (fig. 2). Adicionalmente, encontramos que los pacientes con NL activa –clase iiiy iv– tenían mayor disminución en los valores de C3 y C4 en comparación con el resto de los pacientes (fig. 3).
Al igual que lo informado por otros autores15,20,24,30,31,36,la asociación entre anticuerpos anti-ADN y compromiso renal fue estadísticamente significativa cuando las 2 variables estudiadas se habían presentado en cualquier momento de la enfermedad; dicha asociación aumentó si los exámenes se realizaron en el mismo periodo (fig. 5). Estos hallazgos demuestran la fuerte asociación e implicación de los anticuerpos anti-ADN en el compromiso renal15,20,24,30,31,36. Igualmente, se buscó relación entre anticuerpos anti-ADN y alteraciones hematológicas como se ha descrito en la literatura15,25,30; sin embargo, solo se encontró asociación estadísticamente significativa entre anticuerpos anti-ADN y leucopenia en algún momento de la enfermedad.
Con respecto a los anticuerpos anti-Sm y diferentes manifestaciones clínicas de LES, se observó asociación significativa con serositis (pleuritis o pericarditis). Apoyando este hallazgo, Ching et al.37 describieron previamente asociación significativa entre anticuerpos anti-Sm y serositis cuando se expresaban concomitantemente con anticuerpos anti-RNP; similar a lo anterior, Sánchez-Guerrero et al.38 reportaron que la manifestación más común en pacientes con LES y anti-ENA positivos fue pleuritis, mientras que Tang et al.15 encontraron asociación entre anticuerpos anti-Sm y pericarditis. Otro hallazgo encontrado fue la asociación de anticuerpos anti-Sm y lupus discoide, la cual fue descrita previamente por Tang et al.15.
No se encontraron otras asociaciones descritas con anticuerpos anti-Sm y compromiso renal, neurológico o articular24,33,39. No hubo asociación entre anticuerpos anti-RNP y diferentes manifestaciones de LES como artritis, serositis, fotosensibilidad, eritema malar y lupus discoide, contrario a lo descrito en otros estudios15,24.
Cuando se analizaron manifestaciones clínicas como artritis, eritema malar, eritema discoide, serositis y fotosensibilidad con anticuerpos anti-Ro y anti-La, no se halló una asociación estadísticamente significativa, como se ha reportado en estudios previos23–25.
Los diferentes subgrupos de pacientes descritos en este estudio con asociación de características clínicas e inmunológicas pueden ayudar a reforzar la aseveración del comportamiento heterogéneo de esta entidad. Se identificaron grupos de pacientes con características inmunológicas y su asociación clínica, lo que podría permitir un manejo y seguimiento más adecuado de este grupo de pacientes.
Las posibles diferencias en las características clínicas e inmunológicas de nuestro grupo de pacientes con respecto a otras pueden ser el resultado de alteraciones genéticas, como las descritas previamente en poblaciones colombianas, dentro de las cuales se encuentran polimorfismos en genes de citocinas (TNFα-308A/TGFα 1 codón 25C) y polimorfismos en genes que codifican moléculas responsables de la presentación antigénica, como TAP240–43. Sin embargo, no se debe olvidar que los pacientes del presente estudio corresponden a una institución de cuarto nivel de complejidad, por lo que es posible que en los hallazgos mencionados influya un sesgo de referencia de nuestro hospital; de igual forma, al realizarse una recolección retrospectiva de los datos, se pudo haber omitido información clínica de los pacientes. Algunos estudios en poblaciones colombianas han mostrado asociaciones entre manifestaciones cutáneas e hipocomplementemia44; dichos hallazgos no se buscaron en nuestro grupo de pacientes ya que al relacionar las variables hipocomplementemia y compromiso en piel la muestra se redujo considerablemente.
Por otro lado, el propósito de nuestra investigación no planteaba analizar cómo el daño crónico influía en la calidad de vida de los pacientes, ya que en el formato previo de recolección de datos no contábamos con esta información; sin embargo, se debe recalcar que estudios previos en cohortes colombianas de pacientes con LES han asociado el daño crónico con deterioro en la calidad de vida45.
Este estudio no está exento de limitaciones: en primer lugar, dado que es un estudio retrospectivo, no está disponible la información de todas las variables para muchos pacientes. Los análisis se hacen con los datos de los que disponemos en cada caso, y algunos datos clínicos e inmunológicos pudieron haberse perdido. En segundo lugar, es posible que existieran sesgos en la inclusión de pacientes y en consecuencia en la información sociodemográfica y clínica, ya que la entrada de los pacientes al estudio no fue protocolizada y la muestra fue recogida a conveniencia. Los análisis no fueron preespecificados de acuerdo con objetivos o hipótesis concretas y reducidas; en vez de eso se hizo una búsqueda amplia de posibles asociaciones, lo que hace probable que el azar pudiera explicar algunas de las asociaciones observadas. Además, el diseo de corte transversal solo permite encontrar asociaciones, sin poder establecer temporalidad, riesgos, ni causalidad. En tercer lugar, debido a que en los registros evaluados no se incluyeron el estrato socioeconómico, ni el nivel educativo, no se pudo establecer la asociación de estas variables con las manifestaciones graves de la enfermedad y grado de actividad medido por el SLEDAI. Finalmente, como el Hospital Universitario San Vicente Fundación es un centro de referencia de cuarto nivel, la población descrita corresponde a una muestra de pacientes seleccionada de un centro de alta complejidad, principalmente de estratos socioeconómicos bajos y medios; al no tener presente esta variable no podremos extrapolar estos resultados a pacientes con mejor nivel socioeconómico.
Conclusiones
El presente estudio mostró cómo las características epidemiológicas y clínicas de un grupo de pacientes con LES del Hospital Universitario San Vicente Fundación son similares a las descritas en diferentes estudios. Igualmente se encontró que la distribución de las clases de NL semeja lo reportado en diferentes cohortes, y el comportamiento de estas respecto a las manifestaciones renales y el consumo del complemento (C3 y C4) es muy similar a lo descrito en la literatura.
En nuestro grupo de pacientes se evidenciaron títulos positivos de anticuerpos anti-ADN en un porcentaje más alto a lo reportado previamente en otros estudios con diferentes grupos étnicos, de igual forma dichos anticuerpos se asociaron fuertemente a NL. Adicionalmente, se encontró asociación estadísticamente significativa entre anticuerpos anti-Sm y manifestaciones clínicas como serositis y lupus discoide.
Este grupo de pacientes presenta un alto compromiso renal con alta frecuencia de formas clínicas graves clase iii y iv, sus frecuencias difieren de lo descrito en caucásicos y simulan lo descrito en grupos de mestizos, afrodescendientes y asiáticos. Especulando, esto podría ser el resultado de un componente genético el cual predispone a desarrollar cierto tipo de manifestaciones, como el compromiso renal y, por ende, causar mayor morbimortalidad, o también podría deberse a un sesgo de selección de la población, ya que el Hospital Universitario San Vicente Fundación es una institución de cuarto nivel de complejidad.
Responsabilidades éticas
Protección de personas y animales. Los autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datos. Los autores declaran que han seguido los protocolos de su centro de trabajo sobre la publicación de datos de pacientes.
Derecho a la privacidad y consentimiento informado. Los autores han obtenido el consentimiento informado de los pacientes y/o sujetos referidos en el artículo. Este documento obra en poder del autor de correspondencia.
Financiación
Este trabajo fue financiado con recursos propios del Grupo de Inmunología Celular e Inmunogenética (GICIG), el programa Joven Investigador de la Universidad de Antioquia y el Programa Sostenibilidad 2013-2014 de la Universidad de Antioquia.
Conflicto de intereses
Los autores declaran no tener conflicto de intereses.
Agradecimientos
Los autores desean expresar su agradecimiento a Yurika Paola López Alarcón y Carolina Ortiz Vélez, quienes comenzaron la recolección de datos clínicos de los pacientes a través de la Clínica de Lupus; al GICIG, al Hospital Universitario San Vicente Fundación y a los pacientes, quienes permitieron el desarrollo de esta investigación.
Bibliografía
1. González LA, Toloza SM, Alarcón GS. Impact of race and ethnicity in the course and outcome of systemic lupus erythematosus. Rheum Dis Clin North Am. 2014;40:433-54. [ Links ]
2. D'Cruz DP, Khamashta MA, Hughes GR. Systemic lupus erythematosus. Lancet. 2007;369:587-96. [ Links ]
3. González Naranjo LA, Vásquez Duque GM, Uribe Uribe O, Ramírez Gómez LA. Nefropatía lúpica. Presentación clínica, clasificación y tratamiento. Rev Colomb Reumatol. 2006;13:307-33. [ Links ]
4. González LA, Toloza SM, McGwin G Jr, Alarcón GS. Ethnicity in systemic lupus erythematosus (SLE): Its influence on susceptibility and outcomes. Lupus. 2013;22:1214-24. [ Links ]
5. Pons-Estel BA, Catoggio LJ, Cardiel MH, Soriano ER, Gentiletti S, Villa AR, et al. The GLADEL multinational Latin American prospective inception cohort of 1214 patients with systemic lupus erythematosus: Ethnic and disease heterogeneity among "Hispanics". Medicine. 2004;83:1-17. [ Links ]
6. Hahn BH, McMahon MA, Wilkinson A, Wallace WD, Daikh DI, Fitzgerald JD, et al. American College of Rheumatology guidelines for screening, treatment, and management of lupus nephritis. Arthritis Care Res (Hoboken). 2012;64:797-808. [ Links ]
7. Drenkard C, Pons-Estel BA. Manifestaciones clínicas y de laboratorio del lupus eritematoso sistémico. En: Molina J, Molina JF, Gonzalez LA, Vasquez G, editores. Fundamentos de Medicina: Reumatología. 7.ad. Medellín: Corporación para Investigaciones Biológicas; 2012. p. 573-95. [ Links ]
8. Watts R. Autoantibodies in the autoimmune rheumatic diseases. Medicine. 2006;34:441-4. [ Links ]
9. Kavanaugh A, Tomar R, Reveille J, Solomon DH, Homburger HA. Guidelines for clinical use of the antinuclear test and tests for specific autoantibodies to nuclear antigens. American College of Pathologists. Arch Pathol Lab Med. 2000;124:71-81. [ Links ]
10. Molina-Restrepo JF. El laboratorio en las enfermedades reumáticas. Medicina & Laboratorio. 2007;13:11-33. [ Links ]
11. Molina J, Vásquez Duque GM. Autoanticuerpos. En: Molina J, Molina JF, Gonzalez LA, Vasquez G, editores. Fundamentos de Medicina: Reumatología. 7.a ed. Medellín: Corporación para Investigaciones Biológicas; 2012. p. 187-96. [ Links ]
12. Bossuyt X, Hendrick A, Frans J. Antinuclear antibody titer and antibodies to extractable nuclear antigens. Arthritis Rheum. 2005;53:987-8. [ Links ]
13. Hahn BH. Antibodies to DNA. N Engl J Med. 1998;338:1359-68. [ Links ]
14. Isenberg DA, Manson JJ, Ehrenstein MR, Rahman A. Fifty years of anti-ds DNA antibodies: Are we approaching journey's end? Rheumatology (Oxford). 2007;46:1052-6. [ Links ]
15. Tang X, Huang Y, Deng W, Tang L, Weng W, Zhang X. Clinical and serologic correlations and autoantibody clusters in systemic lupus erythematosus: A retrospective review of 917 patients in South China. Medicine (Baltimore). 2010;89:62-7. [ Links ]
16. Sherer Y, Gorstein A, Fritzler MJ, Shoenfeld Y. Autoantibody explosion in systemic lupus erythematosus: More than 100 different antibodies found in SLE patients. Semin Arthritis Rheum. 2004;34:501-37. [ Links ]
17. Tan EM, Cohen AS, Fries JF, Masi AT, McShane DJ, Rothfield NF, et al. The 1982 revised criteria for the classification of systemic lupus erythematosus. Arthritis Rheum. 1982;25:1271-7. [ Links ]
18. Hochberg MC. Updating the American College of Rheumatology revised criteria for the classification of systemic lupus erythematosus. Arthritis Rheum. 1997;40:1725. [ Links ]
19. Alarcón GS, Friedman AW, Straaton KV, Moulds JM, Lisse J, Bastian HM, et al. Systemic lupus erythematosus in three ethnic groups: III. A comparison of characteristics early in the natural history of the LUMINA cohort. LUpus in Minority populations: NAture vs Nurture. Lupus. 1999;8:197-209. [ Links ]
20. Font J, Cervera R, Ramos-Casals M, García-Carrasco M, Sents J, Herrero C, et al. Clusters of clinical and immunologic features in systemic lupus erythematosus: Analysis of 600 patients from a single center. Arthritis Rheum. 2004;33:217-30. [ Links ]
21. Toloza SM, Roseman JM, Alarcón GS, McGwin G Jr, Uribe AG, Fessler BJ, et al. Systemic lupus erythematosus in a multiethnic US cohort (LUMINA): XXII. Predictors of time to the occurrence of initial damage. Arthritis Rheum. 2004;50:3177-86. [ Links ]
22. Alarcón GS, McGwin G Jr, Petri M, Reveille JD, Ramsey-Goldman R, Kimberly RP. Baseline characteristics of a multiethnic lupus cohort: PROFILE. Lupus. 2002;11: 95-101. [ Links ]
23. Moss KE, Ioannou Y, Sultan SM, Haq I, Isenberg DA. Outcome of a cohort of 300 patients with systemic lupus erythematosus attending a dedicated clinic for over two decades. Ann Rheum Dis. 2002;61:409-13. [ Links ]
24. Lu R, Robertson JM, Bruner BF, Guthridge JM, Neas BR, Nath SK, et al. Multiple autoantibodies display association with lymphopenia, proteinuria, and cellular casts in a large, ethnically diverse SLE patient cohort. Autoimmune Dis. 2012;2012:819634. [ Links ]
25. Vilá LM, Alarcón GS, McGwin G Jr, Bastian HM, Fessler BJ, Reveille JD. Systemic lupus erythematosus in a multiethnic US cohort. XXXVII: Association of lymphopenia with clinical manifestations, serologic abnormalities, disease activity, and damage accrual. Arthritis Rheum. 2006;55: 799-806. [ Links ]
26. Bastian HM, Roseman JM, McGwin G Jr, Alarcón GS, Friedman AW, Fessler BJ, et al., LUMINA Study Group. LUpus in MInority populations: NAture vs nurture. Systemic lupus erythematosus in three ethnic groups. XII. Risk factors for lupus nephritis after diagnosis. Lupus. 2002;11:152-60. [ Links ]
27. Anaya JM, Cañas C, Mantilla RD, Pineda-Tamayo R, Tobón GJ, Herrera-Díaz C, et al. Lupus nephritis in Colombians: Contrasts and comparisons with other populations. Clin Rev Allergy Immunol. 2011;40:199-207. [ Links ]
28. Petri M. Hopkins Lupus Cohort. 1999 update. Rheum Dis Clin North Am. 2000;26:199-213. [ Links ]
29. Pradhan VD, Badakere SS, Bichile LS, Dolas MP. Antibodies to Ro/SS-A and La/SS-B in systemic lupus erythematosus and other autoimmune disorders. J Assoc Physicians India. 2002;50:762-5. [ Links ]
30. Julkunen H, Ekblom-Kullberg S, Miettinen A. Nonrenal and renal activity of systemic lupus erythematosus: a comparison of two anti-C1q and five anti-dsDNA assays and complement C3 and C4. Rheumatol Int. 2012;32:2445-51. [ Links ]
31. Gilliam BE, Ombrello AK, Burlingame RW, Pepmueller PH, Moore TL. Measurement of autoantibodies in pediatric-onset systemic lupus erythematosus and their relationship with disease-associated manifestations. Semin Arthritis Rheum. 2012;41:840-8. [ Links ]
32. Ter Borg EJ, Horst G, Hummel EJ, Limburg PC, Kallenberg CG. Measurement of increases in anti-double-stranded DNA antibody levels as a predictor of disease exacerbation in systemic lupus erythematosus. A long-term, prospective study. Arthritis Rheum. 1990;33:634-43. [ Links ]
33. Hitchon CA, Peschken CA. Sm antibodies increase risk of death in systemic lupus erythematosus. Lupus. 2007;16:186-94. [ Links ]
34. Austin HA. Clinical evaluation and monitoring of lupus kidney disease. Lupus. 1998;7:618-21. [ Links ]
35. Senior JM, Pinto LF, Uribe O, de la Cruz OF, Ramírez LA. Nefropatía lúpica: correlación clínico-patológica y respuesta al tratamiento con pulsos de ciclofosfamida. Rev Colomb Reumatol. 1994;1:19-27. [ Links ]
36. Harley JB, Sestak AL, Willis LG, Fu SM, Hansen JA, Reichlin M. A model for disease heterogeneity in systemic lupus erythematosus. Relationships between histocompatibility antigens, autoantibodies, and lymphopenia or renal disease. Arthritis Rheum. 1989;32:826-36. [ Links ]
37. Ching KH, Burbelo PD, Tipton C, Wei C, Petri M, Sanz I, et al. Two major autoantibody clusters in systemic lupus erythematosus. PLoS One. 2012;7:e32001. [ Links ]
38. Sánchez-Guerrero J, Lew RA, Fossel AH, Schur PH. Utility of anti-Sm, anti-RNP, anti-Ro/SS-A, and anti-La/SS-B (extractable nuclear antigens) detected by enzyme-linked immunosorbent assay for the diagnosis of systemic lupus erythematosus. Arthritis Rheum. 1996;39:1055-61. [ Links ]
39. Munves EF, Schur PH. Antibodies to Sm and RNP. Prognosticators of disease involvement. Arthritis Rheum. 1983;26:848-53. [ Links ]
40. Guarnizo-Zuccardi P, López Y, Giraldo M, García N, Rodríguez L, Ramírez L, et al. Cytokine gene polymorphisms in Colombian patients with systemic lupus erythematosus. Tissue Antigens. 2007;70:376-82. [ Links ]
41. Correa PA1, Molina JF, Pinto LF, Arcos-Burgos M, Herrera M, Anaya JM. TAP1 and TAP2 polymorphisms analysis in northwestern Colombian patients with systemic lupus erythematosus. Ann Rheum Dis. 2003;62:363-5. [ Links ]
42. Bastian HM, Alarcón GS, Roseman JM, McGwin G Jr, Vilá LM, Fessler BJ, et al., LUMINA Study Group. Systemic lupus erythematosus in a multiethnic US cohort (LUMINA) XL II: factors predictive of new or worsening proteinuria. Rheumatology (Oxford). 2007;46:683-9. [ Links ]
43. Caster DJ, Korte EA, Nanda SK, McLeish KR, Oliver RK, G'sell RT, et al. ABIN1 dysfunction as a genetic basis for lupus nephritis. J Am Soc Nephrol. 2013;24:1743-54. [ Links ]
44. Velásquez Franco CJ, Anaya Prada A, Rodríguez Padilla LM, Vargas Grajales FI, Ramírez Gómez LA. Manifestaciones cutáneas de lupus eritematoso sistémico temprano y correlación con la actividad sistémica. Iatreia. 2011;24:359-64. [ Links ]
45. Medina JE, Mora C, Jaimes DA, Arbeláez AM, Valencia Toro PA, Salazar RE, et al. Valoración de la actividad, del daño crónico y alteración de la calidad de vida en una cohorte de pacientes colombianos con lupus eritematoso sistémico por medio de SELENA-SLEDAI, BILAG 2004, SLICC/ACR y SF-36. Rev Colomb Reumatol. 2013;20:211-7. [ Links ]