Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Acessos
Acessos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares em
SciELO
Similares em
SciELO -
 Similares em Google
Similares em Google
Compartilhar
Revista Colombiana de Reumatología
versão impressa ISSN 0121-8123
Rev.Colomb.Reumatol. vol.21 no.4 Bogotá out./dez. 2014
https://doi.org/10.1016/j.rcreu.2014.09.001
http://dx.doi.org/10.1016/j.rcreu.2014.09.001
Informe de caso
Lupus eritematoso sistémico activo, síndrome de activación macrofágica y sepsis
Active systemic lupus erythematosus, macrophage activation syndrome and sepsis
María Florencia Fernándeza, Paula Zottera, Lucía Poggioa, Ignacio Javier Gandinoa, María José Padillaa, Carina Victoria Santa Cruzb, Valeria Alejandra Sánchezb, Antonio Saccob y Sebastián Andrés Muñoza,*
a Servicio de Clínica Médica, Hospital General de Agudos Juan A. Fernández, Ciudad Autónoma de Buenos Aires, Argentina
b Servicio de Anatomía Patológica, Hospital General de Agudos Juan A. Fernández, Ciudad Autónoma de Buenos Aires, Argentina
* Autor para correspondencia. Correo electrónico: sebastianamunoz@gmail.com (S.A. Muñoz).
Historia del artículo: Recibido el 23 de abril de 2014 Aceptado el 23 de septiembre de 2014 On-line el 6 de noviembre de 2014
Resumen
El síndrome de activación macrofágica (SAM) es una entidad poco frecuente y grave, caracterizada por una excesiva activación y proliferación de macrófagos y linfocitos T. Los factores desencadenantes son las infecciones, drogas, enfermedades malignas y autoinmunes. El lupus eritematoso sistémico frecuentemente se asocia al SAM. En la práctica clínica, el diagnóstico diferencial entre lupus eritematoso sistémico activo, SAM e infección es un gran desafío para el médico internista. Esto se debe a que los signos, síntomas y datos de laboratorio de estas entidades se superponen. El propósito de nuestro trabajo es el reportar los casos de 2 pacientes con lupus eritematoso sistémico activo, SAM y sepsis.
Palabras clave: Síndrome de activación macrofágica, Lupus eritematoso sistémico, Enfermedades autoinmunes, Infección.
Abstract
Macrophage activation syndrome (MAS) is a rare and severe entity characterized by excessive activation and proliferation of macrophages and T-lymphocytes. The usual triggers are infections, drugs, malignancy and autoimmune diseases. Systemic lupus erythematosus is frequently associated with MAS. In clinical practice, differential diagnosis between active systemic lupus erythematosus, MAS and an infection is a great challenge for the internist. This happens because signs, symptoms and laboratory data from these illnesses overlap to a large degree. The purpose of this paper is to present a report on two patients with active systemic lupus erythematosus, MAS, and sepsis.
Keywords: Macrophage activation syndrome, Systemic lupus erythematosus, Autoimmune disease, Infection.
Introducción
La linfohistiocitosis hemofagocítica (LHH) es un síndrome debido a la activación patológica del sistema inmune, que se caracteriza clínicamente por signos y síntomas de inflamación extrema1. Actualmente, este síndrome es dividido en: LHH genético con sus 2 subgrupos, familiar y asociado a síndromes de inmunodeficiencias primarias, y LHH adquirido. El adquirido se asocia frecuentemente a infecciones, neoplasias y enfermedades autoinmunes (EAI). Cuando se presenta en el contexto de una EAI suele denominarse síndrome de activación macrofágica (SAM), siendo la artritis reumatoide juvenil, la enfermedad de Still del adulto y el lupus eritematoso sistémico (LES) las enfermedades asociadas con mayor frecuencia2.
Las características clínicas comunes del LHH son la presencia de fiebre, hepatoesplenomegalia, citopenias, alteraciones de las enzimas hepáticas, hipertrigliceridemia, coagulopatía con hipofibrinogenemia e hiperferritinemia3. Los hallazgos anatomopatológicos que lo definen son la presencia de histiocitos activados, fagocitando eritrocitos, leucocitos, plaquetas y sus precursores en la médula ósea y en otros órganos del sistema reticuloendotelial2.
El LES es una EAI que puede afectar cualquier órgano o sistema, clínicamente evoluciona con brotes y remisiones, y serológicamente se caracteriza por la presencia de anticuerpos antinucleares (ANA)4. Actualmente, se reconoce al LES como la EAI sistémica que más frecuentemente se asocia al SAM; se estima que su prevalencia es del 0,9-2,4% de los pacientes con LES5–8.
En el contexto del LES, el SAM puede estar asociado a una infección activa. Esta última puede ser consecuencia del tratamiento inmunosupresor o de la inmunodisregulación del LES9. Este escenario, LES, SAM e infección, representa para el médico internista un gran desafío diagnóstico y terapéutico.
El propósito de nuestro trabajo es describir las características clínicas, de laboratorio y el tratamiento de 2 pacientes con diagnóstico de LES activo, SAM y sepsis.
Caso clínico 1
Paciente de sexo femenino, de 35 años de edad, que ingresó a nuestro hospital por poliartritis asimétrica y aditiva de pequeñas y grandes articulaciones, fiebre, astenia, adinamia y pérdida de peso. A su ingreso estaba lúcida, febril y estable hemodinámicamente. Presentaba ictericia, hepatomegalia y pápulas eritematovioláceas en rostro y en miembros inferiores.
Los datos de laboratorio mostraron (tabla 1): anemia, plaquetopenia, linfopenia, insuficiencia renal, microhematuria dismórfica, proteinuria en rango nefrítico, hipertransaminasemia, hiperbilirrubinemia, hipertrigliceridemia, hipofibrinogenemia e hiperferritinemia.
La ecografía abdominal evidenció hepatomegalia heterogénea y leve ascitis. Los hemocultivos fueron positivos para Gemella haemolysans (G. haemolysans) y el cultivo de las lesiones cutáneas para Staphylococcus aureus (S. aureus) meticilino sensible. Se instauró tratamiento antibiótico apropiado.
Las pruebas para VIH 1-2, virus de hepatitisByC, Epstein-Barr y citomegalovirus resultaron negativas.
La paciente evolucionó desfavorablemente y ante la positividad de los ANA (Hep2 1/5.000, patrón homogéneo), los antígenos nucleares extraíbles (anti-ADN, anti-Sm, antiribosomal P y anti-histonas) e hipocomplementemia, se comenzó tratamiento con metilprednisolona intravenosa (iv). Por falta de respuesta y la sospecha de SAM asociada a LES, se agregó gammaglobulina humana hiperinmune (2 g/kg de peso) y ciclofosfamida iv. Posteriormente la paciente fue mejorando lentamente hasta su egreso.
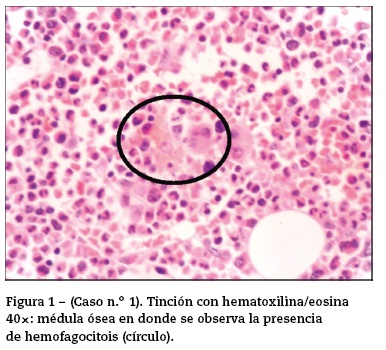
La anatomía patológica de la biopsia de médula ósea confirmó la presencia de hemofagocitosis (fig. 1) y la del riñón nefritis tubulointersticial aguda. La interpretación diagnóstica final fue sepsis, LES activo y SAM.
Caso clínico 2
Paciente de sexo masculino de 24 años de edad que ingresó por fiebre, dolor abdominal, náuseas, vómitos biliosos y diarrea acuosa de 4 días de evolución. Tenía antecedentes de LES, en tratamiento con meprednisona 40 mg e hidroxicloroquina 200 mg/día.
A su ingreso estaba lúcido, febril, estable hemodinámicamente; presentaba leucoplasia oral, derrame pleural bilateral, dolor a la palpación en epigastrio y esplenomegalia.
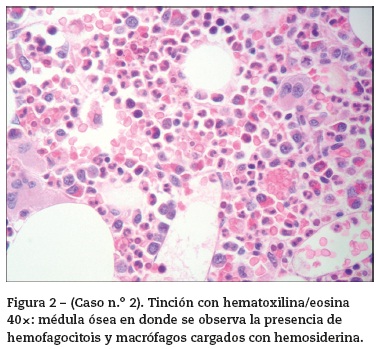
El laboratorio (tabla 1) mostró plaquetopenia, linfopenia, hipertransaminasemia e hiperamilasemia. La radiografía de tórax evidenció derrame pleural bilateral y la pleurocentesis un exudado no complicado. Se interpretó como LES activo, pancreatitis aguda y probable neumonía. Comenzó tratamiento con antibióticos y continuó con metilprednisolona. Evolucionó desfavorablemente con fiebre y deterioro del estado general en forma progresiva. Estudios posteriores mostraron hipertrigliceridemia, hipofibrinogenemia y hiperferritininemia. Sedimento de orina con microhematuria dismórfica y proteinuria en rango nefrítico. Serologías para VIH 1-2, virus hepatitis A,ByC, Epstein Barr y VDRL negativos, IgG citomegalovirus positiva. Los anticuerpos antinucleares (ANA Hep-2), los anticuerpos anti-ADN doble cadena, anti-RNP y anti-Sm resultaron positivos. Las fracciones C3 y C4 del complemento fueron bajas. La ecografía de abdomen mostró el hígado de tamaño conservado con ecoestructura heterogénea difusa, esplenomegalia y adenopatías retroperitoneales. Se realizó biopsia de hígado y médula ósea. En el aspirado de esta última se evidenció hemofagocitosis (fig. 2). Con el diagnóstico de SAM, se realizaron 3 pulsos de 1 g de metilprednisolona y por inadecuada respuesta clínica se agregó gammaglobulina iv y ciclofosfamida (1.000 mg).
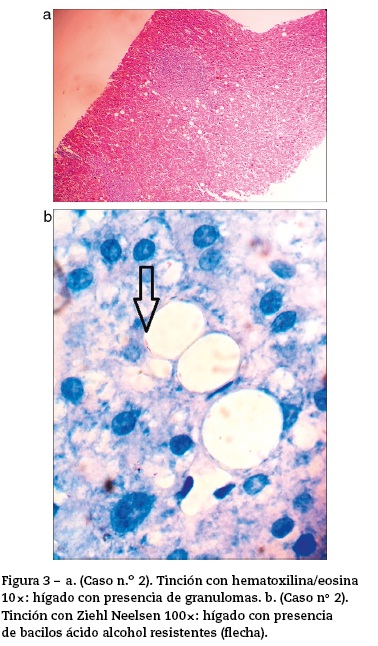
El paciente evolucionó con deterioro del sensorio, nistagmo espontáneo, temblor de intención y posteriormente con estatus convulsivo que requirió intubación orotraqueal. La resonancia magnética nuclear de encéfalo no mostró hallazgos significativos. El líquido cefalorraquídeo evidenció pleocitosis mononuclear, hiperproteinorraquia e hipoglucorraquia, con examen directo y cultivos para bacterias y hongos negativos. Se instauró tratamiento empírico para tuberculosis. Paulatinamente comenzó con recuperación del cuadro clínico; se recibió PCR en liquido cefalorraquídeo y en el material de la biopsia de hígado positiva para Mycobacterium tuberculosis (M. tuberculosis) (fig. 3 a-b). Sin embargo, persistía con hipoxemia por lo cual se realizó angiotomografía de pulmón que confirmó embolismo pulmonar. Inició anticoagulación y posteriormente fue egresado.
Discusión
Hemos descrito 2 pacientes con LES activo, SAM y sepsis. El motivo de esta presentación es destacar la rareza de la asociación clínica de las 3 entidades en un mismo paciente y que las mismas comparten signos, síntomas y datos de laboratorio que hacen muy difícil su diagnóstico y tratamiento oportuno.
En los 2 casos el diagnóstico y el estado de actividad del LES no ofrecieron mayores inconvenientes. Sin embargo, ciertos datos de laboratorio como el aumento de las enzimas hepáticas, hipertrigliceridemia, LDH aumentada, hipofibrinogenemia y los valores excesivamente aumentados de ferritina excedían lo esperado para un LES activo. Estos hallazgos junto a la hepatoesplenomegalia y la falta de respuesta inicial al tratamiento nos llevaron a pensar en otros diagnósticos diferenciales, entre ellos el SAM. En ambos pacientes el diagnóstico se confirmó con la presencia de hemofagocitosis en la médula ósea.
La superposición de características clínicas y de laboratorio propias del LES y SAM llevó a diferentes autores a cuestionar la utilidad de los criterios diagnósticos de LHH modificados en el 2004 para ser utilizados en los casos de SAM secundarios a LES10; por esta razón, Parodi et al.11 propusieron criterios diagnósticos preliminares para el SAM secundario a LES juvenil (tabla 2), y más recientemente Ravelli et al.12, también sugirieron modificaciones a los criterios tradicionales para LHH. Estos autores propusieron como criterios sugestivos de SAM la presencia de niveles elevados de proteína C reactiva, citopenias moderadas, reducción de la eritropoyesis, aumento de la granulopoyesis con desviación a la izquierda y altos niveles de interleucina 1b, en ausencia de artritis clínica. Sin embargo, estos criterios no han sido validados para su uso clínico diario en pacientes adultos con LES y SAM.
Es frecuente que el LES activo se presente con fiebre y compromiso hematológico variable. Habitualmente están afectadas una o 2 líneas celulares hematopoyéticas, siendo poco común el compromiso de las 3 series13. Teniendo en cuenta esto, la presencia de fiebre con bi-o tricitopenia y más aún si son persistentes o severas, debería motivar la búsqueda de otras entidades asociadas como infecciones o SAM, entre otros. En estos casos el aspirado con biopsia de médula ósea puede contribuir a esclarecer el diagnóstico.
El compromiso hepático en el LES, aunque frecuente, es explicado usualmente por otra causa (infecciosa, tóxicamedicamentosa, autoinmune, isquémica, etc.). Cuando la causa es el propio LES activo, la elevación de las enzimas hepáticas es leve y correlaciona con la actividad de la enfermedad14. En los 2 pacientes los valores de transaminasas fueron muy elevados, y este hallazgo nos condujo a pensar en otra causa más allá del LES. En el paciente 1 la hipertransaminasemia fue interpretada como parte de SAM, mientras que en el paciente 2 la anatomía patológica del hígado mostró granulomas con presencia de M. tuberculosis, sin hemofagocitosis. En el SAM la hiperbilirrubinemia con hipertransaminasemia y valores elevados de LDH reflejan la disfunción hepática15.
El fibrinógeno, la ferritina y los componentes del complemento son proteínas de fase aguda cuyas concentraciones séricas aumentan en estados inflamatorios agudos. En el LES activo tanto el fibrinógeno como la ferritina suelen aumentar, sin embargo la última no lo hace como en el SAM cuyas concentraciones suelen ser realmente muy elevadas. Sin embargo, en el LES los componentes del complemento frecuentemente están disminuidos indicando actividad de la enfermedad, mientras que esto no parece ocurrir en el SAM. En las infecciones el fibrinógeno, la ferritina y los factores del complemento suelen estar aumentados, a menos que coexista un estado de coagulación intravascular diseminada donde las concentraciones de fibrinógeno disminuyen. Recientemente Rosário et al. propusieron el término «síndromes hiperferritinémicos», dentro del cual incluyeron 4 entidades clínicas (SAM, enfermedad de Still del adulto, síndrome antifosfolipídico catastrófico y shock séptico) que se caracterizan por presentar concentraciones séricas de ferritina muy elevadas y características clínicas y de laboratorio similares. Lo interesante es la hipótesis que propone a la ferritina como una proteína inmunomoduladora que tendría un rol importante en la generación de la «tormenta de citocinas» que se observa en estos procesos y no solo un producto final de la inflamación16. Es decir, la ferritina parecería no ser solo un mero espectador en el SAM, y los valores extremadamente elevados de esta proteína en suero limitarían los diagnósticos diferenciales a unas pocas entidades nosológicas.
El paciente 2 ingresó con el diagnóstico, entre otros, de pancreatitis aguda. Esta puede ser una complicación rara del LES, estimada en un 8% de los pacientes con LES y dolor abdominal17. Los corticoides han sido considerados como causa de pancreatitis aguda18. Por otro lado, la amilasa puede estar elevada en pacientes asintomáticos con LES y corresponder a una macroamilasemia19. Finalmente, la pancreatitis aguda podría ser una manifestación más dentro del SAM secundario a LES20.
Los 2 pacientes tuvieron infecciones concomitantemente al LES activo y al SAM. En el paciente 1 se obtuvo de los cultivos de sangre G. haemolysans y del cultivo de las lesiones de la piel se aisló S. aureus. En el paciente 2 el diagnóstico de infección por M. tuberculosis se realizó por la presencia de la misma en el examen directo de la biopsia de hígado y por la positividad en líquido cefalorraquídeo. Sin lugar a dudas, las infecciones son uno de los desencadenantes más frecuentes del SAM. La lista de microorganismos implicados es muy grande; el S. aureus es una de las bacterias reconocida como gatillo del SAM21, al igual que M. tuberculosis de la cual existen múltiples reportes22. G. haemolysans es una bacteria grampositiva anaerobia facultativa que se encuentra como comensal habitual de la mucosa oral y vías respiratorias superiores23; se la ha implicado en varias infecciones como meningitis, abscesos cerebrales, endoftalmitis, neumonía, etc., pero hasta el momento no hay descripciones en la literatura que involucren a esta bacteria como posible desencadenante del SAM24–26.
Los 2 pacientes recibieron tratamiento antibiótico acorde a los hallazgos microbiológicos e inmunosupresores. Este último consistió en metilprednisolona iv (3 pulsos de 1.000 mg cada uno), ciclofosfamida iv y gammaglobulina humana hiperinmune (2 mg/kg). Si bien no existe un tratamiento estándar para el SAM secundario a LES (o para todas las EAI) se recomienda el tratamiento inmunosupresor agresivo para la EAI con el agregado de gammaglobulina1. Dentro de los inmunosupresores, la ciclofosfamida y la ciclosporina fueron los más utilizados7,8. En pacientes que se encuentran cursando una infección aguda, el uso de inmunosupresores muchas veces debe posponerse algunos días. En estos casos la gammaglobulina es una opción interesante como inmunomodulador en el LES activo y adyuvante del proceso infeccioso27.
El pronóstico en el LHH sin tratamiento es muy pobre28. En el SAM el pronóstico es variable dependiendo en parte de la enfermedad de base, sin embargo la mortalidad global del SAM secundario excede el 50%2.
Conclusiones
El SAM secundario a LES es un síndrome clínico poco frecuente y potencialmente mortal si no se diagnostica y se trata oportunamente. A diferencia del LHH, no existen aún criterios diagnósticos validados, sin embargo su presencia debería considerarse en todo paciente con LES, organomegalias, pancitopenia, compromiso de múltiples órganos y valores plasmáticos elevados de ferritina y triglicéridos. El tratamiento del SAM secundario a LES consiste en el uso de inmunosupresores, siendo los esteroides y la ciclofosfamida los fármacos de elección. Las infecciones deberían considerarse como posibles gatillos del SAM y tratarse previamente al inicio del tratamiento inmunosupresor.
Responsabilidades éticas
Protección de personas y animales. Los autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datos. Los autores declaran que han seguido los protocolos de su centro de trabajo sobre la publicación de datos de pacientes.
Derecho a la privacidad y consentimiento informado. Los autores han obtenido el consentimiento informado de los pacientes y/o sujetos referidos en el artículo. Este documento obra en poder del autor de correspondencia.
Conflicto de intereses
Los autores declaran no tener ningún conflicto de intereses.
Bibliografía
1. Jordan MB, Allen CE, Weitzman S, Filipovich AH, Mc Clain KL. How I treat hemophagocytic lymphohistiocytosis. Blood. 2011;118:4041-52. [ Links ]
2. Rosado FGN, Kim AS. Hemophagocytic lymphohistiocytosis. An update on diagnosis and pathogenesis. Am J Clin Phatol. 2013;139:713-27. [ Links ]
3. Filipovich AH. Hemophagocytic lymphohistiocytosis and other hemophagocytic disorders. Immunol Allergy Clin North Am. 2008;28:293-313. [ Links ]
4. Lahita RG. Sex and age in systemic lupus erythematosus. En: Lahita RG, editor. Systemic lupus erythematosus. 1.a ed. New York: Wiley and Sons; 1986. p. 523-39. [ Links ]
5. Wong KF, Hui PK, Chan JK, Chan YW, Ha SY. The acute lupus hemophagocytic syndrome. Ann Intern Med. 1991;114:387-90. [ Links ]
6. Morales-Polanco M, Jiménez-Balderas FJ, Yañez P. Storage histiocytes and hemophagocytosis: A common finding in the bone marrow of patients with active systemic lupus erythematosus. Arch Med Res. 1996;27:57-62. [ Links ]
7. Fukaya S, Yasuda S, Hashimoto T, Oku K, Kataoka H, Horita T, et al. Clinical features of haemophagocytic syndrome in patients with systemic autoimmune diseases: analysis of 30 cases. Rheumatology (Oxford). 2008;47:1686-91. [ Links ]
8. Lambotte O, Khellaf M, Harmouche H, Bader-Meunier B, Manceron V, Goujard C, et al. Characteristics and long-term outcome of 15 episodes of systemic lupus erythematosus-associated hemophagocytic syndrome. Medicine (Baltimore). 2006;85:169-82. [ Links ]
9. Kumakura S, Ishikura M, Kondo M, Murakawa Y, Masuda J, Kobayashi S. Autoimmune-associated hemophagocytic syndrome. Mod Rheumatol. 2004;14:205-15. [ Links ]
10. Henter JI, Horne A, Aricó M, Egeler RM, Filipovich AH, Imashuku S, et al. HLH-2004: Diagnostic and therapeutic guidelines for hemophagocytic lymphohistiocytosis. Pediatr Blood Cancer. 2007;48:124-31. [ Links ]
11. Parodi A, Davì S, Pringe AB, Pistorio A, Ruperto N, Magni-Manzoni S, et al., Lupus Working Group of the Paediatric Rheumatology European Society. Macrophage activation syndrome in juvenile systemic lupus erythematosus: A multinational multicenter study of thirty-eight patients. Arthritis Rheum. 2009;60:3388-99. [ Links ]
12. Ravelli A, Grom AA, Behrens EM, Cron RQ, et al. Macrophage activation syndrome as part of systemic juvenile idiopathic arthritis: Diagnosis, genetics, pathophysiology and treatment. Genes Immun. 2012;13:289-98. [ Links ]
13. Monrad SU, Kaplan MJ. Cellular hematology. En: Lahita RG, editor. Systemic lupus erythematosus. 5.a ed London UK: Elsevier Inc; 2011. p. 905-20. [ Links ]
14. Piga M, Vacca A, Porru G, Cauli A, Mathieu A. Liver involvement in systemic lupus erythematosus: Incidence, clinical course and outcome of lupus hepatitis. Clin Exp Rheumatol. 2010;28:504-10. [ Links ]
15. Janka GE. Familial and acquired hemophagocytic lymphohistiocytosis. Annu Rev Med. 2012;63:233-46. [ Links ]
16. Rosário C, Zandman-Goddard G, Meyron-Holtz EG, D'Cruz DP, Shoenfeld Y. The hyperferritinemic syndrome: Macrophage activation syndrome, Still's disease, septic shock and catastrophic antiphospholipid syndrome. BMC Med. 2013;11:185-96. [ Links ]
17. Reynolds JC, Inman RD, Kimberly RP, Chuong JH, Kovacs IE, Walsh MB. Acute pancreatitis in systemic lupus erythematosus: Report of twenty cases and review of the literature. Medicine. 1982;61:25-32. [ Links ]
18. Ebert EC, Hagspiel KD. Gastrointestinal and hepatic manifestations of systemic lupus erythematosus. J Clin Gastroenterol. 2011;45:436-41. [ Links ]
19. Hasselbacher P, Myers AR, Passero AR. Serum amylase and macroamylase in patients with systemic lupus erythematosus. Br J Rheumatol. 1988;27:198-201. [ Links ]
20. Omori CH, Lotito AP, Jesus AA, Porta G, Silva CA. Acute pancreatitis in juvenile systemic lupus erythematosus: A manifestation of macrophage activation syndrome? Lupus. 2010;19:1654-8. [ Links ]
21. Ito S, Takada N, Ozasa A, Hanada M, Sugiyama M, Suzuki K, et al. Secondary hemophagocytic syndrome in a patient with methicillin-sensitive Staphylococcus aureus bacteremia due to severe decubitus ulcer. Intern Med. 2006;45:303-7. [ Links ]
22. Brastianos PK, Swanson JW, Torbenson M, Sperati J, Karakousis PC. Tuberculosis-associated haemophagocytic syndrome. Lancet Infect Dis. 2006;6:447-54. [ Links ]
23. La Scola B, Raoult D. Molecular identification of Gemella species from three patients with endocarditis. J Clin Microbiol. 1998;36:866-71. [ Links ]
24. Anil M, Ozkalay N, Helvaci M, Agus N, Guler O, Dikerler A, et al. Meningitis due to Gemella haemolysans in a pediatric case. J Clin Microbiol. 2007;45:2337-9. [ Links ]
25. Lee MR, Lee SO, Kim SY, Yang SM, Seo YH, Cho YK. Brain abscess due to Gemella haemolysans. J Clin Microbiol. 2004;42:2338-40. [ Links ]
26. Raman SV, Evans N, Freegard TJ, Cunningham R. Gemella haemolysans acute postoperative endophthalmitis. Br J Ophthalmol. 2003;87:1192-3. [ Links ]
27. Gelfand EW. Intravenous immune globulin in autoimmune and inflammatory diseases. N Engl J Med. 2012;367:2015-25. [ Links ]
28. Henter JI, Samuelsson-Horne A, Aricò M, Egeler RM, Elinder RM, Filipovich AH, et al. Treatment of hemophagocytic lymphohistiocytosis with HLH-94 immunochemotherapy and bone marrow transplantation. Blood. 2002;100: 2367-73. [ Links ]