Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista Colombiana de Reumatología
Print version ISSN 0121-8123
Rev.Colomb.Reumatol. vol.22 no.1 Bogotá Jan./June 2015
https://doi.org/10.1016/j.rcreu.2015.02.004
Informe de caso
http://dx.doi.org/10.1016/j.rcreu.2015.02.004
Síndrome de Guillain Barré asociado a enfermedad de Graves: rol de la plasmaféresis en la patología tiroidea autoinmune
Guillain Barré syndrome associated with Graves disease: the role of plasmapheresis in autoimmune thyroid disease
Guillermo E. Guzmán G.a,*, Fernando Lizcanob y Marcela Peralta F.c
a Endocrinología, Fundación Clínica Valle del Lili, Cali, Colombia
b Endocrinología, Fundación Cardioinfantil, Bogotá, Colombia
c Universidad de La Sabana, Bogotá, Colombia
* Autor para correspondencia. Correo electrónico: guillermoeguzmangomez@hotmail.com (G.E. Guzmán G.).
Historia del artículo: Recibido el 3 de abril de 2014 Aceptado el 10 de febrero de 2015 On-line el 16 de marzo de 2015
Resumen
Mujer de 36 años que ingresa en el servicio de urgencias por paresia en miembros inferiores, asociada a diarrea y dolor abdominal en los 10 días previos. Al examen neurológico se encuentra fuerza proximal 4/5 y distal 3/5 en todos los grupos musculares, con hiporreflexia en miembro inferior izquierdo. La electromiografía reporta neuropatía motora desmielinizante, de predominio en miembros inferiores, confirmando la sospecha diagnóstica de Guillain Barré. Durante la hospitalización la paciente presenta niveles suprimidos de TSH, T4 libre elevada con un incremento de la captación tiroidea con Tc-99 m pertecnetato, diagnosticando una enfermedad de Graves asociada. Ambas enfermedades son causadas por autoinmunidad, por lo que la plasmaferésis se usó, siendo buena la respuesta en el control de los síntomas neurológicos por Guillain Barré . Pero sin ningún control bioquímico tiroideo, cuestionando el rol de la plasmaféresis en el tratamiento de la enfermedad tiroidea autoinmune.
Palabras clave: Plasmaféresis, Tiroides, Hipertiroidismo, Síndrome de Guillain-Barré.
Abstract
A 36 year old woman was seen in the emergency service due to paresis in the lower limbs, ;combined with diarrhea and abdominal pain in the previous ten days. The neurological examination showed proximal strength 4/5 and distal strength 3/5 in all the muscular groups, with hyporeflexia in the lower left limb. The electromyography showed demyelinating motor neuropathy with predominance in the lower limbs, confirming Guillain-Barre. During admission, the patient had low TSH levels, high free T4 levels, and elevated Tc-99 m pertechnetate thyroid uptake, leading to the diagnosis of Graves' disease. Both diseases are caused by autoimmunity. This is the second case reported in the literature demonstrating this. Plasmapheresis was helpful in neurological symptoms but not in the thyroid disease, questioning the role of plasmapheresis in the treatment of autoimmune thyroid disease. Both diseases are caused by autoimmunity; therefore plasmapheresis was an option in Guillain-Barré, but not in Graves' disease.
Keywords: Plasmapheresis, Thyroid, Hyperthyroidism, Guillain-Barre Syndrome.
Introducción
La plasmaféresis es un procedimiento extracorpóreo cuyo objetivo es remover elementos específicos del plasma como los autoanticuerpos patógenos. Esta ha sido utilizada como herramienta terapéutica en patologías autoinmunes como el síndrome de Guillain Barré 1. El sistema endocrino no es ajeno al compromiso por autoanticuerpos, siendo la enfermedad tiroidea la más frecuente de este tipo2. No obstante, el compromiso puede ser de 2 o más glándulas, incluso asociado con patologías extraglandulares autoinmunes, lo que se conoce como un síndrome poliglandular autoinmune.
En el caso que se presenta a continuación, se trata de una mujer de 36 años con Guillain Barré y enfermedad de Graves, en el que evaluamos los posibles efectos de la plasmaféresis en la patología tiroidea autoinmune3.
Resumen de caso
Paciente femenina de 36 años previamente sana, que ingresa en el servicio de urgencias por cuadro de taquicardia, paresia en miembros inferiores, sin síntomas deglutorios ni dificultad respiratoria. Al examen neurológico se encuentra paresia dada por fuerza proximal 4/5 y distal 3/5 en todos los grupos musculares, tono, trofismo normal, reflejos miotendinosos en miembro inferior izquierdo +/ + + + +, respuesta plantar neutra bilateral, sensibilidad superficial normal, disminución de sensibilidad vibratoria y batiestésica en miembros inferiores, aumento del polígono de sustentación a la marcha, incapacidad para marchar en talones o puntas de pie. La electromiografía muestra prolongación de la latencia distal motora del nervio tibial posterior bilateral, con disminución de la amplitud; disminución de la amplitud del potencial de acción motor del nervio peronero bilateral, con dispersión temporal del potencial de acción motor. Resultados concordantes con neuropatía motora desmielinizante, de predominio en miembros inferiores: Guillain Barré Hughes 3, programando 5 sesiones de plasmaféresis.
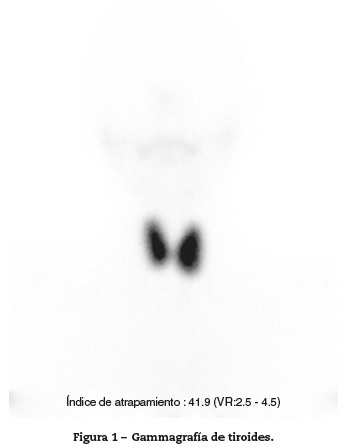
Concomitantemente, se documenta un bocio difuso palpable grado I, sin exoftalmos con niveles de TSH 0,03 mUI/L (VR 0,4-4,5), T4 libre 2,15ng/dl (VR 0,8-1,4), T3 total 3,06ng/dl (VR 0,6-1,8), anticuerpos antitiroglobulínicos 10 Ul/ml (negativos), antiperoxidasa 10,9 UI/ml (negativos), ecografía de tiroides con vascularización aumentada y gammagrafía de tiroides con Tc-99 m pertecnetato, que muestra captación intensa y difusa, todo compatible con enfermedad de Graves (fig. 1).
Se deja en observación para evaluar respuesta a la plasmaféresis; iniciando solo propranolol para control de respuesta ventricular por taquicardia. Se descartó otro compromiso endocrino como hiperparatiroidismo primario (Ca ionizado: 1,2mmol/L, VR 1,1-1,4), insuficiencia suprarrenal (cortisol basal 8 am: 12 mcg/dl), diabetes insí pida (Na:136 mEq/L, VR 135-145, densidad urinaria calculada 600 mosmo/L), diabetes mellitus (glucemia en ayuno 90mg/dl, Hba1c 5,7%) e hipogonadismo (función gonadal normal dada regularidad menstrual). Aunque no se realizó la medición de anticuerpos específicos para cada órgano endocrino. Posterior a la quinta sesión de plasmaféresis se evidencia recuperación paulatina de la fuerza en miembros inferiores pero elevación persistente de las pruebas de función tiroidea con T4 libre de 4,98 ng/dl, determinando no respuesta bioquímica, por lo que se decide inicio de metimazol, evaluando a los 5 días función tiroidea, demostrando mejoría en los niveles de T4 libre y también de la taquicardia.
En conclusión, se trata del segundo caso de la literatura que asocie un Guillain Barré a enfermedad de Graves, mostrando este caso fallo terapéutico a la plasmaféresis3.
Discusión
El Guillain Barré es un síndrome que abarca una serie de trastornos tipo neuropatía periférica y se caracteriza por una pará lisis aguda arrefléctica con disociación albúmino-citológica. La clínica en general se caracteriza por entumecimiento, parestesias, debilidad, dolor simétrico o alguna combinación de ellos. La debilidad progresa en un periodo de 12 horas a 28 días, asociado con hiporreflexia o arreflexia. En algunos casos, se puede encontrar asociación con síntomas respiratorios o diarrea, que se presenta de 3 días a 6 semanas anteriores al inicio de los síntomas.
La fisiopatología del Guillain Barré se relaciona con una causa autoinmune4. Los hallazgos patológicos en la polineuropatía inflamatoria aguda incluyen infiltrados inflamatorios, con presencia de linfocitos T y macró fagos, y á reas de desmielinización segmental. Existe activación del complemento, por unión de anticuerpos a las células de Schwann, generando la vesiculación de la mielina; una semana posterior a la activación del complemento se presenta la invasión de macró fagos. Los autoanticuerpos de inmunoglobulina G, los gangliósidos GM1 y GD1 están asociados con neuropatía axonal motora aguda y neuropatía motora por bloqueo de conducción, pero no con la polineuropatía desmielinizante inflamatoria aguda. En las opciones terapéuticas están inmunoglobulina o plas-maféresis que a la luz de la evidencia actual no demuestra diferencias estadísticamente significativas en la recuperación de la enfermedad5,6.
La enfermedad de Graves también es un proceso autoinmune, pero en este caso, autoanticuerpos se unen al receptor de TSH (RTSH) y activan la función tiroidea llevando a hiper-tiroidismo. La mayoría de los pacientes tienen anticuerpos contra el RTSH y antiperoxidasa tiroidea, y cerca del 50% de los pacientes tienen anticuerpos contra tiroglobulina, que fueron estos últimos negativos para nuestra paciente.
La producción de los autoanticuerpos es dependiente de linfocitos T, sobre todo CD4+, con una efectiva presentación antigénica dependiente del antígeno de histocompatibilidad humano tipo II (HLA tipo II)7. Hallazgos histológicos soportan la acción de linfocitos T, es el caso de la oftalmopatía por enfermedad de Graves, con el infiltrado difuso y focal mononuclear que se produce en los músculos extraoculares y glándulas lacrimales, consistente en linfocitos T predominantemente CD4+, CD8+, en menor proporción linfocitos B y macró fagos8.
En este caso clínico se demuestra la presencia concomitante de 2 trastornos autoinmunes raramente asociados, siendo el segundo caso descrito en la literatura. Conocemos las limitantes del reporte de nuestro caso como la dificultad de contar con anticuerpos antigangliósidos para síndrome de Guillain Barré y anticuerpos anti-RTSH específicos de enfermedad de Graves, pero dada la poca utilidad práctica y disponibilidad en nuestro medio no se hicieron9"12. A pesar de ello, se trata del segundo caso descrito en la literatura que asocia Guillain Barré a enfermedad de Graves, sin poder clasificarlo como síndrome poliglandular autoinmune, ya que es necesario tener 2 o más glándulas comprometidas para el diagnóstico3.
En los síndromes poliglandulares, una de las hipó tesis radica en las células presentadoras de antígeno que desencadenan una respuesta dependiente de linfocitos Thl y Th2. Otra de las teorías corresponde a mimetismo genético, dado por modelos animales en los que el reconocimiento viral lleva a reacción cruzada con antígenos del huésped, iniciando la autoinmunidad13. Se ha clasificado tradicionalmente en tipo I», con la presencia de por lo menos 2 características de la tríada consistente en hipoparatiroidismo (80-85%), insuficiencia suprarrenal (70-75%) y candidiasis mucocutánea (90-100%)14;y tipo II» por la presencia de insuficiencia suprarrenal primaria y diabetes mellitus tipo I3,7,15. No obstante, el espectro de la enfermedad endocrina autoinmune se ha ido ampliando desde su descripción inicial, encontrando, actualmente, nuevas asociaciones, inclusive no solo con órganos endocrinos. De ahí se deriva el síndrome poliglandular autoinmune tipo III, que constituye una afección autoinmune tiroidea en combinación con otro trastorno autoinmune y que, a su vez, se subdivide en tipo IIIa con diabetes mellitus mediada por autoinmunidad; IIIb con anemia perniciosa; y el IIIc con vitíligo o alopecia u otra alteración orgánica inmunológica específica14.
En nuestro caso hicimos pruebas de funcionalidad que descartaron transitoriamente otro compromiso endocrino como: hiperparatiroidismo primario, diabetes mellitus, diabetes insípida e hipogonadismo. No cumpliendo así criterios estrictos de un síndrome poliglandular tipo III, en este caso no clasificado. Sin embargo, no realizamos anticuerpos específicos contra acido glutámico descarboxilasa (GAD 65), islote pancreático, insulina, NALP5 (parathyroid-specific NACHT leucine-rich-repeat protein 5), CaSR (receptor sensible de calcio), hipófisis, hipotálamo u ovario, por lo que una falla poliglandular en el futuro no puede ser descartada y aún más en el contexto autoinmune de esta paciente, pudié ndose tratar de la presentación inicial de un síndrome poliglandular16"22. Esto último cobra valor, sobre todo, considerando la asociación de halotipos del antígeno de histocompatibilidad humano (HLA) con síndromes poliglandulares tipo II o III. Ya que, por ejemplo, los halotipos HLA DRB1*0405-DQA1*0303-DQB1*0401 y DRB1*0802-DQA1*0301-DQB1*0302 están asociados con diabetes y enfermedad de Graves concomitante, lo que obligará en el futuro a la tipificación del halotipo HLA para identificar el riesgo, por ejemplo, de desarrollar diabetes y, por ende, a un seguimiento estricto de glucemia23"25.
La plasmaféresis practicada, es un procedimiento terapéutico en el que a partir de la sangre extraída se separa en elementos plasmáticos y celulares, removiendo del plasma componentes específicos, muchos de ellos implicados en procesos patológicos. Esta estrategia ha sido utilizada en una gran variedad de patologías, principalmente, autoinmunes por su capacidad de disminuir rápidamente las concentraciones de anticuerpos y complejos autoinmunes; siendo hasta el momento un tratamiento efectivo para el Guillain Barré y dado el sustrato autoinmune de muchas enfermedades tiroideas se ha venido utilizando en estas últimas con resultados variados4,26,27. Si bien su mecanismo propuesto en la enfermedad tiroidea autoinmune para la mejoría es la depuración de los anticuerpos anti-RTSH, la confirmación de esta teoría con medición de estos antes y después de la plasmaféresis no se ha reportado. No obstante, las hormonas tiroideas están unidas a proteínas en un número mayor al 99% y basado en que la plasmaféresis remueve las hormonas fijadas a proteínas, diluye las hormonas tiroideas en la solución de reemplazo y se obtiene nueva albúmina por la solución reemplazada, permitiendo nuevos sitios de fijación para la hormona tiroidea, esto logra un efecto neto en la disminución de la T4l transitorio28.
Para enfermedad de Graves la experiencia es pobre, siendo una alternativa para restaurar el estado eutiroideo o inclusive en tratamiento de la orbitopatía tiroidea29. La mayoría de los casos descritos en la literatura corresponde a pacientes con alguna contraindicación para uso de antitiroideos orales, utilizando la plasmaféresis como terapia puente a la cirugía, con resultados variados en la reducción de T4l posterior a una o más sesiones11. Se ha usado también en tormenta tiroidea, pero son escasos los reportes de éxito en dicha indicación30-32.
En nuestro caso el mayor soporte patológico fue el Guillain Barré, decidiendo esperar la respuesta de la patología tiroidea a la plasmaféresis, que después de 5 sesiones no fue satisfactoria y que se reflejó en el incremento de los niveles de hormona tiroidea. No se realizó la medición de autoanticuerpos ni de T4l diaria al término de cada sesión, ya que los valores de estos cambian a pocas horas de cada sesión según algunas series, prediciendo una respuesta temprana al tratamiento y en ese orden de ideas definir una terapia alterativa para la patología tiroidea sin esperar al total de las sesiones de plasmaféresis planeadas.
Los criterios de respuesta a plasmaféresis no son del todo claros. No obstante, se han encontrado reducciones hasta en un 89,9% de T4l como en el nivel de anticuerpos, lo cual se ha logrado desde una sesión hasta múltiples, inclusive 17 como es reportado en la literatura. Sin embargo, creemos que basados en el resultado negativo de este caso, probablemente la medición T4l al término de la primera sesión podría predecir respuesta a la terapia, siendo una reducción de al menos 8,4% lo mínimo esperado, según registros de la literatura internacional, para determinar éxito y definir una terapia adicional, sumado, quizás, a la disminución del título de anticuerpos RTSH33,34.
Conclusión
En el caso clínico descrito anteriormente, se describe la presentación concomitante y posible relación entre el síndrome de Guillain Barré y la enfermedad de Graves, que al parecer tienen una fisiopatología de autoinmunidad común. El diagnóstico de ambas enfermedades en la paciente lo convierte en un probable síndrome poliglandular autoinmune tipo III, con mala respuesta de la enfermedad tiroidea a la plasmaféresis. La recomendación de plasmaféresis en patología tiroidea autoinmune es débil, siendo solo una opción cuando se han agotado todas las opciones terapéuticas. Incluso en caso de respuesta no hay consenso que aclare el número de
sesiones necesarias para buscar un nivel de normalidad de función tiroidea. Por ende, a la luz de la evidencia actual, son necesarios estudios prospectivos que aclaren el rol de la plasmaféresis en la patología tiroidea.
Responsabilidades éticas
Protección de personas y animales. Los autores declaran que los procedimientos seguidos se conformaron a las normas éticas del comité de experimentación humana responsable y de acuerdo con la Asociación Médica Mundial y la Declaración de Helsinki.
Confidencialidad de los datos. Los autores declaran que han seguido los protocolos de su centro de trabajo sobre la publicación de datos de pacientes.
Derecho a la privacidad y consentimiento informado. Los autores han obtenido el consentimiento informado de los pacientes y/o sujetos referidos en el artículo. Este documento obra en poder del autor de correspondencia.
Conflicto de intereses
Los autores declaran no tener ningún conflicto de intereses.
Bibliografía
1. Restrepo CA, Márquez E, Sanz MF. Plasmaféresis terapéutica, tipos, técnica e indicaciones en medicina interna. Acta Med Colomb. 2009;34:23-32. [ Links ]
2. Melmed S, Polonosky K, Larden R, Kronenberg H. Williams Textbooks of Endocrinology. 12th ed. Philadelphia: Elsevier; 2012. [ Links ]
3. Lee JH, Ahn KS, Lee SC, Bae JD, Park YB, Keum SM, et al. A case of Graves' disease associated with Guillain-Barre syndrome. J Korean Soc Endocrinol. 1997;12(4):614-20. [ Links ]
4. Yuki N, Hartung HP. Guillain-Barre syndrome. N Engl J Med. 2012;366(24):2294-304, http://dx.doi.org/10.1056/NEJMra1114525. Publicación electrónica 15 Jun 2012. PubMed PMID: 22694000. [ Links ]
5. Hughes RA, Swan AV, van Doorn PA. Intravenous immunoglobulin for Guillain-Barre syndrome. Cochrane Database Syst Rev. 2012;7:Cd002063. Publicación electrónica 13 Jul 2012. DOI: 10.1002/14651858.CD002063.pub5. PubMed PMID: 22786476. [ Links ]
6. Patwa HS, Chaudhry V, Katzberg H, Rae-Grant AD, So YT. Evidence-based guideline: intravenous immunoglobulin in the treatment of neuromuscular disorders: report of the Therapeutics and Technology Assessment Subcommittee of the American Academy of Neurology. Neurology. 2012;78(13):1009-15. Publicación electrónica 29 Mar 2012. DOI: 10.1212/WNL.0b013e31824de293. PubMed PMID: 22454268. [ Links ]
7. Karamifar H, Dalili S, Karamizadeh Z, Amirhakimi G, Dalili H. Autoimmune polyglandular syndrome type 2: an unusual presentation. Acta Med Iran. 2010;48(3):196-7. Publicación electrónica 9 Dic 2010. PubMed PMID: 21137658. [ Links ]
8. Bahn RS. Graves' ophthalmopathy. N Engl J Med. 2010;362(8):726-38. Publicación electrónica 26 Feb 2010. DOI: 10.1056/NEJMra0905750. PubMed PMID: 20181974; PMCID: Pmc3902010. [ Links ]
9. Criteria for diagnosis of Guillain-Barre syndrome. Ann Neurol. 1978;3(6):565-6. Publicación electrónica 1 Jul 1978. DOI: 10.1002/ana.410030628. PubMed PMID: 677829. [ Links ]
10. Hersalis Eldar A, Chapman J. Guillain Barre syndrome and other immune mediated neuropathies: Diagnosis and classification. Autoimmun Rev. 2014;13(4-5):525-30. Publicación electrónica 18 Ene 2014/. DOI: 10.1016/j.autrev.2014.01.033. PubMed PMID: 24434363. [ Links ]
11. Willison HJ, Yuki N. Peripheral neuropathies and anti-glycolipid antibodies. Brain. 2002;125 Pt 12:2591-625. Publicación electrónica 14 Nov 2002. PubMed PMID: 12429589. [ Links ]
12. Ozbey N, Kalayoglu-Besisik S, Gul N, Bozbora A, Sencer E, Molvalilar S. Therapeutic plasmapheresis in patients with severe hyperthyroidism in whom antithyroid drugs are contraindicated. Int J Clin Pract. 2004;58(6):554-8. Publicación electrónica 18 Ago 2004. PubMed PMID: 15311553. [ Links ]
13. Dittmar M, Kahaly GJ. Polyglandular autoimmune syndromes: immunogenetics and long-term follow-up. J Clin Endocrinol Metab. 2003;88(7):2983-92. Publicación electrónica 5 Jul 2003. DOI: 10.1210/jc.2002-021845. PubMed PMID: 12843130. [ Links ]
14. Arya RK, Gupta DK, Chaudhary SC. A rare case of autoimmune polyglandular syndrome type IIIc. Indian J Endocrinol Metab. 2012;16(3):480. Publicación electrónica 26 May 2012. DOI: 10.4103/2230-8210.95741. PubMed PMID: 22629534; PMCID: Pmc3354875. [ Links ]
15. Kahara T, Wakakuri H, Takatsuji J, Motoo I, Shima KR, Ishikura K, et al. Autoimmune polyglandular syndrome type 3 with anorexia. Case Rep Endocrinol. 2012;2012:657156. Publicación electrónica 11 Ene 2013. DOI: 10.1155/2012/657156. PubMed PMID: 23304573; PMCID: Pmc3530857. [ Links ]
16. De Bellis A, Sinisi AA, Pane E, Dello Iacovo A, Bellastella G, di Scala G, et al. Involvement of hypothalamus autoimmunity in patients with autoimmune hypopituitarism: role of antibodies to hypothalamic cells. J Clin Endocrinol Metab. 2012;97(10):3684-90. Publicación electrónica 3 Ago 2012. DOI: 10.1210/jc. 2012-2269. PubMed PMID: 22855340. [ Links ]
17. Alimohammadi M, Bjorklund P, Hallgren A, Pontynen N, Szinnai G, Shikama N, et al. Autoimmune polyendocrine syndrome type 1 and NALP5, a parathyroid autoantigen. N Engl J Med. 2008;358(10):1018-28. Publicación electrónica 7 Mar 2008. DOI: 10.1056/NEJMoa0706487. PubMed PMID: 18322283. [ Links ]
18. Goswami R, Brown EM, Kochupillai N, Gupta N, Rani R, Kifor O, et al. Prevalence of calcium sensing receptor autoantibodies in patients with sporadic idiopathic hypoparathyroidism. Eur J Endocrinol. 2004;150(1):9-18. Publicación electrónica 10 Ene 2004. PubMed PMID: 14713274. [ Links ]
19. Jaeger C, Hatziagelaki E, Petzoldt R, Bretzel RG. Comparative analysis of organ-specific autoantibodies and celiac disease-associated antibodies in type 1 diabetic patients, their first-degree relatives, and healthy control subjects. Diabetes Care. 2001;24(1):27-32. Publicación electrónica 24 Feb 2001. PubMed PMID: 11194235. [ Links ]
20. Bjork E, Velloso LA, Kampe O, Karlsson FA. GAD autoantibodies in IDDM, stiff-man syndrome, and autoimmune polyendocrine syndrome type I recognize different epitopes. Diabetes. 1994;43(1):161-5. Publicación electrónica 1 Ene 1994. PubMed PMID: 7505244. [ Links ]
21. Falorni A, Minarelli V, Bartoloni E, Alunno A, Gerli R. Diagnosis and classification of autoimmune hypophysitis. Autoimmun Rev. 2014;13(4-5):412-6. Publicación electrónica 18 Ene 2014. DOI: 10.1016/j.autrev.2014.01.021. PubMed PMID: 24434361. [ Links ]
22. Silva CA, Yamakami LY, Aikawa NE, Araujo DB, Carvalho JF, Bonfa E. Autoimmune primary ovarian insufficiency. Autoimmun Rev. 2014;13(4-5):427-30. Publicación electrónica 15 Ene 2014. DOI: 10.1016/j.autrev.2014.01.003. PubMed PMID: 24418305. [ Links ]
23. Hashimoto K, Maruyama H, Nishiyama M, Asaba K, Ikeda Y, Takao T, et al. Susceptibility alleles and haplotypes of human leukocyte antigen DRB1 DQA1, and DQB1 in autoimmune polyglandular syndrome type III in Japanese population. Horm Res. 2005;64(5):253-60. Publicación electrónica 29 Oct 2005. DOI: 10.1159/000089293. PubMed PMID: 16254435. [ Links ]
24. Mizokami T, Yamauchi A, Sato Y, Toyonaga M, Imoto H, Kojima H, et al. Simultaneous occurrence of type 1 diabetes mellitus and Graves' disease: a report of two cases and a review of the literature. Intern Med. 2013;52(22):2537-43. Publicación electrónica 19 Nov 2013. PubMed PMID: 24240794. [ Links ]
25. Flesch BK, Matheis N, Alt T, Weinstock C, Bux J, Kahaly GJ. HLA class II haplotypes differentiate between the adult autoimmune polyglandular syndrome types II and III. J Clin Endocrinol Metab. 2014;99(1):E177-82. Publicación electrónica 5 Nov 2013. DOI: 10.1210/jc. 2013-2852. PubMed PMID: 24187405. [ Links ]
26. Enghofer M, Badenhoop K, Zeuzem S, Schmidt-Matthiesen A, Betz C, Encke A, et al. Fulminant hepatitis A in a patient with severe hyperthyroidism: rapid recovery from hepatic coma after plasmapheresis and total thyroidectomy. J Clin Endocrinol Metab. 2000;85(5):1765-9. Publicación electrónica 8 Jun 2000. DOI: 10.1210/jcem.85.5.6491. PubMed PMID: 10843149. [ Links ]
27. De Rosa G, Testa A, Menichella G, Cecchini L, Cavallaro A, Mantovani M, et al. Plasmapheresis in the therapy of hyperthyroidism associated with leukopenia. Haematologica. 1991;76 Suppl 1:72-4. Publicación electrónica 1 Mar 1991. PubMed PMID: 1713877. [ Links ]
28. Robbins J. Werner and Ingbar's the thyroid. A fundamental and clinical text. 8th ed Philadelphia: Lippincott Williams & Wilkins; 2000. [ Links ]
29. Glinoer D, Etienne-Decerf J, Schrooyen M, Sand G, Hoyoux P, Mahieu P, et al. Beneficial effects of intensive plasma exchange followed by immunosuppressive therapy in severe Graves' ophthalmopathy. Acta Endocrinol (Copenh). 1986;111(1):30-8. Publicación electrónica 1 Ene 1986. PubMed PMID: 2868602. [ Links ]
30. Ashkar FS, Katims RB, Smoak WM 3rd, Gilson AJ. Thyroid storm treatment with blood exchange and plasmapheresis. JAMA. 1970;214(7):1275-9. Publicación electrónica 16 Nov 1970. PubMed PMID: 5536311. [ Links ]
31. Carhill A, Gutiérrez A, Lakhia R, Nalini R. Surviving the storm: two cases of thyroid storm successfully treated with plasmapheresis. BMJ Case Rep. 2012;2012. Publicación electrónica 23 Oct 2012. DOI: 10.1136/bcr-2012-006696. PubMed PMID: 23087271. [ Links ]
32. Miljic D, Stojanovic M, Jesic R, Bogadnovic G, Popovic V. Role of plasma exchange in autoimmune hyperthyroidism complicated by severe tiamazol-induced cholestatic jaundice. Transfus Apher Sci. 2013;49(2):354-6. Publicación electrónica 13 Jun 2013. DOI: 10.1016/j.transci.2013.05.007. PubMed PMID: 23756266. [ Links ]
33. Almeida RF, Comarella AP, Silveira MB, Silva AR, Ferri Casini A. [Plasmapheresis before thyroidectomy in a patient with thyrotoxicosis and hepatotoxicity by propylthiouracil: case report]. Arq Bras Endocrinol Metabol. 2013;57(4):322-6. Publicación electrónica 6 Jul 2013. PMID: 23828438. [ Links ]
34. Winters JL. American Society for Apheresis guidelines on the use of apheresis in clinical practice: practical, concise, evidence-based recommendations for the apheresis practitioner. J Clin Apher. 2014;29(4):191-3. Publicación electrónica 4 Jun 2014. DOI: 10.1002/jca.21334. PubMed PMID: 24890667. [ Links ]