Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares en
SciELO
Similares en
SciELO -
 Similares en Google
Similares en Google
Compartir
Revista Colombiana de Reumatología
versión impresa ISSN 0121-8123
Rev.Colomb.Reumatol. vol.22 no.3 Bogotá jul./sep./ 2015
https://doi.org/10.1016/j.rcreu.2015.06.003
http://dx.doi.org/10.1016/j.rcreu.2015.06.003
Informe de caso
Poliangeítis granulomatosa con eosinofilia. Revisión y reporte de caso de una paciente con eosinofilia, mononeuropatía de miembro inferior, rinosinusitis y asma
Eosinophilic granulomatosis with polyangiitis, Review and case report of a patient with eosinophilia, lower limb mononeuropathy, sinusitis and asthma
Alfredo Sánchez Betancourta,* y Milagros González Colea
a Universidad San Judas Tadeo, San José, Costa Rica
* Autor para correspondencia. Correo electrónico: drsanchez@usanjudas.ac.cr (A. Sánchez Betancourt).
Historia del artículo: Recibido el 24 de abril de 2015 Aceptado el 25 de junio de 2015 On-line el 16 de agosto de 2015
Resumen
La poliangeítis granulomatosa con eosinofilia es una enfermedad infrecuente, fuertemente asociada al asma y a la sinusitis. Debido a que las manifestaciones de la enfermedad se generan en diferentes fases, el diagnóstico no siempre se realiza de forma oportuna con serias consecuencias para los pacientes. Esta enfermedad presenta manifestaciones cutáneas, respiratorias, cardiacas, otorrinolaringológicas, neurológicas y renales, entre otras. Presentamos el caso de una paciente femenina de 26 arios de edad, portadora de una rino-sinusitis atópica desde la infancia, vitíligo y asma de inicio reciente, por lo cual consultó en múltiples ocasiones a diferentes servicios de urgencias por broncoespasmos y eosinofilia. Posteriormente desarrolló una neuropatía periférica de la extremidad inferior, que fue valorada en un hospital de la ciudad de San José. Se realizó igualmente una revisión bibliográfica del tema.
Palabras clave: Vasculitis, Granulomatosis eosinofílica, Churg-Strauss, Neuropatía periférica, Vasculitis ANCA positivas, Poliangeítis.
Abstract
Eosinophilic granulomatosis with polyangiitis is a rare disease frequently associated with asthma and sinusitis. This condition poses a challenge for clinicians because it manifests itself in different phases, as there is often a delay in the diagnosis, with serious consequences for the patients. There are a wide variety of clinical manifestations of the disease such as cutaneous, respiratory, cardiac, ENT, neurological, and renal involvement, to name a few. A case report is presented involving a 26 year old female with a history of chronic rhinosi-nusitis, vitiligo, and recent onset asthma who was seen in the emergency department a San José hospital on many occasions with bronchospasm and eosinophilia. She later developed a peripheral neuropathy in her lower extremity. A literature review on the subject is also presented.
Keywords: Vasculitis, Eosinophilic granulomatosis, Churg-Strauss, Peripheral neuropathy, ANCA positive vasculitis, Polyangiitis.
Introducción
La poliangeítis granulomatosa con eosinofilia fue descrita por primera vez por los patólogos Jacob Churg y Lotte Strauss1, pertenecientes al Hospital Mount Sinai de la ciudad de Nueva York, en 1951, posterior a la revisión de 13 casos con presentación similar.
El epónimo «síndrome de Churg-Strauss» fue reemplazado debido a que se creó una sola nomenclatura para las poliangeítis.
Es una enfermedad infrecuente; su incidencia en Estados Unidos es de 1-3 casos por 100.000 adultos2, y su prevalencia es de 6,8 casos por millón3. Tiende a afectar más a hombres que a mujeres, con una edad media de presentación de 45,5 años, y es más frecuente en personas de ascendencia europea4. Para este artículo se realizó una revisión del material bibliográfico publicado en Costa Rica y no se logró encontrar otro reporte de esta enfermedad.
Se considera como una vasculitis de pequeños y medianos vasos5, asociada a eosinofilia, granulomas necrosantes y asma5.
En su evolución natural la enfermedad cuenta con 3 fases: la asmática o prodrómica, la eosinofílica y la vasculítica6 .Cada fase cuenta con una variación en la presentación clínica del cuadro, lo cual dificulta su diagnóstico. El uso de fármacos inhibidores de los leucotrienos y anti-IgE7 se ha visto asociado con el inicio de la enfermedad8,9.
Existen criterios diagnósticos propuestos por el American College of Rheumatology (ACR) (tabla 1). La presencia de 4 o más criterios provee una sensibilidad del 85% y una especificidad del 99,7%10.
A continuación presentamos el caso de una paciente femenina portadora de asma bronquial y rinosinusitis de larga data, que inició con una neuropatía periférica e hipereosinofilia.
Presentación de caso
Se trata de una paciente femenina de 26 años de edad, portadora de una rinosinusitis atópica desde la infancia, vitíligo y asma de inicio reciente (un año), por lo cual consultó en múltiples ocasiones a diferentes servicios de urgencias por broncoespasmos. Se le designó un esquema terapéutico con salbutamol inhalado, beclometasona y montelukast.
Tres meses previos a su diagnóstico definitivo, consulta por un dolor precordial, que fue catalogado como costocondritis y manejado de forma ambulatoria. En ese mismo mes es internada en un centro médico debido a una neumonía adquirida en la comunidad y a una crisis asmática persistente. Se le efectuó un hemograma, que arrojó una eosinofilia del 46% con escasa leucocitosis. La eosinofilia el día siguiente fue del 67%. Se le realiza una velocidad de eritrosedimentación, que es reportada como de 51 mm/h. La paciente fue tratada con anti-bioterapia y broncodilatadores, y al quinto día fue egresada con escasas sibilancias y sin dificultad respiratoria.
Dos meses antes del diagnóstico, fue valorada por el servicio de neurología por una lumbociática izquierda y se notó que presentaba una abolición del reflejo aquiliano izquierdo. A la vez inició con una lesión cutánea eritematosa, pruriginosa, de aspecto violáceo, que parecía ser una «picadura de insecto».
Inició con parestesias y espasmos musculares en el pie izquierdo, una semana después manifestó dolor en la pantorrilla de la misma extremidad que le impedía deambular, por lo cual fue internada en el servicio de Medicina Interna del Hospital México. Se le practicó una resonancia magnética, que descartó la presencia de una hernia discal. En esa misma instancia se le practicó un estudio de velocidad de conducción nerviosa, que arrojó una denervación aguda activa del nervio ciático, común solamente en los músculos inervados por este por debajo de la rodilla.
Por el antecedente de dolor precordial se le realizó una eco-cardiografía, que mostró una disminución de la contractilidad cardiaca de forma difusa, una fracción de eyección de 32-29% y una insuficiencia mitral leve.
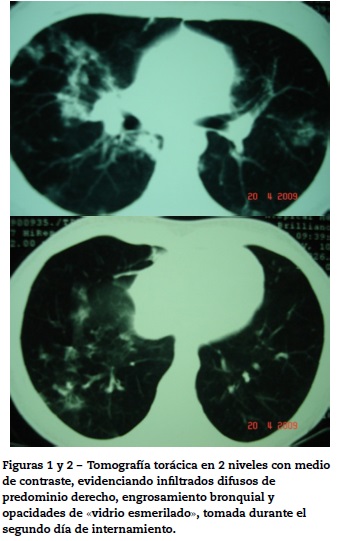
Durante este internamiento la paciente presentaba dificultad respiratoria, con broncoespasmos y hemoptisis, por lo que se solicitó una tomografía de tórax, la cual mostró infiltrados parenquimatosos difusos con predominio periférico, más abundante en pulmón derecho, engrosamiento bronquial y opacidades con aspecto de «vidrio esmerilado» (figs. 1 y 2).
Se le realiza una serie de exámenes de laboratorio, los cuales muestran los siguientes resultados relevantes:
Anemia normocítica y normocrómica, eosinofilia del 55%, IL-2 e IL-6 elevadas, IgE elevada, factor reumatoide positivo, interferón alfa elevado y p-ANCA positivo (1/40, MPO+).
La paciente cumple con 5 de los 6 criterios del ACR, por lo cual se diagnostica como una vasculitis granulomatosa eosinofílica o síndrome de Churg-Strauss.
Se inicia tratamiento con corticosteroides a altas dosis, con una buena respuesta terapéutica, generando una normalización de los marcadores serológicos un mes después del inicio del tratamiento (VES: 5 mm/h; eosinófilos en sangre: 3%).
Manifestaciones clínicas
Pulmonares
La manifestación más común de esta entidad patológica es el asma bronquial, y se presenta en casi la totalidad de los pacientes afectados. Como manifestaciones menos frecuentes encontramos neumonitis eosinofílica11 y hemorragia alveolar12. Debido a que la eosinofilia genera un estado pro-trombótico, también se ve asociada a tromboembolismos pulmonares13.
Otorrinolaringológicas
La presentación más frecuente en esta región es la sinusitis crónica asociada a una rinitis alérgica y, en ciertos casos, pólipos nasales14. Otras manifestaciones menos frecuentes son: sordera neurosensorial, otitis media supurativa, rotura timpánica15, parálisis facial y vértigo16.
Cardiacas
La afectación cardiaca se puede manifestar de múltiples formas, entre ellas encontramos la miocardiopatía restrictiva o dilatada, arritmias, valvulopatía, muerte súbita17, efusión pericárdica18, arteritis coronaria19 y rara vez los aneurismas coronarios20.
Musculocutáneas y articulares
La púrpura palpable es la lesión cutánea más frecuentemente vista en la poliangeítis granulomatosa con eosinofilia21. Otras manifestaciones cutáneas son placas eritematosas con o sin ulceración22, petequias23, prurito, nódulos subcutáneos y dermatitis24. El compromiso cutáneo se observa en 2 tercios de los pacientes25 y la superficie extensora del codo es el sitio más afectado26. Existen reportes de miositis circunscrita27 y difusa28 relacionada con esta enfermedad. Existe también sinovitis de pequeñas y medianas articulaciones29. Como una manifestación infrecuente encontramos la necrosis de los dígitos30. Parece existir una correlación infrecuente entre la poliangeítis granulomatosa con eosinofilia y la artritis reumatoidea31.
Neurológicas y oftalmológicas
La afectación más común es una mononeuritis múltiple, que con mayor frecuencia y severidad afecta los nervios fibulares32. Esta condición puede progresar a una polineuropatía32. La afectación es, principalmente, de orden motor, aunque también presenta alteraciones sensitivas en un menor porcentaje y se manifiesta en una proporción similar en miembros superiores e inferiores33. Las manifestaciones neurológicas tienden a ser similares, tanto en distribución y progreso, a las de la poliarteritis nodosa y la artritis reumatoi-dea. Las manifestaciones neurológicas tienden a presentarse de forma más tardía que las respiratorias32. Existen también manifestaciones menos frecuentes, tales como accidentes cerebrovasculares34,35, isquemia del nervio óptico, amaurosis fugax, parálisis del músculo oblicuo superior36, parálisis del nervio motor ocular común37 y afectación conjuntival29.
Renales
Aproximadamente el 25% de los pacientes con poliangeítis granulomatosa con eosinofilia presentan enfermedad renal38. La histología más frecuente de la afectación renal es la glo-merulonefritis necrosante con semilunas, aunque existe una gran variedad de cuadros inflamatorios glomerulares38. La manifestación clínica más frecuente es una insuficiencia renal aguda que evoluciona rápidamente. La proteinuria microscópica y la hematuria están presentes en todos los pacientes con afectación renal39.
Gastrointestinales
Entre el 31 y el 45% de los pacientes presentan manifestaciones gastrointestinales40. El dolor abdominal es el síntoma más frecuente6, y también se observan diarrea, sangrado digestivo, pérdida de peso, pancreatitis, dehiscencia de tejidos reparados40, isquemia intestinal y perforación de víscera hueca41. El abdomen agudo se manifiesta de forma infrecuente y está asociado a mal pronóstico42.
Estudios de laboratorio y gabinete
Como parte de los criterios diagnósticos del ACR encontramos la presencia de una eosinofilia mayor al 10%, por lo cual se considera como un marcador inespecífico de la enfermedad43. La concentración de la eotaxina-3 está asociada a la fase activa de la enfermedad y se correlaciona con la elevación de los niveles de los reactantes de fase aguda, IgE y número de eosinófilos en sangre periférica44
El entre el 4045 y el 74,3% de los pacientes diagnosticados con esta enfermedad son positivos para el anticuerpo antineutrófilo citoplasmático perinuclear (ANCA), y en un menor porcentaje, c-ANCA positivos45. Se encontró una fuerte prevalencia de ANCA-anti-mieloperoxidasa (MPO) versus el ANCA-proteinasa 3 (PR3)46, aunque esta tendencia varía en el caso de las poblaciones del Reino Unido y del norte de Europa47. Los pacientes con positividad para el ANCA muestran manifestaciones clínicas diferentes de aquellos que carecen de este marcador45. Los pacientes ANCA negativos tienden a tener menos compromiso renal24 y mayor incidencia de enfermedad cardiaca14.
Las biopsias tisulares son de importancia diagnóstica; en el caso de las biopsias cutáneas, se recomienda que se realicen en un periodo menor a 48 h en caso de lesiones purpúricas y en 72 h en las lesiones nodulares21. El patrón histológico más frecuente en biopsias son los granulomas necrosantes extravasculares48.
Los hallazgos radiológicos más comunes son las consolidaciones transitorias no segmentales49. La lesión más frecuente observada por medio de tomografía de alta resolución es la presencia de opacidades de vidrio esmerilado u opacidades difusas bilaterales50. Estas manifestaciones están presentes en el 90% de los casos; en el 50% de los casos se observa la presencia de líneas septales. En el 88% de los pacientes se visualizan anormalidades pulmonares por medio de tomografía51.
En la evaluación de las manifestaciones cardiacas los hallazgos electrocardiográficos más frecuentes son alteraciones inespecíficas del segmento ST y cambios en la onda T. La ecocardiografía puede mostrar disfunción del ventrículo izquierdo y un derrame pericárdico de pequeño o mediano tamaño25.
Tratamiento
El tratamiento tradicional para la generar remisión en pacientes con esta enfermedad es el uso de glucocorticoides o ciclofosfamida52,53.
El tratamiento habitual es la prednisolona oral a una dosis 1 mg/kg/día por un mes, seguido por disminuciones de 2,5 mg por semana hasta llegar a los 10mg/día. A partir de ese momento se disminuye 1 mg por semana hasta suspender el fármaco54.
La ciclofosfamida también es utilizada para la inducción de la remisión53,54; el fármaco se puede dar de forma oral a 2 mg/kg/día por 12 meses o darse en pulsos mensuales de 0,6 g/m2.
La ciclofosfamida parece especialmente útil en la disminución del daño miocárdico y en la disfunción contráctil55.
Se ha visto que la utilización de metilprednisolona en pulso, agregado a prednisolona oral a una dosis de 1 mg/kg/día, por 3 semanas, es efectiva para inducir la remisión56.
El uso de rituximab como monoterapia o en conjunto con prednisolona en pacientes, por 4 semanas, es igual de efectivo para el tratamiento de vasculitis severa que el régimen de ciclofosfamida-azatioprina, con un número de efectos adversos similar57.
En un estudio comparativo se encontró que el rituximab y la azatioprina son fármacos de mantenimiento muy efectivos en el tratamiento de las vasculitis asociadas al ANCA58, aunque la toxicidad del rituximab a largo plazo aún no está del todo clara.
El uso concomitante de inmunoglobulinas con corticosteroides como inductor de remisión ha probado ser efectivo59. Esta terapia también es de utilidad en el tratamiento de la neuropatía periférica residual60. También se ha notado que el uso de interferón-a23, eternacept y remicade61 es de utilidad en casos refractarios en combinación con el tratamiento tradicional.
La eficacia del tratamiento se mide acorde con la capacidad de inducir una remisión y de mantener al paciente libre de vasculitis. Un paciente se considera en remisión una vez que ha pasado 6 meses sin sintomatologia11, y se considera libre de enfermedad después de pasar 18 meses sin síntomas una vez concluido el tratamiento54.
El Birgminham Vasculitis Activity Score se utiliza para determinar la presencia o ausencia de enfermedad activa en las vasculitis sistémicas62. Actualmente se utiliza la tercera versión63.
Pronóstico
Sin recibir tratamiento, hasta el 50% de los pacientes mueren en un periodo de 3 meses desde el inicio de la vasculitis64.
La principal causa de muerte en los pacientes con esta enfermedad es el compromiso cardiaco asociado65.
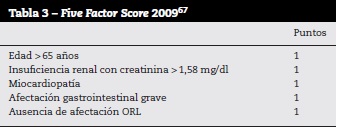
El Five Factor Score (puntaje de 5 factores) es un sistema de puntuación que se utiliza para determinar la probabilidad de muerte en un periodo de 5 años en pacientes portadores de una vasculitis necrosante sistémica. Originalmente fue creado en 199666 (tabla 2). En el año 2009 (tabla 3) se revisa y se modifican 2 de los 5 factores previos para su utilización en pacientes con diagnóstico reciente. En pacientes con un puntaje de 0, la supervivencia en 5 años es del 91%, de 1 punto es del 79% y de más de 2 puntos es del 60%67.
Responsabilidades éticas
Protección de personas y animales. Los autores declaran que los procedimientos seguidos se conformaron a las normas éticas del comité de experimentación humana responsable y de acuerdo con la Asociación Médica Mundial y la Declaración de Helsinki.
Confidencialidad de los datos. Los autores declaran que en este artículo no aparecen datos de pacientes.
Derecho a la privacidad y consentimiento informado. Los autores declaran que en este artículo no aparecen datos de pacientes.
Conflicto de intereses
Los autores declaran no tener ningún conflicto de intereses.
Bibliografía
1. Churg J, Strauss l. Allergic granulomatosis, allergic angiitis and periarteritis nodosa. Am J Pathol. 1951;27:277-301. [ Links ]
2. Eustace JA, Nadasdy T, Choi M. The Churg-Strauss syndrome. J Am Soc Nephrol. 1999;10:2048-55. [ Links ]
3. Martin RM, Wilton LV, Mann RD. Prevalence of Churg-Strauss syndrome, vasculitis, eosinophilia and associated conditions: Retrospective analysis of 58 prescription-event monitoring cohort studies. Pharmacoepidemiol Drug Saf. 1999;8: 179-89. [ Links ]
4. Mahr A, Guillevin L, Poissonnet M, Aymé S. Prevalences of polyarteritis nodosa, microscopic polyangiitis, Wegener's granulomatosis, and Churg-Strauss syndrome in a French urban multiethnic population in 2000: A capture-recapture estimate. Arthritis Rheum. 2004;51:92-9. [ Links ]
5. Jennette J, Falk R, Bacon P, Basu N, Cid M, Ferrario F, et al. 2012 Revised International Chapel Hill Consensus Conference Nomenclature of Vasculitides. Arthritis Rheum. 2012;65:1-11. [ Links ]
6. Noth I, Strek ME, Leff AR. Churg-Strauss syndrome. Lancet. 2003;361:587-94. [ Links ]
7. Wechsler ME, Wong DA, Miller MK, Lawrence-Miyasaki L. Churg-Strauss syndrome in patients treated with omalizumab. Chest J. 2009;136:507-18. [ Links ]
8. Green RL, Vayonis AG. Churg-Strauss syndrome after zafirlukast in two patients not receiving systemic steroid treatment. Lancet. 1999;353:725-6. [ Links ]
9. Keogh KA, Specks U. Churg-Strauss syndrome: Clinical presentation, antineutrophil cytoplasmic antibodies, and leukotriene receptor antagonists. Am J Med. 2003;115:284-90. [ Links ]
10. Masi AT, Hunder GG, Lie JT, Michel BA, Bloch DA, Arend WP, et al. The American College of Rheumatology 1990 criteria for the classification of Churg-Strauss syndrome (allergic granulomatosis and angiitis). Arthritis Rheum. 1990;33:1094-100. [ Links ]
11. Della Rossa A, Baldini C, Tavoni A, Tognetti A, Neglia D, Sambuceti G, et al. Churg-Strauss syndrome: Clinical and serological features of 19 patients from a single Italian centre. Rheumatology. 2002;41:1286-94. [ Links ]
12. Omori K, Hoshino T, Hiramoto H, Oshita H, Shoda H, Okamoto N, et al. A case of hearing loss and diffuse alveolar hemorrhage associated with microscopic polyangitis. Nihon Kokyuki Gakkai Zasshi. 2009;47:711-6. [ Links ]
13. Takayasu V, Felipe-Silva A. Eosinophilic granulomatosis with polyangiitis (Churg-Strauss) syndrome and pulmonary thromboembolism: an overlooked concomitance. Autop Case Rep. 2013;3:11-9. [ Links ]
14. Comarmond C, Pagnoux C, Khellaf C, Cordier M, Hamidou JF, Viallard M, et al. Eosinophilic granulomatosis with polyangiitis (Churg-Strauss): Clinical characteristics and long-term followup of the 383 patients enrolled in the French Vasculitis Study Group cohort. Arthritis Rheum. 2013;65:270-81. [ Links ]
15. Amor Dorado J, Barreira Fernández M, Regueiro Villarin S, González-Gay M. Manifestaciones audiovestibulares en las vasculitis sistémicas. Acta Otorrinolaringol Esp. 2009;60:432-42. [ Links ]
16. Bacciu A, Bacciu S, Mercante G, Ingegnoli F, Grasselli C, Vaglio A, et al. Ear, nose and throat manifestations of Churg-Strauss syndrome. Acta Otorhinolaryngol Ital. 2006;126:503-9. [ Links ]
17. Sud A, Brum RL, Victor K, Koudounis P, Carr-White GS, Rajani R. Multimodality imaging of Churg-Strauss myocarditis. Heart Metab. 2014;62:27-30. [ Links ]
18. Gendelman S, Zeft A, Spalding S. Childhood-onset eosinophilic granulomatosis with polyangiitis (formerly Churg-Strauss Syndrome): A contemporary single-center Cohort. J Rheuma. 2013;40:929-35. [ Links ]
19. Chumbley LC, Harrison EG Jr, DeReme RA. Allergic granulomatosis and angiitis (Churg-Strauss syndrome). Report and analysis of 30 cases. Mayo Clin Proc. 1977;52:477-84. [ Links ]
20. Htun P, Horger M, Gawaz M, Fateh-Moghadam S. Clinical images giant coronary artery aneurysms and eosinophilic granulomatosis with polyangiitis. Arthritis Rheum. 2013;65, 1406-1406. [ Links ]
21. Chen KR. Importance of Cutaneous Vasculitis in Rheumatology. Rheumatology (Sunnyvale). 2014;4, 2161-1149. [ Links ]
22. Termeer CC, Simon JC, Schopf E. Low-dose interferon alfa-2b for the treatment of Churg-Strauss syndrome with prominent skin involvement. Arch Dermatol. 2001;137:136-8. [ Links ]
23. Tatsis E. Interferon-α treatment of four patients with the Churg-Strauss syndrome. Ann Intern Med. 1998;129:370. [ Links ]
24. Kim M, Sohn K, Song W, Park H, Cho S, Min K, et al. Clinical features and prognostic factors of Churg-Strauss syndrome. Korean J Intern Med. 2014;29:85. [ Links ]
25. Conron M, Beynon HL. Churg-Strauss syndrome. Thorax. 2000;55:870-7. [ Links ]
26. Finan MC, Winkelmann RK. The cutaneous extravascular necrotizing granuloma (Churg-Strauss granuloma) and systemic disease: A review of 27 cases. Medicine (Baltimore). 1983;62:142-58. [ Links ]
27. Billing K. Orbital myositis in Churg-Strauss syndrome. Arch Ophthalmol. 2004;122:393. [ Links ]
28. Parent M, Larue S, Ellezam B. Eosinophilic granulomatosis with polyangiitis (Churg-Strauss syndrome) presenting as diffuse myositis. BMC Musculoskelet Disord. 2014;15:388. [ Links ]
29. Margolis R, Kosmorsky G, Lowder C, Schoenfield L. Conjunctival Involvement in Churg-Strauss syndrome. Ocul Immunol Inflamm. 2007;15:113-5. [ Links ]
30. Otani Y, Anzai S, Shibuya H, Fujiwara S, Takayasu S, Asada Y, et al. Churg-Strauss Syndrome (CSS) manifested as necrosis of fingers and toes and liver infarction. J Dermatol. 2003;30:810-5. [ Links ]
31. Draibe J, Salama A. Association of ANCA associated vasculitis and rheumatoid arthritis: A lesser recognized overlap syndrome. SpringerPlus. 2015;4:50. [ Links ]
32. Hattori N. Clinicopathological features of Churg-Strauss syndrome-associated neuropathy. Brain. 1999;122:427-39. [ Links ]
33. Del Giardino LG, Cavallaro T, Anzola GP, Ferrari S, Unit N. Neuropathy in Churg-Strauss syndrome: a comparison study of 24 cases with or without prior leukotriene antagonist exposure. Eur Ann Allergy Clin Immunol. 2014;46:201-9. [ Links ]
34. Taormina G, Andolina G, Banco M, Costanza-Gaglio E, Bonura A, Buscemi S. An uncommon presentation of eosinophilic granulomatosis with polyangiitis: A case report. J Med Case Rep. 2014;8:190. [ Links ]
35. Sairanen T, Kanerva M, Valanne L, Lyytinen J, Pekkonen E. Churg-Strauss syndrome as an unusual aetiology of stroke with haemorrhagic transformation in a patient with no cardiovascular risk factors. Case Rep Neurol. 2011;3:32-8. [ Links ]
36. Weinstein J. Churg-Strauss syndrome (allergic granulomatous angiitis). Arch Ophthalmol. 1983;101:1217. [ Links ]
37. Tsuda H, Ishikawa H, Majima T, Sawada U, Mizutani T. Isolated oculomotor nerve palsy in Churg-Strauss syndrome. Intern Med. 2005;44:638-40. [ Links ]
38. Sinico R, Toma L, Maggiore U, Tosoni C, Bottero P, Sabadini E, et al. Renal involvement in Churg-Strauss syndrome. Am J Kidney Dis. 2006;47:770-9. [ Links ]
39. Kikuchi Y lkehata N, Tajima O, Yoshizawa N, Miura S. Glomerular lesions in patients with Churg-Strauss syndrome and the anti-myeloperoxidase antibody. Clin Nephrol. 2001;55:429-35. [ Links ]
40. Cir C. Churg-strauss abdominal manifestation. Cir Cir. 2014;82:153-7. [ Links ]
41. Assmann G, Molinger M, Pfreundschuh M, Bohle R, Zimmer V. Gastrointestinal perforation due to vasculitis at primary diagnosis of eosinophilic granulomatosis with polyangiitis (EGPA) despite a high dose glucocorticosteroids treatment. SpringerPlus. 2014;3:404. [ Links ]
42. Singh R, Singh D, Abdou N. Churg-Strauss syndrome presenting as acute abdomen: are gastrointestinal manifestations an indicator of poor prognosis? Int J Rheum Dis. 2009;12:161-5. [ Links ]
43. Monach P. Biomarkers in vasculitis. Curr Opin Rheumatol. 2014;26:24-30. [ Links ]
44. Polzer K, Karonitsch T, Neumann T, Eger G, Haberler C, Soleiman A, et al. Eotaxin-3 is involved in Churg-Strauss syndrome - a serum marker closely correlating with disease activity. Rheumatology. 2008;47:804-8. [ Links ]
45. Sinico R, di Toma L, Maggiore U, Bottero P, Radice A, Tosoni C, et al. Prevalence and clinical significance of antineutrophil cytoplasmic antibodies in Churg-Strauss syndrome. Arthritis Rheum. 2005;52:2926-35. [ Links ]
46. Solans R. Montelukast and Churg-Strauss syndrome. Thorax. 2002;57:183-5. [ Links ]
47. Watts R, Carruthers D, Scott D. Epidemiology of systemic vasculitis: Changing incidence or definition? Semin Athritis Rheum. 1995;25:28-34. [ Links ]
48. Davis MD, Daou MS, McEvoy MT, Su WD. Cutaneous manifestations of Churg-Strauss syndrome: A clinicopathologic correlation. J Am Acad Dermatol. 1997;37:199-203. [ Links ]
49. Silva CI, Müller NL, Fujimoto K, Johkoh T, Ajzen SA, Churg A. Churg-Strauss syndrome: High resolution CT and pathologic findings. J Thorac Imaging. 2005;20:74-80. [ Links ]
50. Castañer E, Alguersuari A, Gallardo X, Andreu M, Pallardó Y, Mata J, et al. When to suspect pulmonary vasculitis: Radiologic and clinical clues. RadioGraphics. 2010;30:33-53. [ Links ]
51. Worthy S, Müller N, Hansell D, Flower C. Churg-Strauss syndrome: The spectrum of pulmonary CT findings in 17 patients. Am J Roentgeno. 1998;170:297-300. [ Links ]
52. Zand L, Specks U, Sethi S, Fervenza F. Treatment of ANCA-associated vasculitis: New therapies and a look at old entities. Adv Chronic Kidney Dis. 2014;21:182-93. [ Links ]
53. Stone J, Merkel P, Spiera R, Seo P, Langford C, Hoffman G, et al. Rituximab versus cyclophosphamide for ANCA-associated vasculitis. N Engl J Med. 2010;363:221-32. [ Links ]
54. Gayraud M. Treatment of good-prognosis polyarteritis nodosa and Churg-Strauss syndrome: Comparison of steroids and oral or pulse cyclophosphamide in 25 patients French Cooperative Study Group for Vasculitides. Rheumatology. 1997;36:1290-7. [ Links ]
55. Miszalski-Jamka T, Szczeklik W, Sokolowska B, Karwat K, Miszalski-Jamka K, Jazwiec P,et al. noncorticosteroid immunosuppression limits myocardial damage and contractile dysfunction in eosinophilic granulomatosis with polyangiitis (Churg-Strauss syndrome). J Am Coll Cardiol. 2015;65:103-5. [ Links ]
56. Ribi C, Cohen P Pagnoux C, Mahr A, Arène J, Lauque D, et al. Treatment of Churg-Strauss syndrome without poor-prognosis factors: A multicenter, prospective, randomized, open-label study of seventy-two patients. Arthritis Rheum. 2008;58:586-94. [ Links ]
57. Specks U, Merkel P, Seo P, Spiera R, Langford C, Hoffman G, et al. Efficacy of remission-induction regimens for ANCA-associated vasculitis. N Engl J Med. 2013;369:417-27. [ Links ]
58. Hebert LA, Alvarado A, Rovin B, Guillevin L, Pagnoux C, Karras A. 24. Rituximab or azathioprine maintenance in ANCA-associated vasculitis. N Engl J Med. 2015;372:385-7. [ Links ]
59. Tsurikisawa N, Saito H, Oshikata C, Tsuburai T, Akiyama K. High-dose intravenous immunoglobulin treatment increases regulatory T cells in patients with eosinophilic granulomatosis with polyangiitis. J Rheumatol. 2012;39:1019-25. [ Links ]
60. Koike H, Akiyama K, Saito T, Sobue G. Intravenous immunoglobulin for chronic residual peripheral neuropathy in eosinophilic granulomatosis with polyangiitis (Churg-Strauss syndrome): A multicenter, double-blind trial. J Neurol. 2015;262:752-9. [ Links ]
61. ARBACH O. Treatment of refractory Churg-Strauss-syndrome (CSS) by TNF-blockade. Immunobiology. 2002;206:496-501. [ Links ]
62. Luqmani R, Bacon P, Moots R, Janssen B, Pall A, Emery P, et al. Birmingham Vasculitis Activity Score (BVAS) Dim system necrotizinig vasculitis. QJM. 1994;87:671-8. [ Links ]
63. Mukhtyar C, Lee R, Brown D, Carruthers D, Dasgupta B, Dubey S, et al. Modification and validation of the Birmingham Vasculitis Activity Score (version 3). Ann Rheum Dis. 2008;68:1827-32. [ Links ]
64. Baldini C, Talarico R, della Rossa A, Bombardieri S. Clinical manifestations and treatment of Churg-Strauss syndrome. Rheum Dis Clin North Am. 2010;36:527-43. [ Links ]
65. Hasley P, Follansbee W, Coulehan J. Cardiac manifestations of Churg-Strauss syndrome: Report of a case and review of the literature. Am Heart J. 1990;120:996-9. [ Links ]
66. Guillevin L, Lhote F, Gayraud M, Cohen P, Jarrousse B, Lortholary O, et al. Prognostic factors in polyarteritis nodosa and Churg-Strauss syndrome. Medicine. 1996;75:17-28. [ Links ]
67. Guillevin L, Pagnoux C, Seror R, Mahr A, Mouthon L, Toumelin P. The Five-Factor Score revisited. Medicine. 2011;90:19-27. [ Links ]