Introducción
El lupus eritematoso sistémico (LES) es una enfermedad auto-inmune crónica caracterizada por múltiples anormalidades inmunológicas que llevan a una afectación multiorgánica1; el curso clínico es variable, y se caracteriza por ser recurrente e intermitente2,3. La prevalencia de esta patología parece estar aumentando a través del tiempo, posiblemente debido a la mayor tasa actual de diagnóstico temprano y supervivencia de la enfermedad1,4,5. Sin embargo, la tasa de mortalidad sigue siendo alta, aproximadamente tres veces mayor a la de individuos sanos6. Esta, además, aumenta ante factores de riesgo ligados per se a la enfermedad, como altos niveles de actividad del LES, presencia de daño renal, presencia de desórdenes neuropsiquiátricos, pulmonares, hematológicos o la asociación con síndrome antifosfolípido6.
Dentro de todo el espectro clínico del LES, la afectación del sistema nervioso representa el mayor desafío diagnóstico y terapéutico, ya que engloba una numerosa variedad de manifestaciones neurológicas7. Estas varían en su presentación desde focales hasta difusas, centrales, periféricas, aisladas, complejas, leves o severas8,9. A su vez, pueden presentarse en cualquier momento de la enfermedad1, ya sea en actividad o inactividad clínica de ésta9,10.
A nivel epidemiológico se ha reportado una prevalencia del LES neuropsiquiátrico (NPSLE) del 12 al 95%7,10. Aproximadamente el 93% de estos casos involucra el sistema nervioso central (SNC) y el 7% restante compromete el sistema nervioso periférico (SNP) 9. Por otro lado, el 60% son primarios y el 40% secundarios a los efectos adversos de los medicamentos inmunosupresores o a las infecciones11. Finalmente, del 40 al 50% de las manifestaciones se asocian a un índice de actividad de LES (SLEDAI, por sus siglas en inglés) elevado comparado con pacientes sin NPSLE12. Por tanto, esta forma de presentación, junto con la nefritis lúpica, representan las formas clínicas más severas del LES y, a su vez, las más asociadas a un peor pronóstico y a peor calidad de vida7,13.
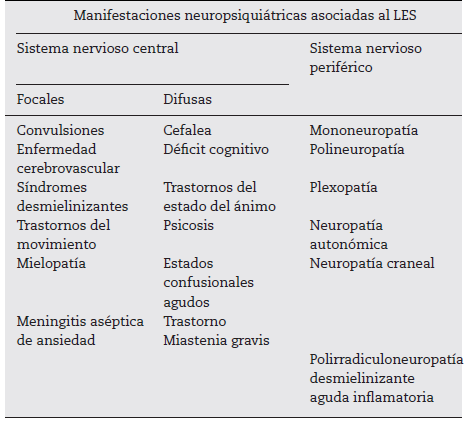
Las diferentes afectaciones y síntomas que pueden ser desencadenados por el NPSLE obligaron al establecimiento, en 1999, por parte del American College of Rheumatology (ACR), de una lista de 19 manifestaciones neurológicas que definieran la enfermedad (tabla 1). De estas, 12 involucran el SNC y 7 el SNP7,8,14. Así mismo, las manifestaciones del SNC se pueden subdividir en focales y difusas9.
Aunque existe una variedad de ayudas paraclínicas e imagenológicas que se han reportado como potencialmente útiles para el diagnóstico del NPSLE, no existe aún un estándar de oro disponible9. Por esto, actualmente se dirigen esfuerzos para identificar biomarcadores que puedan mejorar la sensibilidad y la especificidad del diagnóstico de esta patología.
En este artículo se revisan diferentes anticuerpos asociados al NPSLE, su posible rol fisiopatológico, su prevalencia y su asociación en esta forma de presentación clínica del LES.
Métodos
Métodos de búsqueda de la literatura
Se realizó una búsqueda sistemática de artículos hasta mayo de 2018 en las bases de datos Scielo, Clinical Trials, Clinics Review Article, Academic Search Ultimate, Medline, Embase y Google Scholar. La búsqueda se restringió a literatura en inglés y en espanol. Durante la búsqueda no hubo restricciones de fecha. Al llevar a cabo la búsqueda en Medline, esta se hizo a través de Pubmed por medio de los términos MeSH: Systemic lupus erythematosus, Neurological involvement, Antibodies. Posteriormente se enlazaron con el conector booleano AND.
Selección de artículos y extracción de información
Al finalizar la búsqueda, los artículos fueron guardados en una base de datos construida en Excel. De esta forma se excluyeron artículos duplicados y se inició el proceso de selección de los relevantes para esta publicación. Se tuvieron en cuenta los artículos que incluyeran las palabras clave en el título o en el abstract. Se revisó que cada artículo cumpliera con los criterios de inclusión, y finalmente se realizó un consenso entre todos los autores para unificar y revisar la base de datos.
Criterios de inclusión
Tipos de estudio: incluimos estudios de cohorte, casos y control, estudios aleatorizados, no aleatorizados y revisiones de tema.
Tipo de población: pacientes adultos con compromiso neurológico por LES en los que se evaluaran anticuerpos específicos.
Intervención: estudios que describieran la función, técnicas de laboratorio utilizadas para su detección y aplicación clínica de estos anticuerpos.
Resultados
Posterior a la búsqueda inicial se encontraron 66 artículos, de los cuales la mayoría estaban en Medline y Google Scholar. Tras realizar la exclusión de los artículos a los que no se tuviera acceso completo y de artículos duplicados, se seleccionaron un total de 56 artículos.
Mecanismos fisiopatológicos del lupus neuropsiquiátrico
La patogénesis del NPSLE es particularmente compleja y envuelve una variedad de mecanismos fisiopatológicos que a la fecha no han podido ser claramente dilucidados7,9. Sin embargo, la evidencia actual sugiere dos posibles mecanismos.
El primero es una vasculopatía no inflamatoria (fig. 1A), donde los principales agentes iniciadores son los anticuerpos antifosfolípidos7. Dichos anticuerpos intervienen en la cascada de la coagulación y se unen a las células endoteliales produciendo un estado procoagulante15. Esto trae como consecuencia trombosis e isquemia de vasos de diferente calibre a nivel cerebral, lo cual lleva finalmente a la aparición clínica del NPSLE, principalmente el de carácter focal7,15, que al presentarse se correlaciona con niveles altos de tales anticuerpos en el 92% de los casos14.
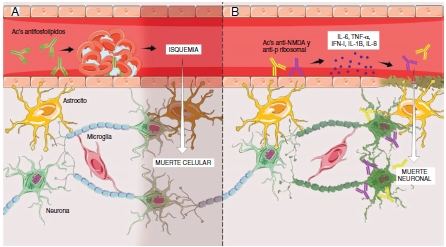
Figura 1 A) Mecanismo vascular no inflamatorio mediado por anticuerpos antifosfolípidos que llevan a la formación de microtrombos a nivel cerebral con posterior isquemia y muerte celular del segmento involucrado. Este mecanismo explica principalmente las manifestaciones focales del NPSLE. B) Mecanismo autoinmune inflamatorio mediado por anticuerpos, principalmente anti-NMDA y anti-Pribosomales, que promueven liberación de citoquinas proinflamatorias que ocasionarán disrupción del endotelio de la barrera hematoencefálica y posterior paso de dichos anticuerpos al parénquima cerebral, que finalmente llevarán a la apoptosis neuronal. Este mecanismo explica las manifestaciones difusas del NPSLE. Figura desarrollada por Lady J. Ríos-Serna.
El segundo es un mecanismo autoinmune inflamatorio (fig. 1B) donde los principales agentes iniciadores son los anticuerpos anti-P ribosomales o anti-N-metil-D-aspartato (NMDA); sin embargo, también se han visto asociados otros, como los anti-endoteliales y los anti-neuronales7. La presencia de niveles elevados en el líquido cefalorraquídeo (LCR) de dichos anticuerpos ha generado la duda en los investigadores sobre si estos son formados intratecal o periféricamente7,9. La respuesta que han arrojado las investigaciones es que son formados periféricamente y que posteriormente pasan a través de una barrera hematoencefálica (BHE) disfuncional7, que ha sido permeabilizada previamente por factores como la hipertensión arterial, el tabaquismo y las infecciones7,15, o por factores dependientes del LES, como el depósito de complejos inmunes en el endotelio, promoviendo la liberación de citoquinas (IL-6, IL-8, IL-10, TNF-a, INF-1) que ocasionarán inflamación celular y, finalmente, disrupción de la BHE, facilitando el paso de los anticuerpos a través de esta7,15-20. Una vez dentro del parénquima cerebral, estos inducen muerte celular tanto por acción directa como por liberación de citoquinas proinflamatorias sobre las neuronas19. Cabe resaltar que algunos estudios también han demostrado que los anticuerpos pueden ser formados intratecalmente7,9,15 y que tienen un trofismo particular sobre las neuronas ubicadas en áreas cerebrales encargadas de la memoria y del comportamiento, como el hipocampo y la amígdala19. Es por esto que este segundo mecanismo se ha asociado al NPSLE de carácter difuso7,9.
Anticuerpos anti-P ribosomales
Son anticuerpos que reconocen un determinante antigénico de 22 aminoácidos ubicados en la cadena C-terminal de 3 proteínas ribosomales (P0, P1, P2) 19. Este antígeno, a su vez, es compartido por la proteína NSPA (neuronal Surface P antigen), que es expresada en la superficie celular de neuronas distribuidas en áreas cerebrales encargadas del control de las emociones, funciones cognitivas y memoria21-23. Este anticuerpo, mediante su acción directa sobre dichas neuronas, lleva a la inhibición de la síntesis proteica22, al influjo de calcio al espacio intracelular y, finalmente, a la apoptosis celular24. Los títulos altos de anticuerpos anti-P ribosoma-les se han asociado principalmente al NPSLE de carácter difuso25, y la psicosis es la manifestación con la que más se ha correlacionado19,21,26. Su primera asociación se demostró en un estudio en el cual los títulos de estos anticuerpos estaban elevados en 18 (90%) de 20 pacientes con LES que cursaban con psicosis, en tanto que en otras manifestaciones difusas del NPSLE solo estaban elevados en un 15%27. Aunque los resultados son controversiales, hoy en día se sigue investigando sobre su asociación con otras manifestaciones difusas, como la depresión y el déficit cognitivo21,23. Por otra parte, un metaanálisis que incluyó 1.537 pacientes determinó que la sensibilidad y la especificidad de los anti-P ribosomales para el diagnóstico del NPSLE son del 26 y del 80%, y que para el diagnóstico de la psicosis o trastornos del estado de ánimo son del 27 y del 80%28, respectivamente. Otros estudios han demostrado, además, que los títulos de estos anticuerpos se elevan antes y durante los estados de psicosis o los periodos de actividad clínica del LES, sugiriendo que pueden tener un valor predictivo identificando futuras crisis23,27.
Los anticuerpos anti-P ribosomales son detectados mediante ELISA o por immunoblot29, y pueden estar presentes tanto en suero como en LCR de pacientes con NPSLE21,23. Por último, su sensibilidad y su especificidad en pacientes con LES pero sin NPSLE es del 37 y del 96%, respectivamente27, y su prevalencia varía según la edad y las características del paciente, siendo la prevalencia en jóvenes mayor que en adultos (20-40% vs. 10-20%)19,27, y en caucásicos menor que en asiáticos (6-20% vs. 36-40%)29,30.
Anticuerpos anti-N metil D aspartato
Se han descrito como un subconjunto de anticuerpos anti-DNA de doble cadena, que ejercen una reacción cruzada contra la subunidad NR2 del receptor N-metil-D-aspartato (NMDA) 31. Este receptor se encuentra ampliamente distribuido en diferentes áreas cerebrales, como la amígdala, el hipotálamo anterior y el hipocampo32. Diferentes estudios han demostrado que el efecto de estos anticuerpos sobre dicho receptor es dosis-dependiente: a bajas concentraciones lo activa, promoviendo la excitación neuronal, y a altas concentraciones promueve la sobrexcitación y consecuente apoptosis celular31,33. Interesantemente, no se ha observado pérdida neuronal cuando la BHE permanece intacta, por lo que surge la hipótesis que se necesita de otros factores que permeabilicen la BHE para que los anticuerpos anti-NMDA puedan pasar y ejercer su efecto sobre las neuronas9,14. Títulos elevados de estos anticuerpos, tanto en suero como en LCR de pacientes con LES31, se han asociado a déficit cognitivo, principalmente compromiso de la memoria a corto plazo14,22. Un artículo en específico demostró que la prevalencia de los anticuerpos anti-NMDA en pacientes con déficit cognitivo y LES era del 31%34, cercano a otro, en el que fue del 48%35. Además, se han correlacionado con trastornos del estado de ánimo, como depresión9,22. Sin embargo, su asociación con dichas manifestaciones del NPSLE sigue siendo controversial, debido a las diferencias entre los diferentes métodos clínicos y de laboratorio utilizados en los estudios35-37. Finalmente, en pacientes con LES pero sin NPSLE se ha reportado una prevalencia que oscila entre el 25 y el 50%22,33,34.
Anticuerpos antifosfolípidos
Uno de los anticuerpos más estudiados en relación con el NPSLE son los antifosfolípidos (anti-cardiolipina, anticoagulante lúpico y anti- 02 glicoproteína) 25. En los pacientes con LES que cursan concomitantemente con síndrome antifosfolípido (SAF) se ha encontrado un mayor riesgo de trombosis a causa de la presencia de los anti-02 glicoproteína, que puede afectar cualquier parte del organismo, incluyendo el SNC38. Por otro lado, en otra investigación realizada para evaluar la relación entre los anticuerpos antifosfolípidos y NPSLE se encontró que en los pacientes que cumplían con criterios de clasificación de SAF la prevalencia de NPSLE era muy alta, con títulos elevados tanto para IgG como para IgM anti-cardiolipinas39. Otro estudio reciente sustenta aún más la importancia de buscar activamente los anticuerpos antifosfolípidos en los pacientes con LES, ya que aproximadamente el 40% de ellos los tienen presentes, incluso sin manifestaciones clínicas de SAF, y se relacionan con un mayor riesgo de complicaciones neurológicas, tanto focales como difusas40. Se generan entonces dos aspectos relevantes: la presencia de dichos anticuerpos indican mayor riesgo de manifestaciones neurológicas en los pacientes con LES, y la prevalencia de estos anticuerpos en dichos pacientes es muy alta, por lo cual se vuelve muy importante determinar su positividad41.
Otros anticuerpos relacionados con el lupus eritematoso sistémico neuropsiquiátrico
Anticuerpos anti-neuronales. Estos anticuerpos han sido descritos como capaces de reaccionar contra una amplia variedad de antígenos neuronales de 22 a 130 kDa; sin embargo, no se han podido identificar claramente42. Múltiples investigaciones han demostrado títulos elevados de estos anticuerpos en suero y LCR de personas con NPSLE difuso43-46. En un estudio se encontraron títulos altos en 20 (74%) de 27 pacientes con NPSLE, comparado con positividad en solo 2 (11%) de 18 sin NPSLE. Otro estudio reportó títulos altos en 15 (50%) de 31 individuos con NPSLE, comparados con solo 4 (29%) de 14 sin NPSLE44. Otro los encontró elevados en 13 de 15 pacientes con NPSLE45, mientras que en un último estudio se encontraron elevados en 39 de 41 personas con la patología46. Se han podido observar mayores concentraciones de dichos anticuerpos en pacientes con psicosis que en los que no cursan con cuadros psicóticos; adicional-mente, los niveles disminuyen cuando mejora el episodio agudo46. Lo anterior demuestra una asociación importante de estos anticuerpos con el NPSLE; sin embargo, se necesitan estudios con un mayor número de individuos para determinar su sensibilidad y especificidad diagnóstica.
Anticuerpos anti-endoteliales. Son también un grupo heterogéneo de anticuerpos que reaccionan contra diversos antígenos en la membrana de las células endoteliales22,47. Sin embargo, actualmente se realizan investigaciones en busca de un antígeno en particular47. Los anticuerpos anti-endoteliales se han relacionado con la disrupción endotelial de la BHE en pacientes con NPSLE, mecanismo que, como ya se mencionó, es muy importante en la patogénesis de esta enfermedad47. Un estudio mostró títulos elevados de estos anticuerpos en 5 de 14 sujetos con NPSLE48, principalmente en aquellos con psicosis y depresión49.
Anticuerpos anti-acuaporina 4. Las acuaporinas (AQP) son canales transmembrana encargados del transporte de agua por medio de la formación de poros en la membrana celular. Se ubican en múltiples partes del cuerpo humano y cumplen diversas funciones fisiológicas. En los seres humanos las AQP capaces de transportar agua son las AQP0, AQP1, AQP2, AQP4, AQP5, AQP6 y AQP8. En este caso se enfatiza en la AQP450, la cual se encuentra en los astrocitos y células gliales, siendo la única presente en estas células51. En 2004 se descubrió un autoanticuerpo IgG1 específico (91%) y sensible (73%) que se unía a las AQP4 expresadas en los astrocitos y se relacionaba con la neuromielitis óptica (NMO), que hasta ese momento era considerada una variante de la esclerosis múltiple52. Los IgG-NMO o anti-AQP4 son autoanticuerpos IgGl que se unen a la AQP4 y activan el complemento, iniciándose así el depósito de inmunocomplejos que atacan la membrana celular. Se produce un infiltrado leucocitario importante que desencadena lesión en el SNC, con la consiguiente pérdida de la mielina53, llevando finalmente a la aparición de la NMO o enfermedad de Devic, una enfermedad autoinmune inflamatoria desmielinizante del SNC cuyo diagnóstico se basa en tres criterios, siendo uno de estos la presencia de una serología positiva para IgG-AQP450. En un estudio que abarcó 89 pacientes con LES, en el 2,2% de ellos se encontraban anticuerpos anti-AQP4 durante 11 años sin presentar ninguna manifestación de NMO54. Sin embargo, en el 1-2% de los pacientes con LES se produce mielitis, de los cuales entre el 21 y el 48% ocurren bajo el contexto de neuromyelitis optica spectrum disorder (NMOSD). En este estudio, además, se obtuvo una baja incidencia de NMOSD con anti-AQP4 positiva en el 0,54%54. Con lo anterior, se podría considerar que si bien los anti-AQP4 pueden estar presentes en los pacientes con LES, no es frecuente encontrarlos; por lo tanto, aunque puedan ser responsables de algunas manifestaciones neurológicas, no son los anticuerpos con mayor impacto en el NPSLE.
Otras herramientas útiles en el diagnóstico del lupus eritematoso sistèmico neuropsiquiátrico
Se han descrito en la literatura herramientas adicionales a los anticuerpos séricos para apoyar el diagnóstico de este tipo de complicaciones. Entre ellas está la aplicación de pruebas neuropsiquiátricas, en las que el hallazgo más frecuente en quienes se confirma NPSLE es el déficit de atención20. El análisis de líquido cefalorraquídeo es otra opción, a pesar de que puede encontrarse normal en algunos casos20; aun así, se han iniciado estudios de proteómica con el fin de distinguir marcadores que se expresen específicamente en el NPSLE55. Se ha planteado el uso del electroencefalograma cuantitativo, puesto que es sensible para detectar el compromiso de SNC hasta en un 80%20 y aporta medidas objetivas de la severidad del mismo56. Por su parte, la resonancia nuclear magnética destaca como la imagen de mayor utilidad para descartar diagnósticos diferenciales y para identificar anormalidades en personas con síntomas focales20.
Conclusión
A pesar de que el NPSLE sigue siendo una patología sin un estándar de oro para el diagnóstico, cabe resaltar el número de estudios que se han enfocado en el entendimiento de su patogenia y han orientado a los clínicos hacia la búsqueda de biomarcadores asociados a las manifestaciones de la enfermedad. Entre los que se han encontrado con una fuerte relación están los anticuerpos antifosfolípidos, los anti-P ribosomales y los anti-NMDA. Por esta razón es importante realizar investigaciones encaminadas a demostrar su utilidad en pacientes con NPSLE con el fin de que en un futuro puedan ser aplicados en la práctica clínica (tabla 2).











 text in
text in