Introducción
El pannus desde los inicios de la descripción clínica de la artritis reumatoide (AR) ha mostrado tener un papel fundamental en el desarrollo de la enfermedad, y ha sido mejor entendido a medida que se han desarrollado técnicas histológicas, de biología molecular o de imágenes.
Se ha considerado al pannus en la clínica como una manifestación tardía, inactiva e irreversible de la enfermedad, siendo este un término netamente histológico. Esta confusión es aún más evidente cuando se refiere a la monitoría clínica de la AR, en donde se usan expresiones como pannus, sinovitis o sinovitis crónica, sin claridad de la actividad de la enfermedad.
Para la presente revisión se realizó una búsqueda de la literatura en las bases de datos de Pubmed y Embase usando los términos pannus, rheumatoid arthritis, ultrasonography, magnetic resonance desde 1900 hasta 2015; se buscaron textos y libros no indexados respecto al tema para hacer una descripción narrativa e histórica acerca del pannus, su formación y el papel patológico en la AR.
Inicios de la descripción clínica e histológica del pannus en la artritis reumatoide
Aunque antes de 1859 se habían usado términos similares al de AR, fue Garrod (fig. 1) en el capítulo xv de su libro The nature and treatment of gout and rheumatic gout1,2 quien describió con gran precisión la enfermedad que conocemos hoy en día, la diferenció de la gota y la fiebre reumática, detalló en ilustraciones (fig. 2) las deformidades características y denotó el carácter grave de la enfermedad respecto a las otras, debido a su difícil control y a su curso clínico incapacitante.
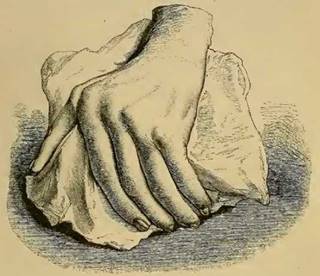
Figura 2 Ilustración del libro de Garrod que muestra una mano deformada con desviación cubital causada por la artritis reumatoide1,2.
A pesar de la exhaustiva descripción clínica de la AR, Garrod no hizo referencia al compromiso articular desde el punto de vista histopatológico. Décadas después William Ord, médico del St. Thomas's Hospital en Londres, en su escrito de 1880, publicado en el British Medical Journal, intentó aclarar algunas dudas respecto al término AR que, como anotó, era usado frecuentemente de forma inespecífica para catalogar enfermedades diferentes. Ord sugirió que este nombre se utilizara exclusivamente para el tipo de compromiso articular inflamatorio y con derrame articular que no correspondiera a la gota, la fiebre reumática (reumatismo) o la escrófula, y que se caracterizaba por atrofia ósea y del cartílago junto con hipertrofia sinovial. Esta afirmación daba indicios de que existía una relación en la fisiopatogenia de la AR4.
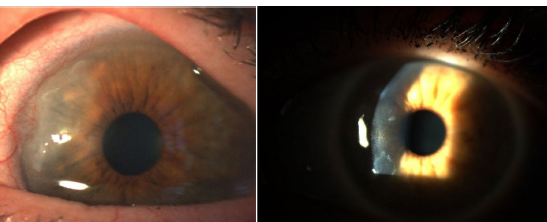
En 1905 y 1909 Nichols y Richardson, en sus trabajos publicados en Journal of Medical Research y en The Boston Medical and Surgical Journal5, respectivamente, hicieron una de las mejores descripciones clinicopatológicas de las enfermedades reumáticas y diferenciaron 2 grupos de pacientes, uno que describió las características clínicas similares a la AR y el otro las características de la osteoartritis6. A pesar de que los 2 artículos de Nichols y Richardson hacen referencia a casos de artritis deformante no escrofulosa, la minuciosa representación del cuadro clínico, acompañada de fotos e imágenes radiográficas, claramente nos narra casos de AR. Estos autores recopilaron además una serie de muestras histológicas de 75 casos clínicos, y llegaron a una conclusión importante: existen 2 patrones histológicos de compromiso articular, uno de deterioro del cartílago articular y otro de engrosamiento de la membrana sinovial; este último guarda una estricta relación con la invasión del tejido óseo y del cartílago articular causando destrucción y, ocasionalmente, neoformación ósea desorganizada. En esta misma publicación de Nichols y Richardson se describe la artritis proliferativa con formación de un tejido de granulación muy vascularizado, con un componente celular de origen mesenquimal principalmente de la membrana sinovial y que lo denominaron como tejido similar a pannus. Esta es la primera vez que se usó el término pannus articular5. Es importante anotar que el término pannus ya se usaba en ese tiempo para describir en oftalmología algunos tipos de lesiones de la córnea, definido por la American Academy of Ophtalmology como crecimiento de tejido fibroso y vascular entre el epitelio y la capa de Bowman, se ve con frecuencia en casos de edema corneal crónico, tras la inflamación de la córnea7 (fig. 3). Ambos, pannus sinovial y pannus corneal, describieron las lesiones similares a un «paño», que es la traducción literal del inglés.
Algunas de las imágenes y descripciones del estudio de Nichols y Richardson de 19095 se muestran en las figuras 4-6.
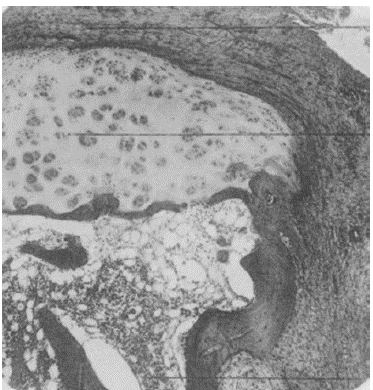
Figura 4 Fotografía de microscopia de luz de la falange distai de un paciente que padecía de la enfermedad denominada, en esa época, como artritis proliferativa tipo extremo. Muestra la formación de tejido grueso de granulación que invade y destruye el cartílago articular5,6.
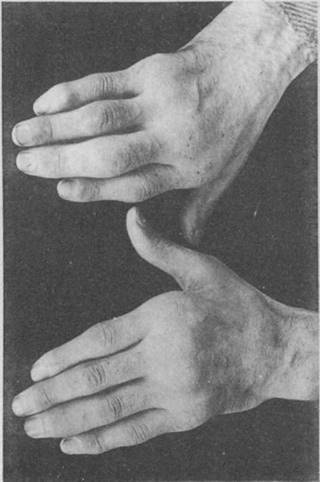
Figura 5 Fotografía de las manos de un paciente de 35 años con antecedente de uretritis gonocócica, que desarrolló años más tarde y de forma progresiva poliartritis de pequeñas y grandes articulaciones. Clasificado como artritis proliferativa5,6.
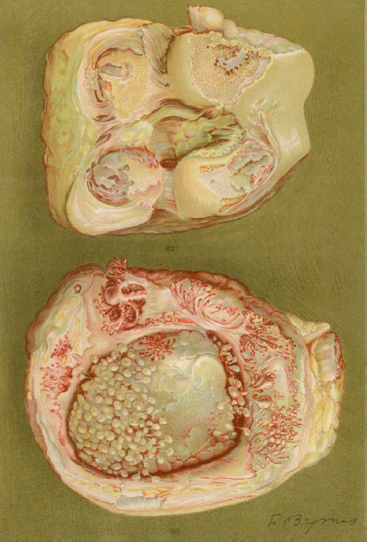
Figura 6 Dibujo de la autopsia de una mujer de 40 años con clínica de poliartritis de grandes y pequeñas articulaciones que produjeron gran discapacidad y anquilosis. Se evidencia la pérdida del cartílago articular y de zonas de formación ósea que causan la anquilosis de la rodilla5,6.
En 1959 Kulka publicó una revisión de la patogénesis de la AR9 teniendo como referencia el trabajo de Nichols y Richardson5, y clasificó las lesiones histológicas de la AR en 3 tipos: el primero lo clasificó como cambios inflamatorios de la membrana sinovial, el segundo como la degeneración y la necrosis de tejido conectivo y el tercero como infiltración inflamatoria vascular de arteriolas y vénulas. El primer tipo de lesión corresponde al pannus descrito en 1909 por Nichols y Richardson, que consiste en un engrosamiento sinovial que causa la resorción del cartílago. Kulka encontró mediante microscopia de luz, por una parte, que la lesión destructiva del cartílago se caracterizaba por el crecimiento del tejido sinovial inflamado crónicamente o pannus y, por otra parte, que el tejido de granulación que proliferaba desde los espacios medulares subcondrales y que se extendía a través dela placa subcondral para unirse al pannus y rodearlo en un movimiento como en pinza puede progresar hasta aislar fragmentos de cartílago marginal (fig. 7)9.
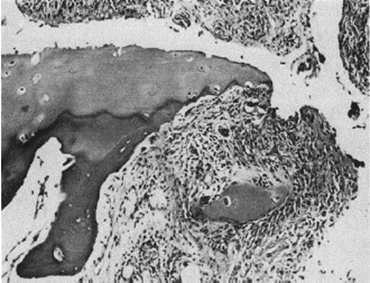
Figura 7 Histología con microscopia de luz. Lesión destructiva en el margen de la articulación interfalángica. Se ve el tejido sinovial o pannus junto con el tejido de granulación, en lo que se denominó movimiento de pinza, y que aísla un fragmento de cartílago, señalado como «C»9.
Kulka en su trabajo definió los criterios histológicos para diagnosticar AR, si se cumplían con al menos 3 de las 5 características distintivas en ausencia de otro diagnóstico probable:
Hipertrofia vellosa.
Proliferación de células sinoviales superficiales generalmente en empalizada.
Infiltración marcada de células inflamatorias (linfocitos o células plasmáticas) con tendencia a formar nódulos linfoides.
Depósito compacto de fibrina.
Focos de células necróticas.
Aunque subrayó que ninguna de estas era específica, la combinación de 3 o más en ausencia de otras enfermedades era de considerable valor diagnóstico para AR (fig. 8).
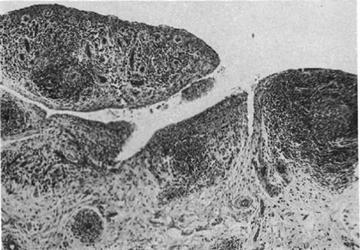
Figura 8 Histología con microscopía de luz. Clásica sinovitis de rodilla en AR que muestra hipertrofia vellosa, infiltración vascular y nódulos linfoides con un centro germinal en el extremo derecho9.
Microscopia electrónica y modelo tumoral del pannus
En 1975 Kobayashi y Ziff10 realizaron estudios con microscopia electrónica del pannus y su unión con el cartílago, con el fin de ayudar a aclarar el proceso del daño articular. Aunque Ziff ya había descrito en 196011 alteraciones de la membrana sino-vial, este autor, con Kobayashi, describieron que en el pannus podían originarse proteasas lisosomales que degradaban las mucoproteínas del cartílago y que podían ser secretadas en lugares específicos, como en los márgenes articulares donde ocurre la producción inicial del pannus, es decir, en la unión de la membrana sinovial con el cartílago articular12.
Estos investigadores analizaron muestras de la unión sinovial-cartílago de 8 pacientes con diagnóstico de AR, encontrando 3 tipos de lesiones: en la primera lesión, una infiltración celular mononuclear de los vasos que penetran el cartílago formando, ocasionalmente, dentro de la matriz del cartílago, agregados o nidos celulares (además de células plasmáticas, linfocitos y granulocitos). En estos nidos encontraron, además, disolución del colágeno circundante, lo que llevó a la teoría de una secreción de enzimas proteolíticas (fig. 9). En el segundo tipo de lesión, una invasión directa al cartílago de células monocíticas y fibroblastos no bien diferenciados que se pueden manifestar como fagocíticas o fibroblásticas, que presentan un contenido granular amorfo citoplasmático con prolongaciones celulares que degradan la matriz cartilaginosa de colágeno que puede verse entre las extensiones celulares (fig. 10). En el tercer tipo de lesión el cubrimiento del cartílago por una capa gruesa de tejido fibroso y vascularizado que interviene con la vascularización normal del cartílago articular.
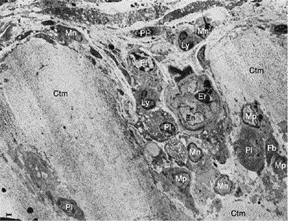
Figura 9 Imágenes por microscopía electrónica del pannus. Se muestra la invasión de un vaso (En: endotelio; Er: eritrocito) en la unión del pannus y el cartílago (Ctm) por linfocitos (Ly), células plasmáticas (Pl), monocitos (Mn), macrófagos (Mp) y fribroblastos (Fb)10.

Figura 10 Microscopia electrónica que muestra fibroblastos con lisosomas (Lys) inmersos y extensiones citoplasmáticas múltiples invadiendo la matriz del cartílago (Ctm)10.
En las 2 décadas siguientes el papel protagónico del pannus en la fisiopatologia de la enfermedad articular de la AR no se limitó únicamente a la descripción de la destrucción del cartílago. Edward Harris, en 199013, publicó una de las revisiones más completas de la fisiopatologia de la AR, clasificándola en 5 tipos según características inmunológicas y del daño articular. Describió que en los estadios iniciales (estadio 2) existía un papel de la sinovial no engrosada y la neovascularización mediada por citoquinas de los macrófagos14 con acumulación de linfocitos perivasculares15. Como lo había demostrado por microscopia electrónica Kobayashi10, los linfocitos, en su mayoría T CD4+16 con escasos T reguladores17) activan los linfocitos B locales madurando a células plasmáticas productoras de anticuerpos en el tejido sinovial18, lo que involucra este tejido como parte de la iniciación y la progresión de la enfermedad. Harris, además, describió que en estados más avanzados de la enfermedad (estadio 4) se inicia la proliferación extravagante de la sinovial llegando a pesar hasta 100 veces más de lo normal, lo que interpretó como un comportamiento similar al de un tumor con gran actividad celular de los sinoviocitos, como lo confirmó en medios de cultivo enriquecido que incluso crecían aislada y autónomamente19, lo que llevó a plantearse por primera vez el modelo de oncogenes como sucede en el cáncer.
Componentes celulares del pannus
Aunque numerosos investigadores continuaron estudiando el componente del tejido engrosado o pannus, no se llegó a un acuerdo con relación a su patogenia. En 1983 Burmester et al20. estudiaron células no linfocíticas del pannus mediante anticuerpos monoclonales dirigidos contra antígenos de macrófagos y fibroblastos. Encontraron 3 tipos de células de línea sinovial; la primera pertenecía en su mayoría (el 40% del total) a células monocíticas o macrófagos con capacidad fagocítica, con receptores Fc y expresión de HLA DR o del tipo ii. El segundo tipo celular eran también similares a monocitos, pero no fagocíticos, con expresión del HLA-DR sin que se encontraran otros antígenos monocíticos. La última línea de células que se encontró fue positiva para marcadores de fibroblastos, pero sin expresión del HLA-DR u otros antígenos de monocitos (entre el 20% y el 40% del total), lo cual fue confirmado en 1987 con estudios de células clonadas y cultivos celulares21. La importancia de estas células sinoviales se basó en la activación, entre otros, del protooncogén c-jun como respuesta al estímulo de la IL-122, y que es similar a las células neoplásicas que incrementan la expresión de colagenasa con capacidad para destruir, junto con la estromelisina y otras metaloproteinasas, la matriz del cartílago y del hueso23,24, hallazgo que ya había sido hecho por Ziff desde 196011.
Zvaifler y Firestein25 en 1994 consideraron que el origen del pannus aún no estaba claro, y que la evidencia estaba dividida entre un tejido sinovial crónicamente inflamado y un tejido conectivo especializado altamente vascularizado, que se iniciaba en la interface sinovial-hueso y que históricamente se había definido como el sitio del inicio del proceso destructivo5,10,26-28. En esta revisión plantearon 2 posibilidades acerca de la procedencia de estos sinoviocitos, que son similares a los fibroblastos y que llamaron pannocitos20. Una primera hipótesis fue que las células inmaduras mesenquimales eran las primeras en invadir los vasos que penetran el cartílago y que pudiesen ser reemplazadas o que evolucionarían hacia fibroblastos27, proceso mediado por factores inflamatorios (factor X) no conocidos e independientes de factores inmunológicos derivados de células T, como fue demostrado también en modelos animales29,30. La segunda hipótesis era dependiente de las citoquinas de los linfocitos, menos sustentada hasta ese momento y basada en estudios de inicios de los 90 del siglo pasado31-33, que describía la disminución de la expresión genómica de los linfocitos y sus productos en los tejidos y el líquido sinovial (fig. 11).
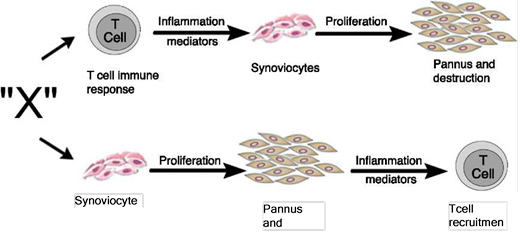
Figura 11 Vías alternativas por las que el factor desconocido «X» en AR podría inducir la formación del pannus. Puede iniciar por la vía dependiente de las células T o por la vía de los sinoviocitos25.
En la revisión de Zvaifler y Firestein25 se intenta entender no solo el origen, sino la perpetuación del pannus fundamentándose en 2 posibilidades. Una posibilidad es la que contempla (como se mencionó desde 1989) un modelo tumoral en el que las células sinoviales son transformadas por una señal que las hace proliferar e inducir la expresión de oncogenes y la producción de enzimas que degradan la matriz o proteínas de adhesión34,35. Estas señales pueden proceder de moléculas solubles como citoquinas o de agentes etiológicos que no se especifican. Desde este punto de vista los tejidos como el cartílago o el hueso no hacen parte de su desarrollo, sino que son afectados por el pannus. La segunda posibilidad se soporta en que compuestos procedentes de los condrocitos o complejos inmunes inmersos en el cartílago son los encargados de activar los sinoviocitos para que invadan el tejido y abandonen su lugar natural. Sin embargo, no se ha establecido el proceso por el cual los sinoviocitos similares a fibroblastos, carentes de receptores Fc, se vean afectados por estos complejos inmunes36, siendo probable que las células monocíticas-macrófagos sean intermediarios. Una posible explicación de esto último es la unión de proteínas del complemento y complejos inmunes a la vitronectina y sus receptores, lo que afecta la diferenciación, migración y proliferación de los fibroblastos y que posteriormente se ve amplificado por el contacto de estas células con el colágeno, la fibronectina y otras metaloproteinasas37,38 mediante la expresión de receptores como el VCAM-1, que hasta ese momento era la única molécula de adhesión sobreexpresada conocida en los sinoviocitos similares a fibroblastos39. En este segundo escenario el cartílago no solo sería el tejido afectado por el pannus, sino el inductor y perpetuador de esta respuesta. A pesar de lo anterior, sigue siendo claro que la conservación del pannus es dependiente de las citoquinas que estimulan el crecimiento celular y de la producción de enzimas sintetizadas por los sinoviocitos derivados de monocitos40 y de los sinoviocitos similares a los fibroblastos que in vitro se demostró que las sintetizan41, bajo la regulación e intermediación de linfocitos T, monocitos y sus productos que son la mayoría celular del pannus42.
Los trabajos de Burmester en 198320 fueron fundamentales para la continuidad del estudio del componente celular del pannus. El grupo de Xue en 1997 estudió especímenes de artroplastia que contenían pannus de pacientes con AR y observó unas células denominadas PSC, que fueron investigadas fenotípicamente por microscopia e inmunohistoquímica con una expresión proteica y genómica específica43. Encontraron en estas células positividad para filamentos de vimentina, marcadores de inmunofluorescencia (fig. 12) y similitud morfológica en microscopia con los fibroblastos. Sin embargo, el marcador de safranina O que reacciona con proteoglicanos (fig. 13), así como la expresión de mARN del colágeno tipo ii que se usa para identificar células similares a los condrocitos, fueron también positivas, razón por la que se concluye su carácter mixto entre fibroblasto y condrocito.
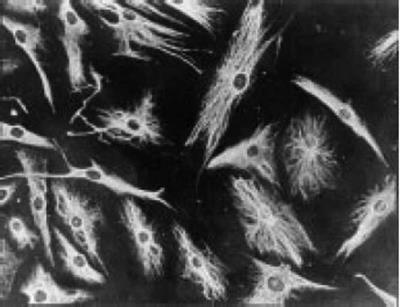
Figura 12 Micrografía de inmunofluorescencia que demuestra la positividad de las células PSC para anticuerpos antivimentina marcados con isotiocianato de fluoresceína. Similar a lo que se encuentra en los fibroblastos43.
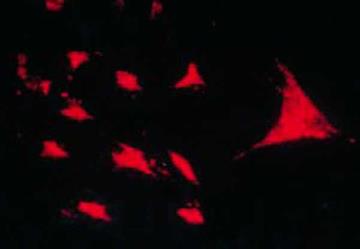
Figura 13 Ensayo de transcriptasa reversa in situ para demostrar la expresión de ARNm de colágeno tipo ii en el cultivo de PSC, lo que les confiere características de condrocito a estas células43.
El estudio de expresión genómica evidenció, además, la alta actividad de protooncogenes para c-myc, c-jun y c-fos que permite la alta producción de enzimas como catepsina B y L y algo de colagenasa.
En años posteriores salieron a la luz evidencias de las características del tejido en enfermedad articular temprana y la expresión aumentada del gen p5344, mutaciones que se observaban más en estados avanzados45. En el año 2003 Smeets et al. observaron diferencias en las características celulares, expresión de citoquinas, factores angiogénicos y metaloproteinasas del pannus, obtenidos de especímenes de pacientes con enfermedad tardía, que consistía en pacientes que eran llevados a reemplazo articular sin signos de actividad clínica de artritis, comparados con muestras de pacientes que fueron llevados a artroscopia y que se consideraron como pacientes en estadios tempranos de la enfermedad porque conservaban aún actividad clínica de la artritis46. Las diferencias entre ambos grupos fue el mayor número de macrófagos y linfocitos T derivados de las muestras de artroscopia o de enfermedad temprana, así como de mayor expresión de TNF-a, IL-6, metaloproteinasas (MMP-1,MMP-3, MMP-13) y del factor de angiogénesis (VEGF).
Frecuentemente se considera al pannus como un tejido fibroso sin mayor actividad biológica y como un remanente del daño articular que pareciese ser irreversible. Sin embargo, el pannus se comporta como un medio que produce alta cantidad de enzimas proteolíticas con un papel patológico central, como las MMP 1, 3, 13 y 1447. Especialmente la MMP 3 o estromelisina (ya mencionada)23,24,48, como se demostró en el año 200549, su alta producción mediante detección del ARNm en la unión sinoviocartilaginosa, así como de su dependencia de la IL-1b para la estimulación de su síntesis y que se diferencia de la MMP-1 o colagenasa tipo 1 que se presenta en menor cantidad y que es estimulada por el TNF-a.
Pannus y factor nuclear kappa B
El factor de transcripción factor nuclear kappa B (NF-kB) es uno de los reguladores más importantes de la transcripción genómica de citoquinas, quimoquinas y moléculas de adhesión, desempeña un papel en la degradación del cartílago y hueso articular50, está aumentado tanto en tejido sinovial de pacientes como en modelos animales51-53 con AR, principalmente en la unión pannus-cartílago53 donde existe un mayor número de células, produciendo el factor, que en lugares de la sinovial fuera de esta unión. La importancia del factor NF-kB con relación al daño articular no solo se ve reflejada en el aumento de citoquinas, sino en la osteoclastogénesis, proceso clave en la erosión ósea54,55 que depende de la línea mieloide y de la unión RANK-RANKL56-58, permitiendo la activación, migración y sobrevida del osteoclasto59,60. El RANKL deriva de linfocitos T, sinoviocitos similares a fibroblastos y células fuera de la unión del pannus-hueso50,61-63. Pettit et al., en 200664, estudiaron el patrón de expresión del RANKL, NF-kB y la osteoprotegerina (inhibidor natural del RANKL que bloquea su unión con el receptor y, por tanto, obstaculiza la osteoclastogénesis) en muestras de pannus de pacientes con AR, específicamente de la unión pannus-hueso, donde nunca antes se había estudiado. El resultado fue que tanto el RANKL como la osteoprotegerina se expresan en microambientes donde ocurre la unión del pannus con el hueso o el cartílago, y se produce la erosión o daño tisular, siempre en proporciones que favorecen la maduración del osteoclasto y su activación, dato corroborado en el año 2008 que mostró este desequilibrio molecular65.
Imágenes diagnósticas y pannus
Cooperberg, en 1978, fue el primero en demostrar la sinovitis mediante ecografía, observando un engrosamiento de la membrana sinovial de la rodilla en una imagen de escala de grises66, y aún más detallado en los trabajos de De Flaviis de 1988 al implementar un protocolo de ecografía en la mano de pacientes con AR67. Pasaron 6 años hasta que Newman usara el método de Doppler sobre tendones y bursas68, y 2 años después lo usara en el engrosamiento sinovial de rodillas de pacientes con AR69. Matias Hau, en 1999, usando ecografía de alta resolución, empleó el modo Doppler sobre el pannus de manos en pacientes con AR por primera vez, demostrando una hipervascularización70 en articulaciones de las rodillas, confirmándose el incremento en la vascularización, como fue encontrada en los estudios realizados un siglo atrás5,12,14,15) (fig. 14).
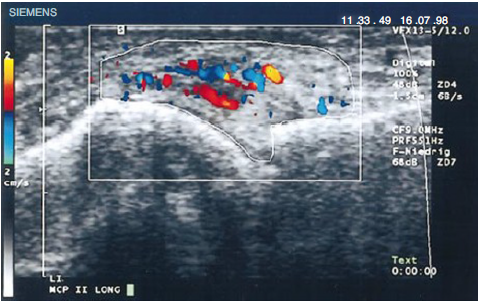
Figura 14 Ecografía longitudinal de articulación metacarpofalángica donde se muestran las primeras imágenes de Dopplercon aumento de la vascularización del pannus en un paciente con AR70.
Habiendo sido demostrado cambios del tejido sinovial por ecografía, lo siguiente era determinar si este pannus, como se ve clínicamente, presenta también involución. El primero en realizar este tipo de estudio con ecografía fue Newman en 1996, cuando usó Doppler en AR69 y notó cambios en el grado de vascularización después del tratamiento con esteroides intraarticulares. Estos mismos resultados fueron evidentes en el trabajo de Stone en 200171, quien comparó las imágenes de articulaciones metacarpofalángicas antes y después de terapia con metilprednisolona endovenosa o prednisolona oral. Con el uso de inhibidores del TNF-a Hau et al. publicaron en el año 2002 un trabajo que mostró los cambios en la vascularización del pannus72 en pacientes tratados con etanercept, así como en otros estudios posteriores73-76. Taylor demostró el cambio de la hipervascularización con infliximab77 y Naredo lo hizo en el año 200878.
El uso de resonancia magnética, que se inició en 1988 con el trabajo de Gilkeson, quien encontró que era un mejor método para detectar erosiones en manos de pacientes con AR79 y Kusunoglu en 1990 demostró que era útil para diferenciar engrosamiento sinovial de derrame articular80. La visualización del pannus por este método se inició en 1994 cuando Ostergaard valoró, por primera vez, el crecimiento sinovial y su relación con la actividad de la enfermedad81 confirmado por un trabajo más extenso de Sugimoto en 199882, y finalmente en 2003 el grupo de OMERACT definió sinovitis en resonancia nuclear magnética como un aumento del grosor sinovial luego de la inyección de contraste, lo que en definitiva es la evidencia del pannus83.
Conclusiones
La historia ha permitido entender el papel fundamental del pannus en la destrucción articular, semejado a veces con una lesión tumoral por su rápido y abundante crecimiento, favoreciendo la producción de anticuerpos que permite la perpetuación del proceso autoinmune, lo que contradice la idea de que el pannus es un tejido de granulación escasamente activo, limitado a ser cicatricial o residual. Estas características intervienen en los procesos de desarrollo, progresión y destrucción articular del hueso y cartílago, evidente hace más de 100 años, y comprobado con técnicas de microscopía y biología molecular. Por tanto, no es correcta la idea de que el pannus hace referencia a algo definitivo o irreversible, puesto que no solo es parte activa de la enfermedad, sino que su involución es posible en respuesta al tratamiento. Se debería también evitar el mal uso del término, y así tener menos confusión en la valoración clínica de la enfermedad. Estos cambios se han atribuido históricamente a lo denominado como sinovitis, que no es más que la inflamación del tejido sinovial evaluada clínicamente. El término sinovitis no permite diferenciarlo del pannus, ya que se refiere a un hallazgo histológico, razón por la que el pannus no se contempla dentro de la valoración clínica inicial o de seguimiento en los pacientes con AR por las diferentes sociedades científicas.
La continuación del estudio del pannus como componente indispensable en la patogenia de la AR permitiría entender mejor la enfermedad desde su inicio y determinar nuevos caminos para su evaluación clínica o por imágenes, así como encontrar tratamientos más dirigidos que detengan la destrucción articular.











 text in
text in