Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista Colombiana de Reumatología
Print version ISSN 0121-8123
Rev.Colomb.Reumatol. vol.27 supl.1 Bogotá Dec. 2020 Epub Aug 21, 2021
https://doi.org/10.1016/j.rcreue.2019.12.003
Artículos de Revisión
Esclerosis sistémica y participación gastrointestinal
aDepartment of Rheumatology, Hospital Universitari Mútua de Terrassa, Terrassa. Spain
bAutoimmune Diseases Unit, Department of Rheumatology, Hospital Universitari de la Santa Creu i Sant Pau, Barcelona. Spain
La esclerosis sistémica (ES) es una enfermedad autoinmune sistémica en la que las manifestaciones gastrointestinales son una complicación frecuente. El compromiso gastrointestinal está presente hasta en 90% de los pacientes. Las áreas más afectadas son el esófago y el tracto anorrectal. El reflujo, la pirosis y la dismotilidad son las principales causas de malestar gastrointestinal. La función anorrectal alterada puede presentarse temprano en el curso de la ES y es un factor importante en el desarrollo de incontinencia fecal. Las recomendaciones actuales para tratar los trastornos gastrointestinales en la ES incluyen el uso de inhibidores de la bomba de protones, procinéticos y de antibióticos en forma rotativa. Esta revisión discute los mecanismos fisiopatológicos propuestos, la presentación clínica, las diferentes técnicas de diagnóstico y el manejo actual del compromiso de cada sección del tracto gastrointestinal en la ES.
Palabras clave: Esclerosis sistémica; Dismotilidad; Seudoobstrucción intestinal crónica; Disfagia; Incontinencia fecal; Enfermedad por reflujo gastroesofágico; Gastroparesia; Sobrecrecimiento bacteriano en el intestino delgado
Systemic sclerosis (SSc) is a systemic autoimmune disease in which gastrointestinal manifestations are a frequent complication. Gastrointestinal involvement is present in up to 90 % of patients. The most affected areas are the esophagus and the anorectal tract. Reflux, heartburn and dysmotility are the leading causes of gastrointestinal discomfort. Disordered anorectal function can occur early in the course of SSc and is an important factor in the development of fecal incontinence. Current recommendations to treat gastrointestinal disorders in SSc include the use of proton pump inhibitors, prokinetics and rotating antibiotics. This review discusses the proposed pathophysiological mechanisms, the clinical presentation, the different diagnostic techniques and the current management of the involvement of each section of the gastrointestinal tract in SSc.
Keywords: Systemic sclerosis; Dysmotility; Chronic intestinal; pseudo-obstruction; Dysphagia; Fecal incontinence; Gastroesophageal reflux disease; Gastroparesis; Small intestinal bacterial; overgrowth
Introducción
El compromiso del tracto gastrointestinal (TGI) es común en los pacientes con Esclerosis Sistémica (ES), afectando hasta al 90% de los pacientes1-4, y siendo una causa importante de morbimortalidad por la enfermdad5.
Al igual que otras complicaciones de la enfermedad, en la ES se presenta una disfunción de la microcirculación, del sistema inmune y de los mecanismos de control de la fibrosis en el TGI. El esófago es el área más afectada del TGI en la ES y la disfagia y la enfermedad por reflujo gastroesofágico son las principales manifestaciones6,7. El compromiso gástrico es menos frecuente, aunque puede ser responsable del retardo en el vaciamiento gástrico y de la ectasia vascular antral gástrica8-11. El compromiso intestinal, aunque por lo general es asintomático, puede poner en peligro la vida. El intestino delgado puede presentar estasis intestinal y estar propenso a un sobrecrecimiento bacteriano que causa diarrea severa, dolor abdominal y pérdida de peso. El compromiso del colon puede causar un estreñimiento severo12,13. El área anorrectal puede verse afectada en más del 50% de los pacientes, causando un gran impacto en la calidad de vida14. La presencia de colangitis biliar primaria (CBP) es relativamente frecuente en los pacientes con ES (7-17%), especialmente en la esclerosis sistémica cutánea limitada (EScl)15,16.
El instrumento del Consorcio de Ensayos Clínicos sobre Esclerodermia de la Universidad de California en Los Ángeles relativo al Tracto Gastrointestinal 2.0 (UCLA GIT 2.0) se puede utilizar para evaluar la presencia y la severidad de los síntomas gastrointestinales en pacientes con ES, así como su impacto en la calidad de vida. Este instrumento ha sido validado y los propios pacientes reportan sus síntomas a través de 34 preguntas agrupadas en siete subgrupos: reflujo, distensión abdominal, diarrea, manchado de la ropa con materia fecal, estreñimiento, bienestar emocional y funcionamiento social, calificados de acuerdo con la severidad17.
No existen ensayos clínicos aleatorizados específicos para evaluar las diferentes terapias para el manejo de las complicaciones del TGI en los pacientes con ES, y la mayoría de las opciones de tratamiento se basan en la evidencia en otras enfermedades o en recomendaciones de expertos.
En este manuscrito revisamos el conocimiento reciente de la patogénesis, las manifestaciones clínicas, los exámenes y los tratamientos que se utilizan para manejar las diferentes manifestaciones gastrointestinales en la ES.
Métodos
Métodos de búsqueda de literatura
Se llevó a cabo una investigación bibliográfica hasta junio de 2019 en las bases de datos MEDLINE, EMBASE y Cochrane Library para encontrar estudios que cumplieran los criterios de inclusión.
La investigación en Medline se hizo a través de Pub-med utilizando los términos MeSH: systemic, orofacial sclerosis, microstomia, xerostomia, periodontal disease, dysmotility, gastroesophageal reflux disease, esophageal dysphagia, Barret esophagus, esophageal adenocarcinoma, gastroparesis, watermelon stomach, intestinal dysmotility, constipation, diarrhea, intestinal bacterial overgrowth, intestinal pseudo-obstruction, intestinal cystoid pneu-matosis, diverticulosis, primary biliary cholangitis, autoimmune hepatitis, pancreatic insufficiency, fecal incontinence, rectal prolapse.
Solamente se incluyeron artículos publicados en inglés.
Selección de artículos y extracción de la información
Los artículos seleccionados se guardaron en una base de datos; inicialmente, se tuvieron en cuenta aquellos artículos que tenían las palabras clave incluidas en el resumen o en el título. Posteriormente, se descartaron los artículos que no cumplían con los criterios de inclusión, y se celebró un comité entre los autores para unificar la base de datos y escoger aquellos artículos que eran relevantes para esta revisión.
Criterios de inclusión
Para la selección de los estudios se tuvo en cuenta que estos cumplieran los siguientes criterios de inclusión en términos del tipo de estudio, población e intervención.
Tipos de estudio: para la inclusión se consideraron los metaanálisis, revisiones sistemáticas (RS) de ensayos clínicos aleatorizados (ECA), ECA, estudios de cohorte prospectivos y retrospectivos, así como protocolos institucionales. No se utilizó como criterio que los estudios tuvieran un tiempo mínimo de seguimiento o un tamaño de muestra mínimo.
Tipo de población: pacientes mayores de 18 años con ES y compromiso gastrointestinal.
Intervención: estudios que describen la afección gastrointestinal, explicando la fisiopatología, la clínica, las técnicas de diagnóstico, el pronóstico, el tratamiento y las complicaciones.
Criterios de exclusión
Artículos sin acceso al texto completo.
Artículos duplicados
Estudios que no fueron realizados en humanos
Al final de la investigación, un total de 2101 artículos fueron analizados por los investigadores. Después de excluir los artículos duplicados, los artículos sin acceso al texto completo o los estudios no realizados en humanos, obtuvimos un total de 148 artículos. La tabla 1 resume las complicaciones del TGI en la ES y el enfoque que encontramos en la literatura.
Discusión
Cavidad oral
La cavidad oral se ve afectada en 10-70% de los pacientes con ES18. Las complicaciones más frecuentes son externas a la cavidad oral, tales como microstomía y microquilia, ambas presentes en 50-80% de los csos19-21.
La microstomía es causada principalmente por fibrosis de los tejidos periorales y produce una reducción de la apertura bucal22. Ocasionalmente puede afectar el habla o la masticación y predisponer a enfermedades periodontales21. Cuando se observa en las etapas tempranas, se recomiendan los ejercicios de estiramiento de la boca, masajes, y la técnica de Kabat (ejercicios de estimulación muscular facial)23 de manera regular para mantener el beneficio24.
La xerostomía se presenta en 30-68% de los pacientes19,20 y la enfermedad superpuesta con el síndrome de Sjögren puede aparecer hasta en un 23% de los casos25. La sequedad de la boca favorece el desarrollo de caries dental, alteraciones del gusto, atrofia e infecciones de la boca21,26. Para reducir los síntomas se recomienda la ingesta de pequenas cantidades de agua y el uso de enjuagues bucales con saliva artificial20,21. En la microstomía de la enfermedad periodontal están implicados el aumento de la distancia interincisal27,28 y una higiene oral defectuosa. Es recomendable realizar exámenes periódicos por odontólogos con experiencia en ES28. Otras complicaciones menos frecuentes son el compromiso del hueso mandibular o la presencia de artropatía temporomandibular29,30. Se ha encontrado un mayor riesgo de carcinoma escamocelular de la lengua en los pacientes con ES31.
Esófago
El compromiso esofágico es la afectación más frecuente del TGI, presente hasta en 90% de los casos6,7,32,33, y ha sido descrito más comúnmente en la ESlc4. Los mecanismos patológicos propuestos son: dano vascular con hipoperfusión e isquemia22, daño neurológico causado por los cambios microvasculares de los vasa vasorum y compromiso nervioso debido al infiltrado inflamatorio y/o fibrótico24,34. Estos cambios causan disfunción de la motilidad esofágica, principalmente en la parte inferior35. También se ha descrito un componente neurológico autoinmune en las manifestaciones gastrointestinales27,28, y se ha postulado la participación de los anticuerpos antimuscarínicos contra el receptor 3 de acetilcolina36-38 mediante la inhibición de la contractilidad de los músculos lisos39. Se ha encontrado una disminución de la amplitud de la contractilidad y una baja presión de reposo del esfínter esofágico inferior40,41, que se traducen en síntomas como disfagia, tos, pirosis, regurgitación o dispepsia39,42.
La disfagia esofágica está presente en 4,3% de los pacientes con ES43, afectando la masticación. Si existe una disfagia exclusiva para sólidos, es aconsejable descartar una causa obstructiva como una estenosis esofágica44. La presencia de estenosis esofágica, candidiasis esofágica, tratamiento inmunosupresor y supresión ácida crónica debida a inhibidores de la bomba de protones (IBP) se ha asociado con la presencia de disfagia en la ES45.
La enfermedad por reflujo gastroesofágico (ERGE) se presenta hasta en 70% de los pacientes1,46-51 y es una manifestación clínica frecuente a nivel esofágico52,53. Debido a la disminución de la presión en el esfínter esofágico inferior (EEI), el número de episodios de reflujo aumenta y junto con la menor capacidad de motilidad del esófago, el ácido gástrico permanece más tiempo en el esófago y puede pasar a la tráquea y a la faringe54. La neutralización del ácido gástrico por la saliva es reducida e incompleta, empeorada por el síndrome seco orofaringeo55.
Las complicaciones que han sido asociadas con la ERGE son: estenosis esofágica (30%), esófago de Barrett (37%), tos, broncoespasmo o laringoespasmo48,56-60.
Además, el compromiso esofágico puede contribuir al desarrollo de enfermedad pulmonar intersticial (EPI)61,62. Una revisión retrospectiva con más de 400 pacientes con ES mostró que un mayor diámetro esofágico se correlacionó con reducciones de los valores funcionales pulmonares44,62. Otro estudio identificó niveles similares de pepsina en los fluidos bronquiales y gástricos en los pacientes con ES63. Se ha sugerido la monitorización del pH como un factor pronóstico en los pacientes con ES con EPI64.
Es recomendable hacer una evaluación esofágica en todos los pacientes con ES, siendo la manometría, la monitorización del pH y la endoscopia los procedimientos más útiles42. La manometría esofágica es esencial para el diagnóstico de dismotilidad esofágica65, especialmente en las etapas iniciales. La manometría de alta resolución permite hacer una mejor evaluación de todo el esófago66-69, sin embargo, esta técnica aún no está validada65; la monitorización del pH esofágico, con o sin impedancia, permite detectar el reflujo gastroesofágico. Se ha observado una monitorización anormal del pH hasta en 85% de los pacientes con ES46,70,71, pero en la práctica clínica solo se utiliza en los pacientes con síntomas de reflujo resistente42. La endoscopia es la mejor herramienta para evaluar la disfagia o identificar la presencia de ERGE y sus complicaciones. El esófago de Barrett es causado por ERGE crónica, y requiere controles endoscópicos periódicos debido a la presencia de una lesión de la mucosa esofágica normal y su reemplazo por mucosa metaplásica29. La presencia de mucosa metaplásica es un factor de riesgo relevante para adenocarcinoma de esófago.
Otras herramientas de diagnóstico menos útiles son la gammagrafía, las imágenes por resonancia magnética; el esofagograma con bario o la cápsula endoscópica65,72.
Las primeras medidas para el tratamiento del compromiso esofágico en la ES se basan en recomendaciones higienico-dietéticas como el consumo de alimentos blandos en pequenas cantidades; la ingesta de abundantes líquidos; evitar ciertas sustancias como alcohol, cafeína, especias, entre otras; levantar la cabecera de la cama o comer aproximadamente 2-3 horas antes de acostarse32,73. No existen ensayos clínicos aleatorizados que hayan encontrado evidencia de las diferentes opciones farmacológicas para tratar las complicaciones esofágicas en los pacientes con ES. Para tratar la ERGE se recomienda el uso de IBP74 y estos pueden ser útiles para la prevención de úlceras y estenosis esofágica44,75. Se ha visto una disminución del adenocarcinoma de esófago en los pacientes sometidos a tratamiento con IBP76. Los antagonistas de los receptores H2 (anti-H2) estarían indicados en los casos refractarios a los IBP77.
El uso de procinéticos puede aliviar diferentes trastornos de la motilidad (disfagia, ERGE, distensión abdominal, seudoobstrucción, saciedad temprana)74. La cisaprida (agonista de los receptores 5-HT4 y antagonista de los receptores 5-HT3) puede mejorar la motilidad gástrica y esofágica, pero también causa una disminución del tono del esfínter esofágico inferior y de la motilidad del intestino delgado78-81. Se ha demostrado que la domperidona (antagonista de los receptores D2) en asociación con los IBP es útil para disminuir la severidad de los síntomas de motilidad82. La metoclopramida ha mostrado un aumento del tono del esfínter esofágico inferior en pacientes con ES y también mejora la motilidad83-85. La prucaloprida (agonista 5-HT4) demostró una mejoría de la motilidad en una serie de pacientes con ES86. Otras alternativas son la buspirona y el baclofeno que pueden mejorar la ERGE al aumentar el tono del esfínter inferior e intensificar las contracciones esofágicas72. De acuerdo con las últimas recomendaciones del Grupo Europeo de Ensayos e Investigación sobre Esclerodermia (EUSTAR) se sugiere el uso de procinéticos para los trastornos de motilidad sintomáticos en los pacientes con ES74. Respecto al uso de terapias inmunomoduladoras, hay un estudio observacional con el uso de inmunoglobulinas intravenosas en pacientes con ES y enfermedad del TGI, evidenciando una disminución de la frecuencia y la intensidad de los sintomas de la ERGE87.
Algunos pacientes con ERGE refractaria al tratamiento médico requieren técnicas invasivas tales como esofagec-tomía, fundoplicatura, o derivación en Y de Roux29. Los pacientes con estenosis esofágica pueden beneficiarse de las dilataciones endoscópicas29.
Estómago
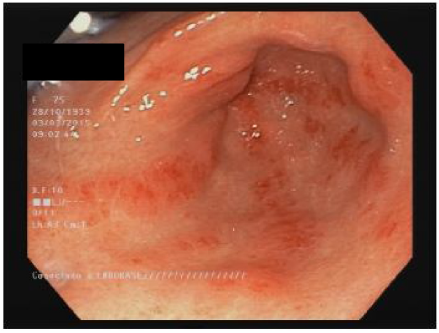
Alrededor del 50% de los pacientes con ES tienen compromiso estomacal13,60. Las manifestaciones más frecuentes son el retardo en el vaciamiento gástrico y la ectasia vascular antral gástrica (EVAG o estómago en sandía; fig. 1)8,10,88. Aunque se desconoce el mecanismo específico de la enfermedad gástrica, se han propuesto como posibles causas el dano microvascular, un compromiso del sistema nervioso periférico y la disfunción miogénica41. La gastroparesia puede afectar al 10-80% de los pacientes3,8,14,48,61,89,90.
Las manifestaciones clínicas presentes son dolor/distensión abdominal, hinchazón, y más comúnmente, saciedad temprana y náuseas postprandiales91. La severidad de los síntomas no se correlaciona con el grado de compromiso92,93.
La gammagrafía es el examen recomendado para evaluar la motilidad a ese nivel91 y la píldora endoscópica puede ser útil en los pacientes que no toleran la gammagrafía72. En la ES, el retardo en el vaciamiento de los líquidos se correlaciona con saciedad temprana y anorexia72. Otras herramientas de diagnóstico son: las pruebas del aliento, manometría esofágica-gastrointestinal, tomografía computarizada por emisión de fotón único (SPECT, por sus siglas en inglés) o resonancia magnética gástrica94-96.
El tratamiento con medidas higienico-dietéticas y el evitar medicamentos que afectan el tránsito intestinal tales como opioides o neurolépticos72 son las primeras medidas sugeridas. La metoclopramida (antagonista de los receptores D2 y agonista de 5-HT4) es el fármaco de primera línea para la gastroparesia91. Se ha demostrado que la meto-clopramida mejora las náuseas y la distensión posprandial en los pacientes con ES83,84. Se puede considerar la cisaprida y la domperidona en algunos casos72. En los pacientes refractarios, se ha demostrado que los macrólidos como la eritromicina mejoran el vaciamiento gástrico de sólidos97,98 pero pueden reducir el tránsito del intestino delgado y alterar el intervalo QT99. La buspirona (agonista de los receptores 5-HT1a) puede producir alivio de la dispepsia funcional, pero también produce una disminución del vaciamiento gástrico de los líquidos72. La levosulpirida (antagonista de receptores D2) parece disminuir el tiempo de llenado gástrico. En estudios con pacientes sin ES, la levosulpirida ha demostrado superioridad sobre la metroclopramida o la domperidona72. La prucoloprida (agonista de los receptores 5-HT4) mejora la motilidad del duodeno y disminuye los efectos de gastroparesia86. Se ha demostrado que la grelina (una neurohormona secretada por el estómago y el intestino delgado) mejora el vaciamiento gástrico en los pacientes con gastroparesia con o sin ES72,100. El uso de terapias antieméticas (ondansetrón, prometazina, meclizina o cannabinoides) para mejorar la gastroparesia no es raro. En los casos severos se pueden considerar procedimientos más invasivos como inyecciones de bótox e implantes de estimuladores gástricos72.
La EVAG se encuentra hasta en 22,3% de los pacientes88. La EVAG probablemente se produce debido a una alteración del componente microvascular de la ES8,101. Un estudio reciente encontró una mayor presencia de EVA Genlospacientes con diagnóstico temprano de ES y en los pacientes del subgrupo difuso (ESdc)10. También se publicó una asociación negativa con anticuerpos antitopoisomerasa (ATA)102 y anti-U1-ribonucleoproteina88. La asociación de la EVAG con otros autoanticuerpos es objeto de controversia103. Las principales manifestaciones clínicas incluyen anemia por deficiencia de hierro o hemorragia gastrointestinal alta103. Cabe señalar la recomendación de descartar la presencia de ES en los pacientes con EVAG88,101. El diagnóstico se hace por endoscopia, que muestra múltiples ectasias vasculares pequenas confluentes con orientación longitudinal desde los pliegues del antro hasta el píloro104. El tratamiento inicial es una terapia de apoyo con suplementos de hierro o transfusiones de glóbulos rojos. Si la terapia conservadora falla, se requerirá terapia endoscópica con ablación laser, fotocoagulación con argón plasma o ligadura endoscópica con banda, especialmente para los pacientes con sangrado relacionado con EVAG44. La antrectomía está reservada únicamente para los casos graves105.
Intestino delgado
Las complicaciones del intestino delgado en la ES son frecuentes y el duodeno es el más afectado (40-88%)106. Se cree que las alteraciones del intestino delgado son el resultado de lesiones histológicas progresivas similares a las de otros órganos en la ES. Sjögren propuso una progresión del dano basada en el compromiso vascular (grado 0), deterioro neurogénico (grado 1) y disfunción miogénica (grado 2) con reemplazo del músculo liso normal por fibrosis colágena y atrofia41. La dismotilidad del intestino delgado se debe a cambios neuropáticos ymiopáticos por isquemia vascular y causa dan o en los nervios, atrofia del músculo liso y finalmente fibrosis106. Esto contribuye al sobrecrecimiento bacteriano en el intestino delgado (SBID)107.
La seudo obstrucción intestinal crónica (POIC) se caracteriza por un mal funcionamiento de la motilidad gastrointestinal con síntomas y signos de obstrucción intestinal aguda y crónica en ausencia de oclusión mecánica108. La POIC por lo general es secundaria a atonía, dilatación y retraso en el tránsito dentro del intestino delgado, también puede ocurrir perforación debido a fibrosis serosa con pérdida de adherencia de la pared en la capa muscular101. Pueden desarrollarse divertículos yeyunales debido a protrusión de la pared intestinal101. Los rayos x pueden indicar su presencia y el contraste baritado muestra asas intestinales dilatadas y acumulación de alimentos55. Otros métodos de diagnóstico alternativos son la gammagrafía, la cápsula endoscópica o la enterografía107.
Para evitar las manifestaciones del intestino delgado es muy importante que los pacientes con ES mantengan una ingesta adecuada de líquidos y eviten los laxantes y los alimentos ricos en fibra, ya que estos pueden empeorar los síntomas29. En caso de dismotilidad del intestino delgado y POIC, el empleo de procinéticos también puede ser de utilidad. La octreotida y la cisaprida favorecen la motilidad duodenal81,109. La octreotida en combinación con eritromicina mejora el dolor abdominal y las náuseas109, pero su uso prolongado puede favorecer la aparición de colelitiasis y perforación intestinal110.
La presencia del SBID ocurre en 43-60% de los pacientes con ES y puede ocasionar náuseas, vómito, diarrea, distensión abdominal, hinchazón y signos relacionaos con malabsorción (pérdida de peso, esteatorrea, déficit de vitaminas)111. La severidad del SBID se puede correlacionar con la sintomatología107,112,113. El estándar de oro para el diagnóstico es el cultivo del aspirado yeyunal114, pero en la práctica clínica se utilizan otros análisis como la prueba de aliento para hidrógeno o metano115. El uso intermitente o rotativo de antibióticos puede ser de utilidad112,113.
La pneumatosis cystoides intestinalis se caracteriza por múltiples quistes con contenido de aire en la pared intestinal debido a la elevación de las presiones intraluminales causada por sobrecrecimiento bacteriano111. Es un hallazgo radiográfico raro con imágenes quísticas radiolúcidas debido a la presencia de aire en la submucosa o en la subserosa, para lo cual se recomienda un manejo conservador. Además, puede producir un neumoperitoneo en caso de ruptura13,116,117.
Colon
El compromiso del intestino grueso (20-50%) generalmente es asintomático118, pero la presencia de afectación cardiaca, pulmonar, renal o cutánea está relacionada con la presencia de síntomas colónicos13.
Los síntomas del intestino grueso probablemente son causados por una inflamación de la pared intestinal que produce atrofia muscular, fibrosis y dismotilidad. La hipomotilidad del colon puede ocasionar un retraso en el tiempo de tránsito intestinal y estreñimiento con un aumento del sobrecrecimiento bacteriano que puede producir diarrea malabsortiva119,120. La diverticulosis presenta un riesgo de ulceración e infección debido a la retención fecal, y durante la evolución de la enfermedad la pared intestinal se vuelve rígida, ocasionando una falsa resolución del divertículo121.
La seudoobstrucción crónica del intestino grueso es una complicación rara que se expresa en forma de náuseas, vómito, distensión y cambios en el ritmo deposicional, recomendándose un manejo conservador; la estimulación eléctrica o la cirugía deben ser utilizadas como último recurso terapéutico para la POIC13,120,121. En caso de estreñimiento de aparición reciente en pacientes con ES, son necesarios los estudios endoscópicos o de imágenes diagnósticas para excluir malignidad, estenosis, diverticulosis y otras enfermedades del colon120. El manejo es sintomático29,120utilizando laxantes estimulantes77,122, además de otros fármacos que ayudan a tratar el estreñimiento como la metoclopramida, la domperidona y la prucaloprida99,122,123.
Anorrectal
Los síntomas anorrectales se presentan en 50-70% de los pacientes y afectan al esfínter anal interno (EAI) produciendo incontinencia fecal, estreñimiento y prolapso rectal124. El compromiso del EAI puede deberse a una patología primaria de los músculos o neuronas o ser secundario a isquemia/inflamación de la pared anorrectal7,125. La disminución del reflejo inhibitorio anorrectal es una evidencia adicional de deterioro de los nervio periféricos en ES126. El estreñimiento y el prolapso rectal se producen a medida que la enfermedad progresa causando alteraciones en la relajación y restricción en la distensión127. Los estudios manométricos muestran una inhibición del reflejo anorrectal y presiones de compresión normales128, la ecografía endoanal o la resonancia magnética rectal también pueden evaluar la integridad y las anomalías estructurales129,130. Las recomendaciones dietéticas pueden mejorar la motilidad intestinal y la integridad del EAI, incluyendo la incontinencia fecal; los antidiarreicos pueden ser útiles, pero deben usarse con cuidado ya que pueden exacerbar el estreñimiento e inducir un prolapso rectal13. La estimulación del nervio sacro mejora los síntomas, pero no hay evidencia a largo plazo122.
Hígado
La enfermedad hepática en ES es rara (1,5% de los pacientes) y la CBP es la afectación más frecuente44. De hecho, la ES es la enfermedad autoinmune sistémica que más se asocia con CBP (7-17%)131. La ESlc está más asociada132-135, al igual que la presencia de anticuerpos anticentrómero (AAC)136,137. Los anticuerpos antimitocondriales (AAM) están presentes hasta en un 94% de los pacientes con CBP asociada a ES32,138,139. Se ha observado la presencia de AAM hasta en 13 y 3% de los pacientes con ESlc y ESdc, respectivamente, sin presentar una clara relación con CBP subyacente29.
Los pacientes son por lo general asintomáticos y el diagnóstico se hace por una elevación inexplicada de la fosfatasa alcalina hepática y la presencia de AAM140. Los anticuerpos anti-gp210 y anti-sp100 aumentan la sensibilidad hasta el 100%29. La biopsia hepática solo es necesaria para el diagnóstico cuando no hay anticuerpos específicos para CBP29.
El ácido ursodesoxicólico (AUDC) sigue siendo el tratamiento de elección para la CBP, y se recomienda el trasplante de hígado en pacientes con la enfermedad en etapa tardía. Se ha demostrado que la prednisona y la budesonida mejoran la histología en una etapa temprana, pero no hay estudios a largo plazo. El sulindaco y el benzofibrato mejoran la función hepática en grupos limitados de pacientes con una respuesta incompleta al AUDC140. Los pacientes con CBP y ES han mostrado una progresión más lenta en comparación con los pacientes con CBP aislada141. En los pacientes con ES y CBP se recomienda la monitorización cada uno o dos años con pruebas de función hepática141. La hepatitis autoinmune es rara y por lo general se asocia con una ESlc142,143. Otras enfermedades hepáticas relacionadas con la ES son: hiperplasia nodular regenerativa, hipertensión portal idiopática, rotura espontánea del hígado, infarto hepático masivo y obstrucción del conducto hepático relacionada con vasculitis144.
Páncreas
La enfermedad pancreática en ES es rara y a veces se puede confundir con SBID32,145. En caso de sospecha de SBID, se debe descartar una insuficiencia pancreática si no hay respuesta después de iniciar los antibióticos146. También se han reportado casos de necrosis pancreática, pancreatitis aguda hemorrágica y pancreatitis crónica147.
Conclusiones
El compromiso gastrointestinal es común en la ES y puede afectar a todo el tracto digestivo. El esófago es el área más comprometida. Pueden aparecer diversas manifestaciones clínicas, las cuales tienen un gran impacto en la calidad de vida de los pacientes. Se recomienda la evaluación del esófago por manometría en todos los pacientes con ES y el uso de otras herramientas para determinar el compromiso gastrointestinal depende de las diferentes manifestaciones clínicas que presentan los pacientes. El manejo se basa en medidas higienico-dietéticas, así como en el tratamiento de los diferentes síntomas. Es importante identificar la afección gastrointestinal para prevenir complicaciones a largo plazo, así como para excluir las causas de los síntomas no relacionados con la ES.
REFERENCIAS
[1]. Abu-Shakra M, Guillemin F, Lee P. Gastrointestinal manifestations of systemic sclerosis. Semin Arthritis Rheum. 1994;24(1):29-39. [ Links ]
[2]. Young MA, Rose S, Reynolds JC. Gastrointestinal manifestations of scleroderma. Rheum Dis Clin North Am. 1996;22(4):797-823. [ Links ]
[3]. Gyger G, Baron M. Gastrointestinal manifestations of scleroderma: recent progress in evaluation, pathogenesis, and management. Curr Rheumatol Rep. 2012;14(1):22 9. [ Links ]
[4]. Schmeiser T, Saar P, Jin D, Noethe M, Muller A, Soydan N, et al. Profile of gastrointestinal involvement in patients with systemic sclerosis. Rheumatol Int. 2012;32(8):2471 8. [ Links ]
[5]. Steen VD, Medsger TA Jr. Severe organ involvement in systemic sclerosis with diffuse scleroderma. Arthritis Rheum. 2000;43(11):2437-4. [ Links ]
[6]. Akesson A, Wollheim FA. Organ manifestations in 100 patients with progressive systemic sclerosis: a comparison between the CREST syndrome and diffuse scleroderma. Br J Rheumatol. 1989;28(4):281 6. [ Links ]
[7]. Roberts CG, Hummers LK, Ravich WJ, Wigley FM, Hutchins GM. A case-control study of the pathology of oesophageal disease in systemic sclerosis (scleroderma). Gut. 2006;55(12):1697 703. [ Links ]
[8]. Marie I, Ducrotte P, Antonietti M, Herve S, Levesque H. Watermelon stomach in systemic sclerosis: its incidence and management. Aliment Pharmacol Ther. 2008;28(4):412 21. [ Links ]
[9]. McNearney TA, Sallam HS, Hunnicutt SE, Doshi D, Wollaston DE, Mayes MD, et al. Gastric slow waves, gastrointestinal symptoms and peptides in systemic sclerosis patients. Neurogastroenterol Motil. 2009;21(12):1269 e120. [ Links ]
[10]. Ingraham KM, O'Brien MS, Shenin M, Derk CT, Steen VD. Gastric antral vascular ectasia in systemic sclerosis: demographics and disease predictors. J Rheumatol. 2010;37(3):603-7. [ Links ]
[11]. Zuber-Jerger I, Muller A, Kullmann FGelbmann CM, Endlicher E, Muller-Ladner U, et al. Gastrointestinal manifestation of systemic sclerosis thickening of the upper gastrointestinal wall detected by endoscopic ultrasound is a valid sign. Rheumatology (Oxford). 2010;49(2):368 72. [ Links ]
[12]. Ponge T, Bruley des Varannes S. [Digestive involvement of scleroderma]. Rev Prat. 2002;52(17):1896 900. [ Links ]
[13]. Sallam H, McNearney TA, Chen JD. Systematic review: pathophysiology and management of gastrointestinal dysmotility in systemic sclerosis (scleroderma). Aliment Pharmacol Ther. 2006;23(6):691 712. [ Links ]
[14]. Franck-Larsson K, Graf WRonnblom A. Lower gastrointestinal symptoms and quality of life in patients with systemic sclerosis: a population-based study. Eur J Gastroenterol Hepatol. 2009;21(2):176 82. [ Links ]
[15]. Marasini B, Gagetta M, Rossi V, Ferrari P. Rheumatic disorders and primary biliary cirrhosis: an appraisal of 170 Italian patients Ann Rheum Dis. 2001;60(11):1046 9. [ Links ]
[16]. Assassi S, Fritzler MJ, Arnett FC, Norman GL, Shah KR, Gourh P, et al. Primary biliary cirrhosis (PBC), PBC autoantibodies, and hepatic parameter abnormalities in a large population o systemic sclerosis patients. J Rheumatol. 2009;36(10):2250 6. [ Links ]
[17]. Khanna D, Hays RD, Marania P, Seibold JR, Impens A, Mayes MD, et al. Reliability and validity of the University of California, Los Angeles Scleroderma Clinical Trial Consortium Gastrointestinal Tract Instrument. Arthritis Rheum. 2009;61(9):1257 63. [ Links ]
[18]. Raja J, Ng CT, Sujau I, Chin KF, Sockalingam S. High-resolution oesophageal manometry and 24-hour impedance-pH study in systemic sclerosis patients: association with clinical features, symptoms and severity. Clin Exp Rheumatol. 2016;34 Suppl 100(5):115 21. [ Links ]
[19]. Bajraktari IH, Kryeziu A, Sherifi F Bajraktari H, Lahu A, Bajraktari G. Oral manifestations of Systemic Sclerosis and Correlation with anti-Topoisomerase I Antibodies (SCL-70). Med Arch. 2015;69(3):153 6. [ Links ]
[20]. Crincoli V, Fatone L, Fanelli M, Rotolo RP, Chiala A, Favia G, et al. Orofacial Manifestations and Temporomandibular Disorders of Systemic Scleroderma An Observational Study. Int J Mol Sci. 2016;17(7). [ Links ]
[21]. Jung S, Martin T, Schmittbuhl M, Huck O. The spectrum of orofacial manifestations in systemic sclerosis: a challenging management. Oral Dis. 2017;23(4):424 39. [ Links ]
[22]. Nagy G, Kovacs J, Zeher M, Czirjak L. Analysis of the oral manifestations of systemic sclerosis. Oral Surg Oral Med Ora Pathol. 1994;77(2):141 6. [ Links ]
[23]. Auluck A. Widening of periodontal ligament space and mandibular resorption in patients with systemic sclerosis. Dentomaxillofac Radiol. 2007;36(7):441 2. [ Links ]
[24]. Pizzo G, Scardina GA, Messina P. Effects of a nonsurgical exercise program on the decreased mouth opening in patients with systemic scleroderma. Clin Oral Investig. 2003;7(3):175-8. [ Links ]
[25]. Avouac J, Sordet C, Depinay C, Ardizonne M, Vacher-Lavenu MC, Sibilia J, et al. Systemic sclerosis-associated Sjogren's syndrome and relationship to the limited cutaneous subtype: results of a prospective study of sicca syndrome in 133 consecutive patients. Arthritis Rheum. 2006;54(7):2243-9. [ Links ]
[26]. Chu CH, Yeung CM, Lai IA, Leung WK, Mok MY. Oral health of Chinese people with systemic sclerosis. Clin Oral Investig. 2011;15(6):931 9. [ Links ]
[27]. Wood RE, Lee P. Analysis of the oral manifestations of systemic sclerosis (scleroderma). Oral Surg Oral Med Oral Pathol. 1988;65(2):172 8. [ Links ]
[28]. Baron M, Hudson M, Tatibouet S, Steele R, Lo E, Gravel S, et al. The Canadian systemic sclerosis oral health study: orofacial manifestations and oral health-related quality of life in systemic sclerosis compared with the general population. Rheumatology (Oxford). 2014;53(8): 1386 94. [ Links ]
[29]. McFarlane IM, Bhamra MS, Kreps A, Iqbal S, Al-Ani F, Saladini-Aponte C, et al. Gastrointestinal Manifestations of Systemic Sclerosis. Rheumatology (Sunnyvale). 2018;8(1). [ Links ]
[30]. Dagenais M, MacDonald D, Baron M, Hudson M, Tatibouet S, Steele R, et al. The Canadian Systemic Sclerosis Oral Health Study IV: oral radiographic manifestations in systemic sclerosis compared with the general population. Oral Surg Oral Med Oral Pathol Oral Radiol. 2015;120(2):104 -11. [ Links ]
[31]. Derk CT, Rasheed M, Spiegel JR, Jimenez SA. Increased incidence of carcinoma of the tongue in patients with systemic sclerosis. J Rheumatol. 2005;32(4): 637- 41. [ Links ]
[32]. Kirby DF, Chatterjee S. Evaluation and management of gastrointestinal manifestations in scleroderma. Curr Opin Rheumatol. 2014;26(6):621-9. [ Links ]
[33]. Wipff J, Allanore Y,Soussi F, Terris B, Abitbol V,Raymond J, et al. Prevalence of Barrett's esophagus in systemic sclerosis. Arthritis Rheum. 2005;52(9):2882-8. [ Links ]
[34] . Thonhofer R, Siegel C, Trummer M, Graninger W. Early endoscopy in systemic sclerosis without gastrointestinal symptoms. Rheumatol Int. 2012;32(1):165-8. [ Links ]
[35]. Naylor WP, Douglass CW, Mix E. The nonsurgical treatment of microstomia in scleroderma: a pilot study. Oral Surg Oral Med Oral Pathol. 1984;57(5):508-11. [ Links ]
[36]. Bennani I, Lopez R, Bonnet D, Prevot G, Constantin A, Chauveau D, et al. Improvement of Microstomia in Scleroderma after Carbon Dioxide Laser Treatment. Case Rep Dermatol. 2016;8(2):142 50. [ Links ]
[37]. Montesi A, Pesaresi A, Cavalli ML, Ripa G, Candela M, Gabrielli A. Oropharyngeal and esophageal function in scleroderma. Dysphagia. 1991;6(4):219-23. [ Links ]
[38]. Lahcene M, Oumnia N, Matougui N, Boudjell M, Tebaibia A, Touchene B. Esophageal dysmotility in scleroderma: a prospective study of 183 cases. Gastroenterol Clin Biol. 2009;33(6-7):466-9. [ Links ]
[39]. Matucci-Cerinic M, Czirjak L. Immune-endothelial-nerve interaction: an explanation for the failure of the gastrointestinal system in systemic sclerosis? Ann Rheum Dis. 2009;68(5):609-10. [ Links ]
[40]. Hamel-Roy J, Devroede G, Arhan P, Tetreault L, Duranceau A, Menard HA. Comparative esophageal and anorectal motility in scleroderma. Gastroenterology. 1985;88 1 Pt 1:1-7. [ Links ]
[41]. Sjogren RW. Gastrointestinal motility disorders in scleroderma. Arthritis Rheum. 1994;37(9):1265-82. [ Links ]
[42]. Denaxas K, Ladas SD, Karamanolis GP. Evaluation and management of esophageal manifestations in systemic sclerosis. Ann Gastroenterol. 2018;31(2):165-70. [ Links ]
[43]. Sigterman KE, van Pinxteren B, Bonis PA, Lau J, Numans ME. Short-term treatment with proton pump inhibitors, H2-receptor antagonists and prokinetics for gastro-oesophageal reflux disease-like symptoms and endoscopy negative reflux disease. Cochrane Database Syst Rev. 2013;(5). Cd002095. [ Links ]
[44]. Savarino E, Furnari M, de Bortoli N, Martinucci I, Bodini G, Ghio M, et al. Gastrointestinal involvement in systemic sclerosis. Presse Med. 2014;43 10 Pt 2:e279-91. [ Links ]
[45]. Campbell WL, Schultz JC. Specificity and sensitivity of esophageal motor abnormality in systemic sclerosis (scleroderma) and related diseases: a cineradiographic study. Gastrointest Radiol. 1986;11(3):218-22. [ Links ]
[46]. Stentoft P, Hendel L, Aggestrup S. Esophageal manometry and pH-probe monitoring in the evaluation of gastroesophageal reflux in patients with progressive systemic sclerosis. Scand J Gastroenterol. 1987;22(4):499-504. [ Links ]
[47]. Kaye SA, Siraj QH, Agnew J, Hilson A, Black CM. Detection of early asymptomatic esophageal dysfunction in systemic sclerosis using a new scintigraphic grading method. J Rheumatol. 1996;23(2):297 301. [ Links ]
[48]. Weston S, Thumshirn M, Wiste J, Camilleri M. Clinical and upper gastrointestinal motility features in systemic sclerosis and related disorders. Am J Gastroenterol. 1998;93(7): 1085-9. [ Links ]
[49]. Vardar R, Vardar E, Bor S. Is the prevalence of intestinal metaplasia at the squamocolumnar junction different in patients with progressive systemic sclerosis? Turk J Gastroenterol. 2010;21(3):251-6. [ Links ]
[50]. Lahcene M, Oumnia N, Matougui N, Boudjell M, Tebaibia A, Touchene B. Esophageal involvement in scleroderma: clinical, endoscopic, and manometric features. ISRN Rheumatol. 2011;2011, 325-826. [ Links ]
[51]. Liu X, Li M, Xu D, Hou Y, Wang Q, Tian Z, et al. Prevalence and clinical importance of gastroesophageal reflux in Chinese patients with systemic sclerosis. Clin Exp Rheumatol. 2012;30 2 Suppl 71:S60 -6. [ Links ]
[52]. Johnson DA, Drane WE, Curran J, Cattau EL Jr, Ciarleglio C, Khan A, et al. Pulmonary disease in progressive systemic sclerosis. A complication of gastroesophageal reflux and occult aspiration? Arch Intern Med. 1989;149(3):589-93. [ Links ]
[53]. Zhang XJ, Bonner A, Hudson M, Baron M, Pope J. Association of gastroesophageal factors and worsening of forced vital capacity in systemic sclerosis. J Rheumatol. 2013;40(6):850-8. [ Links ]
[54]. Ebert EC. Esophageal disease in scleroderma. J Clin Gastroenterol. 2006;40(9):769-75. [ Links ]
[55]. Ebert EC. Gastric and enteric involvement in progressive systemic sclerosis. J Clin Gastroenterol. 2008;42(1):5 12. [ Links ]
[56]. Orringer MB, Dabich L, Zarafoneti CJ, Sloan H. Gastroesophageal reflux in esophageal scleroderma: diagnosis and implications. Ann Thorac Surg. 1976;22(2):120-30. [ Links ]
[57]. Clements PJ, Kadell B, Ippoliti A, Ross M. Esophageal motility in progressive systemic sclerosis (PSS). Comparison of cine-radiographic and manometric evaluation. Dig Dis Sci. 1979;24(8):639 44. [ Links ]
[58]. Zamost BJ, Hirschberg J, Ippoliti AF, Furst DE, Clements PJ, Weinstein WM. Esophagitis in scleroderma. Prevalenc and risk factors. Gastroenterology. 1987;92(2):421-8. [ Links ]
[59]. Lock G, Pfeifer M, Straub RH, Zeuner M, Lang B, Scholmerich J, et al. Association of esophageal dysfunction and pulmonary function impairment in systemic sclerosis. Am J Gastroenterol. 1998;93(3):341-5. [ Links ]
[60]. Clements PJ, Becvar R, Drosos AA, Ghattas L, Gabrielli A. Assessment of gastrointestinal involvement. Clin Exp Rheumatol. 2003;21 3 Suppl 29:S15 8. [ Links ]
[61]. Marie I, Dominique S, Levesque H, Ducrotte P, Denis P, Hellot MF, et al. Esophageal involvement and pulmonary manifestations in systemic sclerosis. Arthritis Rheum. 2001;45(4):346-54. [ Links ]
[62]. Richardson CB, Singer JP. Lung Transplantation for Scleroderma-related Lung Disease. Curr Respir Care Rep. 2014;3(3):79-87. [ Links ]
[63]. Christmann RB, Wells AU, Capelozzi VL, Silver RM. Gastroesophageal reflux incites interstitial lung disease in systemic sclerosis: clinical, radiologic, histopathologic, and treatment evidence. Semin Arthritis Rheum. 2010;40(3):241-9. [ Links ]
[64]. Fisichella PM, Reder NP, Gagermeier J, Kovacs EJ. Usefulness of pH monitoring in predicting the survival status of patients with scleroderma awaiting lung transplantation. J Surg Res. 2014;189(2):232-7. [ Links ]
[65]. Furst DE, Braun-Moscovic Y, Khanna D. Points to consider for clinical trials of the gastrointestinal tract in systemic sclerosis. Rheumatology (Oxford). 2017;56 suppl 5, v4-v11. [ Links ]
[66]. Kimmel JN, Carlson DA, Hinchcliff M, Carns MA, Aren KA, Lee J, et al. The association between systemic sclerosis disease manifestations and esophageal high-resolution manometry parameters. Neurogastroenterol Motil. 2016;28(8):1157-65. [ Links ]
[67]. Luciano L, Granel B, Bernit E, Harle JR, Baumstarck K, Grimaud JC, et al. Esophageal and anorectal involvement in systemic sclerosis: a systematic assessment with high resolution manometry. Clin Exp Rheumatol. 2016;34 Suppl 100(5):63-9. [ Links ]
[68]. Abozaid HSM, Imam HMK, Abdelaziz MM, El-Hammady DH, Fathi NA, Furst DE. High-resolution manometry compared with the University of California, Los Angeles Scleroderma Clinical Trials Consortium GIT 2.0 in Systemic Sclerosis. Semin Arthriti Rheum. 2017;47(3):403-8. [ Links ]
[69]. Aggarwal N, Lopez R, Gabbard S, Wadhwa N, Devaki P, Thota PN. Spectrum of esophageal dysmotility in systemic sclerosis on high-resolution esophageal manometry as defined by Chicago classification. Dis Esophagus. 2017;30(12):1-6. [ Links ]
[70]. Zaninotto G, Peserico A, Costantini M, Salvador L, Rondinone R, Roveran A, et al. Oesophageal motility and lower oesophageal sphincter competence in progressive systemic sclerosis and localized scleroderma. Scand J Gastroenterol. 1989;24(1):95-102. [ Links ]
[71]. Yarze JC, Varga J, Stampfl D, Castell DO, Jimenez SA. Esophageal function in systemic sclerosis: a prospective evaluation of motility and acid reflux in 36 patients. Am J Gastroenterol. 1993;88(6):870-6. [ Links ]
[72]. Miller JB, Gandhi N, Clarke J, McMahan Z. Gastrointestinal Involvement in Systemic Sclerosis: An Update. J Clin Rheumatol. 2018;24(6):328-37. [ Links ]
[73]. Hansi N, Thoua N, Carulli M, Chakravarty K, Lal S, Smyth A, et al. Consensus best practice pathway of the UK scleroderma study group: gastrointestinal manifestations of systemic sclerosis. Clin Exp Rheumatol. 2014;32 6 Suppl 86. S-214-21. [ Links ]
[74]. Kowal-Bielecka O, Fransen J, Avouac J, Becker M, Kulak A, Allanore Y, et al. Update of EULAR recommendations for the treatment of systemic sclerosis. Ann Rheum Dis. 2017;76(8):1327-39. [ Links ]
[75]. Pakozdi A, Wilson H, Black CM, Denton CP. Does long term therapy with lansoprazole slow progression of oesophageal involvement in systemic sclerosis? Clin Exp Rheumatol. 2009;27 3 Suppl 54:5-8. [ Links ]
[76]. Segel MC, Campbell WL, Medsger TA Jr, Roumm AD. Systemic sclerosis (scleroderma) and esophageal adenocarcinoma: Is increased patient screening necessary? Gastroenterology. 1985;89(3):485-8. [ Links ]
[77]. Nagaraja V, McMahan ZH, Getzug T, Khanna D. Management of gastrointestinal involvement in scleroderma. Curr Treatm Opt Rheumatol. 2015;1(1):82-105. [ Links ]
[78]. Horowitz M, Maddern GJ, Maddox A, Wishart J, Chatterton BE, Shearman DJ. Effects of cisapride on gastric and esophageal emptying in progressive systemic sclerosis. Gastroenterology. 1987;93(2):311-5. [ Links ]
[79]. Kahan A, Chaussade S, Gaudric M, Freitag B, Amor B, Menkes CJ, et al. The effect of cisapride on gastro-oesophageal dysfunction in systemic sclerosis: a controlled manometric study. Br J Clin Pharmacol. 1991;31(6):683-7. [ Links ]
[80]. Limburg AJ, Smit AJ, Kleibeuker JH. Effects of cisapride on the esophageal motor function of patients with progressive systemic sclerosis or mixed connective tissue disease. Digestion. 1991;49(3):156-60. [ Links ]
[81]. Wang SJ, La JL, Chen DY, Chen YH, Hsieh TY, Lin WY. Effects of cisapride on oesophageal transit of solids in patients with progressive systemic sclerosis. Clin Rheumatol. 2002;21(1):43-5. [ Links ]
[82]. Foocharoen C, Chunlertrith K, Mairiang P, Mahakkanukrauh A, Suwannaroj S, Namvijit S, et al. Effectiveness of add-on therapy with domperidone vs alginic acid in proton pump inhibitor partial response gastro-oesophageal reflux disease in systemic sclerosis: randomized placebo-controlled trial. Rheumatology (Oxford). 2017;56(2):214-22. [ Links ]
[83]. Ramirez-Mata M, Ibanez G, Alarcon-Segovia D. Stimulatory effect of metoclopramide on the esophagus and lower esophageal sphincter of patients of patients with PSS. Arthritis Rheum. 1977;20(1):30-4. [ Links ]
[84]. Johnson DA, Drane WE, Curran J, Benjamin SB, Chobanian SJ, Karvelis K, et al. Metoclopramide response in patients with progressive systemic sclerosis. Effect on esophageal and gastric motility abnormalities. Arch Intern Med. 1987;147(9):1597-601. [ Links ]
[85]. Mercado U, Arroyo de Anda R, Avendano L, Araiza-Casillas R, Avendano-Reyes M. Metoclopramide response in patients with early diffuse systemic sclerosis. Effects on esophageal motility abnormalities. Clin Exp Rheumatol. 2005;23(5):685-8. [ Links ]
[86]. Boeckxstaens GE, Bartelsman JF, Lauwers L, Tytgat GN. Treatment of GI dysmotility in scleroderma with the new enterokinetic agent prucalopride. Am J Gastroenterol. 2002;97(1):194-7. [ Links ]
[87]. Raja J, Nihtyanova SI, Murray CD, Denton CP, Ong VH. Sustained benefit from intravenous immunoglobulin therapy for gastrointestinal involvement in systemic sclerosis. Rheumatology (Oxford). 2016;55(1):115-9. [ Links ]
[88]. Hung EW, Mayes MD, Sharif R, Assassi S, Machicao VI, Hosing C, et al. Gastric antral vascular ectasia and its clinical correlates in patients with early diffuse systemic sclerosis in the SCOT trial. J Rheumatol. 2013;40(4):455-60. [ Links ]
[89]. Sridha KR, Lange RC, Magyar L, Soykan I, McCallum RW. Prevalence of impaired gastric emptying of solids in systemic sclerosis: diagnostic and therapeutic implications. J Lab Clin Med. 1998;132(6):541-6. [ Links ]
[90]. Forbes A, Marie I. Gastrointestinal complications: the most frequent internal complications of systemic sclerosis. Rheumatology (Oxford). 2009;48 Suppl 3, iii36-9. [ Links ]
[91]. Camilleri M, Parkman HP, Shafi MA, Abell TL, Gerson L. Clinical guideline: management of gastroparesis. Am J Gastroenterol. 2013;108(1):18-37, quiz 8. [ Links ]
[92]. Maddern GJ, Horowitz M, Jamieson GG, Chatterton BE, Collins PJ, Roberts-Thomson P. Abnormalities of esophageal and gastric emptying in progressive systemic sclerosis. Gastroenterology. 1984;87(4):922-6. [ Links ]
[93]. Marie I, Levesque H, Ducrotte P, Denis P, Hellot MF, Benichou J, et al. Gastric involvement in systemic sclerosis: a prospective study. Am J Gastroenterol. 2001;96(1):77-83. [ Links ]
[94]. Greydanus MP, Camilleri M. Abnormal postcibal antral and small bowel motility due to neuropathy or myopathy in systemic sclerosis. Gastroenterology. 1989;96(1):110-5. [ Links ]
[95]. Ghoos YF, Maes BD, Geypens BJ, Mys G, Hiele MI, Rutgeerts PJ, et al. Measurement of gastric emptying rate of solids by means of a carbon-labeled octanoic acid breath test. Gastroenterology. 1993;104(6):1640-7. [ Links ]
[96]. McNearney T, Lin X, Shrestha J, Lisse J, Chen JD. Characterization of gastric myoelectrical rhythms in patients with systemic sclerosis using multichannel surface electrogastrography. Dig Dis Sci. 2002;47(4):690-8. [ Links ]
[97]. Janssens J, Peeters TL, Vantrappen G, Tack J, Urbain JL, De Roo M, et al. Improvement of gastric emptying in diabetic gastroparesis by erythromycin. Preliminary studies. N Engl J Med. 1990;322(15):1028-31. [ Links ]
[98]. Fiorucci S, Distrutti E, Bassotti G, Gerli R, Chiucchiu S, Betti C, et al Effect of erythromycin administration on upper gastrointestinal motility in scleroderma patients. Scand J Gastroenterol. 1994;29(9):807-13. [ Links ]
[99]. Folwaczny C, Laritz M, Meurer M, Endres SP, Konig A, Schindlbeck N. [Effects of various prokinetic drugs on gastrointestinal transit times in patients with progressive systemic scleroderma]. Z Gastroenterol. 1997;35(10): 905-12. [ Links ]
[100]. Ariyasu H, Iwakura H, Yukawa N, Murayama T, Yokode M, Tada H, et al. Clinical effects of ghrelin on gastrointestinal involvement in patients with systemic sclerosis. Endocr J. 2014;61(7):735-42. [ Links ]
[101]. Kumar S, Singh J, Rattan S, DiMarino AJ, Cohen S, Jimenez SA. Review article: pathogenesis and clinical manifestations o gastrointestinal involvement in systemic sclerosis. Aliment Pharmacol Ther. 2017;45(7):883-98. [ Links ]
[102]. Watson M, Hally RJ, McCue PA, Varga J, Jimenez SA. Gastric antral vascular ectasia (watermelon stomach) in patients with systemic sclerosis. Arthritis Rheum. 1996;39(2):341-6. [ Links ]
[103]. Selinger CP, Ang YS. Gastric antral vascular ectasia (GAVE): an update on clinical presentation, pathophysiology and treatment. Digestion. 2008;77(2):131-7. [ Links ]
[104]. Jabbari M, Cherry R, Lough JO, Daly DS, Kinnear DG, Goresky CA. Gastric antral vascular ectasia: the watermelon stomach. Gastroenterology. 1984;87(5):1165-70. [ Links ]
[105]. Calamia KT, Scolapio JS, Viggiano TR. Endoscopic YAG laser treatment of watermelon stomach (gastric antral vascular ectasia) in patients with systemic sclerosis. Clin Exp Rheumatol. 2000;18(5):605-8. [ Links ]
[106]. Marie I, Ducrotte P, Denis P, Hellot MF, Levesque H. Outcome of small-bowel motor impairment in systemic sclerosis-a prospective manometric 5-yr follow-up. Rheumatology (Oxford). 2007;46(1):150-3. [ Links ]
[107]. Bures J, Cyrany J, Kohoutova D, Forstl M, Rejchrt S, Kvetina J, et al. Small intestinal bacterial overgrowth syndrome World J Gastroenterol. 2010;16(24):2978-90. [ Links ]
[108]. De Giorgio R, Sarnelli G, Corinaldesi R, Stanghellini V. Advances in our understanding of the pathology of chronic intestinal pseudo-obstruction. Gut. 2004;53(11):1549-52. [ Links ]
[109]. Verne GN, Eaker EY, Hardy E, Sninsky CA. Effect of octreotide and erythromycin on idiopathic and scleroderma-associated intestinal pseudoobstruction. Dig Dis Sci. 1995;40(9):1892-901. [ Links ]
[110]. Nikou GC, Toumpanakis C, Katsiari C, Charalambopoulos D, Sfikakis PP. Treatment of small intestinal disease in systemic sclerosis with octreotide: a prospective study in seven patients. J Clin Rheumatol. 2007;13(3):119-23. [ Links ]
[111]. Parodi A, Sessarego M, Greco A, Bazzica M, Filaci G, Setti M, et al. Small intestinal bacterial overgrowth in patients suffering from scleroderma: clinical effectiveness of its eradication. Am J Gastroenterol 2008;103(5):1257-62. [ Links ]
[112]. Marie I, Ducrotte P, Denis P, Menard JF, Levesque H. Small intestinal bacterial overgrowth in systemic sclerosis. Rheumatology (Oxford). 2009;48(10):1314-9. [ Links ]
[113]. Sawadpanich K, Soison P, Chunlertrith K, Mairiang P, Sukeepaisarnjaroen W, Sangchan A, et al. Prevalence and associated factors of small intestinal bacterial overgrowth among systemic sclerosis patients. Int J Rheum Dis. 2019;22(4):695-9. [ Links ]
[114]. Polkowska-Pruszynska B, Gerkowicz A, Szczepanik-Kulak P, Krasowska D. Small intestinal bacterial overgrowth in systemic sclerosis: a review of the literature. Arch Dermatol Res. 2019;311(1):1-8. [ Links ]
[115]. Polkowska-Pruszynska B, Gerkowicz A, Szczepanik-Kulak P, Krasowska D. Small intestinal bacterial overgrowth in systemic sclerosis: a review of the literature. Arch Dermatol Res. 2019;311(1):1-8. [ Links ]
[116]. Balbir-Gurman A, Brook OR, Chermesh I, Braun-Moscovici Y. Pneumatosis cystoides intestinalis in scleroderma-related conditions. Intern Med J. 2012;42(3):323-9. [ Links ]
[117]. Wu LL, Yang YS, Dou Y, Liu QS. A systematic analysis of pneumatosis cystoids intestinalis. World J Gastroenterol. 2013;19(30):4973-8. [ Links ]
[118]. Kaneko M, Sasaki S, Teruya S, Ozaki K, Ishimaru K, Terai E, et al. Pneumatosis Cystoides Intestinalis in Patients with Systemic Sclerosis: A Case Report and Review of 39 Japanese Cases. Case Rep Gastrointest Med. 2016;2016:2474-515. [ Links ]
[119]. Vidal Neira LF, Piscoya Arbanil J, Rolando Castaneda T, Aita Arroyo G, Frias Coronado V, Garcia-Calderon JH. [Digestive involvement in progressive systemic sclerosis]. Arq Gastroenterol. 1988;25(1):8-22. [ Links ]
[120]. Madsen JL, Hendel L. Gastrointestinal transit times of radiolabeled meal in progressive systemic sclerosis. Dig Dis Sci. 1992;37(9):1404-8. [ Links ]
[121]. Emmanuel A. Current management of the gastrointestinal complications of systemic sclerosis. Nat Rev Gastroenterol Hepatol. 2016;13(8):461-72. [ Links ]
[122]. Compton R. Scleroderma with diverticulosis and colonic obstruction. Am J Surg. 1969;118(4):602-6. [ Links ]
[123]. Butt S, Emmanuel A. Systemic sclerosis and the gut. Expert Rev Gastroenterol Hepatol. 2013;7(4):331-9. [ Links ]
[124]. Sjogren RW. Gastrointestinal features of scleroderma. Curr Opin Rheumatol. 1996;8(6):569-75. [ Links ]
[125]. Sattar B, Chokshi RV. Colonic and Anorectal Manifestations of Systemic Sclerosis. Curr Gastroenterol Rep. 2019;21(7):33. [ Links ]
[126]. Malandrini A, Selvi E, Villanova M, Berti G, Sabadini L, Salvadori C, et al. Autonomic nervous system and smooth muscle cell involvement in systemic sclerosis: ultrastructural study of 3 cases. J Rheumatol. 2000;27(5):1203-6. [ Links ]
[127]. Heyt GJ, Oh MK, Alemzadeh N, Rivera S, Jimenez SA, Rattan S, et al. Impaired rectoanal inhibitory response in scleroderma (systemic sclerosis): an association with fecal incontinence. Dig Dis Sci. 2004;49(6):1040-5. [ Links ]
[128]. Kim KC, Park HJ, Lee SK, Chung JP, Lee KS, Chon CY, et al. Anorectal dysfunction in systemic sclerosis. J Korean Med Sci. 1996;11(3):244-9. [ Links ]
[129]. Jaffin BW, Chang P,Spiera H. Fecal incontinence in scleroderma. Clinical features, anorectal manometric findings, and their therapeutic implications. J Clin Gastroenterol. 1997;25(3):513-7. [ Links ]
[130]. deSouza NM, Williams AD, Wilson HJ, Gilderdale DJ, Coutts GA, Black CM. Fecal incontinence in scleroderma: assessment of the anal sphincter with thin-section endoanal MR imaging. Radiology. 1998;208(2): 529-35. [ Links ]
[131]. Thoua NM, Schizas A, Forbes A, Denton CP, Emmanuel AV. Internal anal sphincter atrophy in patients with systemic sclerosis. Rheumatology (Oxford). 2011;50(9):1596-602. [ Links ]
[132]. Zheng B, Vincent C, Fritzler MJ, Senecal JL, Koenig M, Joyal F. Prevalence of Systemic Sclerosis in Primary Biliary Cholangitis Using the New ACR/EULAR Classification Criteria. J Rheumatol. 2017;44(1):33-9. [ Links ]
[133]. Bluestone R, Macmahon M, Dawson JM. Systemic sclerosis and small bowel involvement. Gut. 1969;10(3):185-93. [ Links ]
[134]. Posthuma WF, Ledeboer M, Masclee AA, Dijkmans BA, Westendorp RG, Jebbink MC, et al. Do patients with systemic sclerosis have abnormal gallbladder function? Eur J Gastroenterol Hepatol. 1997;9(7):675-7. [ Links ]
[135]. Lopes MH, Ludwig E, do Amaral BB, Francisconi CF, von Muhlen CA. Motor activity of the gallbladder in systemic sclerosis. Am J Gastroenterol. 1999;94(12):3487-91. [ Links ]
[136]. Manchanda Y, Das S, Sharma VK, Srivastava DN. Scleredema associated with carcinoma of the gall bladder. Br J Dermatol. 2005;152(6):1373-4. [ Links ]
[137]. Nishimagi E, Tochimoto A, Kawaguchi Y, Satoh T, Kuwana M, Takagi K, et al. Characteristics of patients with early systemic sclerosis and severe gastrointestinal tract involvement. J Rheumatol. 2007;34(10):2050-5. [ Links ]
[138]. Wielosz E, Borys O, Zychowska I, Majdan M. Gastrointestinal involvement in patients with systemic sclerosis. Pol Arch Med Wewn. 2010;120(4):132-6. [ Links ]
[139]. Fregeau DR, Leung PS, Coppel RL, McNeilage LJ, Medsger TA Jr, Gershwin ME. Autoantibodies to mitochondria in systemic sclerosis. Frequency and characterization using recombinant cloned autoantigen. Arthritis Rheum. 1988;31(3):386-92. [ Links ]
[140]. Hu S, Zhao F, Wang Q, Chen WX. The accuracy of the anti-mitochondrial antibody and the M2 subtype test for diagnosis of primary biliary cirrhosis: a meta-analysis. Clin Chem Lab Med. 2014;52(11):1533-42. [ Links ]
[141]. EASL Clinical Practice Guidelines: management of cholestatic liver diseases. J Hepatol. 2009;51(2): 237-67. [ Links ]
[142]. Rigamonti C, Shand LM, Feudjo M, Bunn CC, Black CM, Denton CP, et al. Clinical features and prognosis of primary biliary cirrhosis associated with systemic sclerosis. Gut. 2006;55(3):388-94. [ Links ]
[143]. Rodrigues CE, Borges CL, de Carvalho JF. Diffuse systemic sclerosis and autoimmune hepatitis: a unique association. Clin Rheumatol. 2010;29(7):799-801. [ Links ]
[144]. Pamfil C, Zdrenghea MT, Mircea PA, Manzat Saplacan RM, Rednic N, Rednic S. Systemic sclerosis-polymyositis overlap syndrome associated with autoimmune hepatitis and cerebral vasculitis. J Gastrointestin Liver Dis. 2012;21(3):317-20. [ Links ]
[145]. Marie I, Levesque H, Tranvouez JL, Francois A, Riachi G, Cailleux N, et al. Autoimmune hepatitis and systemic sclerosis: a new overlap syndrome? Rheumatology (Oxford). 2001;40(1):102-6. [ Links ]
[146]. Hendel L, Worning H. Exocrine pancreatic function in patients with progressive systemic sclerosis. Scand J Gastroenterol. 1989;24(4):461-6. [ Links ]
[147]. Nihtyanova SI, Ong VH, Denton CP. Current management strategies for systemic sclerosis. Clin Exp Rheumatol. 2014;32 2 Suppl 81:156-64. [ Links ]
[148]. Abraham AA, Joos A. Pancreatic necrosis in progressive systemic sclerosis. Ann Rheum Dis. 1980;39(4):396-8. [ Links ]
Recibido: 03 de Julio de 2019; Aprobado: 10 de Diciembre de 2019











 text in
text in