Introducción
El síndrome de Sjögren (SS) es una enfermedad autoinmune multisistémica que afecta principalmente las glándulas exocrinas y que se caracteriza por la presencia de un proceso inflamatorio crónico que condiciona la disfuncionalidad de las mismas, manifestándose clínicamente por la presencia de síntomas secos como lo son la xeroftalmía y la xerostomía1. Los hallazgos histológicos demuestran la presencia de infiltración linfocítica2,3. Esta enfermedad afecta principalmente a mujeres de mediana edad4, con una prevalencia estimada de 60,82 casos por 100.000 habitantes5.
En el 2016 el Colegio Americano de Reumatología y la Liga Europea contra el reumatismo (ACR/EULAR) crearon unos criterios diagnósticos para el SS6. Están basados en: 1) hallazgos histopatológicos (puntuación de 3), 2) presencia de anticuerpos Ro (puntación de 3), 3) flujo salival no estimulado menor o igual a 0,1ml/min (puntuación de 1), 4) ocular staining score ≥ 5 (o score de Van Bijsterveld mayor o igual a 4) en al menos un ojo (puntuación de 1) y 5) test de Schirmer en al menos un ojo de 5 mm o menos en 5 min (puntuación de 1).
Desde hace algunas décadas se ha intentado objetivar las alteraciones de las glándulas salivales en el paciente con SS a través de la utilización de estudios imagenológicos. La búsqueda de estas alteraciones se ha llevado en estudios de sialografía7, gammagrafía8, cintigrafía9, resonancia magnética10 y ecografía11-13. La mayoría de estudios se han llevado a cabo con la utilización de la ecografía dadas las ventajas en cuanto a disponibilidad, fácil operabilidad, ausencia de radiación ionizante y fácil reproducibilidad, siendo esta en algunos casos controvertida, con mejor rendimiento en ecografía parotídea en manos experimentadas1.
Uno de los estudios más importante y con mayor aceptación en la comunidad académica fue el realizado por el grupo de De Vita et al.1,14 quienes describieron y clasificaron las alteraciones ultrasonográficas en pacientes con SS evaluando las parótidas y glándulas submandibulares con una puntuación de 0 a 6; siendo positivo una puntuación mayor a 2, dado que en algunos estudios se ha demostrado que el corte de 2 se asoció con una sensibilidad del 66%, una especificidad del 98%, un valor predictivo positivo (PPV) del 97% y un valor predictivo negativo (VPN) del 77% para el SS.
Los estudios enfocados en el análisis de la ecografía en el SS en Latinoamérica son escasos15,16, encontrándose entre ellos un artículo publicado por Martire et al.16, en donde, a través de una colaboración de Argentina y México, realizaron una revisión sistemática de la literatura reafirmando la utilidad de la ecografía para la evaluación del compromiso glandular en el SS16. A pesar de lo anterior, siguen siendo pocos los trabajos realizados en Latinoamérica y el presente trabajo en Colombia es el primero en ser publicado, en el conocimiento de los autores.
El objetivo principal de este estudio fue caracterizar las alteraciones ecográficas en una cohorte de pacientes con síndrome seco, que consultan por sospecha de SS, llevada a cabo en un servicio de reumatología en Colombia.
Materiales y métodos
Diseño del estudio y población del estudio
Es un estudio de corte transversal, monocéntrico en el que fueron incluidos de manera consecutiva pacientes quienes cursaban con sintomatología seca; xeroftalmía y xerostomía, atendidos en el Servicio de Reumatología del Hospital de San José de Bogotá en los meses comprendidos entre agosto de 2019 y enero de 2020.
El diagnóstico de SS fue realizado según criterios ACR/EULAR6. Los pacientes que no cumplían estos criterios fueron diagnosticados con síndrome seco no SS y representaban la población de referencia.
Se consideraron como criterios de exclusión a los pacientes menores de 18 años de edad, aquellos con antecedente quirúrgico ocular u oral en el último año, antecedente de radioterapia de cabeza o cuello y pacientes con extracción quirúrgica de glándulas salivales mayores (parótidas, submandibulares).
El estudio fue aprobado el 19 de noviembre de 2018 por el Comité de Ética en Investigación en Seres Humanos HSJ-FUCS (CEISH) con registro 0457-2018, y se desarrolló teniendo en cuenta a la Resolución 8430/1993 del Ministerio de Salud. Previo a la inclusión de los pacientes se solicitó la firma del consentimiento informado el cual fue realizado de acuerdo con la Declaración de Helsinki.
Evaluaciones clínicas y paraclínicas
A todos los pacientes incluidos se les practicó un cuestionario estructurado de datos generales; (edad, estrato socio-económico, actividad laboral), presencia de síntomas secos acorde con los criterios del ACR/EULAR6 consistente en 5 preguntas referentes a: sequedad ocular y sequedad oral por más de 3 meses y uso de sustitutos para la mejoría de síntomas o necesidad de líquidos frecuentes. Se evaluó la presencia de parotidomegalia, compromiso articular o extraglandular, antecedentes de autoinmunidad (lupus erite-matoso sistémico, artritis reumatoide, hipotiroidismo, entre otros), antecedentes generales (hipertensión arterial, diabetes, entre otros), antecedente de enfermedades infecciosas (hepatitis B, hepatitis C, VIH y tuberculosis), antecedentes exposicionales y tóxicos dentro de estos el consumo de cigarrillo (evaluando el consumo actual, la cantidad de cigarrillos/día y el tiempo de consumo), café (consumo actual, el número de tazas/día y el tiempo de consumo), solventes orgánicos, tatuajes, tintura de cabello y otros tóxicos, uso de medicamentos (esteroides, medicamentos modificadores de la enfermedad [DMARDs, por sus siglas en inglés] sintéticos, biológicos) uso de fármacos relacionados con síntomas secos17.
De igual forma se realizó valoración de la historia clínica previa para la verificación de paraclínicos autoinmunes (anti-Ro, anti-La, anticuerpos antinucleares [ANA], factor reumatoide [FR]), así como el complemento, crioglobulinas, gammaglobulinas, paraclínicos infecciosos (hepatitis B, hepatitis C, VIH) perfil metabólico (glucemia, vitamina D, perfil lipídico) y hemograma. En caso de que el paciente no contara con esos paraclínicos se les realizó el mismo día de la toma de biopsia de glándula salival menor (BGSM).
Biopsia de glándula salival menor
Esta biopsia se realizó acorde con las técnicas internacionalmente validadas por medio de técnica insicional, y se interpretó por un patólogo experto del hospital, según lo sugerido por el grupo SICCA2 para determinar la presencia o ausencia de sialoadenitis linfocítica focal y realización del cálculo del puntaje de focus score según lo indicado por los criterios del ACR/EULAR 2016, considerando positivo ≥ 1 foco/4 mm2.
Valoración oftalmológica y salival
A todos los pacientes se les realizó valoración oftalmológica con un tiempo entre la realización de la ecografía y esta valoración, no mayor a un mes, en donde se incluyeron los estudios para el diagnóstico de SS; test de Schirmer, Van Bijsterveld y ocular staining score, siguiendo los lineamientos validados.
Durante la valoración reumatológica se realizó de igual forma el test de flujo salival no estimulado, evaluado mediante técnica estandarizada de escupir durante 15 min, considerándose como positivo menor a 1,5 ml/15 min acorde con Navazesh y Kumaret18.
Evaluación ultrasonográfica
El ecógrafo que se usó para la realización del estudio fue Toshiba, XarioTM 200, utilizando un transductor lineal de alta frecuencia; 10mHz de 4cm de longitud.
La ecografía fue realizada en todos los pacientes por un radiólogo experto. Se realizó la valoración ecográfica de las glándulas (parótidas y submandibulares) con los pacientes acostados en posición supina con el cuello hiperextendido y la cabeza girada hacia el lado opuesto. Las glándulas parótidas fueron valoradas en 2 planos (longitudinal y transversal), y las glándulas submandibulares fueron exploradas solo en el plano longitudinal.
Los siguientes parámetros ecográficos fueron analizados y registrados:
Tamaño de las glándulas: se determinó el volumen en centímetros cúbicos de las 2 parótidas y submandibulares.
Cambios en la ecoestructura de las glándulas: se clasificaron de acuerdo con el sistema de clasificación de De Vita et al.1,14 que se centra principalmente en la heterogeneidad del tejido de la glándula con puntuaciones que van de 0 (glándulas homogéneas) a 3 (glándulas heterogéneas). La tabla 1 resume los hallazgos ecográficos normales evaluados, así como la clasificación de las alteraciones ecográficas valoradas en las glándulas. La puntuación total (0-6) fue representada por la suma de las puntuaciones de cada par de glándulas parótidas y submandibulares. Si las glándulas homónimas eran discordantes para el grado de homogeneidad, se consideró el grado más alto al evaluar la puntuación única (0-3). Se consideró ecografía positiva para el SS aquellos pacientes que tuvieran una puntuación ≥ 2.
Tabla 1 Definición de los hallazgos imagenológicos normales y patológicos en una ecografía de parótidas y submandibulares evaluados en la cohorte de pacientes.
| Hallazgos ecográficos usuales12 | |
| La ecogenicidad de la glándula es isoecoica con el músculo adyacente en donde se logra definir de manera precisa los bordes No debe existir dilatación ductal | |
| Pueden identificarse ganglios en la parótida; los cuales deben ser de pequeño tamaño < 5 mm, y deben conservar su hilio graso. Los ganglios no se identifican en el interior de las submandibulares | |
| Hallazgos patológicos1,12,14 | |
| Grado 0 | Glándula homogénea |
| Grado 1 | Escasas áreas hipoecoicas |
| Grado 2 | Áreas hipoecoicas de tamaño variable, distribuidas de manera dispersa en el parénquima, o la presencia de múltiples imágenes lineales o lesiones puntiformes que no presenta sombra acústica posterior |
| Grado 3 | Grandes lesiones redondeadas hipoecoicas o confluentes o imágenes lineales o lesiones quísticas o áreas de calcificaciones |
La evaluación ultrasonográfica, clínica y la BGSM fueron realizadas el mismo día por evaluadores de manera ciega e independiente.
Análisis estadístico
Los datos se expresaron como mediana y rango intercuartílico (RIQ) para las variables cuantitativas continuas, y como frecuencias y porcentajes absolutos para las variables categóricas.
Las comparaciones entre grupos se realizaron utilizando la prueba paramétrica de la t de Student y la prueba no paramétrica U de Mann-Whitney, según correspondiera para las variables continuas. Las variables dicotómicas (ecografía positiva para el SS vs. demás variables categóricas y presencia o ausencia del SS por criterios vs. demás variables categóricas) se compararon utilizando el análisis de la tabla de contingencia y la prueba de Chi-cuadrado o la prueba exacta de Fisher según correspondiera. En todas las pruebas estadísticas, un valor de p<0,05 se consideró estadísticamente significativo. Los análisis estadísticos fueron realizados en el paquete estadístico SPSS® v.21.
Resultados
En el estudio fueron incluidos 50 individuos con un promedio de edad de 55,91 años, quienes cursaban con síntomas secos, de los cuales 19 (38%) cumplían con criterios para el SS y 31 (62%) fueron clasificados como síndrome sicca.
La tabla 2 resume las características de la población total a estudio, así como las características de pacientes con ecografía considerada positiva para el SS en comparación con la población con ecografía considerada negativa para el SS.
Tabla 2 Principales características sociodemográficas, clínicas y exposicionales en 50 pacientes con síntomas secos acorde con hallazgos ecográficos.
Se encontró que la mayor población afectada por síndrome seco fueron las mujeres (94%). El 53,2% de los pacientes se dedicaban a labores del hogar.
De la población en estudio, 19 tenían como antecedente personal hipotiroidismo (desconociéndose en la totalidad si correspondía o no a etiología autoinmune), 13 tenían antecedente de enfermedad autoinmune familiar; dentro de las cuales se destaca la artritis reumatoide en un 52,9% y lupus eritematoso sistémico en un 11,8%. En la tabla 2 se muestra que no hubo diferencia estadística significativa en la presencia de enfermedades autoinmunes (diferentes al SS en los 2 grupos), siendo 19% en el grupo de pacientes con ecografía considerada positiva para el SS en comparación con la población con ecografía considerada negativa para el SS con el 6,9% en el grupo de SS (p = 0,22).
A todos los pacientes se les realizó perfil infeccioso que incluyó hepatitis B, C o VIH; enfermedades infecciosas que pueden condicionar sequedad, siendo negativo en todos los pacientes. Respecto a factores exposicionales, el 22% de los pacientes con síntomas secos consumían cigarrillo, un 84% café y un 60% referían uso de tinturas para el pelo.
Dentro del grupo de pacientes con ecografía considerada positiva para el SS se encontró una mayor proporción de pacientes positivos para el SS por criterios del ACR/EULAR 2016 (tabla 3), cuando se comparó con aquellos con ecografía considerada negativa para el SS (66,7 vs. 17,2%; p< 0,0001). Se documentó que los pacientes con ecografía considerada positiva para el SS presentaron una proporción mayor de presencia de anti-La (p = 0,002), ANA (p = 0,008), anti-Ro (p< 0,0001) y linfopenia (p = 0,007), con diferencia estadística significativa cuando se comparó con la población con ecografía considerada negativa para el SS (tabla 2).
Tabla 3 Criterios diagnósticos para el síndrome de Sjögren ACR/EULAR 2016 y hallazgos ecográficos.
| Criterios del SS | |||||
|---|---|---|---|---|---|
| Descriptor | Casos/evaluados | Porcentaje | Ecografía positiva para el SS (N = 21;42%) N (%) | Ecografía negativa para el SS (N = 29; 58%) N (%) | Valor de p |
| Biopsia positiva | 10/50 | 20 | 7 (33,3) | 3 (10,3) | 0,073 |
| Anticuerpos positivos | |||||
| Anti-Ro | 18/50 | 36 | 14 (66,7) | 4 (13,8) | < 0,0001 |
| Valoración oftalmológica | |||||
| Ocular staining score/van Bijsterveld score positivo | 12/45 | 26,7 | 7/18 (38,9) | 5/27 (18,5) | 0,175 |
| Schirmer positivo | 29/45 | 64,4 | 14/18 (77,8) | 15/27 (55,6) | 0,127 |
| Test de flujo salival no estimulado | |||||
| Test de flujo salival positivo | 18/44 | 40,9 | 10/18 (55,6) | 8/26 (30,8) | 0,1 |
| Diagnóstico de SS por criterios | |||||
| SS confirmado | 19/50 | 38 | 14 (66,7) | 5 (17,2) | < 0,0001 |
| SS: síndrome de Sjögren. | |||||
Hubo una tendencia en la presencia de FR en la población con ecografía considerada positiva para el SS (47,4 vs. 20%; p = 0,054), así como a la positividad de la biopsia para el SS (33,3 vs. 10,3%; p = 0,073) (tabla 3). Los pacientes con ecografía considerada positiva para el SS presentaron una mayor proporción de individuos que respondieron de manera positiva a la pregunta ¿Bebe con frecuencia líquidos para ayudarse durante las comidas? en comparación con aquellos con ecografía considerada negativa para el SS (p = 0,041). Por último, los pacientes con ecografía positiva para el SS presentaron un valor menor de flujo salival no estimulado en mililitros cuando se compararon con aquellos con ecografía negativa para el SS (p = 0,019) (tabla 2).
En las comparaciones de pacientes con el SS respecto a aquellos de referencia con síndrome seco no SS, no se encontraron diferencias significativas en las variables sociodemográficas, clínicas, exposicionales, familiares ni medicamentosas, excepto en aquellas propias de los criterios del SS (biopsia, pruebas oculares y positividad para flujo salival, así como en su valor crudo) en adición a una mayor proporción de pacientes con anti-La positivo en el grupo de SS positivo (43,8 vs. 4,8%; p = 0,012) y presencia de ANA positivo (100 vs. 65,4%; p = 0,008). A su vez, los pacientes con SS tuvieron una mediana de meses mayor en comparación con aquellos pacientes con síntomas secos no SS cuando se evaluó la temporalidad (meses) al responder positivamente a la pregunta usa sustitutos lagrimales más de 3 veces al día (4 RIQ60 vs. 0 RIQ4; p = 0,043). Respecto a las variables ecográficas, los pacientes con SS tuvieron un volumen menor (en cm3) en todas las 4 glándulas, siendo significativa la diferencia en la submandibular derecha (0,009). Como hemos mencionado, los pacientes con SS tuvieron una proporción mayor de ecografía con hallazgos considerados positivos para el SS (p < 0,0001).
Tabla 4 Clasificación, grados de compromiso y volumen de las glándulas salivales (parótidas y submandibulares)
| Clasificación del grado ecográfico discriminado por glándula | ||
|---|---|---|
| Número de pacientes | Porcentaje | |
| Parótida consolidado | ||
| Grado 0 | 26 | 52 |
| Grado 1 | 5 | 10 |
| Grado 2 | 3 | 6 |
| Grado 3 | 16 | 32 |
| Submandibular consolidado | ||
| Grado 0 | 32 | 64 |
| Grado 1 | 3 | 6 |
| Grado 2 | 2 | 4 |
| Grado 3 | 13 | 26 |
| Volumen ecográfico calculado en centímetros cúbicos acorde a cada glándula | ||
| Glándula | Promedio (DE) | |
| Parótida derecha | 7,9 (3,8) | |
| Parótida izquierda | 7,9 (3,8) | |
| Submandibular derecha | 3,9 (1,6) | |
| Submandibular izquierda | 4 (2,2) | |
| DE: desviación estándar. | ||
Discusión
Múltiples métodos imagenológicos se han utilizado para valorar la glándula salival en pacientes con SS. A escala mundial se han realizado estudios que han demostrado la utilidad de la ecografía para clasificar a los pacientes con síndrome seco no SS de pacientes con el SS. Como se mencionó, los estudios latinoamericanos son escasos16,19 y en Colombia, hasta la actualidad, no se han realizado estudios que evalúen esta herramienta diagnóstica. En el presente estudio se realizó la evaluación de 50 pacientes que consultaron al servicio de reumatología con síntomas secos. Se valoraron los criterios para el diagnóstico del SS, así como el análisis de posibles factores que pueden actuar como variables de confusión (glucemia, hepatitis C, hipotiroidismo, etc.). Posteriormente se les practicó, por un radiólogo experto, una ecografía de glándula salival que incluye las parótidas y las glándulas submandibulares, con el fin de definir las alteraciones que se encuentran relacionadas con el SS mediante el uso de la clasificación de De Vita et al.1,14. Se encontraron alteraciones estructurales de las glándulas (traduce en mayor puntaje de la clasificación) en los pacientes con SS con respecto a los pacientes con síndrome seco no SS. En las figuras 1-4 se ejemplifican 4 casos donde se ilustran los diferentes grados de compromiso ecográfico glandular.
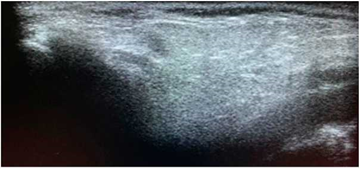
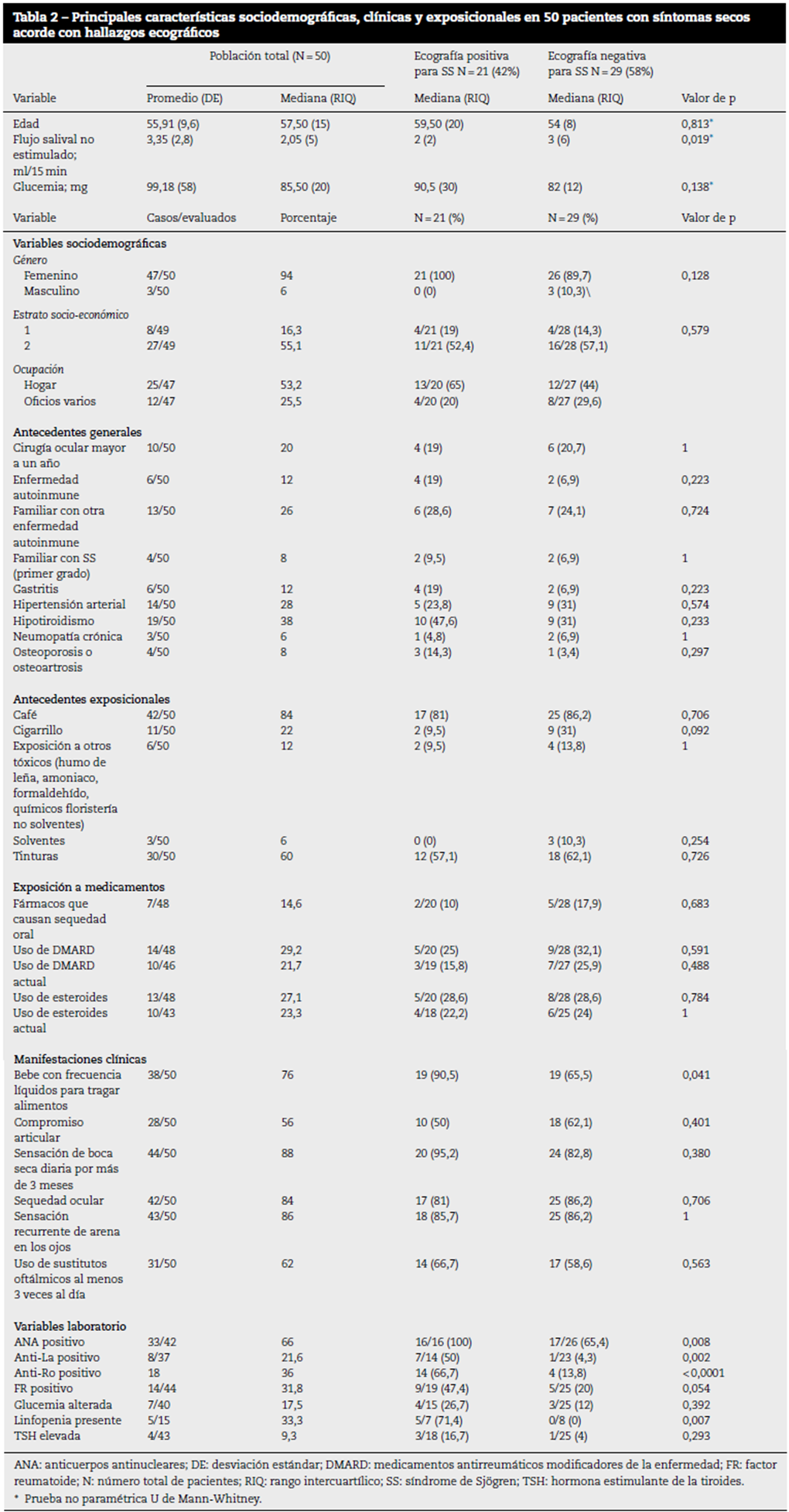
Figura 1 Ecografía de parótida normal. Paciente femenina de 54 años, quien cursa con 6 meses de evolución de síntomas secos, sin antecedentes de importancia, con positividad únicamente del test de Schirmer, sin criterios diagnósticos de SS (grado 0) adecuada visualización de los contornos de la parótida. Su ecogenicidad es homogénea. No se identifican áreas hipoecoicas o bandas ecogénicas en el interior del parénquima.
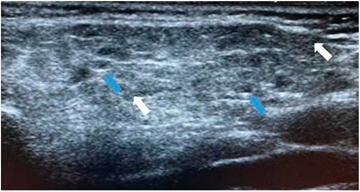
Figura 2 Ecografía de parótida con hallazgos ecográficos grado 1. Paciente femenina de 46 años con cuadro clínico de aproximadamente 5 años de síntomas secos, con antecedente de consumo de cigarrillos (índice paquete/año de 2,5 por 5 años), con estudios negativos para el diagnóstico de SS. Existe leve alteración en la ecogenicidad del parénquima parotídeo (flechas), con áreas de mayor y menor densidad (flechas blancas). Se identifican en su interior aisladas. Imágenes ovaladas hipoecoicas (flechas azules).
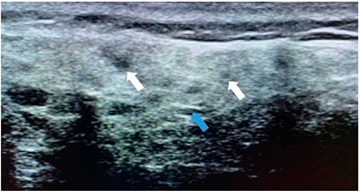
Figura 3 Ecografía de parótida con hallazgos ecográficos grado 2. Paciente masculino de 68 años con sintomatología seca de larga data, sin antecedentes clínicos de importancia, quien presenta ANA y anti-Ro positivo, alteraciones oftalmológicas, así como flujo salival patológico. Se observa ecogenicidad heterogénea del parénquima parotídeo, con evidencia de áreas ovaladas hipoecoicas de diferentes tamaños (flechas blancas). Se identifican algunas imágenes lineales ecogénicas en su interior (flecha azul).
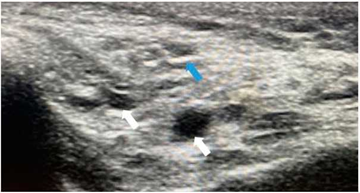
Figura 4 Ecografía de parótida con hallazgos ecográficos grado 3. Paciente femenina de 47 años con cuadro clínico de un año de evolución de síntomas secos, estudios inmunológicos (ANA, anti-Ro y anti-La) positivos, así como pruebas oftalmológicas patologías. Antecedente familiar de primer grado de SS (madre). Se identifica ecogenicidad heterogénea del parénquima parotídeo, con grandes áreas ovaladas hipoecoicas, algunas confluentes (flechas blancas). Asociado se identifican algunas imágenes lineales ecogénicas en su interior (flechas azules).
Según los criterios actuales para el diagnóstico del SS es necesaria la realización de la BGSM6. Si bien este es un procedimiento sencillo y de pocas complicaciones, presenta limitaciones como la realización del procedimiento en una institución hospitalaria para evitar complicaciones inmediatas (sangrado, lipotimia o hematomas) y otros como dolor, signos inflamatorios, trastornos de sensibilidad y granuloma20. Caporali et al., describieron efectos adversos como parestesias y tumefacción local, entre otros21. En otros estudios se describen los trastornos sensitivos (anestesia y parestesia) como las complicaciones encontradas con mayor frecuencia, siendo transitorias en la mayoría de los casos22. La BGSM es una prueba que puede llegar a ser incómoda para el paciente y puede dar falsos positivos; como en los fumadores y las personas que toman corticoides, en quienes se pueden presentar alteraciones histológicas23. En Colombia, este tipo de biopsia contempla mayor tiempo de espera para recibir la cita con el especialista, la autorización y la realización del procedimiento.
Se considera que una de las ventajas de las imágenes diagnósticas frente a la BGSM, es que tienen tiempos de espera mucho menor24. Además, la ecografía de la glándula salival es una herramienta simple, no invasiva, utilizada en pacientes con SS desde hace un par de décadas, sin embargo, en la actualidad no se tiene en cuenta como criterio diagnóstico; razón por lo cual múltiples estudios se han realizado para establecer su utilidad25,26. Diversos trabajos de investigación han intentado establecer un sistema de puntuación para estandarizar su uso y su mejor desempeño como prueba diagnóstica27,28. Para la detección y el seguimiento de cambios glandulares, la ecografía puede ser una buena modalidad de imagen, dado por su bajo costo, accesibilidad y la ausencia de complicaciones respecto a la biopsia29. En nuestro estudio se encontraron diferencias con tendencia a ser estadísticamente significativas, sin llegar a serlo, al compararse la positividad para BGSM entre los 2 grupos (ecografía con alteraciones paren-quimatosas positivas para el SS vs. pacientes con ecografía sin alteraciones), con un valor de p = 0,073, que se atribuye inicialmente al tamaño de la muestra.
Otro de los criterios diagnósticos para el SS es la presencia de anti-Ro. El perfil inmunológico para el paciente que cursa con una enfermedad autoinmune de tipo SS puede incluir adicionalmente: ANA, FRy anti-La. El presente estudio demuestra que existe asociación entre la presencia de anti-Ro (p < 0,0001), anti-La (p = 0,002) y ANA (p < 0,008) con alteraciones ecográficas y con tendencia a ser significativa con el FR (p = 0,054). Estudios previos habían encontrado una relación similar al presente estudio, referente a la positividad de las pruebas de anti-Ro, anti-La y alteraciones ecográficas13,30. De igual forma, se ha descrito la relación entre la presencia de FR y ecogra-fía en el paciente con SS, como lo fue descrito por Chiara et al., quienes encontraron asociación estadísticamente significativa con un valor de p<0,00011. Esto podría demostrar de manera indirecta la relación del subfenotipo serológico con el clínico evaluado a través de ecografía, lo que diferenciaría quizá a los pacientes con SS de los pacientes con sicca por otras causas. Recientemente, el grupo de Jousse-Joulin et al. han demostrado una asociación entre los hallazgos por ecografía y los criterios para SS 2016 ACR/EULAR, donde involucran la ecografía como un criterio más con un punto acorde a su positividad al igual que puntúa el test de flujo salival y las pruebas oftalmológicas31. Se determinó en el estudio mencionado, que la ecografía tuvo el mismo peso que las pruebas menores dentro de los criterios 2016 ACR/EULAR, lo que incrementó la sensibilidad y mantuvo la especificidad en valores similares a los de los criterios para su adecuada clasificación diagnóstica. Otros grupos han demostrado que al reemplazar la BGSM por la ecografía, en los criterios de 2016 ACR/EULAR, la sensibilidad y la especificidad disminuyeron ligeramente, pero al adicionarla como un criterio más, la sensibilidad mejoró, como se mencionó en el estudio de Jousse-Joulin et al.31.
Las glándulas salivales afectadas con el SS muestran hallazgos ecográficos característicos como son la presencia de áreas hipoecoicas delineadas por líneas o áreas hiperecoicas32. Estas alteraciones son visualizadas en la glándula, por lo tanto, condiciona heterogeneidad en el parénquima. La ecografía también ha sido utilizada como examen de seguimiento en aquellos pacientes con aumento del volumen persistente en las glándulas salivales en pacientes con el SS, con la ventaja de no necesitar radiación ionizante29. Es llamativo que a través del presente estudio se encontró una mayor presencia de xerostomía subjetiva en los pacientes con hallazgos patológicos en la ecografía, por medio de la pregunta ¿Bebe con frecuencia líquidos para tragar alimentos? (p = 0,041), así como objetiva por medio de la evaluación del flujo salival no estimulado (p = 0,019), siendo este último menor en los pacientes con hallazgos ecográficos asociados al SS. Si bien la asociación con biopsia positiva para el SS fue limítrofe (p = 0,073), todo lo anterior evidencia una relación directa entre las alteraciones apreciadas a través de la ecografía y el subfenotipo seco a nivel oral, bien sea a través de pruebas objetivas o subjetivas.
La ecografía como herramienta diagnóstica para el SS se ha estudiado en los últimos 15 años, los resultados de los estudios con mayor impacto se relacionan en la tabla 5.
Tabla 5 Resultados de los principales estudios a escala mundial utilizando ecografía en el SS.
| Autores | Año del estudio | Lugar de origen del estudio | Resultados ecográficos |
| De Vita et al.14 | 1992 | Italia |
|
| Salaffi y et al.33 | 2000 | Italia |
|
| Hočevar et al.34 | 2005 | Eslovenia |
|
| Theander y Mandl27 | 2014 | Suecia |
|
| E: especificidad; S: sensibilidad; SS: síndrome de Sjögren; SS 1rio: síndrome de Sjögren primario; SS 2rio: síndrome de Sjögren secundario. | |||
Se revisaron estudios que evalúan los hallazgos con aplicación del Doppler color y espectral en pacientes con SS. El grupo de Caroti et al. encontraron posterior a la administración de jugo de limón, aumento en la señal al Doppler color del parénquima afectado con aumento de las velocidades en ramas de la arteria carótida externa y facial. Aún faltan estudios que determinen la utilidad del Doppler en el diagnóstico del SS33-35.
Tras analizar los diferentes estudios mencionados, se destaca la escasez de trabajos originales en la población latinoamericana, lo que se debe resaltar debido a que el SS, en nuestro país, tiene una prevalencia importante reportada en el 2018 en mayores de 18 años del 0,08%36. En un estudio realizado en 20 países con pacientes con diagnóstico de SS provenientes de los 5 continentes, se demostró que los pacientes de Suramérica tenían mayor frecuencia de alteraciones en los test de evaluación ocular y positividad en los resultados de la BGSM37. Con lo mencionado previamente, se resalta la necesidad de estudiar estas poblaciones a través de nuevas herramientas diagnósticas como la ecografía.
El uso de distintos métodos imagenológicos para el diagnóstico o evaluación del SS ha sido amplio. Cada técnica y modalidad de imagen tiene ventajas y desventajas, así como mejor o menor sensibilidad y especificidad.
Uno de los métodos iniciales para la valoración de la glándula salival fue la sialografía, en la que se administra medio de contraste a través del conducto parotídeo, se evalúa la distribución y se clasifica según las alteraciones encontradas. Su principal desventaja es la exposición a radiación ionizante y posibles alergias al medio de contraste26,38.
La cintigrafía es una técnica de medicina nuclear que a través del uso de radiofármacos evalúa la función glandular. En pacientes con compromiso por el SS el tiempo de eliminación del radiotrazador puede tardar hasta una hora; lo que hace que el estudio sea de larga duración; adicionalmente, no hay amplia disponibilidad de gammacámaras en todos los hospitales lo que es un factor limitante para el uso de este método26.
Es conocida la utilidad de la resonancia magnética (RM) en la evaluación de la parótida en pacientes con sospecha de SS, los hallazgos se basan en las alteraciones en secuencias T1 como focos de hiperintensidad, que traducen en cambios por reemplazo graso de la glándula e involucro de la glándula por el SS39,40. Se han desarrollado técnicas a partir de la resonancia «sialografía por RM» que permite una mejor valoración de las glándulas41; esta técnica ha mostrado una alta sensibilidad y especificidad, sin embargo, su uso no es amplio al no tener disponibilidad de resonancia en todos los servicios de radiología.
La elastografía es un método que permite evaluar la rigidez de un tejido, actualmente su uso es amplio para evaluar el parénquima hepático16,42. Aún no se ha establecido su verdadera utilidad en pacientes con síndrome seco. De igual forma, la tomografía por emisión de positrones no ha sido estudiada para el diagnóstico del SS y lo descrito en la literatura son escasos reportes de casos43.
A nivel latinoamericano, se encontraron 5 trabajos que referencian el uso de la ecografía con SS15,16,24,44,45. En uno de los estudios realizado por Busamia et al., en Córdoba, Argentina, en el año 2016, en el cual se evalúo el compromiso de las glándulas salivales mayores en 50 pacientes, empleando la clasificación propuesta por De Vita et al.1,14, se reportó una concordancia entre grados de biopsia y ecografías de 0,633 con una p = 0,001, lo que indicó una alta asociación entre ambas variables15. Dado el vacío de conocimiento y el comportamiento de esta enfermedad en la población latinoamericana y colombiana, el presente estudio evaluó variables ecográficas comunes de modo similar a lo evaluado por Busamia et al., y se relacionaron con las pruebas clínicas establecidas, lo que determinó patrones específicos del comportamiento ecográfico cuando se comparan los pacientes con SS frente a los que no lo tienen, sin embargo, está aún por determinarse la sensibilidad y la especificidad del método, los cuales no fueron objeto de este estudio. Los hallazgos del presente estudio están en concordancia con los mostrados por Nitsche et al., quienes plasman su experiencia en el uso de la ecografía para la evaluación de glándulas salivales mayores en el SS de pacientes latinoamericanos y concluyen que esta modalidad refleja de manera indirecta el grado de infiltración de las glándulas salivales, siendo finalmente un buen método auxiliar para el estudio de la enfermedad44. Finalmente, los estudios de revisión de Martire et al.16 y los realizados por Lam y Saldarriaga et al., en el 2015 y 2016, respectivamente, donde desarrollan una revisión narrativa y exponen la utilidad de la ecografía de la glándula salival en distintas enfermedades (desde lo inflamatorio hasta lo tumoral), así como para el diagnóstico del SS24,45. Describen las alteraciones ecográficas de las glándulas en pacientes con SS y anotan las limitaciones como la variabilidad interobservador.
En el 2019 el grupo de OMERACT realizó un consenso de definiciones respecto a los hallazgos ecográficos normales y patológicos12. La clasificación semicuantitativa propuesta por este grupo es muy similar a la que utilizamos en el presente trabajo, implementando los mismos grados (0 a 3). De igual forma, desestimaron incluir en la evaluación ecográfica a las glándulas sublinguales, lo que tampoco fue contemplado en la clasificación utilizada por el presente estudio.
Dentro de los hallazgos novedosos en el grupo de trabajo de OMERACT, se incluyeron 2 descriptores adicionales a la clasificación: la presencia de reemplazo graso y la fibrosis en las glándulas salivales. Respecto al reemplazo graso, consideraron este hallazgo como posible característica normalmente visualizada en pacientes adultos mayores, y rara vez presente en pacientes con SS. La fibrosis fue considerada como un hallazgo que puede estar presente en pacientes con SS de larga data, y en algunas ocasiones en pacientes con corto tiempo de evolución de la enfermedad. En el presente trabajo no tuvimos en cuenta la presencia de reemplazo graso ni fibrosis, hallazgos que deben investigarse e incluirse en futuros trabajos.
Adicionalmente el estudio tiene como debilidad que las pruebas oftalmológicas no se evaluaron en su totalidad, obteniendo en el 90% (n = 45) de resultados, así como el flujo salival evaluado en el 88% (n = 44) de casos.
En la mayoría de los estudios que involucran la ecografía en el SS, se analizaron los pacientes con SS, sin enfermedades autoinmunes asociadas (poliautoinmunidad, previamente llamado SS secundario), sin embargo, dada la alta frecuencia de este fenómeno en esta enfermedad se decidió analizar la cohorte completa independiente de que presentaran otras enfermedades autoinmunes46. En el presente estudio no hubo diferencias en la proporción de pacientes con SS y poliautoinmunidad en comparación con aquellos con síndrome seco no SS y presencia de otras enfermedades autoinmunes (10,5 vs. 12,9%; p = 0,802). A su vez, la presencia de otras enfermedades autoinmunes no tuvo diferencias significativas al comparar los grupos con ecografía considerada positiva para el SS y aquellos con ecografía negativa. Con mayor vehemencia se resalta, que otra debilidad del presente estudio es la ausencia de pruebas que confirmaran si aquellos pacientes con hipotiroidismo tenían positividad para anticuerpos antitiroideos. La mediana de evolución en meses de los síntomas secos de los pacientes con SS fue de 24 (RIQ 84) y de 6 (RIQ 21) en aquellos con síntomas secos no SS, sin diferencias significativas (p = 0,464). Se determinó que, en futuros estudios con un tamaño de muestra mayor, se podría verificar si el tiempo de evolución de estos síntomas podría incidir en la diferenciación ecográfica entre aquellos con SS y quienes no lo padecen.
Existen estudios que han encontrado una relación directa entre los hallazgos patológicos en la ecografía de glándula salival, el pronóstico y el daño en pacientes con SS, medidos a través de escalas de actividad: EULAR Sjögren’s syndromeDisease Activity Index (ESSDAI), Sjögren’s syndromeDisease Activity Index (SSDAI), autoreporte como el Sjögren’s syndromePatient Reported Index (ESSPRI) y de daño Sjögren’s syndromeDisease Damage Index (SSDDI), siendo que aquellos pacientes con mayor puntaje en estas escalas, presentaron mayor puntaje acorde a la escala de De Vita en ecografía de glándulas salivales mayores47. Por último, se quiere resaltar la necesidad de nuevos estudios para evaluar la importancia de la ecografía en términos de pronóstico y daño en pacientes con SS.
Conclusión
A través de este estudio se puede concluir que la presencia de alteraciones a nivel de las glándulas salivales mayores es más acentuada (de manera significativa) en pacientes con diagnóstico definitivo de SS a través de criterios validados actuales, cuando se comparan con pacientes que consultan a un servicio de reumatología por síntomas secos no SS. A su vez, se demuestra la relación que existe entre la ecografía de glándulas salivales mayores y uno de los criterios propuestos por la ACR/EULAR6 para el diagnóstico del SS, como lo es el anti-Ro. Adicionalmente, se demuestra la relación que existe entre la positividad de la ecografía en términos de alteraciones que sugiere el SS y la presencia de ANA, factor reumatoide y anti-La; paraclínicos no involucrados en los criterios actuales clasificatorios del SS, pero indispensables en la valoración integral del paciente con enfermedad autoinmune. De igual forma se evidenció una relación significativa entre las alteraciones ecográficas y las alteraciones subjetivas y objetivas de xerostomía.
El presente trabajo busca llamar la atención al personal de salud encargado de valorar pacientes con esta enfermedad sobre la importancia que cobra la ecografía como una herramienta práctica, asequible, de bajo costo y reproducible, la cual puede aportar datos importantes para el diagnóstico de pacientes con el SS y posiblemente en su seguimiento.
Consideramos que el presente proyecto abre una ventana en la incursión de realización de nuevos estudios que permitan evaluar las características operativas de la prueba llegando incluso a proponer su uso dentro de nuevos criterios para el diagnóstico del SS.














