Introducción
Las miopatías inflamatorias idiopáticas (MII) son un grupo heterogéneo de entidades poco frecuentes, caracterizadas por un compromiso multisistémico que produce inflamación no supurativa de la musculatura esquelética que se puede acompañar de afectación orgánica en piel, articulaciones, pul món, tracto gastrointestinal y corazón1. Estas condiciones pueden conllevar un deterioro severo de la calidad de vida2. Su incidencia y prevalencia varía entre 1,16 y 19 millones por año y de 2,4 a 33,8 casos por cada 100.000 habitan tes, respectivamente, dependiendo de la zona geográfica, los métodos de investigación utilizados y los criterios de clasifi cación aplicados3.
Las entidades que hacen parte del grupo de MII inclu yen la dermatomiositis (DM), la polimiositis (PM), la miopatía necrosante inmunomediada (MNI) y la miositis por cuerpos de inclusión (MSI) (1. El síntoma cardinal es la debilidad mus cular, aunque puede haber una afectación órgano-específica que produzca un síndrome clínico específico. La demostración serológica de afectación inflamatoria muscular la constituye la elevación de la creatinfosfoquinasa (CPK), la aldolasa, la deshidrogenasa láctica (LDH) y las transaminasas. Entre las ayudas diagnósticas para demostrar el compromiso miopático se encuentran la electromiografía y la imagen por resonancia magnética, la cual, de igual forma, ayuda a orientar el sitio de la biopsia. Esta última es importante pues los hallazgos histopatológicos específicos permiten diferenciar los subtipos clínicos de MII4.
Los criterios de clasificación más utilizados para MII son los de Bohan y Peter5 y los de Tanimoto et al. (6, los cuales se basan en hallazgos clínicos, histopatológicos y neurofisiológicos, en combinación con niveles séricos elevados de enzimas musculares, así como autoanticuerpos específicos (solo en Tanimoto et al.). Sin embargo, no incorporan otros hallazgos útiles para distinguir los subtipos de pacientes con miositis, como lo son las imágenes por resonancia magnética y la caracteri zación por inmunohistoquímica, que incluye la expresión de moléculas del complejo mayor de histocompatibilidad (CMH) en las fibras musculares y subtipos de células inflamatorias involucradas4.
Hasta el momento en Colombia existen pocas descrip ciones de pacientes con MII, sin embargo, esta es la serie más grande hasta el momento. En este estudio se describen las características clínicas, serológicas y de tratamiento de pacientes con diagnóstico de MII en un hospital de cuarto nivel en Cali, Colombia.
Métodos
Pacientes
De forma retrospectiva, se revisaron las historias clínicas de pacientes con diagnóstico de MII, según los códigos CIE-10, que fueron tratados en la Fundación Valle del Lili, un hospital de cuarto nivel de complejidad, ubicado en Cali, Colombia, entre el 1 de enero del 2011 y el 31 de diciembre del 2017. Se selec cionaron aquellos pacientes con MII que cumplían criterios clasificatorios de Bohan y Peter5, en tanto que se excluyeron los pacientes menores de 18 años y aquellos con diagnós tico de miopatías por causa tóxica, metabólica, infecciosa o neuromuscular.
Se registraron las características clínicas y de laborato rio al momento del diagnóstico y durante el seguimiento. Las enfermedades autoinmunes asociadas fueron definidas de acuerdo con los criterios clasificatorios para las respec tivas enfermedades (artritis reumatoide, lupus eritematoso sistémico, esclerosis sistémica, síndrome de Sjögren, vascu litis). La refractariedad al tratamiento se definió como una falla en la respuesta con 2 medicamentos (de manera indi vidual o recibidos simultáneamente) inmunomoduladores o inmunosupresores al ser administrados en su dosis máxima por 3 meses. La remisión de la enfermedad se definió como la normalización de los valores de CPK y la mejoría de la debi lidad muscular por un periodo continuo de 6 meses o más. Este estudio fue aprobado por el comité de ética de nuestra institución.
Análisis estadístico
Se llevó a cabo un análisis estadístico descriptivo. Las variables continuas se expresaron en promedio y desviación estándar o mediana y rango intercuartílico, y fueron analizadas por medio de t test o Mann-Whitney U test, de acuerdo con la dis tribución de la normalidad. Para el análisis de datos se empleó el programa STATA 12.1.
Resultados
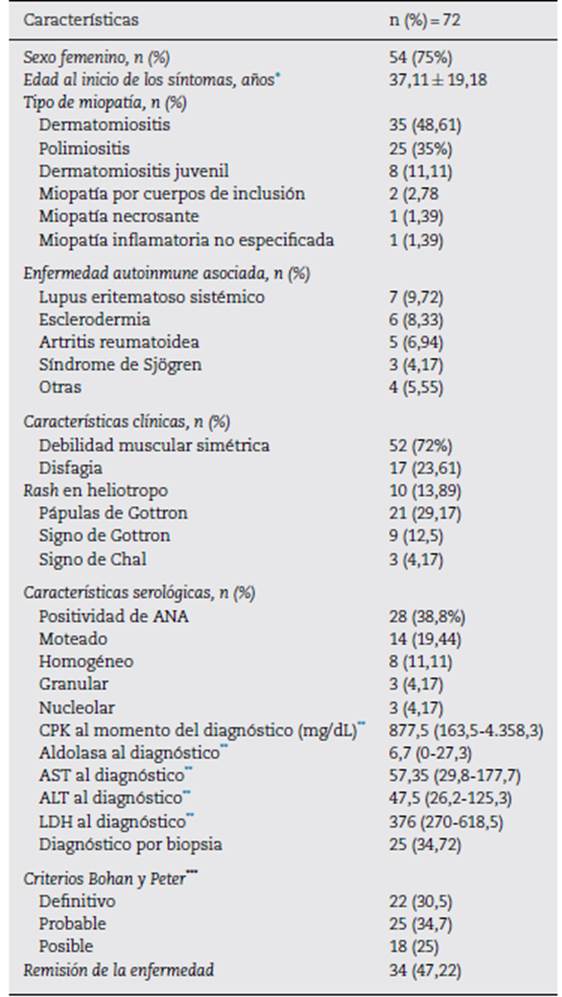
Durante el periodo de 2011-2017 se atendieron 270 pacientes con diagnóstico de miopatía. Después de la revisión de histo rias clínicas se descartaron 198 pacientes de acuerdo con los criterios de exclusión. Se obtuvo un total de 72 pacientes con MII, de los cuales 18 (25%) fueron hombres y 54 (75%) muje res, con predominio del sexo femenino en proporción 3:1. La media de edad de los pacientes en el momento del inicio de los síntomas fue de 37,11 ± 19,18 años. En torno a la distribu ción de MII, 35 pacientes (48,6%) tenían DM, 25 (34,7%) PM, 8 (11,1%) dermatomiositis juvenil, 2 (2,7%) MSI, 1 (1,3%) MNI y1 (1,3%) miopatía inflamatoria no especificada.
Con respecto a la frecuencia de los síntomas y los signos, la mayoría de los pacientes incluidos (72%) presentó síntomas de debilidad muscular y 17 (23,6%) presentaron disfagia. Dentro de las manifestaciones dermatológicas, las pápulas de Gottron se presentaron en 21 pacientes (29,7%), el signo de Gottron en 9 (12,5%), el rash en heliotropo en 10 (13,8%) y el signo de Chal en 3 (4,1%). Por otra parte, en relación con las comorbilidades, 25 pacientes (34,7%) presentaban enfer medad autoinmune asociada. El lupus eritematoso sistémico (LES), la más frecuente, se presentó en 7 pacientes (9,7%), seguido de la esclerodermia, en 6 (8,3%); la artritis reumatoide, en 5 (6,94%); el síndrome de Sjogren, en 3 (4,2%); la vasculitis del sistema nervioso central, la vasculitis cutánea leucocitoclástica, el síndrome poliglandular autoinmune y el pioderma gangrenoso, en un paciente (1,4%) cada una. Adicio nalmente, 39 pacientes (54,17%) presentaron comorbilidades no autoinmunes. Sin embargo, 19 (26,38%) registraron más de 2 enfermedades no autoinmunes de forma concomitante, entre las cuales destacaron: hipertensión arterial, en 11 casos (15,28%), enfermedad tiroidea, en 10 (13,89%) y diabetes mellitus en 6 (8,33%).
En 3 pacientes se documentaron enfermedades neoplásicas: 2 malignidades hematológicas (síndrome mieloproliferativo y linfoproliferativo) y un carcinoma de tiroides. En 14 pacientes (19%) se presentó compromiso pulmonar intersticial. De estos, 5 presentaron patrón en vidrio esmerilado (35,7%), al igual que panalización, de los cuales uno tenía sobreposición con esclerodermia y otro presentó la combina ción de ambos patrones. En los casos restantes se describió un patrón restrictivo pulmonar. De estos casos vale la pena mencionar que presentaban sobreposición con esclerodermia y en un caso con escoliosis. Así mismo, de los pacientes con compromiso pulmonar, la mayoría (n°=°6, 42,8%) alcanzó la remisión clínica en el último control por reumatología, mien tras que uno (7,1%) requirió oxígeno domiciliario permanente, otro (7,1%) requirió terapia de rehabilitación pulmonar y el resto presentó algún grado de compromiso clínico persistente, como disnea.
A 25 pacientes (34,7%) se les realizó la biopsia de músculo, lo que ayudó a confirmar el diagnóstico. En los 47 pacientes restantes (65,3%) el diagnóstico fue apoyado en electromiografía con patrón miotático, resonancia nuclear magnética con evidencia de edema muscular y el criterio clínico del reumatólogo. En cuanto a los exámenes de laboratorio, 28 pacientes (38,8%) tenían anticuerpos antinucleares (ANA) positivos (definidos como un título ≥1:160), siendo el patrón moteado el más frecuente, al presentarse en 14 pacientes (19,4%). El anti-Jo1 fue positivo en solo un paciente. Por último, la velocidad de sedimentación globular (VSG) y la proteína C reactiva (PCR) estaban elevadas en 33 (45,8%) y 26 (36%) pacientes, respecti vamente. En la tabla 1 se resumen las características clínicas y serológicas de los pacientes con MII.
Tabla 1 Características clínicas, demográficas y serológicas
∗ Promedio ± desviación estándar;
∗∗ Mediana (RIC); ALT: alanino aminotransferasa; ANA: anticuerpos antinucleares; AST: aspartato aminotransferasa; CPK: creatinfosfoquinasa; LDH: lactato deshidrogenasa. ***
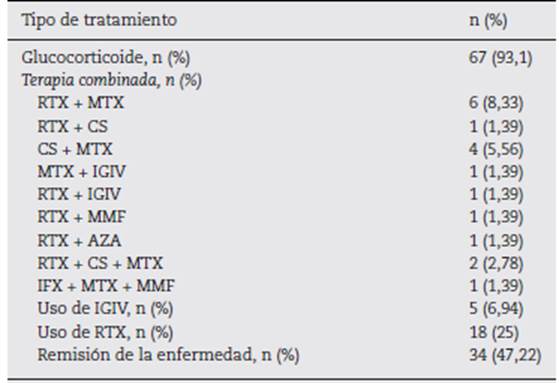
En relación con el tratamiento recibido, la mayoría de los pacientes (n = 67, 93,1%) se trató con glucocorticoides. La terapia inmunomoduladora constituye una alternativa para ahorrar dosis de estos. En general, los pacientes recibieron diferentes terapias convencionales inmunomoduladoras en el curso de la enfermedad, como metotrexato en 34 pacientes (47,2%) y azatioprina en 23 (31,9%). No obstante, la respuesta clínica se evidenció en 18 pacientes (25%) tratados con rituximab (RTX) como monoterapia o combinado con otro fármaco inmunosupresor (metotrexato, 6 (8,3%); ciclosporina, uno (1,3%); inmunoglobulina intravenosa, uno (1,3%); azatioprina, uno (1,3%); y micofenolato de mofetilo, uno (1,3%). Trece de los pacientes tratados con RTX presentaron respuesta al tratamiento, con una mediana de tiempo de 60 días (RIC: 36-141) posteriores a la aplicación de la primera dosis del medicamento, con objetivación de una mejoría en la fuerza muscular y descenso en las enzimas musculares. Previamente a la aplicación del RTX, la mediana de CPK fue de 687 U/L (RIC: 205-3.368), y después de su aplicación, teniendo en cuenta el reporte más cercano a la fecha de la evaluación de la fuerza muscular, la mediana de CPK fue de 167 U/L (RIC: 81,5-506,5).
La terapia combinada más utilizada después del RTX-metotrexato fue la ciclosporina-metotrexato, que se empleó en 4 pacientes (5,56%), en tanto que se utilizó inmunoglobulina intravenosa en 5 de ellos (5,64%). Si bien el RTX fue ampliamente utilizado, como monoterapia o en conjunto con otro medicamento, no se empleó como primera línea de tratamiento en ninguno de los casos, a diferencia de los glucocorticoides que se usaron inicialmente en todos los pacientes. En 34 pacientes (47,2%) se obtuvo la remisión de la enfermedad (tabla 2).
Discusión
Este es el registro más grande de pacientes con MII en Colombia. El estudio se realizó con el objetivo de analizar de forma retrospectiva las características clínicas, de laboratorio y tratamiento de los pacientes con MII en un hospital en Cali, Colombia.
En torno al subtipo de MII, la entidad más frecuente en casi la mitad de los pacientes fue la DM, a diferencia de otros estudios en los cuales la PM fue la entidad más común7,8. Este hallazgo podría estar relacionado con que varios de los pacien tes durante el proceso diagnóstico fueron reclasificados como DM después de los hallazgos histopatológicos compatibles con esta entidad. La biopsia muscular se realizó en el 35% de la población, constituyendo una herramienta adicional para el diagnóstico certero de los diferentes subgrupos de MII9-11.
Las MII se asocian a diversas enfermedades autoinmunes y se describen con una frecuencia muy variable, entre el 7% y el 60% de acuerdo con diferentes series12,13. En nuestra población la asociación con enfermedades autoinmunes fue del 35%, principalmente con LES. En un estudio retrospectivo realizado en Brasil con una cohorte de 220 pacientes, en el cual la inten ción fue estudiar la sobreposición de síndromes (PM/DM), se observó que las asociaciones más comunes fueron la esclero sis sistémica, el LES y la AR, con frecuencias del 48,4%, 29% y 22,6%, respectivamente14. En una cohorte de 160 pacientes con MII en Hungría, de aquellos pacientes que tenían un síndrome de sobreposición (39), 33,3% tenía escleromiositis, 27,6% AR, 23,1% síndrome de Sjogren y 12,8% LES15.
Los ANA pueden ser positivos en un 5,9% y hasta un 30,8% de la población sana16. Se presentan con mayor frecuencia en mujeres y en individuos de edad avanzada17. Pueden ser positivos también en enfermedades autoinmunes como AR, síndrome de Sjögren, esclerosis sistémica, enfermedad mixta del tejido conectivo y MII. En nuestra población, el 38,8% de los pacientes tenía ANA positivos, siendo el patrón moteado el más frecuente. Por otra parte, el anti-Jo1 fue positivo en solo un paciente. Este anticuerpo hace parte del grupo de anticuerpos específicos de miositis (MSA) y es el que se presenta con mayor frecuencia (hasta 20%) en MII. Además, se aso cia con el síndrome antisintetasa y constituye un marcador de mal pronóstico18. El resto del panel de autoanticuerpos específicos no se evaluó puesto que estos no se encuentran disponibles en nuestra institución.
La asociación de MII y malignidad se reportó desde 191619. Una de las cohortes más grandes de MII de Australia incluyó a 537 pacientes con diagnóstico confirmado por biopsia, y se encontraron 116 casos de malignidad en 104 pacientes, con una asociación mayor en aquellos pacientes con DM20. Un metaanálisis reciente describe el aumento del riesgo para malignidad en pacientes con PM y DM, con un riesgo rela tivo (RR) de 1,62 (IC 95% 1,19-2,04) y 5,50 (IC 95% 4,31-6,70), respectivamente21. Sin embargo, en nuestro estudio, solo 3 pacientes presentaron enfermedades neoplásicas asociadas con miopatía inflamatoria.
En relación con el tratamiento, son 3 los pilares fundamentales, e incluyen el control o la eliminación de factores causales, el uso de terapia inmunosupresora y rehabilita ción. En torno a los inmunosupresores, los GC constituyen la primera línea de tratamiento. En nuestro estudio, casi la totalidad de los pacientes recibió esta medicación. El metotrexate, la ciclosporina, la azatioprina, el micofenolato mofetilo, la ciclofosfamida y el IVIG constituyen una alternativa para aquellos casos refractarios, o son utilizados como ahorrado res de dosis de GC. Por otra parte, en pacientes refractarios a la primera línea de tratamiento, tras descartar otra condi ción subyacente (como miopatía necrosante o miositis por cuerpos de inclusión), se considera el inicio de agentes bio lógicos como el RTX22, el cual puede ser utilizado en conjunto con otro fármaco inmunomodulador o en monoterapia con GC.
El RTX es un anticuerpo monoclonal que se une al antígeno CD20 expresado en la superficie de los linfocitos B, lo que da como resultado la depleción de los CD20 positivos en san gre periférica dentro de los siguientes 6-9 meses23. Su uso se implementó de manera empírica en pacientes que no presen taron una adecuada respuesta al tratamiento convencional, bajo la premisa y evidencia de autoanticuerpos circulantes en alrededor de un 80% en los pacientes con MII y de célu las B en la región perivascular de los músculos en este grupo de pacientes24-26. En nuestro estudio 18 pacientes recibie ron este tipo de terapia inmunomoduladora combinada con RTX, siendo el metotrexato el fármaco más utilizado junto al RTX. Se observó una tasa de remisión de aproximadamente el 40%, en comparación con otros estudios cuya tasa es reportada como menor al 10%8.
Dentro de las limitaciones del estudio, no fue posible hacer la biopsia muscular en la totalidad de los pacientes, teniendo en cuenta que no se llevaba a cabo de manera protocolaria desde la fecha en que se empezó a registrar a los pacien tes. Otra limitación incluye el posible sesgo de selección al ser un estudio retrospectivo, e incluir pacientes registrados de acuerdo con el código CIE-10.
Conclusión
En esta cohorte, la miopatía inflamatoria más prevalente fue la DM, que es común en mujeres y se presenta en la cuarta década de vida. El tratamiento con glucocorticoides fue el más utilizado. La terapia inmunosupresora combinada constituye una alternativa para el control de la enfermedad.