Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Acessos
Acessos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares em
SciELO
Similares em
SciELO -
 Similares em Google
Similares em Google
Compartilhar
Revista Colombiana de Reumatología
versão impressa ISSN 0121-8123
Rev.Colomb.Reumatol. vol.29 no.1 Bogotá jan./mar. 2022 Epub 11-Jan-2023
https://doi.org/10.1016/j.rcreu.2020.09.008
Investigación original
Caracterización clínica de pacientes con miopatía inflamatoria en 2 instituciones de alta complejidad en Colombia: estudio descriptivo
a Departamento de Medicina Interna, Universidad Pontificia Bolivariana, Medellín, Colombia
b Escuela de Ciencias de la Salud, Universidad Pontificia Bolivariana, Medellín, Colombia
c Departamento de Investigación, Escuela de Ciencias de la Salud, Universidad Pontificia Bolivariana, Medellín, Colombia
d Departamento de Reumatología, Clínica Universitaria Bolivariana, Medellín, Colombia
Introducción:
Existe poca información sobre las miopatías inflamatorias en Colombia. El obje tivo fue identificar las características demográficas y clínicas de estos pacientes en dos instituciones de alta complejidad entre los arios 2010 y 2015.
Materiales y métodos:
Se realizó un estudio descriptivo y retrospectivo. Mediante revisión de registros médicos, se obtuvo información sobre variables demográficas y clínicas. Las variables cualitativas se expresaron mediante frecuencias absolutas y relativas, y las cuantitativas con media y desviación estándar (DE) o mediana con rangos intercuartílicos (RIQ), dependiendo de la distribución de los datos. Se utilizó el paquete estadístico IBM SPSS® v.22.
Resultados:
Se incluyeron 105 pacientes con edad promedio de 50,4 años (DE: 15,1); 76 mujeres (72,4%). En total, 50 sujetos (48,5%) tuvieron diagnóstico definitivo. La miopa tía inflamatoria más común fue dermatomiositis (n = 66; 62,9%). La piel fue el órgano más comúnmente afectado (n = 66; 62,9%). La debilidad muscular estuvo presente en 60 individuos (57,1%). El signo de alarma más frecuente fue el trastorno de la deglución (n = 28; 26,7%). La creatinfosfoquinasa tuvo mayor elevación en polimiositis con una mediana de 1.800 Ul/l (RIQ: 365-6.157). Los medicamentos más utilizados fueron los glucocorticoides (n = 83; 79%). Hubo refractariedad al tratamiento inmunosupresor, principalmente en síndrome antisintetasa (n = 5; 35,7%). Cinco pacientes (4,8%) murieron por infecciones (neumonía y bacteriemia).
Conclusiones:
En esta cohorte, la entidad más común fue la dermatomiositis y el órgano más afectado fue la piel. Hubo presentación relevante de signos de alarma, refractariedad al tratamiento inmunosupresor y valores de enzimas musculares menores comparados con otras cohortes. La mortalidad fue principalmente por complicaciones infecciosas.
Palabras clave: Dermatomiositis; Polimiositis; Colombia; Clasificación; Terapéutica
Background:
There is little information on inflammatory myopathies in Colombia. The objective was to identify the demographic and clinical characteristics of these patients in two tertiary care hospitals between 2010 and 2015.
Materials and methods:
A descriptive, retrospective survey was carried out, by reviewing medical records and obtaining information on demographic and clinical variables. The qualitative variables were expressed using absolute and relative frequencies, and the quantitative with mean and standard deviation (SD), or median with interquartile ranges (IQR), depending on data distribution. The IBM SPSS 22 statistical package was used.
Results:
A total of 105 patients with a mean age of 50.4 years (SD: 15.1) were included, with 76 (72.4%) women. In total, 50 subjects (48.5%) had a definitive diagnosis. The most common inflammatory myopathy was dermatomyositis (n = 66; 62.9%). The skin was the most commonly affected organ (n=66; 62.9%). Muscle weakness was present in 60 individuals (57.1%). The most frequent alarm sign was swallowing disorder (n = 28; 26.7%). Creatine phosphokinase was higher in polymyositis, with a median of 1800IU/L (IQR: 365-6157). The most widely used drugs were glucocorticoids (n = 83; 79%). Some patients were refractory to immunosuppressive treatment, mainly in antisynthetase syndrome (n = 5; 35.7%). Five patients (4.8%) died of infections (pneumonia and bacteraemia).
Conclusions:
In this cohort, the most common entity was dermatomyositis, and the most affected organ was the skin. There was a significant presentation of warning signs, refractoriness to immunosuppressive treatment, and lower muscle enzyme values compared to other cohorts. Mortality was mainly due to infectious complications.
Keywords: Dermatomyositis; Polymyositis; Colombia; Classification; Therapeutics
Introducción
Las miopatías inflamatorias (MII) son un grupo heterogéneo de enfermedades autoinmunes crónicas adquiridas, con compro miso multisistemico1, que tienen una etiología desconocida, fisiopatología autoinmune y son de pronóstico variable. Entre las MII se encuentran: la dermatomiositis (DM), la polimiositis (PM), las miopatías por cuerpos de inclusión (MCI), la miositis necrosante (NM), la miopatía inflamatoria -como parte de un síndrome de superposición con otras enfermeda des autoinmunes-, el síndrome paraneoplásico y el síndrome antisintetasa (SAS) (2-6.
En las MII, el inicio de los síntomas, que suele ser agudo o subagudo, se manifiesta principalmente con debilidad mus cular proximal y simétrica, secundaria a la inflamación y la necrosis de la fibra muscular3,7,8. Conforme progresa la enfermedad, puede generarse atrofia crónica e irreversible, que constituye una importante causa de discapacidad y morbilidad3,7.
Como enfermedades sistémicas, las MII pueden asociarse con manifestaciones extramusculares, entre las cuales las más frecuentes son las cutáneas y las pulmonares. Una de estas últimas es el síndrome antisintetasa, el cual conlleva un peor pronóstico3,7,9.
El curso clínico de las MII es variable, con patrones: monocíclico, policíclico y activos de forma persistente10. El tratamiento de estas entidades se basa en glucocorticoides, pero pueden utilizarse otros inmunomoduladores e inmunosupresores7,10.
Estimar con precisión los datos epidemiológicos de las MII es difícil, dada su baja prevalencia y las variaciones en los cri terios de clasificación8. Revisiones sistemáticas y estudios de cohorte han calculado una incidencia global que oscila entre 6 pacientes/1.000.000/año y una prevalencia de 14/100.000 habitantes11-13. En el registro EuroMyositis13 se encontró la DM como el subtipo más común de las MII (31%). En los adultos estas enfermedades se presentan entre los 45 y los 65 años14,15, con más frecuencia en el género femenino, con una relación M:H (2:1) (13,15-17.
En Latinoamérica existen pocos estudios con respecto a la epidemiología y el comportamiento de estas enfermedades18, y se encuentran diferencias con lo publicado en la literatura global.
En Colombia se han publicado algunos reportes de caso19-22 y estudios descriptivos23,24 acerca de estas entidades. En los últimos años ha cambiado su clasificación, concepción y tra tamiento, por lo cual resulta relevante y necesario obtener información actualizada de estas enfermedades. El objetivo del presente estudio fue describir las características demográ ficas y clínicas de los pacientes con MII en 2 instituciones de alta complejidad.
Materiales y métodos
Diseño del estudio y selección de los pacientes
Se llevó a cabo un estudio observacional, descriptivo, retros pectivo de una cohorte de pacientes con MII admitidos en 2 centros de alta complejidad entre los años 2010 y 2015.
Se incluyeron pacientes mayores de 18 años, con diagnós tico de DM o PM realizado por médico reumatólogo o que cumpliera con los criterios de Bohan y Peter modificados6,25-28. Se excluyeron pacientes que tuvieran diagnóstico de otra enfermedad reumatológica.
Proceso de recolección de la información
La información del estudio se obtuvo mediante la revisión de historias clínicas físicas y electrónicas de los pacientes que cumplieron con los criterios de inclusión, los datos fue ron registrados en un formulario electrónico diseñado con la herramienta MAGPI, según las variables necesarias para cum plir con los objetivos del estudio. Se hizo una prueba piloto con 12 historias clínicas, con el fin de estandarizar el proceso de recolección, verificar la calidad de los datos registrados y realizar posibles ajustes al formulario.
En el caso de las variables no encontradas en los registros de historia clínica seleccionados, se llevó a cabo una búsqueda en registros de enfermería, resultados de laboratorio y valoraciones hechas por otras especialidades.
Las variables recolectadas fueron las siguientes:
Demográficas: edad, sexo, fecha de nacimiento y edad en años al momento del diagnóstico.
Antropométricas: peso, talla e índice de masa corporal.
Características clínicas: compromiso muscular (distal o pro ximal), escala de fuerza muscular (según Medical Research Council29) y comorbilidades (neoplasias, infecciosas, car diovasculares, sistémicas).
Se clasificaron las MII según los criterios de Bohan y Peter modificados30. Para la miopatía por cuerpos de inclusión, se tuvieron en cuenta los criterios del Centro Europeo Neuromuscular (ENMC, por sus siglas en inglés) 201131, mientras que en el caso de la miopatía necrosante se tuvieron en cuenta hallazgos clínicos y la relación temporal con el uso de medicamentos32.
Desenlaces clínicos: hospitalización, ingreso a unidad de cuidados intensivos, muerte, infecciones recurrentes (defi nidas como más de un episodio de infección en los últimos seis meses que hubiera requerido manejo hospitalario), complicaciones, limitación funcional determinada por la clase funcional de Steinbroker33, deterioro de la función renal (incremento mayor a 0,3mg/dl/en 48 h o más de 1,5 veces el valor de la creatinina basal) (34, refractariedad al tratamiento (definida como falla para lograr remisión de la enfermedad luego de una dosis de 0,5 mg/kg de metilprednisolona durante un mes, con desmonte progresivo en los siguientes 3 meses o incapacidad para obtener mejoría luego de tratar con terapia inmunosupresora de segunda línea o inmunoglobulina) (35.
Laboratorio: creatincinasa total (CPK), lactato deshidrogenasa (LDH), aldolasa, transaminasas (AST, ALT), pruebas de autoinmunidad (ANA, anti-ENA, anti Jo-1).
Ayudas diagnósticas: resonancia magnética nuclear (RMN), electromiografía (EMG) y biopsia muscular.
Tratamiento: glucocorticoides y otros medicamentos inmunomoduladores a inmunosupresores (cloroquina, hidroxicloroquina, metotrexate, micofenolato mofetil, inmunoglobulina intravenosa, ciclosporina, tacrolimus, azatioprina y rituximab) según el tipo de miopatía inflamatoria.
Procesamiento de la información
La información fue exportada a una base de datos de Microsoft Excel® 2011, la cual contenía campos de restricción de ingreso de datos para disminuir posibles errores en la digitación; ade más, se hizo una categorización de las variables cuantitativas según los criterios clínicos. Antes de proceder al análisis de la información, se verificó su consistencia mediante la explora ción de valores y la concordancia de los datos registrados. En caso de algún dato confuso, se hizo una nueva revisión de la historia clínica.
Plan de análisis
Las variables cualitativas se expresaron mediante frecuencias absolutas y relativas, mientras que para las cuantitativas se emplearon media y desviación estándar (DE), o mediana con sus respectivos rangos intercuartílicos (RIQ) dependiendo de la distribución de los datos. Los análisis estadísticos se llevaron a cabo con el paquete estadístico IBM SPSS® v.22.
Control de sesgos
Consideraciones éticas
Según la Resolución 8430 de 1993, artículo 11, del Ministe rio de Salud de Colombia, esta investigación se considera sin riesgo, ya que se utilizaron métodos documentales retrospectivos realizando una revisión de historias clínicas, con previa aprobación por parte del comité de ética de inves tigación de las instituciones participantes.
Resultados
Características demográficas y comorbilidades
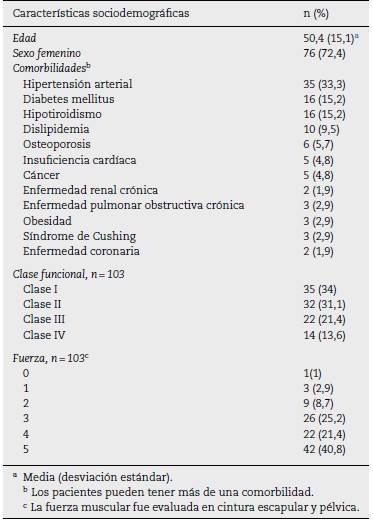
Se revisaron 315 registros clínicos, de los cuales 105 cum plieron criterios de elegibilidad; 76 pacientes (72,4%) fueron mujeres, la edad promedio fue de 50,4 (±15,1) años al momento del ingreso a la cohorte. La comorbilidad más fre cuente fue la hipertensión arterial (n= 35; 33,3%), seguida por la diabetes mellitus (n = 16; 15,2%) y el hipotiroidismo (n = 16; 15,2%). En cuanto a la clase funcional al momento de ingre sar a la cohorte, la mayoría tenía clases II (31,1%) y III (21,4%). Cincuenta y un sujetos (48,6%) requirieron hospitalización y 7 (6,7%) ingresaron a la unidad de cuidados intensivos (tabla 1).
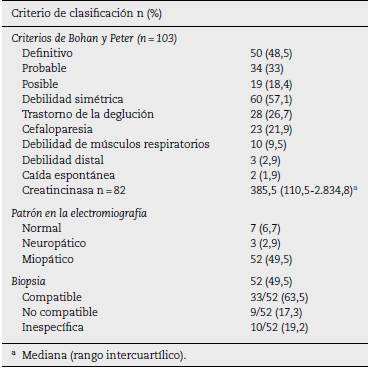
Criterios de clasificación
La miopatía inflamatoria se clasificó como definitiva en 50 individuos (48,5%). Adicionalmente, 60 pacientes (57,1%) presentaron debilidad muscular simétrica, seguida en fre cuencia por trastorno de la deglución (26,7%).
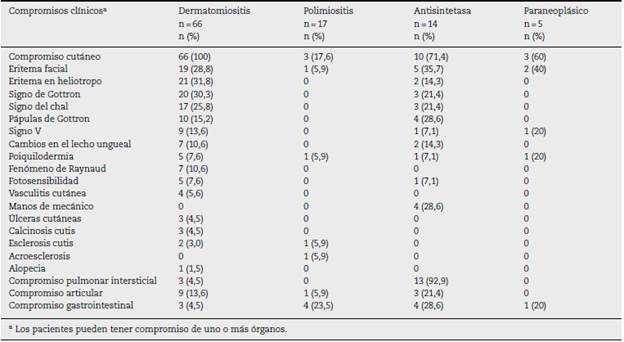
En cuanto a las ayudas diagnósticas, la RMN muscular se llevó a cabo en 44 sujetos (41,9%), de los cuales 8 (18,2%) tuvieron un resultado compatible con miopatía inflamatoria (tabla 2). El tipo de miopatía inflamatoria más frecuente fue la dermatomiositis (n = 66; 62,9%) (tabla 3).
Tabla 2 Criterios de clasificación, predictores de gravedad y ayudas diagnósticas en una cohorte de miopatía inflamatoria
Características clínicas según tipo de miopatía inflamatoria
La piel fue el órgano comprometido con mayor frecuencia, especialmente en dermatomiositis (n = 66; 100%), y de estas manifestaciones cutáneas, el eritema en heliotropo (n = 21; 31,8%) y el signo de Gottron (n = 20; 30,3%) fueron los más frecuentes.
En el síndrome antisintetasa el pulmón fue el órgano más afectado (n = 13; 92,9%), debido sobre todo a enfermedad pul monar intersticial, mientras que el compromiso articular se presentó en 3 (21,4%) pacientes (tabla 4).
Hallazgos de laboratorio
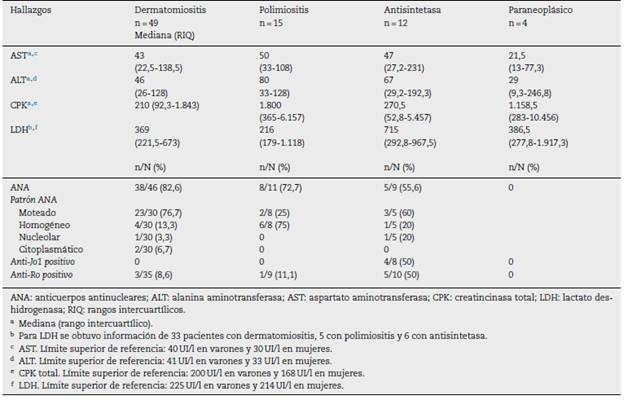
Las enzimas musculares que más presentaron elevación en todos los grupos de miopatías fueron la CPK total y la LDH. La CPK total tuvo mayor elevación en polimiositis, con una mediana de 1.800 UI/l (365-6.157), mientras que para la LDH se registró mayor elevación en el síndrome antisintetasa, con una mediana de 715 UI/l (292,8-967,5). Los anticuerpos anti-Ro fueron positivos en el 50% de los pacientes con síndrome antisintetasa y en el 11,1% de individuos con polimiositis. En la tabla 5 se presentan otros resultados.
Tratamiento
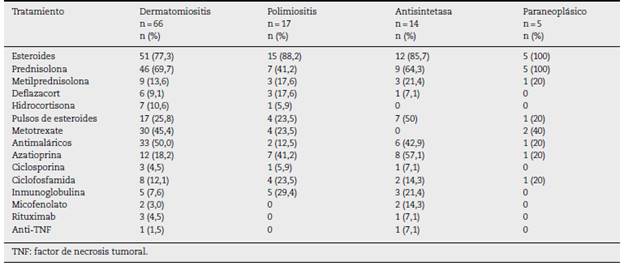
Los esteroides, utilizados en 83 (81,3%) sujetos, fueron el prin cipal tratamiento en todos los tipos de miopatías. El esteroide usado con mayor frecuencia fue la prednisolona (n = 67; 65,7%), seguido por la metilprednisolona (n=16; 15,7%). Siete (50%) individuos con síndrome antisintetasa requirieron pulsos de esteroides, mientras que en el grupo de miopatías paraneo-plásicas solo uno requirió esta terapia.
Por otra parte, los antimaláricos fueron usados con mayor frecuencia en los pacientes con dermatomiositis (n = 33; 50%); la azatioprina (AZA) se utilizó en 8 (57,1%) de los pacientes con síndrome antisintetasa. Finalmente, el micofenolato mofetil (MF) se usó en 2 pacientes con síndrome anti-sintetasa. El metotrexate (MTX) se empleó en 36 (33,3%) pacientes de todos los tipos de miopatía. El resto del manejo inmunosupresor se describe en la tabla 6. Dos pacientes recibieron anti-TNF por miopatía inflamatoria refractaria: una paciente con dermatomiositis tratada con adalimumab y un paciente con síndrome antisintetasa tratado con etanercept.
Desenlaces clínicos
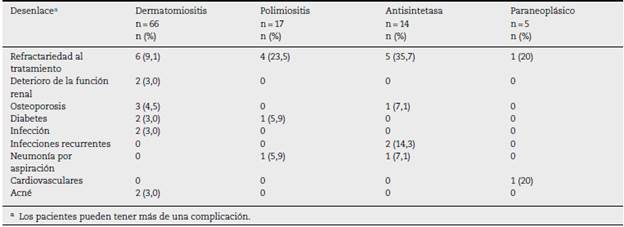
La complicación más frecuente fue la refractariedad al tratamiento inmunosupresor, principalmente en síndrome antisintetasa (n = 5; 35,7%) yen la polimiositis (n = 4; 23,5%); la segunda en frecuencia correspondió a infecciones recurrentes en el grupo de síndrome antisintetasa (n = 2; 14,3%), seguida por neumonía por aspiración en síndrome antisintetasa (n = 1; 7,1%) y en polimiositis (n = 1; 5,9%) (tabla 7). Dos pacientes pre sentaron compromiso renal, el cual fue explicado por otras etiologías diferentes a miopatías inflamatorias.
Cinco pacientes (4,8%) fallecieron durante la primera valo ración, de los cuales 2 tenían miopatía paraneoplásica, uno dermatomiositis, uno polimiositis y otro síndrome antisintetasa; 4 de estos pacientes fallecieron por complicaciones infecciosas como neumonía y bacteriemia, mientras que un paciente falleció por paro cardiorrespiratorio secundario a falla respiratoria.
Discusión
Hasta donde se tiene conocimiento, este es el estudio más amplio sobre miopatías inflamatorias en Colombia.
Se encontró una mayor proporción de mujeres afec tadas, lo cual concuerda con otros estudios locales e internacionales12,13,15,23,36.
Dentro de las comorbilidades, los hallazgos son similares a otras series de pacientes37-39.
Por otro lado, se destaca la importante cantidad de pacien tes que requirieron ingreso a hospitalización y unidad de cuidados intensivos, lo que es indicio de un curso crónico, progresivo y grave. Otros autores también han descrito una mayor tasa de hospitalización en pacientes con miopatías inflamatorias40,41, lo cual se relaciona con el curso progresivo de la enfermedad40.
En la actualidad existen varios criterios de clasificación para las miopatías inflamatorias (Bohan y Peter27,28, Tani-moto et al. (42, Targoff et al. (43, Dalakas y Hohlfeld2, ENMC(30), sin embargo, la mayoría no han sido ampliamente valida dos. Los más utilizados en los diferentes estudios clínicos son los de Bohan y Peter, con una alta sensibilidad (98%) y baja especificidad (55%)27,28. En nuestro estudio, el diagnós tico de miopatía inflamatoria fue realizado por criterio clínico del reumatólogo tratante, en tanto que los pacientes fueron clasificados de acuerdo con los criterios de Bohan y Peter modi ficados. Recientemente, se publicaron los nuevos criterios clasificatorios American College of Rheumatology (ACR)/European League Against Rheumatism (EULAR), los cuales han demos trado tener una buena correlación con los criterios de Bohan y Peter ampliamente utilizados, con una sensibilidad del 93% y una especificidad del 88% cuando se tiene información de biopsia44. Lo anterior muestra que los criterios de clasificación utilizados en la cohorte tienen un desempeño adecuado, incluso al compararlos con los nuevos criterios.
El compromiso muscular en la mayoría de los pacientes se dio por debilidad proximal y simétrica. En el estudio realizado por Pinto et al. (23 se encontró debilidad muscular en cintura pélvica hasta en el 80% de los pacientes, y se hicieron hallaz gos cutáneos en dermatomiositis similares a los descritos en nuestra cohorte, excepto por una mayor frecuencia de fenó meno de Raynaud, cambios vasculíticos, manos de mecánico, poiquilodermia y calcinosis cutis.
Otras manifestaciones extramusculares como la disfagia, el compromiso articular y la enfermedad pulmonar intersticial difusa (EPID) fueron similares a los hallazgos hechos por Pinto et al. (23. Por otro lado, en un estudio publicado por Dobloug et al. se encontró debilidad muscular como hallazgo predomi nante en el 84% de los pacientes, disnea en el 44% de DM y el 22% de PM, disfagia en el 23% y fenómeno de Raynaud junto con manos de mecánico, que fueron más frecuentes en DM45. Al comparar lo descrito anteriormente con los datos reporta dos por el registro EuroMyositis13, se puede apreciar que hubo similitud en la debilidad muscular como síntoma cardinal de los diferentes subtipos de miopatías; sin embargo, en dicho registro hubo mayor frecuencia de algunas manifestaciones cutáneas como fenómeno de Raynaud, manos de mecánico, calcinosis cutis y úlceras cutáneas; mientras que en el SAS hubo mayor compromiso articular que en lo descrito en nues tra cohorte.
Con respecto a las ayudas de laboratorio, debe aclararse que solo se encuentran algunos anticuerpos específicos de miositis (anti-Jo1, y anti-Pm/Scl); no obstante, en la descripción de los criterios clasificatorios ACR/EULAR30 también se puso en evidencia la falta de disponibilidad de los datos de anticuerpos específicos.
Al evaluar los resultados de laboratorio resulta llamativo que la mitad de los pacientes con antisintetasa tuvieron posi tividad de anti-Ro y anti-Jo1. Koenig et al. (46 mostraron que los anticuerpos anti-Jo1 se encontraron de manera concomitante con los anti-Ro en un 73%, en tanto que se halló una menor respuesta a la prednisolona y un mayor requerimiento de tera pia de segunda línea entre aquellos pacientes con positividad de anti-Jo1, lo cual podría ser una explicación de por qué en nuestra cohorte el subgrupo de antisintetasa fue más refrac tario al tratamiento y requirió mayor cantidad de pulsos de esteroides.
En nuestra serie, las enzimas musculares que más presen taron elevación fueron la CPK total y la LDH; sin embargo, existen algunas diferencias con respecto a otras publicaciones de Noruega45 y España37 en las que se encontraron mayo res niveles de CPK total en pacientes con dermatomiositis, polimiositis y síndrome paraneoplásico. Algunas hipótesis podrían explicar tal hallazgo, como el hecho de que muchos pacientes venían con diagnóstico y tratamiento inmunosupresor previamente al ingreso al estudio, y es posible que esto disminuya los niveles de CPK total. Otra explicación de estos hallazgos es que los pacientes con MII de larga dura ción pueden presentarse con valores de CPK total cercanos a lo normal, lo cual ocurre cuando la mayor parte del mús culo ha sido afectada y se reemplaza por tejido graso. También debe reconocerse la baja especificidad de la LDH en miopatías inflamatorias47.
Lo descrito en el presente estudio es concordante con los esquemas de tratamiento analizados por Meyer et al. (48. Otros estudios, en su mayoría cohortes retrospectivas13,37,49, series de casos50 y algunos ensayos clínicos51-54, han descrito el uso de esteroides como terapia de primera línea aunado a otros inmunosupresores8,50. En una publicación realizada por Nuño et al. (37, los esquemas de tratamiento utilizados fueron simila res a los encontrados en el presente trabajo. Llamó la atención el uso de anti-TNF en 2 pacientes de la cohorte (uno con dermatomiositis y otro con síndrome antisintetasa), en los cuales estos medicamentos se utilizaron por enfermedad refracta ria. En ninguno de los 2 casos hubo respuesta; además, existe evidencia de recaídas frecuentes55 con su uso y la posible inducción y el empeoramiento de la miopatía inflamatoria y el compromiso pulmonar en estas entidades56.
Los hallazgos relacionados con complicaciones y mortali dad fueron semejantes a complicaciones infecciosas descritas en un estudio publicado por Murray et al. (57, en el cual se reportó que, de las 15.407 hospitalizaciones por DM y PM, el 4,5% de los pacientes murió y las principales causas de mortalidad fueron neumonía e infección. Las infecciones en pacientes con MII pueden ser explicadas por el mayor riesgo de infecciones bacterianas y fúngicas, incluso en ausencia de manejo inmunosupresor, lo cual sugiere defectos en la inmu nidad mediada por células que predisponen a infecciones. Asimismo, se presentaron menos muertes con respecto a otros estudios23,49,58, dado que se trata de la descripción del ingreso de los pacientes a la cohorte y no hay datos de seguimiento en el tiempo.
Este estudio tiene varias limitaciones: fue inevitable el sesgo de selección, debido a que los centros participantes tie nen un alto nivel de complejidad y es posible que los pacientes tuvieran mayor gravedad de la enfermedad o fueran amplia mente estudiados. Adicionalmente, puede haber sesgos de información asociados al diseño retrospectivo del estudio, pero se trató de controlarlos con las estrategias descritas en materiales y métodos.
Como fortalezas de este trabajo se destacan el importante número de pacientes incluidos y los criterios clasificatorios actualizados.
Conclusiones
En una cohorte de pacientes con miopatías inflamatorias del noroccidente colombiano se encontró una frecuencia impor tante de hospitalización y de ingreso a la unidad de cuidados intensivos, lo cual tiene relación con mayor gravedad de la enfermedad y refractariedad al tratamiento. Asimismo, hubo un número importante de pacientes con síndrome antisintetasa, quienes a su vez presentaron mayor refractariedad al tratamiento.
Agradecimientos
A las instituciones participantes
REFERENCIAS
1. Dalakas MC. Polymyositis, dermatomyositis and inclusion-body myositis. N Engl J Med. 1991;325:1487-98, http://dx.doi.org/10.1056/NEJM199111213252107. [ Links ]
2. Dalakas MC, Hohlfeld R. Polymyositis and dermatomyositis. Lancet. 2003;362:971-82, http://dx.doi.org/10.1016/S0140-6736(03)14368-1. [ Links ]
3. Dalakas MC. Inflammatory muscle diseases: a critical review on pathogenesis and therapies. Curr Opin Pharmacol. 2010;10:346-52, http://dx.doi.org/10.1016/j.coph.2010.03.001. [ Links ]
4. Schmidt J, Dalakas MC. Pathomechanisms of inflammatory myopathies: recent advances and implications for diagnosis and therapies. Expert Opin Med Diagn. 2010;4:241-50, http://dx.doi.org/10.1517/17530051003713499. [ Links ]
5. Mastaglia FL, Phillips BA. Idiopathic inflammatory myopathies: epidemiology, classification, and diagnostic criteria. Rheum Dis Clin North Am. 2002;28:723-41, http://dx.doi.org/10.1016/s0889-857x(02)00021-2. [ Links ]
6. Lundberg IE, Miller FW, Tjärnlund A, Bottai M. Diagnosis and classification of idiopathic inflammatory myopathies. J Intern Med. 2016;280:39-51, http://dx.doi.org/10.1111/joim.12524. [ Links ]
7. Dalakas MC. Inflammatory muscle diseases. N Engl J Med. 2015;372:1734-47, http://dx.doi.org/10.1056/NEJMra1402225. [ Links ]
8. Schmidt J. Current classification and management of inflammatory myopathies. J Neuromuscul Dis. 2018;5:109-29, http://dx.doi.org/10.3233/JND-180308. [ Links ]
9. Lazarou IN, Guerne PA. Classification, diagnosis, and management of idiopathic inflammatory myopathies. J Rheumatol. 2013;40:550-64, http://dx.doi.org/10.3899/jrheum.120682. [ Links ]
10. Ernste FC, Reed AM. Idiopathic inflammatory myopathies: Current trends in pathogenesis, clinical features, and up-to-date treatment recommendations. Mayo Clin Proc. 2013;88:83-105, http://dx.doi.org/10.1016/j.mayocp.2012.10.017. [ Links ]
11. Meyer A, Meyer N, Schaeffer M, Gottenberg JE, Geny B, Sibilia J. Incidence and prevalence of inflammatory myopathies: a systematic review. Rheumatology. 2014;54:50-63, http://dx.doi.org/10.1093/rheumatology/keu289. [ Links ]
12. Furst DE, Amato AA, Lorga SR, Gajria K, Fernandes AW. Epidemiology of adult idiopathic inflammatory myopathies in a U.S. managed care plan. Muscle Nerve. 2012;45:676-83, http://dx.doi.org/10.1002/mus.23302. [ Links ]
13. Lilleker JB, Vencovsky J, Wang G, Wedderburn LR, Diederichsen LP, Schmidt J, et al. The EuroMyositis registry: an international collaborative tool to facilitate myositis research. Ann Rheum Dis. 2018;77:30-9, http://dx.doi.org/10.1136/annrheumdis-2017-211868. [ Links ]
14. Irazoque-Palazuelos F, Barragán-Navarro Y. Epidemiología, etiología y clasificación. Reumatol Clin. 2009;5:2-5, http://dx.doi.org/10.1016/j.reuma.2009.09.007. [ Links ]
15. Prieto S, Grau JM. The geoepidemiology of autoimmune muscle disease. Autoimmun Rev. 2010;9:A330-4, http://dx.doi.org/10.1016/j.autrev.2009.11.006. [ Links ]
16. Amato AA, Greenberg SA. Inflammatory myopathies. Continuum (Minneap Minn). 2013;19:1615-33, http://dx.doi.org/10.1212/01.CON.0000440662.26427.bd. [ Links ]
17. Grable-Esposito P, Katzberg HD, Greenberg SA, Srinivasan J, Katz J, Amato AA. Immune-mediated necrotizing myopathy associated with statins. Muscle Nerve. 2010;41:185-90, http://dx.doi.org/10.1002/mus.21486. [ Links ]
18. Shamim EA, Rider LG, Pandey JP, O'Hanlon TP, Jara LJ, Samayoa EA, et al. Differences in idiopathic inflammatory myopathy phenotypes and genotypes between Mesoamerican Mestizos and North American Caucasians: ethnogeographic influences in the genetics and clinical expression of myositis. Arthritis Rheum. 2002;46:1885-93, http://dx.doi.org/10.1002/art. 10358. [ Links ]
19. Escobar MR, González Naranjo LA, Pantoja Márquez AE, Ramírez Gómez LA, Vásquez Duque GM. Complicaciones pulmonares de las miopatías inflamatorias idiopáticas: a propósito de un caso con miopatía diafragmática. Rev Colomb Reumatol. 2009;16:301-9, http://dx.doi.org/10.1016/S0121-8123(09)70106-9. [ Links ]
20. de la Cámara Fernández I, de Juanes Montmeterme A. Miopatía inflamatoria asociada a timoma: reporte de un caso. Rev Colomb Reumatol. 2017;24:193-5, http://dx.doi.org/10.1016/j.rcreu.2017.02.008. [ Links ]
21. Guzmán CV, Cubides MF, Reyes E, Londoño J, Santos P, Bautista W, et al. Miopatía por cuerpos de inclusión: caso clínico y revisión de la literatura. Rev Med. 2010;18:93-9, http://dx.doi.org/10.18359/rmed.1302. [ Links ]
22. Mesa M, Pinto LF, Velásquez-Franco CJ, Ortega H, Márquez JD. Enfermedad pulmonar intersticial como manifestación inicial de síndrome antisintetasa. Rev Colomb Reumatol. 2010;17:257-64, http://dx.doi.org/10.1016/S0121-8123(10)70073-6. [ Links ]
23. Pinto L, Ángel A, Bohórquez R, López C. Caracterización de los pacientes con polimiositis y dermatomiositis del Servicio de Reumatología del Instituto de Seguros Sociales de Medellín, Colombia, 1992-2000. Rev Colomb Reumatol. 2003;10:9-18. [ Links ]
24. Vega Castro KP [consultado 15 Jun 2020]. Disponible en: Disponible en: http://bdigital.unal.edu.co/46547/1/274615.2014.pdf , 2014. [ Links ]
25. Selva-O'Callaghan A, Trallero-Araguás E, Martínez MA, Labrador-Horrillo M, Pinal-Fernández I, Grau-Junyent JM, et al. Inflammatory myopathy: diagnosis and clinical course, specific clinical scenarios and new complementary tools. Expert Rev Clin Immunol. 2015;11:737-47, http://dx.doi.org/10.1586/1744666X.2015.1035258. [ Links ]
26. Love LA, Leff RL, Fraser DD, Targoff IN, Dalakas M, Plotz PH, et al. A new approach to the classification of idiopathic inflammatory myopathy: myositis-specific autoantibodies define useful homogeneous patient groups. Medicine. 1991;70:360-74, http://dx.doi.org/10.1097/00005792-199111000-00002. [ Links ]
27. Bohan A, Peter JB. Polymiositis and dermatomyositis (first of two parts). N Engl J Med. 1975;292:344-7, http://dx.doi.org/10.1056/NEJM197502132920706. [ Links ]
28. Bohan A, Peter JB. Polymyositis and dermatomyositis (second of two parts). N Engl J Med. 1975;292:403-7, http://dx.doi.org/10.1056/NEJM197502202920807. [ Links ]
29. Paternostro-Sluga T, Grim-Stieger M, Posch M, Schuhfried O, Vacariu G, Mittermaier C, et al. Reliability and validity of the Medical Research Council (MRC) scale and a modified scale for testing muscle strength in patients with radial palsy. J Rehabil Med. 2008;40:665-71, http://dx.doi.org/10.2340/16501977-0235. [ Links ]
30. Lundberg IE, Tjárnlund A, Bottai M, Werth VP, Pilkington C, de Visser M, et al. 2017 European League Against Rheumatism/ American College of Rheumatology classification criteria for adult and juvenile idiopathic inflammatory myopathies and their major subgroups. Ann Rheum Dis. 2017;76:1955-64, http://dx.doi.org/10.1136/annrheumdis-2017-211468. [ Links ]
31. Hilton-Jones D, Brady S. Diagnostic criteria for inclusion body myositis. J Intern Med. 2016;280:52-62, http://dx.doi.org/10.1111/joim.12480. [ Links ]
32. Allenbach Y, Benveniste O. Acquired necrotizing myopathies. Curr Opin Neurol. 2013;26:554-60, http://dx.doi.org/10.1097/WCO.0b013e328364e9d9. [ Links ]
33. Steinbrocker O, Traeger CH, Batterman RC. Therapeutic criteria in rheumatoid arthritis. J Am Med Assoc. 1949;140:659-62, http://dx.doi.org/10.1001/jama.1949.02900430001001. [ Links ]
34. Ostermann M, Joannidis M. Acute kidney injury 2016: diagnosis and diagnostic workup. Crit Care. 2016;20:299, http://dx.doi.org/10.1186/s13054-016-1478-z. [ Links ]
35. Brandão M, Marinho A. Idiopathic inflammatory myopathies: definition and management of refractory disease. Autoimmun Rev. 2011;10:720-4, http://dx.doi.org/10.1016/j.autrev.2011.05.021. [ Links ]
36. Rosa J, Garrot LF, Navarta DA, Saucedo C, Scolnik M, Bedran Z, et al. Incidence and prevalence of polymyositis and dermatomyositis in a health management organization in Buenos Aires. J Clin Rheumatol. 2013;19:303-7, http://dx.doi.org/10.1097/RHU.0b013e3182a21ba8. [ Links ]
37. Nuño L, Joven B, Carreira P, Maldonado V, Larena C, Llorente I, et al. Multicenter registry on inflammatory myositis from the Rheumatology Society in Madrid, Spain: descriptive analysis. Reumatol Clin. 2017;13:331-7, http://dx.doi.org/10.1016/j.reuma.2016.07.010. [ Links ]
38. Ungprasert P, Suksaranjit P, Spanuchart I, Leeaphorn N, Permpalung N. Risk of coronary artery disease in patients with idiopathic inflammatory myopathies: a systematic review and meta-analysis of observational studies. Semin Arthritis Rheum. 2014;44:63-7, http://dx.doi.org/10.1016/j.semarthrit.2014.03.004. [ Links ]
39. Diederichsen LP, Diederichsen ACP, Simonsen JA, Junker P, S0ndergaard K, Lundberg IE, et al. Traditional cardiovascular risk factors and coronary artery calcification in adults with polymyositis and dermatomyositis: a danish multicenter study. Arthritis Care Res (Hoboken). 2015;67:848-54, http://dx.doi.org/10.1002/acr.22520. [ Links ]
40. Taborda AL, Azevedo PC, Isenberg DA. Retrospective analysis of the outcome of patients with idiopathic inflammatory myopathy: a long-term follow-up study. Clin Exp Rheumatol. 2014;32:188-93. [ Links ]
41. Bernatsky S, Panopalis P, Pineau CA, Hudson M, St. Pierre Y, Clarke AE. Healthcare costs of inflammatory myopathies. J Rheumatol. 2011;38:885-8, http://dx.doi.org/10.3899/jrheum.101083. [ Links ]
42. Tanimoto K, Nakano K, Kano S, Mori S, Ueki H, Nishitani H, et al. Classification criteria for polymyositis and dermatomyositis. J Rheumatol. 1995;22:668-74. [ Links ]
43. Targoff IN, Miller FW, Medsger TA Jr, Oddis CV. Classification criteria for the idiopathic inflammatory myopathies. Curr Opin Rheumatol. 1997;9:527-35, http://dx.doi.org/10.1097/00002281-199711000-00008. [ Links ]
44. Hoogendijk JE, Amato AA, Lecky BR, Choy EH, Lundberg IE, Rose MR, et al. 119th ENMC international workshop: trial design in adult idiopathic inflammatory myopathies, with the exception of inclusion body myositis, 10-12 October 2003, Naarden, The Netherlands. Neuromuscul Disord. 2004;14:337-45, http://dx.doi.org/10.1016/j.nmd.2004.02.006. [ Links ]
45. Dobloug C, Garen T, Bitter H, Stjárne J, Stenseth G, Gr0vle L, et al. Prevalence and clinical characteristics of adult polymyositis and dermatomyositis; data from a large and unselected Norwegian cohort. Ann Rheum Dis. 2015;74:1551-6, http://dx.doi.org/10.1136/annrheumdis-2013-205127. [ Links ]
46. Koenig M, Fritzler MJ, Targoff IN, Troyanov Y, Senécal J-L. Heterogeneity of autoantibodies in 100 patients with autoimmune myositis: insights into clinical features and outcomes. Arthritis Res Ther. 2007;9:R78, http://dx.doi.org/10.1186/ar2276. [ Links ]
47. Castro C, Gourley M. Diagnosis and treatment of inflammatory myopathy: issues and management. Ther Adv Musculoskelet Dis. 2012;4:111-20, http://dx.doi.org/10.1177/1759720X11425092. [ Links ]
48. Meyer A, Scirè CA, Talarico R, Alexander T, Amoura Z, Avcin T, et al. Idiopathic inflammatory myopathies: state of the art on clinical practice guidelines. RMD Open. 2019;4 Supl 1:e000784, http://dx.doi.org/10.1136/rmdopen-2018-000784. [ Links ]
49. Shu XM, Lu X, Xie Y, Wang GC. Clinical characteristics and favorable long-term outcomes for patients with idiopathic inflammatory myopathies: a retrospective single center study in China. BMC Neurol. 2011;11:143, http://dx.doi.org/10.1186/1471-2377-11-143. [ Links ]
50. Moghadam-Kia S, Aggarwal R, Oddis CV. Treatment of inflammatory myopathy: emerging therapies and theraputic targets. Expert Rev Clin Immunol. 2015;11:1265-75, http://dx.doi.org/10.1586/1744666X.2015.1082908. [ Links ]
51. Valiyil R, Casciola-Rosen L, Hong G, Mammen A, Christopher-Stine L. Rituximab therapy for myopathy associated with anti-signal recognition particle antibodies: a case series. Arthritis Care Res. 2010;62:1328-34, http://dx.doi.org/10.1002/acr.20219. [ Links ]
52. Villalba L, Hicks JE, Adams EM, Sherman JB, Gourley MF, Leff RL, et al. Treatment of refractory myositis: a randomized crossover study of two new cytotoxic regimens. Arthritis Rheum. 1998;41:392-9, http://dx.doi.org/10.1002/1529-0131(199803)41:3<392::AID-ART3>3.0.CO;2-X. [ Links ]
53. Dalakas MC, Illa I, Dambrosia JM, Soueidan SA, Stein DP, Otero C, et al. A controlled trial of high-dose intravenous immune globulin infusions as treatment for dermatomyositis. N Engl J Med. 1993;329:1993-2000, http://dx.doi.org/10.1056/NEJM199312303292704. [ Links ]
54. Joffe MM, Love LA, Leff RL, Fraser DD, Targoff IN, Hicks JE, et al. Drug therapy of the idiopathic inflammatory myopathies: predictors of response to prednisone, azathioprine, and methotrexate and a comparison of their efficacy. Am J Med. 1993;94:379-87, http://dx.doi.org/10.1016/0002-9343(93)90148-i. [ Links ]
55. Dastmalchi M, Grundtman C, Alexanderson H, Mavragani CP, Einarsdottir H, Helmers SB, et al. A high incidence of disease flares in an open pilot study of infliximab in patients with refractory inflammatory myopathies. Ann Rheum Dis. 2008;67:1670-7, http://dx.doi.org/10.1136/ard.2007.077974. [ Links ]
56. Brunasso AM, Aberer W, Massone C. New onset of dermatomyositis/polymyositis during anti-TNF-a therapies: a systematic literature review. ScientificWorldJournal. 2014;2014:179180, http://dx.doi.org/10.1155/2014/179180. [ Links ]
57. Murray SG, Schmajuk G, Trupin L, Lawson E, Cascino M, Barton J, et al. A population-based study of infection-related hospital mortality in patients with dermatomyositis/polymyositis. Arthritis Care Res. 2015;67:673-80, http://dx.doi.org/10.1002/acr.22501. [ Links ]
58. Dobloug GC, Svensson J, Lundberg IE, Holmqvist M. Mortality in idiopathic inflammatory myopathy: results from a Swedish nationwide population-based cohort study. Ann Rheum Dis. 2018;77:40-7, http://dx.doi.org/10.1136/annrheumdis-2017-211402. [ Links ]
Recibido: 15 de Junio de 2020; Aprobado: 10 de Septiembre de 2020; Publicado: 24 de Diciembre de 2021











 texto em
texto em