Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista Colombiana de Reumatología
Print version ISSN 0121-8123
Rev.Colomb.Reumatol. vol.29 no.4 Bogotá Oct./Dec. 2022 Epub Aug 18, 2023
https://doi.org/10.1016/j.rcreu.2021.03.005
Reporte de casos
Vasculitis ANCA y glomerulonefritis membranoproliferativa asociada con síndrome de Sjögren: reporte de caso y revisión de la literatura
a Departamento de Medicina Interna, Pontificia Universidad Javeriana, Bogotá, Colombia
b Departamento de Nefrología, Pontificia Universidad Javeriana. Bogotá, Colombia
c Hospital Universitario San Ignacio, Bogotá, Colombia
La vasculitis asociada con anticuerpos anticitoplasma de neutrófilos-ANCA puede presentarse concomitantemente con síndrome de Sjögren primario o surgir durante su evolución. Se presenta el caso de una paciente que cursó con síntomas secos, test de Schirmer positivo, perfil de autoinmunidad compatible con síndrome de Sjögren y, de forma simultánea, deterioro de la función renal, anemia y disnea, por lo que requirió biopsia renal y fibrobroncoscopia. Los estudios complementarios documentaron glomerulonefritis aguda necrosante con proliferación extracapilar y patrón membranoproliferativo con depósito de complejos inmunes. El lavado broncoalveolar fue compatible con hemorragia alveolar. Se hizo diagnóstico de síndrome de pulmón-rinón secundario a vasculitis ANCA y se instauró tratamiento con esteroide y ciclofosfamida intravenosa, con mejoría clínica y paraclínica. El compromiso renal mixto encontrado en este caso es infrecuente en pacientes con SS, y el tratamiento cambia ostensiblemente, de ahí la importancia del diagnóstico diferencial y el reporte en la literatura.
Palabras clave: ANCA; Hemorragia alveolar; Síndrome de Sjögren; Vasculitis; Reporte de caso
ANCA-associated vasculitis may occur concomitantly with primary Sjögren's syndrome (SS) or arise during its evolution. We present the case of a patient who underwent dry symptoms, a positive Schirmer test and an SS-compatible autoimmunity profile and, simultaneously, deterioration of renal function, anaemia, and dyspnoea, requiring renal biopsy and fibro-bronchoscopy. Complementary studies documented acute necrotizing glomerulonephritis with extracapillary proliferation, and membranoproliferative pattern with immune complex deposition. Bronchoalveolar lavage was compatible with alveolar haemorrhage. Kidney lung syndrome secondary to ANCA vasculitis was diagnosed and treatment with steroid and intravenous cyclophosphamide with clinical and paraclinical improvement was instituted. Mixed renal involvement found in this case is uncommon in patients with SS, and treatment changes significantly, hence the importance of differential diagnosis and reporting in the literature.
Keywords: ANCA; Alveolar haemorrhage; Sjögren's syndrome; Vasculitis; Case report
Introducción
La presentación conjunta de 2 o más entidades autoinmunes representa un reto diagnóstico en la práctica clínica, dada la diversidad de manifestaciones y la complejidad en el manejo. Dentro del conjunto de síndromes de poliautoinmunidad, la presencia conjunta de vasculitis y síndrome Sjögren (SS) es rara y tiene de base mecanismos genéticos y medioambientales. El cuadro clínico es diverso, por lo que se dificulta el reconocimiento de alguno de ellos como manifestación primaria del otro. Dentro de las complicaciones más graves están la hemorragia alveolar difusa y la glomerulonefritis rápidamente progresiva, las cuales son más frecuentes en casos de vasculitis pauciinmunes que en SS se asocian con tasas de mortalidad elevadas, si no se tratan de manera oportuna. Adicionalmente, el compromiso renal mixto encontrado en este caso (glomerulonefritis aguda necrosante y patrón membra-noproliferativo) es raro y tiene implicaciones importantes en el tratamiento1-3.
Reporte de caso
Paciente femenina de 62 años con antecedente de exposición al humo de leña durante 13 años, ingresó por cuadro de 6 meses de evolución de tos seca, intermitente, no asociada con cambios de temperatura ni con el ejercicio. En los últimos 15 días se acompañó de disnea de medianos esfuerzos y odinofagia. Refiere xeroftalmia y xerostomía de 2 años de evolución, sin otros estigmas de autoinmunidad. No tiene antecedentes familiares de autoinmunidad conocidos. Ingresa normotensa, sin desaturación, taquicárdica y afebril, con estertores finos de predominio en bases pulmonares. Se toma radiografía de tórax con evidencia de opacidades alveolares multilobares (fig. 1).
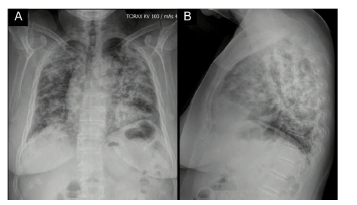
Figura 1 Radiografía de tórax: proyección posteroanterior (A) y lateral (B) con presencia de opacidades alveolares que comprometen 4 cuadrantes.
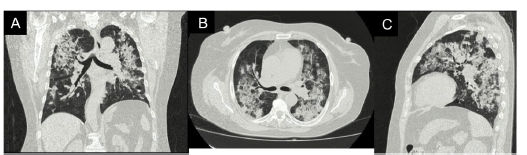
Figura 2 Tomografia de alta resolución de tórax proyección coronal (A), axial (B) y sagital (C). Engrasamiento de las paredes de la via aérea central y áreas de consolidación de distribución broncéntricas distribuidas en ambos pulmones, algunas asociadas con áreas de vidrio esmerilado.
Tabla 1 Perfil de autoinmunidad
| Paraclínico | Resultado /Título | Rango de referencia |
|---|---|---|
| ANCA por IFI | ||
| pANCA | Positivo 1:640 | Negativo |
| cANCA | Negativo | Negativo |
| ANCA por Elisa | ||
| Anti-PR3 | 2,7U/ml | Negativo: menor de 5 U/ml |
| Antimieloperoxidasa | 46,1 U/ml | Negativo: menor de 5 U/ml |
| Anticuerpos antinucleares (Hep2000) | 1/320 dilucionesPatrón moteado | Negativo: menor 1/80 dilución |
| Anti-La (SSB) | 87,96 U | Negativo: 0-20U |
| Anti-Ro (SSA) | 142,27 U | Negativo: 0-20U |
| Anti-RNP | 13,87 | Negativo: 0-20U |
| Anti-Sm | 5,81 U | Negativo: 0-20U |
| Anti-ADN | Positivo 1/80 diluciones | Negativo |
| C3 | 115,69 mg/dl | 88-165 mg/dl |
| C4 | 56,39mg/dl | 14-44 mg/dl |
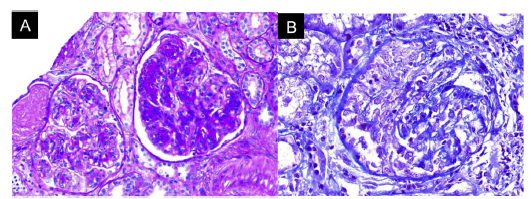
Figura 3 Biopsia renal. A. Patrón de glomerulonefritis aguda necrosante sin cambios de cronicidad. B. Presencia decrescencias celulares, infiltrado mononuclear en el intersticio, da˜no tubular activo y atrofia tubular con necrosis fibrinoide.
Durante su estancia, la paciente nunca presentó fiebre, expectoración purulenta o cuadro sugestivo de proceso infeccioso. Se descartó, en el contexto de pandemia, infección por SARS-CoV-2, con prueba rtPCR negativa. Dentro de los paraclínicos de ingreso se documentó anemia (hemoglobina 9,9 g/dl) de volúmenes normales, homogénea y regenerativa; trombocitosis (plaquetas 507.900 x 103 cél/ul); VSG elevada; creatinina elevada (2,29 mg/dl); análisis de orina con sedimento activo y proteinuria subnefrótica; ecografía crescencias celulares, acompañado de infiltrado mononuclear en el intersticio, daño tubular activo y atrofia tubular con depósito inmune escaso y necrosis fibrinoide, la inmunofluorescencia (IFI) mostró depósitos escasos mesangiales de IgA, IgM y C3 en mesangio, C1q e IgG negativo. Debido al compromiso clínico tan severo, se consideró un cuadro pauciinmune predominante sobre el compromiso glomerular e intersticial del SS. Ante la presentación clínica del paciente asociado con la positividad de ANCA anti-MPO y los hallazgos de la biopsia renal con glomerulonefritis necrosante y proliferación extracapilar, se consideró el diagnóstico de vasculitis ANCA (VAA) adicional al SS.
Se iniciaron pulsos de metilprednisolona, con previa des-parasitación con ivermectina y ciclofosfamida intravenosa basados en el esquema utilizado en el estudio Cyclops4 y bajas dosis de esteroides según el estudio Pexivas5. La evolución clínica fue satisfactoria, sin deterioro respiratorio y con estabilización de la función renal y hemoglobina, por lo que se dio egreso al día 20 de hospitalización. Se hizo control a los 2 meses de egreso, cuando llevaba 2,25 g de dosis total acumulada de ciclofosfamida, con creatinina de control en 1,15 mg/dl y hemoglobina en 11,3 g/dL.
Discusión
El SS es una enfermedad autoinmune que se presenta en mujeres de edad media y afecta a las glándulas exocrinas, pero ocasionalmente puede extenderse a otros órganos como el rinón, los pulmones y el sistema nervioso2. Puede ocurrir como SS primario (SSp) o en asociación con otras enfermedades del tejido conectivo6. La lesión renal más común del SS es la nefritis intersticial con infiltración linfocítica intersticial, fibrosis y atrofia tubular; en contraste, se puede presentar glomerulonefritis, pero es rara7.
La VAA puede presentarse concomitante con el diagnóstico SSp o surgir durante su evolución7. En el caso presentado, la evidencia de valores positivos de anti-Ro y anti-La, la prueba de Schirmer positiva y la presencia de más de un dominio positivo en la escala Sjögren's Syndrome Disease Activity Index (ESSDAI) puntuaron en los criterios clasificatorios para Sjögren establecidos por la Liga Europea contra el Reumatismo (EULAR)8.
La presencia de anti-ADN en pacientes con SS es poco común; en las cohortes estudiadas varía del 2 al 10%9-11. El significado de la positividad se asocia con la probabilidad de desarrollar otras enfermedades autoinmunes más adelante. En este caso, se descartó que la paciente pudiera estar cursando con lupus eritematoso sistèmico debido a una discordancia entre los marcadores de actividad y compromiso paraclínico e histopatológico renal evidenciado12, sin embargo, no se descarta que más adelante esta paciente pudiera presentar fenómeno de poliautoinmunidad sobrea-gregado, por lo que el seguimiento es fundamental.
En el momento del diagnóstico, es frecuente que los pacientes que cursan con VAA concomitante con SSp presenten reactantes de fase aguda elevados y anemia marcada13. Adicionalmente, aunque es raro, pueden tener compromiso renal asociado con VAA, como ocurrió en este caso. En un estudio de Borg et al.14, aproximadamente un tercio tenía VAA ANCA-MPO con compromiso renal limitado. Font et al. demostraron una asociación significativa entre la positividad ANCA del SS con fenómeno de Raynaud, vasculitis cutánea y neuropatías periféricas entre pacientes con SSp15-17; sin embargo, esta paciente no cursó con tales manifestaciones, lo que nos hace pensar que el compromiso renal de glomerulonefritis necrosante sea secundario a un compromiso por VAA como una entidad diferente al compromiso del SS.
El compromiso combinado pulmonar y renal por algunas de estas enfermedades también está descrito como síndrome pulmón-rinón18. Cuando se sospecha VAA en el contexto de SS, la tomografía de alta resolución a menudo determina el patrón predominante de lesión. De ellas, la neumonía en organización es la más comúnmente vista19. Otra anormalidad que se puede presentar es la hemorragia alveolar, la cual se puede manifestar como masas de tamaño variable con o sin signo del halo (hemorragia perinodular)20.
En el 2015, Cornec et al.14 realizaron una revisión de la literatura en búsqueda de SSp y VAA coexistente, e identificaron 22 reportes de caso; en todos ellos, el diagnóstico de VAA fue concomitante o subsecuente con el de SSp. En 5 casos, las manifestaciones de SSp y VAA empezaron al mismo tiempo. Las mujeres representaron el 86,4% de los pacientes. La edad media de diagnóstico fue de 63 años. De los 22 pacientes, 16 cumplieron los criterios de SSp propuestos por el American European Consensus Group (AECG). Dentro de los exámenes de vasculitis, el 76,2% de los pacientes presentaron pANCA con anti-MPO positivo ysus biopsias mostraron un patrón histológico típico de compromiso renal por VAA3.
El tratamiento de los casos de VAA y SS debe fundamentarse en la severidad de la enfermedad y el órgano comprometido. En este caso, debido a la presencia de hemorragia alveolar y alteración de la función renal, asociada con hallazgos de necrosis con proliferación extracapilar celular, se optó por el uso de la ciclofosfamida intravenosa según el esquema del estudio Cyclops, en vista de su eficacia en inducción de remisión en formas severas de vasculitis, con reducción considerable de la mortalidad en los estudios publicados en la literatura21,22. Adicionalmente, puesto que existen estudios observacionales que indican que las dosis altas de glucocorticoides se relacionan con aumento del riesgo de infecciones en pacientes con VAA y el compromiso glomerular del SS se asocia a su vez con mayor morbimortalidad por causas infecciosas, se optó por usar el esquema de bajas dosis de esteroides según el estudio Pexivas4,5.
Como la presencia de ANCA en el contexto de SSp es poco común y puede evolucionar a vasculitis sistémica, los pacientes deben ser monitorizados periódicamente, para realizar un control tanto clínico como paraclínico. Se recomienda realizar análisis de orina, función renal y proteína C reactiva. En pacientes con SSp con presencia de signos de respuesta inflamatoria en laboratorios se podría considerar la realización de tomografía por emisión de positrones con fluorodeoxiglucosa para discriminar entre actividad por SSp y vasculitis asociada23.
Este reporte de caso tiene como fortaleza que describe una condición que se presenta con poca frecuencia en la práctica clínica, contribuyendo a enriquecer el conocimiento sobre la expresión de estas entidades. Dentro de las limitaciones del caso se encuentra la falta de biopsia de glándula salivar, lo que hubiera podido corroborar hallazgos propios del SS. Es poco probable un caso de lupus eritematoso sisté-mico, debido la discordancia entre los marcadores de actividad (complemento normal y anti-ADN positivo en límite inferior) y el compromiso paraclínico e histopatológico renal evidenciado en la paciente24. No obstante, durante el seguimiento de pacientes similares a nuestro caso, se ha observado evolución secundaria de otras enfermedades autoinmunes como lupus eritematoso sistémico y enfermedad mixta del tejido conectivo25. Por tal motivo, es necesario hacer vigilancia periódica de estos pacientes.
Agradecimientos
Al Dr. Samuel Morales, patólogo del Hospital Universitario San Ignacio, Bogotá (Colombia), por el aporte de las imágenes de la biopsia renal.
REFERENCIAS
1. Khan I, Watts RA. Classification of ANCA-associatedvasculitis. Curr Rheumatol Rep. 2013;15:13-8,http://dx.doi.org/10.1007/s11926-013-0383-6. [ Links ]
2. Rodriguez Sánchez MP. Síndrome nefrótico secundario aglomerulonefritis membranoproliferativa por síndrome de Sjögren: reporte de un caso y revisión de la literatura. Acta Médica Colomb. 2017;42, http://dx.doi.org/10.36104/amc.2017.967. [ Links ]
3. Cornec D, Devauchelle-Pensec V, Tobón GJ, Pers JO, Jousse-Joulin S, Saraux A. B cells in Sjögren’s syndrome: frompathophysiology to diagnosis and treatment. J Autoimmun.2012;39:161-7, http://dx.doi.org/10.1016/j.jaut.2012.05.014. [ Links ]
4. Kötter I. Puls versus tägliches orales cyclophosphamid als remissions induktion bei ANCA-assoziierter vaskulitis (CYCLOPS-Studie). Z Rheumatol. 2009;68:575-7, http://dx.doi.org/10.1007/s00393-009-0509-4. [ Links ]
5. Morris A, Geetha D. Pexivas challenges current ANCA-associated vasculitis therapy. Nat Rev Nephrol. 2020;16:373-4, http://dx.doi.org/10.1038/s41581-020-0269-6. [ Links ]
6. Evans R, Zdebik A, Ciurtin C, Walsh SB. Renal involvement inprimary Sjögren’s syndrome. Rheumatology (Oxford).2015;54:1541-8,http://dx.doi.org/10.1093/rheumatology/kev223. [ Links ]
7. Kitaura K, Miyagawa T, Asano K, Oouchi S, Miki T, Fujisawa T,et al. Mixed connective tissue disease associated withMPO-ANCA-positive polyangiitis. Intern Med.2006;45:1177-82, http://dx.doi.org/10.2169/internalmedicine.45.1703. [ Links ]
8. Shiboski CH, Shiboski SC, Seror R, Criswell LA, Labetoulle M,Lietman TM, et al. 2016 American College ofRheumatology/European League Against RheumatismClassification Criteria for Primary Sjögren’s Syndrome: aconsensus and data-driven methodology involving threeinternational patient cohorts. Arthritis Rheumatol.2017;69:35-45, http://dx.doi.org/10.1002/art.39859. [ Links ]
9. Karsh J, Halbert SP, Anken M, Klima E, Steinberg AD. Anti-DNA, anti-deoxyribonucleo protein and rheumatoid factor measured by elisa in patients with systemic lupus erythematosus, Sjögren's syndrome and rheumatoid arthritis. Int Arch Allergy Immunol. 1982;68:60-9, http://dx.doi.org/10.1159/000233068. [ Links ]
10. Fauchais AL, Martel C, Gondran G, Lambert M, Launay D, Jauberteau MO, et al. Immunological profile in primary Sjögren syndrome. Clinical significance, prognosis and long-term evolution to other auto-immune disease. Autoimmun Rev. 2010;9:595-9, http://dx.doi.org/10.1016/j.autrev.2010.05.004. [ Links ]
11. Szanto A, Szodoray P, Kiss E, Kapitany A, Szegedi G, Zeher M. Clinical, serologic, and genetic profiles of patients with associated Sjögren's syndrome and systemic lupus erythematosus. Hum Immunol. 2006;67:924-30, http://dx.doi.org/10.1016/j.humimm.2006.06.006. [ Links ]
12. Stokes MB, Nasr SH, D'Agati VD. Systemic Lupus Erythematosus and other autoimmune diseases (Mixed Connective Tissue Disease, Rheumatoid Arthritis, and Sjögren's Syndrome). In: Zhou XJ, Laszik ZG, Nadasdy T, D'Agati VD, editors. Silva's diagnostic renal pathology. segunda edición Cambridge: Cambridge University Press; 2017. p. 265-303. [ Links ]
13. Chung MP, Yi CA, Lee HY, Han J, Lee KS. Imaging of pulmonary vasculitis. Radiology. 2010;255:322-41, http://dx.doi.org/10.1148/radiol.10090105. [ Links ]
14. Ter Borg EJ, Risselada AP, Kelder JC. Relation of systemic autoantibodies to the number of extraglandular manifestations in primary Sjögren's Syndrome: a retrospective analysis of 65 patients in the Netherlands. Semin Arthritis Rheum. 2011;40:547-51, http://dx.doi.org/10.1016/j.semarthrit.2010.07.006. [ Links ]
15. Guellec D, Cornec-Le Gall E, Groh M, Hachulla E, Karras A, Charles P, et al. ANCA-associated vasculitis in patients with primary Sjögren's syndrome: Detailed analysis of 7 new cases and systematic literature review. Autoimmun Rev . 2015;14:742-50, http://dx.doi.org/10.1016/j.autrev.2015.04.009. [ Links ]
16. Bosch X, Mirapeix E, Font J, Cervera R, Ingelmo M, Khamashta MA, et al. Anti-myeloperoxidase autoantibodies in patients with necrotizing glomerular and alveolar capillaritis. Am J Kidney Dis. 1992;20:231-9, http://dx.doi.org/10.1016/S0272-6386(12)80695-0. [ Links ]
17. O'Sullivan KM, Lo CY, Summers SA, Elgass KD, McMillan PJ, Longano A, et al. Renal participation of myeloperoxidase in antineutrophil cytoplasmic antibody (ANCA)-associated glomerulonephritis. Kidney Int. 2015;88:1030-46, http://dx.doi.org/10.1038/ki.2015.202. [ Links ]
18. Hanamura K, Tojo A, Kinugasa S, Asaba K, Onozato ML, Uozaki H, et al. Detection of myeloperoxidase in membranous nephropathy-like deposits in patients with anti-neutrophil cytoplasmic antibody-associated glomerulonephritis. Hum Pathol. 2011;42:649-58, http://dx.doi.org/10.1016/j.humpath.2010.08.020. [ Links ]
19. Argyropoulou OD, Tzioufas AG. Update on Sjögren's Syndrome 2018. Mediterr J Rheumatol. 2018;29:193-8, http://dx.doi.org/10.31138/mjr.29.4.193. [ Links ]
20. Jonsson R, Theander E, Sjoström B, Brokstad K, Henriksson G. Autoantibodies present before symptom onset in primary Sjögren Syndrome. JAMA. 2013;310:1854-5, http://dx.doi.org/10.1001/jama.2013.278448. [ Links ]
21. Goules AV, Tatouli IP, Moutsopoulos HM, Tzioufas AG. Clinically significant renal involvement in primary Sjögren's Syndrome: clinical presentation and outcome. Arthritis Rheum. 2013;65:2945-53, http://dx.doi.org/10.1002/art.38100. [ Links ]
22. Faurschou M, Sorensen IJ, Mellemkjaer L, Loft AGR, Thomsen BS, Tvede N, et al. Malignancies in Wegener's granulomatosis: incidence and relation to cyclophosphamide therapy in a cohort of 293 patients. J Rheumatol. 2008;35:100-5. [ Links ]
23. Marten K, Schnyder P, Schirg E, Prokop M, Rummeny EJ, Engelke C. Pattern-based differential diagnosis in pulmonary vasculitis using volumetric CT. AJR Am J Roentgenol. 2005;184:720-33, http://dx.doi.org/10.2214/ajr.184.3.01840720. [ Links ]
24. Pickering MC, Walport MJ. Links between complement abnormalities and systemic lupus erythematosus. Rheumatology. 2000;39:133-41, http://dx.doi.org/10.1093/rheumatology/39.2.133. [ Links ]
25. Wang WJ, Wu HS, Chu TS. Anti-neutrophil cytoplasmic antibody-associated pauci-immune crescentic glomerulonephritis complicating Sjögren's syndrome. J Formos Med Assoc. 2011;110:473-7, http://dx.doi.org/10.1016/S0929-6646(11)60070-3. [ Links ]
Consideraciones éticas El reporte de caso fue aprobado por el comité institucional de ética e investigación del Hospital Universitario San Ignacio, Bogotá (Colombia). La paciente dio el consentimiento informado para que su caso fuera publicado.
Disponibilidad de información La información relacionada con el reporte de caso se presenta dentro del manuscrito. Material adicional se pondrá a disposición posteriormente a la solicitud correspondiente al autor.
Recibido: 28 de Diciembre de 2020; Aprobado: 12 de Marzo de 2021; Publicado: 25 de Noviembre de 2022











 text in
text in 


