Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares en
SciELO
Similares en
SciELO -
 Similares en Google
Similares en Google
Compartir
Revista MVZ Córdoba
versión impresa ISSN 0122-0268versión On-line ISSN 1909-0544
Rev.MVZ Cordoba v.10 n.1 Córdoba ene./jun. 2005
ORIGINAL
EFECTO DEL MEDIO Y CONDICIONES DE CULTIVO EN LA PRODUCTIVIDAD DE TRES DIATOMEAS MARINAS CON POTENCIAL ACUÍCOLA.
ENVIRONMENTAL AND CROP CONDITIONS EFECTS ON THREE SEA DIATOMEAN PRODUCTIVITY (YIELD)
WITH ACUICOL POTENTIAL
Martha J. Prieto1*, Martha J. Mogollon2, Ada L. Castro3, Luis A. Sierra3.
1Universidad de Córdoba, Facultad de Medicina Veterinaria y Zootecnia, Departamento de Ciencias Acuícolas.
2Universidad de Córdoba, Facultad de Ciencias Básicas, Departamento de Biología.
3Universidad de Córdoba, Departamento de Ciencias Acuícolas, Programa de Acuicultura.
* Correspondencia: mjprieto@sinu.unicordoba.edu.co
RESUMEN
Las diatomeas Actinocyclus normanii , Cyclotella gromerata y Neodelphyneis pelagica fueron trabajadas en el laboratorio de Alimento Vivo de la Universidad de Córdoba, con el fin de caracterizar las especies, obtener cepas y realizar cultivos experimentales bajo condiciones controladas de temperatura (24°C), salinidad (25-30 ‰) y aireación. Cultivos a 5 ml y 250 ml fueron realizados con dos medios de cultivo como tratamiento (F/2 de Guillar & Rither, y CONWAY) para determinar su efecto sobre la productividad. Mediante observaciones periódicas (cada 6 horas), se registró el tamaño y densidad celular, así como, la tasa de crecimiento (K). Los resultados mostraron diferencia significativa para el efecto de los medios de cultivo sobre el crecimiento poblacional de las microalgas, las cuales alcanzan concentraciones de 267214,1 ± 277,77 cel.ml-1; 1606117 ± 69686,7 cel.ml-1 y 2735703 ± 49180,8 cel.ml-1 respectivamente para cada especie. Se concluyó que estas microalgas por sus características de crecimiento en cultivo, presentan adaptación favorable a las condiciones de manejo para la producción de biomasas frescas con “F/2” siendo este el medio mas adecuado, asimismo, por su tamaño son potencialmente útiles para ser empleadas como partícula nutritiva con fines acuícolas.
Palabras claves: Microalga, Bacillariophyceae, Productividad, Medio de cultivo
ABSTRACT
The laboratory of live food at the Universidad de Cordoba carried out a study on microalgaes Actinocyclus normanii, Cyclotella gromerata y Neodelphyneis pelagica. Two differents culture media (F/2 de Guillar & Rither, y CONWAY), at 5 ml and 250 ml, were used and analyzed to determine the influence of temperature, salinity and airing on growth kinetics and productivity. All experiments were performed under controlled conditions (24 °C and salinity 25-30 ‰). Size, cellular density and growth rate (k) were recorded every six (6) hours. The results show that growth of biomass was highly influenced by culture medium and laboratory conditions, registering 267214,1 ± 277,77 cel.ml-1; 1606117 ± 69686,7 cel.ml-1 y 2735703 ± 49180,8 cel.ml-1 for each diatom respectably for maximum biomass productivity , making this specie highly viable in aquaculture for nutritive purposes.
Key words: Micro algae, Bacillariophyceae, productivity, culture medium.
INTRODUCCIÓN
En acuicultura es de gran interés, producir alimento con el perfil nutricional adecuado para los organismos de explotación, que permita al mismo tiempo mantener la calidad del agua en las unidades de cultivo. Las microalgas tienen en este campo un amplio mercado, en relación con el costo de producción de esta materia prima, gracias a su riqueza en diversos nutrientes y su capacidad de reducir compuestos nitrogenados y elevar la concentración de oxigeno. La importancia del cultivo de microalgas radica en su papel como productores primarios de la cadena trófica, y por lo tanto se constituyen en las primeras formadoras de materia orgánica y, por su tamaño reducido y variado (5 – 50 m en promedio) son de fácil captura y digestión por multitud de organismos que se alimentan en forma directa o indirecta del fitoplancton (Renuard y col. 2002, Aloysio 2003).
Las altas concentraciones de proteínas, carbohidratos, ácidos grasos y vitaminas presentes en las microalgas las hace fundamentales para la alimentación del zooplancton, larvas y estadios juveniles de moluscos, crustáceos y ciertos peces herbívoros (Brown y col.1997, D’Souza y Nelly 2000, Renaud y col. 2002, Aloysio 2003). Cada alga por ser un organismo completo, capaz de sintetizar multitud de compuestos disueltos en el agua, transformar sales inorgánicas en compuestos orgánicos por medio de la fotosíntesis, las hace imprescindibles como alimento vivo. Además, pueden ser aprovechadas como filtros biológicos para la eliminación de excesos de nutrientes (Lopez y col. 2000, Araujo y col. 2002).
El cultivo en masa de microalgas para la alimentación directa e indirecta de las larvas y alevines, tiene en cuenta el tamaño y forma que permitan su captura, manejo e ingestión; el conocimiento sobre la bio-ecología de la especie, su perfil nutricional, espesura de la pared celular que determina su digestibilidad y, en parte el valor nutritivo, resistencia a variaciones ambientales, fácil consecución y manejo, entre otros aspectos (Coutteau, 1996, López y col. 2000). Las diatomeas entre las microalgas de pequeño tamaño y pared celular delgada son consideradas una buena fuente de alimento (Brown y col. 1997, López y col. 2000, Sipauva-Tavares y Rocha 2003).
Las microalgas requieren diferentes factores para su crecimiento, dentro de estos se encuentran: Los requerimientos físico-químicos y los requerimientos nutritivos. Entre los primeros, se destacan la luz, temperatura, salinidad, pH y CO2 (Coutteau 1996, Sánchez y col. 2000, Leonardos y Lucas 2000, Tzovenis y col. 2003). Dentro de los segundos son relevantes los macro nutrientes, que son utilizados para sintetizar compuestos orgánicos, y los micro nutrientes, usados como catalizadores (Coutteau 1996, Hidalgo y col. 1998, Sipauva-Tavares y Rocha 2003). El crecimiento microalgal se rige por la ley del mínimo, es decir, el factor limitante del crecimiento es aquel que está presente en cantidades más próximas al mínimo crítico necesario.
La reproducción de las microalgas en condiciones óptimas se lleva a cabo, en ciclos de división celular, mediante mitosis y su crecimiento puede ser limitado por los niveles de nutrientes inorgánicos, así como, deficiente manipulación en las unidades de cultivo, que en conjunto tienen influencia en la composición bioquímica de estas microalgas por la alteración en la concentración de los nutrientes (Fabregas y col. 1996, Sánchez y col. 2000, Sipauva-Tavares y Rocha 2003); consecuentemente animales alimentados con microalgas afectadas por la limitante de nutrientes pueden mostrar cambios en los parámetros de crecimiento y composición bioquímica.
El presente estudio tuvo como objetivo, determinar en relación al medio de cultivo, los cambios en los parámetros de crecimiento poblacional de las diatomeas marinas Actinocyclus normani, Cyclotella glomerulata y Neodelphineis pelagica.
MATERIALES Y MÉTODOS
Se recolectaron muestras de fitoplancton en la Bahía de Cispatá, en tres estaciones de muestreo en la Ciénaga Mestizo. La investigación se llevó a cabo en el Laboratorio de Alimento Vivo de la Universidad de Córdoba, sede Lorica, en donde se realizó bajo condiciones controladas de temperatura, salinidad, pH, intensidad lumínica y aireación. Para el aislamiento, cultivo y caracterización de las especies de microalgas se siguió el método propuesto por Coutteau (1996) y Sipáuva-Tavares y Rocha (2003). El agua de mar empleada, fue tratada mediante filtros de arena, adición de carbón activado, paso lento por filtros de algodón de 250,10, y 40 micras, para finalmente pasar por luz ultravioleta.
Para la selección de especies se usaron medios de cultivo “F/2 de Guillard” y “CONWAY” (Guillard y Ryther 1962; Guillard 1973) en agua de mar enriquecida y estéril, cada uno con y sin adición de silicato. Por cada una de las cuatro formulas de medio de cultivo, se emplearon tres salinidades diferentes 15, 25 y 35 ‰. Las muestras obtenidas con los arrastres de fitoplancton se observaron al microscopio y luego se procedió a su enriquecimiento general. El aislamiento de las especies de interés se realizó en forma directa utilizando micropipetas Pasteur punta fina; siembras en agar con enriquecimiento selectivo mediante el uso de cajas de Petri; y diluciones sucesivas hasta 10-10 en tubos de ensayo tapa rosca, realizando las repeticiones necesarias hasta asegurar el cultivo clonal. Posteriormente se trabajó la eliminación de contaminantes y purificación de las cepas.
La producción de cultivos estériles, se realizó a partir de una cepa pura previamente aislada en los medios de cultivo “F/2 de Guillar y Rither” y “CONWAY” (Guillard y Ryther 1962; Guillard 1973) mediante inoculo en original y tres replicas por cada especie, volumen y medio de cultivo. El monocultivo cerrado y estático se realizó a volúmenes de 10 ml en tubos de ensayo tapa rosca y volúmenes de 250 ml en envase de vidrio. Se caracterizaron las especies en cultivo, mediante observaciones periódicas (cada seis horas), en microscopio binocular con objetivos de 10x, 40x, y 100x. Para evaluar el diámetro medio de las células se utilizó un ocular micrométrico y para el tiempo de división celular, fases de crecimiento poblacional y fase exponencial se adelantó mediante el recuento celular en el tiempo, empleando la placa Neubauer o hemocitometro.
El uso de la placa Neubauer se ajustó a la metodología descrita por Paniagua et al. (1986) y Treece y Fox (1993). La clasificación taxonómica se realizó empleando las claves de Crawford y col. (1990) y se estimó la tasa de crecimiento de la población de microalgas (R), mediante la ecuación descrita por González et al. (1988). Los cultivos realizados para cada una de las especies en cada volumen, se ajustaron a un diseño al azar con dos tratamientos (medios de cultivo) y tres repeticiones por tratamiento. Se realizó análisis de varianza para determinar diferencias entre tratamientos con respecto al crecimiento poblacional de cada especie en cultivo.
RESULTADOS
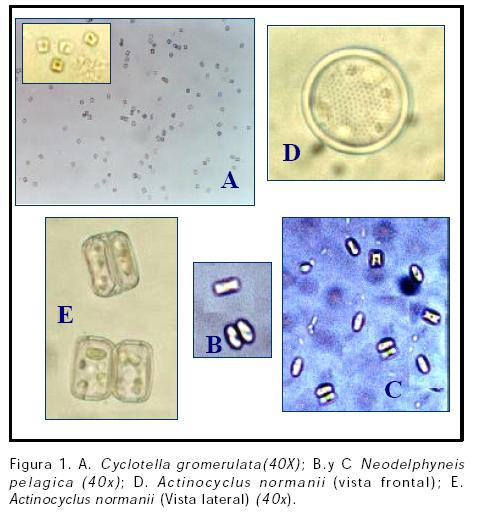
Se aisló satisfactoriamente de la Ciénaga de Mestizo las microalgas de agua marina Actinocyclus normanii, Cyclotella glomerulata y Neodelphineis pelagica, (Figura 1). Las tres microalgas marinas pertenecen a la división Bacillariophyceae, mejor conocidas como diatomeas. La pared celular de las baciliaroficeas es el rasgo mas característico, su pared celular o frústula que consta de dos mitades, la epiteca e hipoteca que se sobreponen y adaptan entre si, en forma muy semejante a como se adaptan las tapas y la base de una caja de Petri, constituyendo éstas las valvas. La reproducción asexual es por división celular vegetativa en donde se forman nuevas valvas dentro de las ya existentes, y las células hijas se separan. En la mayoría de las diatomeas, la hipoteca vieja llega a ser la nueva epiteca para una de las dos células hijas, y hay una reducción de tamaño. El tamaño original de la célula se restaura durante el proceso sexual.
Las tres especies de microalgas presentaron crecimiento bajo las condiciones de manejo, con diferentes fases de variable duración acorde a la especie, medio de cultivo y condiciones ambientales. Los cambios fueron comunes a todas las microalgas. El crecimiento en cultivo inició por la fase de adaptación en donde la mayoría de las células inoculadas fueron viables pero no están en condiciones de dividirse inmediatamente, luego continuó el crecimiento exponencial donde las células comenzaron a dividirse regularmente a una tasa constante, para registrar la tasa de crecimiento máximo en esta fase (Tabla 1).
Posteriormente el tiempo requerido para la duplicación celular aumentó, reduciendo la tasa de crecimiento. Esto fue probablemente debido a las condiciones propias de los cultivos estáticos, en donde la disminución en la disponibilidad de nutrientes en el medio de cultivo o a las alteraciones ambientales como pH, temperatura u otros, pueden reducir la actividad fotosintética. En estas condiciones, la población no aumentó en virtud a que la tasa de crecimiento está compensada con la tasa de mortalidad, entrando así el cultivo en la fase estacionaria. Posteriormente, los cultivos entraron en fase de declinación, en donde la tasa de mortalidad fue mayor a la tasa de reproducción y formación de nuevas células. La disponibilidad de células viables disminuyó geométricamente para todas las especies en los diferentes volúmenes.
Microalga Cyclotella glomerata. Esta diatomea perteneciente a la familia Stephanodiscaceae es de pequeño porte con promedio de 8 µm y tamaño 8 x 5 µm (Figura 1A). Inicialmente fue aislada en medio enriquecido con presencia de silicato en salinidad de 25 ‰, posteriormente fue adaptada progresivamente a salinidades entre 25-30 ‰, en las cuales se realizó el cultivo.
Al realizarse el cultivo de Cyclotella glomerata en 5 ml, empleando como tratamiento los medios de cultivo (T1) Conway y (T2) F/2, se observó el crecimiento poblacional con un corto periodo de latencia entre 60-84 horas. En el T2 tras un corto periodo de adaptación se presentó la fase de aceleración y crecimiento exponencial con una máxima concentración de 463369,3 ± 26526,3 cel.ml-1 a las 120 horas (±5 días) (Tabla 1), seguidamente en la fase de descenso exponencial se registró un segundo pico de crecimiento entre las 400 y 600 horas (±16 a 25 días). Con el T1 se presentó de igual manera una fase de crecimiento no pronunciada permaneciendo posteriormente el cultivo en fase estacionaria para luego alcanzar densidad máxima de 286534,9 ± 22369cel.ml-1 a las 732 horas de cultivo (Tabla 1). Hubo diferencia significativa (P<0.05) para los tratamientos con relación a la densidad máxima y tasa de crecimiento.
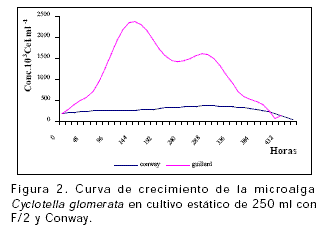
Cyclotella glomerata en cultivo estático de 250 ml, presentó las máximas concentraciones con el T2 (1606117 ± 69686,7 cel.ml-1) en un tiempo de 276 horas (11,5 días) (Tabla 1; Figura 2), con fase de crecimiento de 8,52 días presentando diferencia significativa (P<0.05) con el T1 en el cual Cyclotella glomerata no presentó crecimiento exponencial, la tasa de duplicación registrada fue mínima (0,0025) y no permitió la duplicación de la concentración celular inicial (Tabla 1). Las mejores tasas de crecimiento (k) en volúmenes de 5 y 250 ml para Cyclotella glomerata se registraron empleando F/2 (Tabla 1).
Microalga Neodelphineis pelagica. Esta diatomea perteneciente a la familia Rhaphonedaceae es de pequeño porte con promedio de 12 µm y tamaño 12 x 4 µm (Figura 1B y C). Inicialmente fue aislada en medio enriquecido con presencia de silicato en salinidad de 15 ‰, posteriormente fue adaptada progresivamente a salinidades entre 25-30 ‰, en las cuales se realizó el cultivo.
Neodelphyneis pelágica en cultivos de 5 ml empleando como tratamiento medio (T1) Conway y (T2) F/2, presentó una fase de latencia promedio de 180 horas (±7,5 días) en los dos tratamientos, seguida por la fase de aceleración y de crecimiento exponencial (17 días para T2 y 7,5 días para T1), alcanzándose para el T2 una máxima concentración de 995897,5 ± 60017,3 cel.ml-1 a las 648 horas (27 días), y en el T1 de 505967,4 ± 54873,5 cel.ml-1 a las 468 horas (19,5 días) (Tabla 1); seguidamente se dio la fase de descenso exponencial. Se presentó diferencia significativa para la fase de crecimiento exponencial y la densidad máxima alcanzada en los diferentes medios de cultivo (P<0.05) siendo mejores los valores obtenidos con F/2 (Tabla 1).
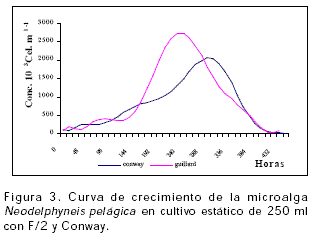
Neodelphyneis pelágica en cultivo estático de 250 ml (Figura 3), presentó las máximas concentraciones con el T2 (2735703 ± 49180,8 cel.ml-1) seguidas por el T1 (2069238 ± 109554 cel.ml-1), en un tiempo de 228 y 288 horas respectivamente (9,5 y 12 días), la fase de crecimiento fue de 6,41 días para T1 y 3,64 días para T2, presentando diferencia significativa (P<0.05) entre tratamientos para las densidades máximas alcanzadas y la fase de crecimiento. Las mejores tasas de crecimiento (k) en volúmenes de 5 y 250 ml para Neodelphyneis pelágica se registraron empleando F/2 (Tabla 1).
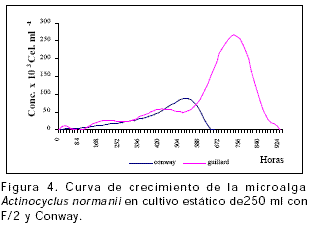
Microalga Actinocyclus normani. Esta diatomea perteneciente a la familia Hemidiscaceae es de gran tamaño con promedio de 50 µm y tamaño 50 x 20 µm (Figura 1D y E). Inicialmente fue aislada en medio enriquecido con presencia de silicato en salinidad de 35 ‰, posteriormente fue adaptada progresivamente a salinidades entre 25-30 ‰, en las cuales se realizó el cultivo. En cultivo, esta microalga presenta crecimiento poblacional lento con bajas concentraciones celulares, en comparación con C. glomerata y N. pelágica principalmente en virtud a su tamaño (Figuras 1 y 4).
El crecimiento de Actynociclus normanii en 5 ml en los medios F/2 (T2) y Conway (T1), registró una fase de latencia promedio de 108 horas (±5 días), luego se presentaron la fases de aceleración y crecimiento exponencial alcanzando una concentración máxima de 65639,03 ± 1272,9 cel.ml-1 a las 520 horas(±22 días) con el T2 y con el T1 la fase de crecimiento exponencial se alcanzó aproximadamente a las 240 horas (+10 días) con una concentración máxima de 10736,78 ± 1063,5 cel.ml-1. Hubo diferencia significativa (p<0,05) para la tasa de crecimiento, la fase exponencial y densidad máxima alcanzada con cada uno de los medios de cultivo.
Actynociclus normanii en cultivo estático de 250 ml (Figura 4), presentó las máximas concentraciones con el T2 (267214,1 ± 277,77 cel.ml-1) en un tiempo de 732 horas (30,5 días) (Tabla 1), con fase de crecimiento de 8,75 días y alta tasa de crecimiento (1,5869), presentando diferencia significativa (P<0.05) con el T1 en el cual Actynociclus normanii presentó crecimiento exponencial menor alcanzando máxima densidad (87832,18 ± 699,0 cel.ml-1) en 528 horas (22 días), la tasa de duplicación registrada fue mínima (0,0051) (Tabla 1). Las mejores tasas de crecimiento (k) en volúmenes de 5 ml (0,7694) y 250 ml (1,5859) para Actynociclus normanii se registraron empleando F/2 (Tabla 1).
DISCUSIÓN
Las microalgas son usadas en acuicultura como alimento vivo para todos los estadios de crecimiento de los moluscos, para los estadios larvales de crustáceos, para algunas especies de peces y en la producción de zooplancton. Para ser nutricionalmente viables, las microalgas deben tener composición química, tamaño, aceptabilidad y digestibilidad aceptables; paralelamente las diferentes especies deben tener suceso bajo las condiciones de manejo.
Los resultados del aislamiento y respuestas de crecimiento descritos anteriormente presentan tres cepas nativas de microalgas, que por sus características de crecimiento y tamaño bajo condiciones locales, tienen potencial para ser usadas como partícula nutritiva en acuicultura. Según Brown y col.(1997), para mejorar la producción de microalgas con fines acuícolas, se debe tener en cuenta que no todas las especies tienen suceso bajo condiciones ambientales específicas de las zonas en las cuales se encuentran los proyectos productivos, por tanto es una necesidad conocer las respuestas de crecimiento óptimo bajo condiciones locales, aislar nuevas cepas más apropiadas para las condiciones locales y conocer el valor nutricional de la microalga en equilibrio con los requerimientos del animal a ser alimentado.
Si bien en el presente estudio no se caracterizó el perfil nutricional de las diferentes cepas en relación a su contenido de proteínas, carbohidratos y ácidos grasos, las respuestas de crecimiento en diferentes medios de cultivo permiten inferir sobre los requerimientos de cada especie para la producción de biomasas frescas y su posterior calidad nutricional.
Las diatomeas Actinocyclus normanii, Neodelphineis pelágica y Cyclotella glomerata presentan tasas de crecimiento diferentes dependiendo del medio de cultivo. Para las tres especies se presentó crecimiento altamente significativo (p< 0,05) en F/2 comparado con el medio Conway Yusoff y col. (2001), quienes trabajando con dos microalgas marinas en tres diferentes medios de cultivo, describen tasas de crecimiento altamente significativa para la diatomea C. calcitrans en agua intersticial diluida (DIW) comparadas con medio Conway (CM) y agua intersticial extraída de estanques de camarón (PIW).
Cada especie de microalga responde ante la disponibilidad y proporción de los diferentes nutrientes principalmente de nitrógeno, fósforo, y en el caso especifico de las diatomeas la disponibilidad de sílice. Los medios Conway y F/2 presentan disponible sílice para las diatomeas marinas en estudio, sin embargo la proporción de nitrógeno es diferente en los dos medios, siendo mayor en el medio de cultivo F/2. Las mayores tasas de crecimiento para las tres especies en F/2 indican sus requerimientos de nitrógeno y dan pautas sobre su posterior calidad nutritiva como partícula alimenticia.
El crecimiento de las microalgas puede ser limitado por bajos niveles de nutrientes inorgánicos, y estas alteraciones en la concentración de nutrientes altera la composición bioquímica de las microalgas (Fabregas y col. 1996). Además de la composición y concentración de nutrientes, la composición bioquímica de las microalgas puede ser alterada sustancialmente por la manipulación de las condiciones de cultivo tales como intensidad de luz (Leonardos y Lucas, 2000; Tzovenis y col. 2003), fotoperíodo o temperatura (Brown y col. 1989, Tzovenis y col. 2003).
D’Souza y Kelly, (2000) encontraron que Tetraselmis suecica cultivada en medio con alta concentración de nitrógeno fue la mejor dieta para larvas de camarón. Igualmente describen que la concentración de carbohidratos fue mayor y la proporción de proteína: energía, así como, la concentración de ácidos grasos (n-3, n-6), fue menor en algas limitadas en nitrógeno.
Según Fidalgo y col. (1998), la composición bioquímica de las microalgas es más afectada por la fase de crecimiento en cultivo que por la disponibilidad de nitrógeno como recurso, en sus resultados el autor describe que la mayor cantidad de proteína se encuentra en la fase de crecimiento exponencial y la mayor concentración de lípidos en la fase estacionaria tardía. Por su parte, Phatarpekar, y col. (2000), estudiando el desempeño en el crecimiento de las microalgas Chaetoceros calcitrans e Isochrysis galbana, afirman que este difiere para cada especie en monocultivos, ya en cultivo mixto de las dos especies C. calcitrans es dominante sobre I. galbana, los autores encuentran que la concentración de clorofila, proteínas, carbohidratos, lípidos son significativamente altos en los cultivos mixtos en comparación con los monocultivos de cada especie.
La composición bioquímica de las microalgas puede ser manipulada por cambios en las condiciones de crecimiento, pero los efectos son variables de unas especies para otras (Brown y col. 1997, Sánchez y col. 2000). Por tanto el conocimiento que se tenga sobre la respuesta a diferentes ambientes es una práctica necesaria en la acuicultura para quien desea optimizar los niveles específicos de nutrientes necesarios para el animal que se alimenta.
En el presente estudio las tres diatomeas presentaron un crecimiento específico y diferente acorde al medio de cultivo y la temperatura; en general el medio de cultivo que permite las mayores tasas de crecimiento es F/2 y las mayores concentraciones en cultivo se alcanzan en temperaturas de 24°C, por tanto la capacidad de crecimiento de las diatomeas Actinocyclus normanii, Neodelphineis pelágica y Cyclotella glomerata en temperaturas promedio de 24°C, describe la disponibilidad de estas cuatro cepas de microalgas tropicales para ser trabajadas con fines acuícolas.
Segun Renaud y col. (2002), quien trabajó el crecimiento y contenido nutricional de cuatro especies de microalgas tropicales Australianas; una diatomea (Chaetoceros sp), dos criptomonas (Rhodomonas sp y Cryptomonas sp) y una especie no identificada de Primesiofita, cultivadas en cinco diferentes temperaturas con medio de cultivo F/2 en salinidad de 25 ‰; afirma que la temperatura optima de crecimiento fue de 25-27 °C para Rhodomonas sp (K=0,27), y 27-30 °C para la primesiofita, Cryptomonas sp y Chaetoceros sp (K= 0.56, 0.33 y 0.87 respectivamente), los autores destacan que solo Chaetoceros sp creció bien entre 33-35 °C (K= 0.78).
Estos autores encontraron como resultado que todas las especies de microalgas tropicales trabajadas presentaron bajos porcentajes de proteína cuando crecieron a temperaturas superiores a 27 °C. Chaetoceros presentó el mayor contenido de lípidos a 25 °C mientras las otras especies presentaron contenidos significativamente altos de lípidos a temperaturas entre 27-30 °C.
Altas temperaturas de crecimiento han sido relacionadas con la disminución significativa en el contenido de proteínas y el incremento en lípidos y carbohidratos (Oliveira y col. 1999), sin embargo, otros estudios encuentran que la respuesta de la composición química de las microalgas a altas o bajas temperaturas de crecimiento varía de especie a especie. Altas temperaturas de crecimiento han sido relacionadas con el incremento en el contenido de proteína y decrecimiento en carbohidratos y lípidos (Thompson y col. 1992, Renaud y col. 1995).
Además de la temperatura, el régimen de luz impuesto para el cultivo de las microalgas es uno de los aspectos críticos puesto que determina el rendimiento y la productividad de las biomasas (Falkowski & Raven, 1997). El esquema de producción de biomasas de Actinocyclus normanii, Neodelphineis pelágica, y Cyclotella glomerata bajo las condiciones de estudio, empleo una intensidad lumínica de 2000 lux y un fotoperíodo de 24: 0 horas luz/oscuridad, los resultados sobre el rendimiento de estas tres microalgas están directamente relacionados a estas condiciones lumínicas y su combinación con la temperatura en el laboratorio. En este sentido Tzovenis y col. (2003) afirman que una comparación directa de diferentes fotoperíodos e flujo de fotones se hace necesaria para decidir sobre el más eficiente régimen de luz para propósitos industriales.
En el presente estudio los resultados demostraron que el flujo de luz continua, con ausencia de fase oscura en el fotoperíodo, fue adecuado para el manejo de las tres cepas de microalgas. Tzovenis y col. (2003) trabajando con una cepa de Isochrysis galbana (T-ISSO), encontraron que la tasa de crecimiento específica de esta especie fue máxima con el incremento de la densidad de flujo de fotones por día. Bajo continua iluminación el tamaño de las células tuvo una correlación altamente significativa con el flujo de luz, y no presentó correlación con el fotoperíodo; los autores concluyen que el rendimiento y la productividad de biomasa de la especie tiene diferentes patrones para luz continua y discontinua, donde el rendimiento y productividad celular son una función del flujo total de luz diaria.
El tamaño es uno de los aspectos que determina la calidad nutritiva de las microalgas (Renaud y col. 2002; Sipaúba-Tavares y Rocha, 2003) puesto que los diferentes organismos en los primeros estadios larvales tienen limitaciones en su abertura bucal, o presentan como en el caso de los moluscos palpos labiales que permiten la selectividad de partículas (Bougrier y col. 1997). El tamaño celular exhibido por Actinocyclus normanii (50 µm), Neodelphineis pelágica (12µm) y Cyclotella glomerata (8µm) las destaca como partículas de adecuado tamaño para ser empleadas como alimento para larvas de crustáceos, larvas de peces marinos y diferentes estados en el desarrollo de los moluscos.
Las microalgas empleadas usualmente en la nutrición animal son de diversos tamaños, en su mayoría pertenecen al nanoplancton (2-20 µm) con excepción de las diatomeas en cadena como por ejemplo Skeletonema con tamaño superior a 60 µm, estos tamaños de partícula son utilizados para alimentación de filtradores activos tales como larvas de camarón, también son usadas diatomeas pennadas adhesivas (Nizschia y Navicula) con tamaño superior a 20 µm para el pastoreo de moluscos bentónicos tales como el Abalone (Brown y col. 1997).
Bajo las condiciones del presente estudio se logró obtener las cepas de las microalgas nativas tropicales Actinocyclus normanii, Neodelphineis pelágica y Cyclotella glomerata, especies que presentan favorable adaptación a las condiciones de manejo en laboratorio para la producción de biomasas frescas, siendo el medio de cultivo más apropiado el “F/2 de Guillard & Rither” con el cual se alcanzan las mayores densidades celulares y las mejores tasas de crecimiento en las tres especies. Estas diatomeas por sus características de crecimiento en cultivo, su desempeño bajo condiciones de estudio y su tamaño, son potencialmente útiles para ser empleadas como partícula nutritiva en la alimentación de larvas de peces, crustáceos y moluscos con fines acuícolas. Se recomienda realizar estudios dirigidos a establecer su composición bromatológica acorde al medio y condiciones de cultivo.
BIBLIOGRAFÍA
1. Bougrier S, Hawkns A, Herzl M. Preingestive selestion of diffent microalgal mixtures in Crassostrea gigas and Mytilus edulis, analysed by flow cytometry. Aquaculture 1997; 150:123-134. [ Links ]
2. Brown M, Jeffrey S, Volkman J, Dunstan G. Nutritional properties of microalgae for mariculture. Aquaculture 1997;151:315-331. [ Links ]
3. Coutteau P. Migro-algae. In: LAVENS, P; SORGELOOS, P. Manual on the production and use of live food for aquaculture. FAO. Roma. 1996; p.295. [ Links ]
4. Crawford R, Mamm D, Round F. The Diatoms. Biology & Morfology of the Genera. 2º Reprint.1996. Cambridge. 1990; p.747. [ Links ]
5. D’souza F, Kelly G. Effects of a diet of a nitrogen-limited alga (Tetraselmis suecica) ongrowth, survival and biochmical composition of tiger prawn (Penaeus monodon) larvae. Aquaculture 2000; 181:311-329. [ Links ]
6. Fabregas J, Otero A, Morales E, Cordero B, Patino M. Tetraselmis suecica cultured in different ´ ˜nutrient concentrations varies in nutritional value to Artemia. Aquaculture 1996; 43:197–204. [ Links ]
7. Fidalgo J, Cid A, Torres E, Sukenik A, Herrero C. Effects of nitrogen source and growth phase on proximate biochemical composition, lipid classes and fatty acid profile of the marine microalga Isochrysis galbana. Aquaculture 1998;166:105-116. [ Links ]
8. González De Infante A, y col. El plancton de las aguas continentales. Monografía 31 OEA. Washington DC.- USA. 1988; p.131. [ Links ]
9. Guillard, R.R.L. y J.H.Ryther. Studiesofmarine planktonic diatoms. I Cyclotella nana Hustedt and Detonula confervacea (Cleve) Gran. Com J Microbiol 1962; 229-398. [ Links ]
10. Guillard, R. R. L Handbook of phycological methods. J. R. Stein Cambridge University press, London. Division rates. 1973; p.289-311. [ Links ]
11. Leonardos L, Lucas I. The nutritional value of algae grown under different culture conditions for Mytilus edulis L. larvae. Aquaculture 2000;182:301-315. [ Links ]
12. Oliveira M, Monteiro M, Robbs P. Leite S. Growth and chemical composition of Spirulena maxima and Spirulena platensis biomass at different temperatures. Aquacul Int 1999; 7:261-275. [ Links ]
13. Paniagua J, Buckle F, Granados C, Loya D. Manual de metodologías y alternativas para el cultivo de microalgas. CICESE. México. 1986; p.93. [ Links ]
14. Phaterpekar P, Sreepada R, Pednekar C, Achutha C. A comparative study on growth performance and biochemical composition of mixed culture of Isochrysis galbana and Chaetoceros calcitrans with monocultures. Aquaculture 2000; 181:141-155. [ Links ]
15. Renaud S, Luong-van T, Lambrinidis G, Parry, D. Effect of temperature on growth, chemical composition and fatty acid composition of tropical Australian microalgae grown in batch cultures. Aquaculture 2002; 211:195-214. [ Links ]
16. Renaud S, Zhou H, Parry D, Thinh L, Woo K. Effect of temperature on the growth, total lipid content and fatty acid composition of recently isolated tropical microalgae Isochrysis sp., Nitzschia closterium, and commercial species Isochrysis sp. clone T.ISO. J Appl Phycol 1995; 7:595-602. [ Links ]
17. Sánchez S, Martinez E, Espinola F. Biomass production and biochemical variability of the marine microalga Isochrysis galbana in relation to culture medium. Biochemical Engineering J 2006:13-18. [ Links ]
18. Sipaúba–Tavares L, ROCHA O. Produção de plâncton (Fitoplâncton e Zooplâncton) para alimentação de organismos aquáticos. RiMa, São Carlos. 2003. [ Links ]
19. Thompson P, Harrison P. Effects of monospecific algal diets of varying biochemical composition on the growth and survival of the Pacific oyster Crassostrea gigas larvae. Mar Biol 1992; 113: 645-654. [ Links ]
20. Treece G, FOX J. Design operation an training manual for an intensive culture shrimp hatchery. Texas A&M. University Sea Grant College Program. Texas. 1993. [ Links ]
21. Tzovenis I, De Pauw N, Sorgeloos P. Optimization of T-ISO biomass production rich in essential fatty acids I. Effect of different light regimes on growth and biomass production. Aquaculture 2003; 216;203-222. [ Links ]
22. Yusoff M, Matias H, Khalid Z, Phang S. Culture of microalgae using intertitial water extracted from shrimp pond bottom sediments. Aquaculture 2001; 201:263-270. [ Links ]














