Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista MVZ Córdoba
Print version ISSN 0122-0268On-line version ISSN 1909-0544
Rev.MVZ Cordoba vol.10 no.2 Córdoba July/Dec. 2005
ORIGINAL
VIGILANCIA CENTINELA PARA EL VIRUS DEL OESTE DEL NILO EN CULICIDOS Y AVES DOMÉSTICAS EN EL
DEPARTAMENTO DE CÓRDOBA
SENTINEL SUVEILLANCE FOR WEST NILE VIRUS IN CULICIDES AND DOMESTIC BIRDS IN CÓRDOBA
Manolo Jaramillo1, José Peña1, Luis Berrocal1, Nicholas Komar2, Marco González1, César Ponce3, Katiuska Ariza3, Salim Máttar1*
1Facultad de Medicina Veterinaria y Zootecnia. Instituto de Investigaciones Biológicas del Trópico. Universidad de Córdoba, Montería, Colombia.
2Centers for Disease Control and Prevention Division of Vector-Borne Infectious Diseases Fort Collins, Colorado, USA. *Correspondencia: smattar@escarsa.net.co
3Facultad de Medicina. Universidad Cooperativa de Colombia. Seccional Santa Marta, Colombia.
RESUMEN
El virus del Oeste del Nilo (VON) género Flavivirus, familia Flaviviridae, es mantenido en la naturaleza en un ciclo enzoótico ave-mosquito-ave. Las aves son los hospederos amplificadores primarios. Humanos y caballos son hospederos incidentales finales. En humanos las infecciones se manifiestan como enfermedad febril autolimitada. También puede presentarse encefalitis o meningoencefalitis. El virus se ha establecido en Norte América y se ha documentado su circulación en México, Jamaica, República Dominicana, Guadalupe, Cuba, Puerto Rico, El Salvador y recientemente en Colombia. Se realizó una vigilancia centinela en culícidos y aves domésticas para hacer un seguimiento a la circulación en el departamento de Córdoba e identificar que especies de mosquitos estaban infectadas con el virus. Se analizaron 4942 mosquitos en 99 pooles por la técnica Vec TestTM (Medical System, Inc. Camarillo, CA) y 162 sueros de aves de corral fueron enviadas al Centers for Disease Control and Prevention Division of Vector-Borne Infectious Diseases Fort Collins, USA, para ser analizadas por MAC-ELISA y debido a las reacciones cruzadas que se dan entre el VON y otros virus del serocomplejo de la encefalitis japonesa se utilizó el test de reducción de la neutralización en placa (PRNT). No se obtuvieron mosquitos o aves positivos.
Palabras clave: Virus del oeste del Nilo, Colombia, culícidos, aves.
ABSTRAC
West Nile Virus (WNV) genus flavivirus, family Flaviviridae, is maintained in nature in an enzootic cycle mosquito-bird-mosquito. Birds are the main amplifying hosts. Humans and horses are incidental dead-end hosts. In humans it yields a self-limited febrile disease; it can produce encephalitis and meningoencephalitis as well. WNV is wide spread in North America and its circulation has been documented in México, Jamaica, Dominican Republic, Guadalupe, Cuba, Puerto Rico, El Salvador and recently Colombia. It was performed a sentinel surveillance in Culicides and domestic birds to follow-up WNV circulation in the department of Córdoba taking into account its circulation evidence in horses of this region and identifying mosquito species infected with the virus. 4.942 mosquitoes were assessed in 99 pools were assessed by Vec TesttTM (Medical System, Inc. Camarillo, CA) and 162 serums of domestic birds were analyzed by MAC-ELISA in the Centers for Disease Control and Prevention, Division of Vector-Borne Infectious Diseases, Fort Collins, USA. Due to the crossed reactions among WNV and others virus of the Japonese Encephalitis, a plaque reduction neutralization test (PRNT) was used. There was not nor positive mosquitoes neither positives birds.
Key words: West Nile virus, Colombia, culicides, birds
INTRODUCCIÓN
El virus del Oeste del Nilo (VON) pertenece a la familia Flaviviridae género Flavivirus, hace parte del serocomplejo de la encefalitis japonesa junto con los virus Cacipacora, Koutango, encefalitis japonesa, encefalitis de San Luis, encefalitis Murray Valley, Usuto y Yaounde (Zeller 2004). Es mantenido en la naturaleza en un ciclo enzoótico ave-mosquito-ave. Fue aislado por primera vez en la provincia West Nile de Uganda en 1937 y está ampliamente disperso en humanos, aves y mosquitos en África, el medio oriente y el sur de Europa (Zeller 2004). Desde los años 90, la frecuencia y severidad de las infecciones en humanos aumentó, como también el número de reportes en una variedad de vertebrados incluyendo mascotas, animales de granja y animales salvajes. Además, fue reconocido en áreas no afectadas previamente (Hayes 2005). El virus tiene dos ciclos de transmisión; uno enzoótico primario o de amplificación que envuelve un grupo de vectores y huéspedes aviares, y uno secundario que envuelve artrópodos diferentes y transmisión a otros hospederos como humanos y caballos. Los principales vectores son los mosquitos del género Culex (Hubalek y col. 1999).
Las aves son los hospederos amplificadores primarios. Humanos y caballos son hospederos incidentales finales. La alta viremia en aves y su duración permite la transmisión a mosquitos, y teniendo en cuenta las migraciones que estas realizan en primavera, se ha sugerido que ellas pueden ser vehículo de introducción en áreas no afectadas (Komar 2003). En humanos la infección por VON se presenta como enfermedad febril autolimitada. En casos de enfermedad neurológica se puede presentar encefalitis, meningitis o meningoencefalitis, con mayor incidencia y mortalidad de encefalitis en personas de mayor edad y pacientes inmunocomprometidos. En humanos se han identificado nuevos modos de transmisión incluyendo; infección a través de productos sanguíneos contaminados, transplante de órganos, leche materna, transmisión intrauterina y exposición ocupacional (Campbell y col. 2002). El virus se ha establecido en Norte América donde ha encontrado vectores competentes, hospederos amplificadores susceptibles y mecanismos eficientes para sobrevivir durante las temporadas frías. Su circulación se ha documentado en México (Elizondo-Quiroga 2005), Jamaica (Dupuis y col. 2003), Republica Dominicana (Komar y col. 2003), Guadalupe (Lefrancois y col. 2005), Cuba, Puerto Rico (Dupuis y col. 2005), El Salvador (Cruz y col. 2005) y recientemente Colombia (Máttar y col. 2005).
El objetivo del presente trabajo fue el de realizar una vigilancia centinela en culícidos y aves domesticas Gallus gallus para monitorear la circulación del VON.
MATERIALES Y MÉTODOS
Selección de áreas geográficas: se establecieron puntos de muestreo en las zonas urbanas y rurales del medio y bajo Sinú en las localidades de Montería, Leticia, Cotorra, Cotocá Arriba, Lorica y en el corregimiento San Sebastián, próximo a la Ciénaga Grande del Bajo Sinú. Adicionalmente, se escogió otro punto de muestreo en el municipio de Planeta Rica, incluido en los territorios de cuenca del Río San Jorge (Figura 1).
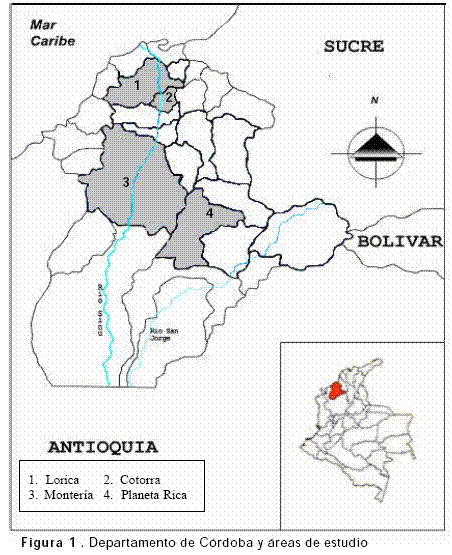
Muestreo y análisis de vectores: La colecta de los individuos fue hecha empleando dos trampas de luz CDC y una trampa Shannon. El muestreo se realizó entre los meses de Octubre y Diciembre de 2004 y durante el primer semestre de 2005, ubicando las trampas en lugares cercanos a cuerpos de agua y a comunidades aviares densas, en sitios urbanos y rurales. Las trampas de luz tuvieron un rango de actividad de 12 horas. Las trampas Shannon se usaron en un rango de dos a tres horas. Los individuos colectados fueron transportados al Instituto de Investigaciones Biológicas del Trópico de la Universidad de Córdoba donde fueron identificados y clasificados en géneros, especie, fecha y lugar de captura. Se formaron pooles de 50 individuos y se analizaron para la presencia del antígeno viral; cuando no se pudo completar el número de 50 individuos de una misma especie, se mezclaron hasta dos géneros en un pool. Los pooles fueron mantenidos a -70°CTM hasta ser analizados utilizando el método VecTesttTM WNV/SLV (Medical Análisis Systems, Camarillo, CA, USA) una prueba inmunocromatográfica que determina cualitativamente presencia o ausencia de antígeno viral en mosquitos infectados. La prueba se inicia con la introducción de la tira que contiene anticuerpos contra el virus en una solución de extracto de mosquitos. El antígeno, de estar presente en la muestra, se une al anticuerpo específico formando un complejo antígeno-anticuerpo-gold que migra a través de la zona del test que contiene los anticuerpos inmovilizados de VON, a los que se une constituyendo un sandwich. Luego el complejo desligado y marcado migra fuera de la zona de test y es capturado después en una zona de control. Una línea rojo púrpura en un área específica de la zona de test indica presencia del antígeno, de no presentarse, la línea de control én la zona de control, muestra si el ensayo fue llevado a cabo correctamente.
Muestreo y análisis de aves: se tomaron muestras en aves domesticas (Gallus gallus) en el municipio de Planeta Rica, una sola vez en Octubre de 2004. Se tomaron 0.5 ml de sangre de una de las alas del ave en tubos Vacutainer®. Las muestras fueron transportadas al Instituto de Investigaciones Biológicas del Trópico de la Universidad de Córdoba donde fueron procesadas para la obtención de suero, éstos fueron almacenados a -70°C hasta su envío al Centers for Disease Control and Prevention Division of Vector-Borne Infectious Diseases Fort Collins, Colorado, para ser analizados utilizando MAC-ELISA (Blitvich y col. 2003) y debido a las reacciones cruzadas que se dan entre el VON y otros virus del serocomplejo de la encefalitis japonesa (Calisher y col. 1989) se utilizó el test de reducción de la neutralización en placa (PRNT) (Beaty y col. 1995).
RESULTADOS
Descripción de áreas geográficas: estas áreas forman parte de los complejos cenagosos de Betancí, Ciénaga Grande del Bajo Sinú, Ciénaga de Bañó y Ciénaga Mono Macho al margen izquierdo del río Sinú a la altura del caserío Leticia, ecosistemas que sostienen una apreciable ornitofauna y por su humedad, considerables comunidades de culícidos. Presenta alturas entre los 0 y 14 msnm. El carácter tropical del valle y el predominio de zonas bajas establece un régimen térmico cálido tropical con temperaturas medias mensuales superiores a los 25°C. La temperatura promedio anual del aire está por encima de los 28 °C, las variaciones de la temperatura en el día son relativamente altas (±10°C). Estas áreas se consideran del tipo bosque seco tropical, caracterizado por precipitaciones que no sobrepasan los 2000 mm anuales, de los cuales más del 80% son en invierno. Las precipitaciones acumuladas durante el período de estudio fueron de 449,1 mm (IDEAM 2004).
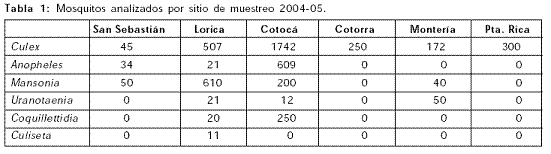
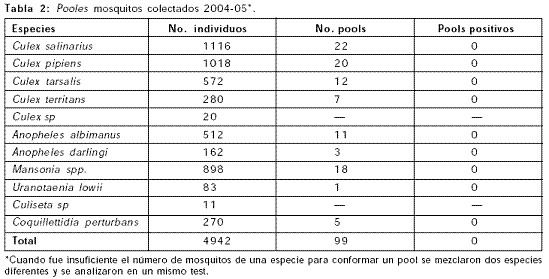
Mosquitos: muestreo e identificación; Se colectaron un total de 4942 mosquitos, en 6 puntos de muestreo; Montería (Caserío Leticia y Universidad de Córdoba), Cotorra, Cotocá Arriba, Lorica y San Sebastián, representando las zonas geográficas del medio y bajo Sinú, y un punto adicional en el municipio de Planeta Rica, perteneciente a la cuenca del río San Jorge. Se identificaron especies de mosquitos de los géneros Culex (60.8%), Anopheles (14%), Mansonia (18%), Coquillettidia (5%), Uranotaenia (2%) y Culiseta (0.20%). Se colectó un promedio de 300 mosquitos por semana durante el muestreo, que incluyó temporada seca y lluviosa. Se formaron 99 pooles con los 4942 mosquitos colectados. Ningún pool fue hallado positivo para VON (Tablas 1 y 2).
Aves: se colectaron muestras de 162 aves de corral Gallus gallus (Orden Galliformes, Familia Phasianidae), ningún ave presentó anticuerpos frente al VON.
DISCUSIÓN
Luego de su entrada al hemisferio Occidental en 1999, el VON se diseminó rápidamente en el Norte del continente (McLean y col. 2002) y desde entonces se hipotetizó su transporte al Neotrópico por las migraciones interoceánicas que anualmente realizan ciertos grupo de aves (Rappole y col. 2002). Estas migraciones, condiciones climáticas adecuadas y biodiversidad en los ecosistemas, facilita en cualquier sitio geográfico la amplificación del virus en hospederos vertebrados susceptibles. La actividad del virus en el Neotrópico ha sido documentada en varias islas del Caribe (Dupuis y col. 2003, Komar y col. 2003, Lefrancois y col. 2005, Dupuis y col. 2005), y recientemente se documentó su circulación en dos departamentos del caribe Colombiano (Mattar y col. 2005).
La ausencia de resultados positivos para la presencia del antígeno viral en mosquitos debe ser interpretada cuidadosamente pues están influenciados por múltiples variables, entre ellas el tipo y número de trampas utilizadas, intensidad y puntos específicos de muestreo, y el lapso de tiempo entre la época del año en que se realizaron las capturas y la época en que el virus estuvo activo y se produjo su salida del ciclo aviar para infectar a los equinos, la cual se desconoce. La proporción de pooles de mosquitos positivos en las poblaciones salvajes son muy bajas incluso cuando las tasas de transmisión son altas (Murgue y col. 2002). Durante un estudio muy intenso en Egipto entre 1951 y 1954, el virus sólo fue aislado en un 1.7% de los pooles analizados. Las tasas de aislamiento han sido similares en Norte América, a pesar del uso de trampas CDC para hembras grávidas del genero Culex, un dispositivo que captura selectivamente grandes números de hembras Cx. pipiens y Cx. restuans que se han alimentado al menos una vez (Murgue y col. 2002).
Cuando se encontró evidencia de la actividad del virus en aves y equinos en la Florida, la seroconversión en gallinas demoró hasta 7.7 semanas (Blackmore y col. 2003), cuando se utilizan aves como centinelas, la infección en estas puede llegar a ser distante en el tiempo con respecto a una primera evidencia en otros huéspedes. Este antecedente podría otorgar una explicación a la ausencia de resultados positivos en las aves analizadas, pues sólo se realizó un muestreo, limitado con relación al precedente sentado e insuficiente de acuerdo con los procedimientos de los sistemas de vigilancias con aves centinelas, que requieren muestreos cada una o dos semanas para detección y confirmación de infección (Komar 2001).
La negatividad de las pruebas utilizadas en este estudio, no significa que el virus no esté circulando en Córdoba, debido a los resultados previamente obtenidos por Máttar y col. (2005).
En conclusión, la complejidad de los ciclos de transmisión de los arbovirus y los múltiples factores por los cuales son influenciados hacen que el resultado de la introducción del VON a Colombia sea impredecible. Es necesario que las autoridades en salud humana y animal aumenten la vigilancia de posibles casos de infección atribuible a VON en humanos, aves y equinos. También se necesita realizar esfuerzos para aislar el virus, o detectar ARN viral específico para confirmar los resultados, e identificar los vectores y huéspedes vertebrados involucrados en el ciclo de transmisión del virus en Colombia.
BIBLIOGRAFÍA
1. Beaty BJ, Calisher CH, Shope RE. Arboviruses. En: Lennette EH, Lennette DA, Lennette ET, editors. Diagnostic procedures for viral, rickettsial, and chlamydial infections. 7th ed. Washington: American Public Health Association 1995; p.189-212. [ Links ]
2. Blackmore CG, Stark LM, Jeter WC, Oliveri RL, Brooks RG, Conti LA, et al. Surveillance results from the first West Nile virus transmission season in Florida, 2001. Am J Trop Med Hyg 2003; 2:141-50. [ Links ]
3. Blitvich BJ, Marlenee NL, Hall RA, Calisher CH, Bowen RA, Roehrig JT, et al. Epitope-blocking enzyme-linked immunosorbent assays for the detection of serum antibodies to West Nile virus in multiple avian species. J Clin Microbiol 2003; 41:1041-7. [ Links ]
4. Calisher CH, Karabatsos N, Dalrymple JM, Shope RE, Porterfield JS, Westaway EG, et al. Antigenic relationships between flaviviruses as determined by cross-neutralization tests with polyclonal antisera. J Gen Virol 1989; 70:37-43. [ Links ]
5. Campbell GL, Marfin AA, Lanciotti RS, Gubler DJ. West Nile virus. Lancet Infect. Dis 2002; 2:519-529. [ Links ]
6. Cruz L, Cardenas VM, Abarca M, Rodríguez T, Reyna RF, Serpas MV, et al. Short Report: Serological evidence of west Nile virus activity in El Salvador. Am J Trop Med and Hyg 2005; 72:612-615. [ Links ]
7. Dupuis AP, Marra PP, Kramer LD. Serologic evidence for West Nile virus transmission in Jamaica, West Indies. Emerg Infect Dis 2003; 9:860-3. [ Links ]
8. Dupuis II AP, Marra PP, Reitsma R, Jones MJ, Louie KL, Kramer LD. Serologic evidence for West Nile virus transmission, Puerto Rico and Cuba. Am J Trop Med Hyg 2005; 2:474-6. [ Links ]
9. Elizondo-Quiroga D. West Nile virus isolation in human and mosquitoes, Mexico. Emerg Infect Dis 2005; 9:1449-52. [ Links ]
10. Hayes EB. Epidemiology and transmission dynamics of west Nile virus disease. Emerg Infect Dis 2005;11:1167-73. [ Links ]
11. Hubalek Z, Halouzka J. West Nile fever-a reemerging mosquito-borne viral disease in Europe. Emerg Infect Dis 1999; 5:643-650. [ Links ]
12. Instituto de hidrología, meteorología y estudios ambientales IDEAM. Noviembre 15 de 2004. URL disponible en Internet: http://bart.ideam.gov.co/treal/treal.htm [ Links ]
13. Komar N. West Nile virus: epidemiology and ecology in North America. Adv Virus Res 2003; 61:185-234. [ Links ]
14. Komar O, Robbins MB, Klenk K, Blitvich BJ, Marlenee NJ, Burkhalter KL, Gubler DJ, Gonzalvez G, Pena CJ, Peterson AT, Komar N. West Nile virus transmission in resident birds, Dominican Republic. Emerg Infect Dis 2003; 9:1299-1302. [ Links ]
15. Komar N. West Nile surveillance using sentinel birds. Ann NY Acad Sci 2001; 951:58-73. [ Links ]
16. Lefrancois T, Blitvich BJ, Pradel J, Molia S, Vachiery N, Pallavicini G, Marlenee NL, Zietsra S, Petitclerc M, Martinez D. West Nile virus surveillance, Guadeloupe, 2003-2004. Emerg Infect Dis 2005; 7:1100-3. [ Links ]
17. Máttar S, Edwars E, Laguado J, Gonzalez M, Komar N. West Nile Virus antibodies in Colombian Horses. [letter]. Emerg Infect Dis 2005; 11:1497-8. [ Links ]
18. McLean RG, Ubico SR, Bourne D, Komar N. West Nile virus in livestock and wildlife. Curr Top Microbiol Immunol 2002; 267:271-308. [ Links ]
19. Murgue B, Zeller H, Deubel V. The ecology and epidemiology of West Nile virus in Africa, Europe and Asia. Curr. Top. Microbiol. Immunol 2002; 267:195-221. [ Links ]
20. Rappole JH, Derrickson SR, Hubalek Z. Migratory birds and spread of West Nile virus in the Western Hemisphere. Emerg Infect Dis 2000; 4:319-28. [ Links ]
21. Zeller H. West Nile Virus: An Overview of Its Spread in Europe and the Mediterranean basin in Contrast to Its Spread in the Americas. Eur J Clin Microbiol Infect Dis 2004; 23:147-156. [ Links ]














