Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares en
SciELO
Similares en
SciELO -
 Similares en Google
Similares en Google
Compartir
Revista MVZ Córdoba
versión impresa ISSN 0122-0268versión On-line ISSN 1909-0544
Rev.MVZ Cordoba v.11 n.1 Córdoba ene./jun. 2006
ORIGINAL
CULTIVO EXPERIMENTAL DEL CLADOCERO Moina sp ALIMENTADO CON Ankistrodesmus sp y Saccharomyces cereviseae
EXPERIMENTAL CULTURE OF CLADOCERANS Moina sp FEED WITH Ankistrodesmus sp and Saccharomyces cereviseae
Martha Prieto*1, Litia De la Cruz2, Mario Morales3.
1Universidad de Córdoba, Facultad de Medicina Veterinaria y Zootecnia, Departamento de Ciencias Acuícolas. * Correspondencia: mjprieto@sinu.unicordoba.edu.co
2Universidad de Córdoba, Departamento de Ciencias Acuícolas, Programa de Acuicultura.
3Universidad de Córdoba, Facultad de Ciencias Básicas, Departamento de Matemáticas y Estadística.
RESUMEN
Objetivo. Realizar un cultivo experimental de cladócero Moina sp alimentado con Ankistrodesmus sp y Saccharomyces cereviseae.
Materiales y métodos. Fueron realizados cultivos experimentales de la cepa de cladóceros Moina sp en el laboratorio de Alimento Vivo de la Universidad de Córdoba, bajo condiciones controladas de temperatura (22°C), pH (7.6), intensidad lumínica (2000 lux) y aireación. Se emplearon dos dietas de alimento como tratamiento (Ankistrodesmus y Ankistrodesmus mas Saccharomyces cereviseae) en concentración de 40 x 105 cel.ml-1 cada uno, para determinar su efecto sobre el desempeño de la población. Diariamente se registró la densidad poblacional y celular.
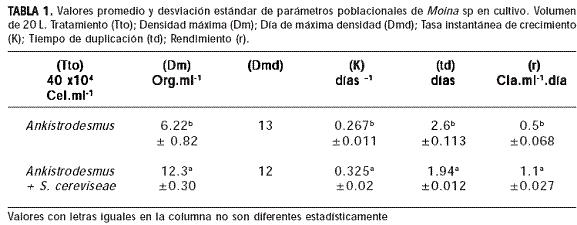
Resultados. Se obtuvieron diferencias significativas para el efecto de las dietas sobre el crecimiento poblacional de los cladóceros, los individuos alimentados con Ankistrodesmus sp + Saccharomyces cereviseae alcanzaron una densidad de 12.3a ±0.30 org/ml-1 presentando mayor tasa instantánea de crecimiento (K) 0.36 ± 0.002, el menor tiempo de duplicación (td) 1.94 ± 0.012 y el mayor rendimiento (r) 1,1 ± 0.07 clad.ml-1.día-1.
Conclusión. Los cladóceros por sus características de crecimiento en cultivo, presentan adaptación favorable a las condiciones de manejo para la producción de biomasas potencialmente útiles como partícula nutritiva con fines acuícolas.
Palabras clave: Alimento vivo, cladóceros, Moina sp, microalga, cultivo.
ABSTRACT
Objetive. Realize an experimental cuculture of cladorerans Moina sp feed with Ankistrodesmus sp and Saccharomyces cereviseae.
Materials and methods. At Universidad de Córdoba, Laboratory of Food Live, experimental cultivations of the cladocerans stump Moina sp under controlled conditions of temperature (22°C), pH (7.6), light intensity (2000 lux) and air condition were made. Two food diets were used as treatments (Ankistrodesmus and Ankistrodesmus + Saccharomyces. cereviseae) in concentration of 40 x 105 cel.ml-1, to determine their effect on the population’s acting. Populational and celular density were registered dail y.
Results. The results showed significant difference for the effect of the diets on the populational growth of the cladocerans, the individuals fed with Ankistrodesmus sp + Saccharomyces cereviseae reaches density of 12.3a ±0.30 org/ml-1 presenting highest instantaneous rate of growth (K) 0.36 ± 0.002, the smallest time of duplication (td) 1.94 ± 0.012 and the highest yield (r) 1,1 ± 0.07 clad.ml-1.day-1.
Conclusions. These cladocerans for their characteristics of growth in cultivation, present favorable adaptation to the handling conditions to produce biomasses potentially useful as nutritious particle with aquaculture purposes.
Key words: Food live, cladocerans, Moina sp, microalgae, culture.
INTRODUCCIÓN
Los cladóceros son organismos de gran utilidad para la acuicultura ya que representan un aporte nutritivo, diversifican el alimento y son presa fácil para larvas de peces y crustáceos (1- 4). Entre los organismos del zooplancton, los cladóceros representan un importante renglón en la cadena trófica de muchos cuerpos de agua particularmente en la Cienaga Grande de Lorica (5).
La producción exitosa de peces con fines acuícolas depende en gran medida de la disponibilidad de organismos zooplanctónicos de talla apropiada para la alimentación de sus larvas y post-larvas En este sentido, los cladóceros constituyen una buena herramienta en acuicultura debido a su pequeña talla, rápido desarrollo, temprana reproducción, alta tasa de multiplicación, fácil manejo y considerable valor comercial entre otros aspectos (6,4).
Entre los muchos organismos que conforman el zooplancton los cladóceros son más vulnerables a la predación (3,7), por tanto son considerados como una presa adecuada para la piscicultura (8). Son apetecidos por diferentes especies de peces tropicales de agua dulce; tal es el caso de Dorada (Brycon sinuensis), Yamú (Brycon amazonicus), Bagre blanco (Sorubim cuspicaudus), Bocachico (Prochilodus magdalenae), Pacu (Piaractus mesopotamicus), Tambaqui (Colossoma macropomum), Curimbatá (Prochilodus scrofa) (9, 10, 7, 11). En general ha sido reportada la preferencia por el consumo de zooplancton de mayor tamaño (cladóceros y copépodos) y consumo insignificante de rotíferos y protozoarios en las mayoría de las especies neotropicales de peces donde fue evaluado el régimen alimentario en la fase de alevinaje. Esto ha conducido a que se desplieguen varias investigaciones en cuanto a su bioecología, longevidad, crecimiento, características morfológicas, cultivos, reproducción, entre otras.
Dentro de los cladóceros se han seleccionado principalmente los géneros Daphnia y Moina por ser de gran importancia en la piscicultura. Estos organismos son muy estudiados con relación a sus condiciones óptimas de cultivo, debido al alto valor nutritivo y a su facilidad de producción (12). Cladóceros del género Moina son considerados presa fácil debido a su forma, movimiento, perfil nutricional y pigmentación (13). Los cladóceros presentan rico valor nutricional, presentan espectro de enzimas importantes (proteinasas, peptidasas, amilasas, lipasas y celulasas) que sirven como exoenzimas en el intestino de las postlarvas (14,13) y algunas especies pueden presentar 60 % de proteína de su peso seco y aminoácidos favorables para los requerimientos nutricionales de larvas y alevinos de peces, así como cantidad total de grasa por peso seco de 20% - 27% para las hembras adulto y del 4% - 6% para los juveniles (15).
En los cladóceros, la edad y la fuente de alimentación determina su calidad nutricional y perfil bromatológico (16). El uso de diferentes dietas para el cultivo de cladóceros del genero Moina, ha sido investigado por diferentes autores, sin embargo para especies nativas de la Cienaga de Lorica, tan solo existe un reporte de estudio sobre el genero Moinodaphnia (4). Los géneros más cultivados han sido Daphnia, Moinodaphnia y Moina, sin embargo, existen pocos registros reportados, ya que los cultivos de estos organismos se limitan a prácticas de fertilización orgánica en estanques (17) y como alimento para peces de acuarismo, utilizado en muchas piscifactorías.
Los cladóceros presentan diferentes respuestas y sensibilidad ante las diversas dietas, deficiencias en nutrientes en las microalgas o en las partículas que consumen como alimento, inciden directamente en su crecimiento y reproducción afectando la fecundidad (16); igualmente importantes en el desempeño de estos organismos en cultivo son los diferentes parámetros físico-químicos, principalmente temperatura (18).
El uso de especies nativas de cladóceros en la alimentación de larvas hasta ahora ha sido limitado por ausencia de tecnologías de manejo que permitan obtener masivamente poblaciones que suplan en calidad y cantidad los requerimientos básicos de las diferentes especies de peces objeto de cultivo. El estudio y cultivo de esta especie en la región representa una valiosa alternativa por ser una presa viva con un enorme potencial acuícola (8, 4, 7). Este estudio tuvo como objetivo evaluar el desarrollo poblacional del cladócero Moina sp en cultivo experimental, utilizando dos dietas alimenticias basadas en microalgas y levaduras.
MATERIALES Y MÉTODOS
La investigación se llevó a cabo en el Laboratorio de Alimento Vivo de la Universidad de Córdoba sede Lorica, en donde se realizó bajo condiciones controladas (temperatura, salinidad, pH, intensidad lumínica y aireación), el cultivo de cladóceros en acuarios de vidrio con capacidad de 20 litros, totalizando 6 parcelas en un diseño de bloques al azar (días de cultivo) con dos tratamientos alimentarios en concentración de 40 x 105 cel.ml–1: la microalga Ankistrodesmus sp y mezcla de Ankistrodesmus sp + Saccharomyces cereviseae (levadura de panificación) en proporción 50:50, con tres replicas por tratamiento.
Las variables dependientes evaluadas fueron: tasa de crecimiento (Ind/Lit), tiempo de duplicación (días), producción diaria (Ind/Lit/dia), densidad final (Ind/ml) y rendimiento (Ind/ml/día). Fueron variables constantes durante el experimento la temperatura (ºC), volumen de cultivo (20 L), calidad del agua, pH, Amonio, Nitritos y Nitratos expresados en mg/L.
Las cepas del genero Moina fueron mantenidas en frascos de vidrio en volumen de 250 ml con densidad máxima de 5 organismos.ml–1, alimentadas con la microalga Ankistrodesmus sp en concentración de 4x105 cel.ml–1, con renovación del 50 % de agua cada tres días, temperatura promedio de 24 °C y exposición indirecta a la luz.
Se generaron en acuarios biomasas iniciales para inoculo, con aireación suave, constante y luz indirecta, se utilizó agua filtrada a 50 micras y se realizaron recambios semanales en un 80 % con la finalidad de estimular la muda y reproducción (19). Estas biomasas fueron inoculadas en cultivos controlados en las unidades experimentales a una densidad de 0.5 org.ml-1, con agua potable reposada y filtrada a 20 micras, aireación suave y exposición directa y constante a la luz.
Diariamente se realizó el conteo de los organismos en los acuarios mediante muestras del cultivo homogenizado; el conteo para estimar la densidad diaria de los cladóceros (Moina sp.) en cada unidad experimental, se hizo empleando el método volumétrico mediante observación en estereoscopio, con vidrio de reloj, vasos y pipetas. Diariamente se registraron los parámetros: temperatura y pH; cada tres días se registraron los niveles de amonio, nitrito y nitrato. La duración del cultivo estuvo sujeta al crecimiento poblacional de cladóceros en cada tratamiento.
La microalga Ankistrodesmus sp fue cultivada mediante el método descrito por Prieto et al (20), utilizando el medio de cultivo F1/2 de Guillard. Diariamente se realizó el conteo de la densidad microalgal y células de levadura en el cultivo experimental de cladóceros, mediante la utilización de una cámara Neubauer. Se calculó el valor promedio de número de células por mililitro a partir de conteo en microscopio de luz con objetivo 40X, utilizando la ecuación propuesta por Paniagua et al (21).
Para las poblaciones de cladóceros en cultivo se determino: la tasa instantánea de crecimiento (R) y el tiempo de duplicación (td) se calcularon mediante las ecuaciones propuestas por González (1988) (22); la densidad absoluta (D) se estimo mediante el conteo y promedio de tres alícuotas de 1 ml en vidrio de reloj mediante un estereoscopio de luz. El Rendimiento (r) se determino relacionando la densidad de los organismos en el tiempo mediante la ecuación r = (Nt1 - Nt0) / t, en igual sentido se calculo la producción diaria mediante la ecuación Pd= (Nf–N0)/(Ti-T0).
La información obtenida sobre los parámetros poblacionales fue procesada mediante análisis de varianza con el fin de establecer diferencias entre los resultados de los tratamientos. Se empleo el software S.A.S. (Statistical Analysis System) (año 1998, versión 6.12).
RESULTADOS Y DISCUSIÓN
La actividad reproductiva de la cepa de Moina, generó poblaciones partenogenéticas en condiciones de temperatura constante (24°C), fotoperíodo de 12:12 horas luz: oscuridad, con exposición indirecta a la luz. El adecuado desempeño reproductivo permite inferir que el tipo y cantidad de alimento (Ankistrodesmus sp. en 4x105 cel.ml–1), así como la renovación periódica de agua (50% C/3 días) y la densidad empleada (2–5 organismos.ml–1) son adecuados para el mantenimiento de la cepa.
En cultivo, el crecimiento poblacional del cladócero Moina sp presentó cuatro diferentes fases que se ajustan al modelo propuesto previamente (22). La primera es la fase de latencia a partir de la fecha de siembra, en donde los organismos durante 1-3 días atravesaron una etapa de adaptación al cultivo, con limitada capacidad reproductiva lo cual se reflejó en la estable densidad de los organismos.
A partir del tercer día se registró el inicio de la segunda fase en donde los organismos empiezan a reproducirse en un período de 3-5.días incrementando levemente su densidad poblacional. En esta fase se presentó diferencia significativa (P<0.05) entre la densidad poblacional de cladóceros de los diferentes tratamientos alimentarios.
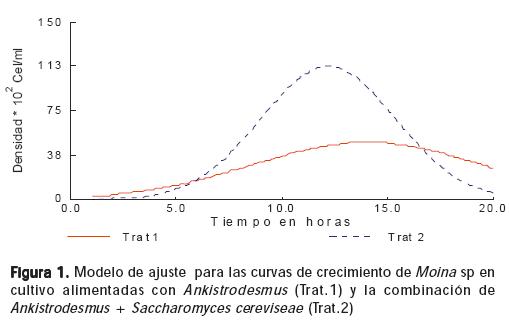
La segunda fase de aceleración es seguida por la fase de crecimiento exponencial con duración de 5–6 días, en la cual la densidad de los cladóceros aumenta rápidamente alcanzando la máxima densidad en cultivo con promedio de 6,22 ± 0,82 clad.ml-1 para el tratamiento 1 y 12,3 ± 0,30 clad.ml-1 para el tratamiento 2, con diferencia significativa entre si (P<0.05) (Tabla 1). Después de la máxima densidad alcanzada se presentó la disminución progresiva en el tamaño de la población durante 5-6 días, caracterizando la fase de descenso exponencial en la cual la tasa de reproducción es menor a la tasa de mortalidad (Figura 1).
Acorde a los resultados, la combinación Ankistrodesmus sp + Saccharomyces cereviseae en proporción 1:1 es una adecuada alternativa alimenticia para el cladócero Moina sp en condiciones de laboratorio. La población alimentada con la mezcla presentó la mayor densidad en cultivo 12,30 ± 0,30 org.ml-1 obtenida en el menor tiempo (12 días). En los cultivos alimentados con esta combinación se observó gran cantidad de hembras con cámara incubatríz abultada, indicando mayor número de huevos por hembra y por consecuencia mayor numero de neonatos, a diferencia de aquellas alimentadas solamente con Ankistrodesmus sp; estas observaciones fueron correspondientes con los conteos de población realizados.
Para la comparación de los tratamientos en el tiempo y la posible proyección de las densidades a obtener en un cultivo, se ajustaron los datos por medio de regresión no lineal. El modelo con mejor r ajuste presento fue:
En donde yt es el valor de la densidad poblacional en el tiempo t y a, b y c son constantes a estimar, siendo , la máxima densidad estimada a obtener, el tiempo mínimo en días requerido para obtener dicha densidad y el tiempo requerido en días para duplicar la población.
En la figura 1 se presenta el crecimiento poblacional con los datos ajustados de acuerdo con el modelo descrito, donde se obtuvo una densidad máxima estimada de 48.30*102 ± 2.105 org.lit-1 aproximadamente en 14.05± 0.37 días para Ankistrodesmus sp (T1), mientras que con Ankistrodesmus sp + Saccharomyces cereviseae (T2) se obtendría una densidad máxima estimada de 112.89*102 ±3.06 aproximadamente a los 12.19 ± 0.10 días. El modelo describe el comportamiento de los datos en 93 y 97 %, para T1 y T2 respectivamente.
El tipo de alimento reveló incidencia en la densidad poblacional, tasa de crecimiento y rendimiento en el cultivo, presentando diferencia significativa (p<0.05) entre tratamientos. Se registraron valores poblacionales más altos en los individuos alimentados con Ankistrodesmus sp + Saccharomyces cereviseae presentando mayor tasa instantánea de crecimiento (K) 0.36 ± 0.002, el menor tiempo de duplicación (td) de 1.94 ± 0.012 y el mayor rendimiento (r) 1,1 ± 0.07 clad.ml-1.día-1 (Tabla 1).
Los resultados poblacionales obtenidos en los cladóceros alimentados con Ankistrodesmus sp + Saccharomyces cereviseae se explican por el valor nutricional que presenta la microalga para la especie (23), la cual cuenta con un porcentaje de proteína de 12 - 35 %; lípidos 14 - 32 % y carbohidratos de 12-17 - 23 %. Además, las proteínas son constituyentes principales de las paredes de las levaduras; la pared celular de S. cereviseae contiene de 6 a 8 % de proteínas, un promedio de 8.5 – 13.5 % de lípidos y contiene una gran contenido de vitamina B (Tiamina, Riboflavina, ácido fólico, etc.) (24), que la hacen interesante para la alimentación de organismos zooplanctónicos.
En igual sentido los resultados superiores en el crecimiento poblacional de Moina sp pueden ser explicados en relación con el tamaño de la partícula disponible y la capacidad de ingesta por parte de los cladóceros. La levadura Saccharomyces cereviseae presenta pequeño tamaño de partícula (5-7µm) y Ankistrodesmus tamaño alrededor de 20µm ofertando partículas de diferente tamaño para neonatos y adultos. Siendo Moina sp un genero perteneciente a la familia Moinidae se espera capacidad de ingestión de partículas alrededor de las 10 µm para neonatos y 20 µm para adultos. El diámetro máximo de partículas que puede ingerir un neonato es de 13.6 µm y el de un adulto es aproximadamente de 24 µm para Moinodaphnia macleayii, (6). Por lo tanto se puede inferir que Moina sp presenta un tamaño de boca en la categoría mencionada considerando que la especie de microalga y levadura presentan las dimensiones adecuadas.
El tamaño de partícula asociado a las características nutritivas hace de este alimento una dieta adecuada para los cladóceros, esto se ajusta a lo descrito por otros autores quienes afirman que la levadura por su pequeño tamaño de partícula, alto contenido de proteínas y estabilidad en la columna de agua, es una dieta aceptable para cladóceros (1); en igual sentido, las microalgas como Ankistrodesmus son consideradas de alto valor nutritivo. También se han empleado tres dietas diferentes de microalgas (Ankistrodesmus, Scenedesmus y Chlorella) en la alimentación de Moina macropopa; las tres especies de microalgas satisfacen los requerimientos nutricionales del cladócero, destacando la marcada diferencia de tamaño entre las partículas de alimento (25).
El valor nutritivo de un alimento influye en la tasa de crecimiento de una población, condicionando el tiempo de desarrollo del juvenil, la tasa de reproducción y la frecuencia reproductiva (22). Esto se confirma en el presente trabajo con los resultados de tasa de crecimiento obtenidos con Moina sp en las dos dietas; donde los organismos alimentados con Ankistrodesmus sp. más levadura presentaron mejores promedios.
Los resultados obtenidos también coinciden con lo reportado por otros autores quienes señalan que las dietas mixtas (alga – levadura) producen las más altas tasas de crecimiento poblacional en cultivo para organismos zooplanctónicos (26). También se afirma que debido al bajo perfil nutricional de la levadura, es recomendable utilizar dietas mixtas alga - levadura o usar otros aditivos para evitar la posible inestabilidad debido al efecto de los productos de degradación de la levadura y la carencia de ciertas vitaminas (26).
En cuanto a la calidad del alimento proporcionado a Moina sp en cultivo, los mejores resultados se registraron con la mezcla de la microalga y levadura. El fitoplancton pobre en HUFA da como resultado bajas tasas de crecimiento en el zooplancton, por tanto alimentar con una combinación de microalgas e otros alimentos, así como la combinación entre microalgas y emulsión con HUFA, incrementa las tasas de crecimiento (27). Las biomasas de zooplancton alimentadas naturalmente, encuentran fuerte correlación entre los diferentes perfiles nutritivos del fitoplancton y las otras partículas disponibles como alimento (28). En el presente estudio, se confirma este hecho, cuando se obtienen mejores tasas de crecimiento en la Moina sp alimentada con la mezcla de Ankistrodesmus + Saccharomyces, cuando comparadas con las obtenidas con los organismos alimentados únicamente con la microalga.
En igual sentido, se describen a los cladóceros del genero Moina más sensibles a las deficiencias de fósforo en las algas de las cuales se alimentan, que otros cladóceros como los del genero Ceriodaphnia (29). Se afirman que los cladóceros Moina crecen mejor y producen más huevos con algas deficientes en nitrógeno y no así en algas deficientes en N y P. De este modo, es importante destacar la importancia del perfil de ácidos grasos (HUFA y PUFA) y la composición de nutrientes en las microalgas y su efecto directo sobre la tasa de crecimiento de los cladóceros y otros organismos del zooplancton.
En cuanto a biomasas de cladóceros y su producción, el número de individuos obtenidos por mililitro en cultivo (12.3± 0.3) estaría indicando inicialmente una respuesta adecuada de la especie a las condiciones de cultivo y su alto potencial para generar biomasa. Se ha reportado para Daphnia magna densidades alcanzadas en cultivo intensivo de 12.000 individuos por litro (2), esto es 12 organismos por mililitro, si se considera su gran tamaño (neonatos 2 mm y adultos 4.5 mm en promedio) es una alta densidad, ahora si se tiene en consideración el tamaño marcadamente menor de Moina sp (neonatos 0.4 mm, adultos 1.0 mm) se resalta el potencial de especie.
Las densidades obtenidas para Moina sp en el presente trabajo coinciden con otros trabajos (2), para D.magna alimentadas con estiércol, sangre, salvado de arroz y fitoplancton; y son menores a los datos reportados por Prieto (2000) (4), quien obtuvo una media de densidad máxima de 22 Clado. ml-1 en volúmenes de 1000ml, alimentando con Chlorella y Ankistrodesmus cladóceros del genero Moinodaphnia.
Los resultados de rendimiento para Moina sp en cultivo experimental de 20 litros (1,1 ± 0,027 org.ml-1.día) coinciden con lo reportado por Pagano et al (2000) (30), quienes realizaron cultivo monoespecífico de Moina micrura, en microambientes de 0,8 m3 en condiciones semicontroladas, alimentando con una mezcla de microalgas cianofíceas, clorofíceas y diatomeas, obteniendo una media de rendimiento de 1,19. Estos autores también reportan un pico máximo de crecimiento poblacional de M. micrura en 10 días, donde se alcanzan las máximas densidades, esto coincide con los resultados del presente estudio donde se observa que en los diferentes volúmenes y con las diferentes dietas, Moina sp alcanza la máxima densidad entre el día 11 y 13.
Los valores registrados para tiempo de duplicación de Moina sp son mayores que los reportados para especies del mismo genero bajo condiciones similares de temperatura en otros sistemas de cultivo. Se ha informado para M. micrura 0,67 –0,92 días como tiempo de duplicación (31); similares valores (1,4 días) fueron reportados para M. dubia en cultivo de 10 litros en acuarios (32), pero valores mucho más bajos (0,4 días) fueron estimados para M. micrura en estanques transitorios para peces en Venezuela (33).
El número de organismo de Moina sp en cultivo creció rápidamente, pero decreció notablemente justo después de alcanzar la densidad máxima, esta situación se vio acompañada por la presencia de efipios, indicadores del cambio de reproducción partenogenética a reproducción sexual. Son conocidos los factores que inducen a este cambio tales como fotoperiodo, alimento, temperatura y condiciones químicas (34, 13). En este estudio la temperatura y el fotoperiodo pueden estar excluidos ya que fueron estables a lo largo del cultivo, no así, la acumulación de productos metabólicos y la disponibilidad de alimento diaria, que son factores dependientes de la densidad (35).
Durante el desarrollo de los cultivos de Moina sp en volumen de 20 litros, se registró: temperatura del agua, pH, nitrito, nitrato y amonio, estos parámetros se comportaron de manera similar en los tratamientos, sin presentar variaciones importantes, ni diferencias significativas. Los valores promedios diarios de temperatura en los cultivos oscilaron entre 22.57± 0.40°C y 22.44± 0,40°C, y el pH estuvo entre 7.66±0.19 y 7.62± 0.16, respectivamente para el T1 el T2. Fueron registrados comportamientos similares para el nitrito y el nitrato siendo alrededor de 0.05± 0.01 y 20±7.07 mg.L-1 respectivamente. Los registros revelaron nivel cero para amonio en las diferentes repeticiones de tratamiento durante todo el tiempo de cultivo.
Los valores de temperatura registrados se enmarcan en el rango de ocurrencia de la especie en condiciones naturales (36), informándose un rango entre 15.8 y 24.1°C. La temperatura es un factor importante para determinar el incremento y el tamaño de las poblaciones de cladóceros en ambientes naturales y en condiciones de laboratorio (37).
El crecimiento poblacional de Moina sp en el estudio está relacionado e influenciado por la temperatura. A mayor temperatura el crecimiento es mejor y se alcanza máximas densidades en menor tiempo. Algunos investigadores afirman que la sobrevivencia de los cladóceros está relacionada inversamente con la temperatura y que la tasa intrínseca de incremento y la tasa de reproductividad incrementan en forma directa con la temperatura haciendo que el tiempo de generación disminuya (18).
Igualmente es de interés el pH del cultivo de Moina sp, parámetro que se registró con promedio 7.62, ligeramente alcalino y enmarcado en el intervalo óptimo de pH para la especie. Algunos investigadores consideran que valores entre 7.0 a 8.7 en condiciones de laboratorio son adecuados para la especie (38); mientras que para ambientes naturales se registran valores de 7.40 a 8.30 (36).
Algunos autores comentan (39) que no se conoce la concentración adecuada de iones para cladóceros, pero usar agua dura con 250mg/L de CO3= es aconsejable. El potasio por debajo de 390mg/L y el magnesio entre 30 y 240µg/L. La temperatura óptima es de 25ºC y la aireación ha de ser generosa para mantener la concentración de 02 por encima de 3,5mg/L y el nivel de amoniaco por debajo de 0,2mg/L.
Las concentraciones de amonio en forma crónica, pueden afectar la densidad de los cladóceros (13). Se reporta para M. macropopa en relación con C. dubia, mejor resistencia frente a exposiciones crónicas de diferentes concentraciones de amonio (40). Los registros en el presente estudio, revelaron niveles cero para amonio en los diferentes volúmenes de cultivo para Moina sp, durante el periodo de cultivo; debido la renovación periódica de agua.
Con relación al fotoperiodo los cultivos tuvieron iluminación constante, durante 24 horas, mediante lámparas de luz blanca con 2000 lux, la cual fue adecuada para el crecimiento de los organismos. Se considera que una intensidad luminosa de por lo menos 3000 lux atrae la gran mayoría de organismos del zooplancton y es el mejor promotor para la tasa de crecimiento (41).
En conclusión, para el cultivo de Moina sp, el alimento Ankistrodsmus sp más Saccharmyces cereviseae, es útil ya que se puede obtener una mayor tasa instantánea de crecimiento, en menor tiempo de duplicación y mayor rendimiento. Moina sp demostró ser una especie que se adaptó a las condiciones de laboratorio, resistencia al manejo; además, su pequeño tamaño en conjunto con sus aspectos reproductivos la hacen interesante como alimento vivo en acuicultura.
BIBLIOGRAFÍA
1. Lavens P, Sorgeloos P. Introduction. In: (eds). Manual on the production and use of life food for aquaculture. FAO Fisheries technical paper No. 361. Rome: FAO, 1996; Cap. 1, p.1-6. [ Links ]
2. Wedler E. Introducción en la Acuicultura con énfasis en los Neotrópicos. 1ra. Edición. 1998; Santa Marta Colombia, 388p. [ Links ]
3. Atencio V. Influencia da primeira alimentação na alevinagem do Yamú Brycon siebenthalae (EIGENMANN,1912). Florianópolis, Brasil, 2000. 130p. Trabajo de grado (Maestria en Acuicultura). Universidad Federal de Santa Catarina. Centro de Ciencias Agrarias. Departamento de Aquicultura. [ Links ]
4. Prieto M. Aspectos reproductivos y pautas para el cultivo de Moinodaphnia sp (Crustacea:cladocera) cepa Ciénaga de Lorica, en condiciones de Laboratorio. Universidad del Magdalena, Instituto de Postgrado. Santa Marta, Magdalena, 2000. [ Links ]
5. Cura E. Contibución a la evaluación limnológica de la Ciénaga de Momil. Departamento de Córdoba. Rev Temas Agrarios 1997; 2:12-15. [ Links ]
6. Montealegre D. Historia de vida de Moinodahnia macleayii (King) (Crustacea: Cladocera) en condiones de Laboratorio. Tesis Biologia Marina. Universidad Jorge Tadeo Lozano. Bogotá Colombia. 1996; 136p. [ Links ]
7. Kerguelen E. Influencia de la primera Alimentación en el desempeño de la larvicultura del Bocachico (Prochilodus magdalenae. Steinchdachner, 1978). Montería, 2001. Trabajo de grado (Acuicultor) Universidad de Córdoba. Facultad de M.V.Z. Departamento de Acuicultura Montería Colombia. 65p [ Links ]
8. Sipaúba-Tavares L. Análise da seletividade alimentar em larvas de tambaqui (Colossoma macropomum) e tambacu (híbrido, pacu - Piaractus mesopotamicus - e tambaqui - Colossoma macropomum) sobre os organismos aquáticos. Acta Limnológica Brasileira 1993; 6:114-1132. [ Links ]
9. Fragadolli C. Estudo comparativo do comportamento alimentar de larvas de pacu Piaractus mesopotamicus (Holmberg, 1887) e Tambaqui Colossoma macropomum (Cuvier,1818) em laboratório. 1990. Dissertação (Mestrado em Produção aquática) - Universidade Federal da Bahia, Salvador BA. [ Links ]
10. Pelli A, Dumont-Neto R, Silva J, Gonçalves S, Souza D, Barbosa N. Início de ingestão de ração por pacú (Piaractus mesopotamicus, Holmberg, 1887), curimba (Prochilodus scrofa Steinchdachner, 1881) e piau (Leporinus friderici, Bloch, 1794). Em condições de criação semi-intensiva. In: Simpósio Brasileiro de Aquicultura 9 1996, Sete Lagoas. Resumos. Sete Lagoas: ABRAQ 1996. 88p. [ Links ]
11. Atencio V, Evoy Zaniboni-Filho, Pardo S, Arias A. Influência da primerira alimentação na larvicultura e alevinagem do yamú Brycon siebenthalae (Characidae). Acta Scientiarum Anim Sci Maringá 2003; 25:61-72. [ Links ]
12. Wiwattanapatapee R, Padoongsombat N, Choochon T, Tang S, Chaimongkol A. Water flea Moina macropopa as novel biocarrier of norffloxacin in aquaculture. J of controlled Release 2002; 83:23-28. [ Links ]
13. Sipaúba –Tavares L, Rocha O. Produção de plâncton (Fitoplâncton e Zooplâncton) para alimentação de organismos aquáticos. São Carlos: RIMA, 2003. 106p. [ Links ]
14. Zimmermann S, Jost H. Recentes Avanços na Nutrição de Peixes: a Nutrição por Fases em Piscicultura Intensiva. In: Simpósio sobre manejo e nutriçào de peixes 2. 1998, Piracicaba. Anais Piracicaba- SP, 1998. p.123-162. [ Links ]
15. Rottman R. Técnicas de la cultura de Moina: El daphnia ideal para alimentar peces de agua dulce. Rev Biol 1999; 601. [ Links ]
16. Ferraào-Filho A, Fileto C, Lopes N, Arcifa M. Effects of essential fatty acids and N and P-limited algae on the growth rate of tropical cladocerans. Freshwater Biology 2003; 48:759-767. [ Links ]
17. Martínez J, Villaseñor R, Rios G, Espinosa F. Effect of food type and concentration on the survical. Longevity, and reproduction of Daphnia magna. Hydrobiology 1994; 287:207-214. [ Links ]
18. Lemke A, Benke A. Growth and reproduction of three cladoceran species from a small wetland in the south-eastern U.S.A. Freshwater Biology 2003; 48:589-603. [ Links ]
19. Barnabe G. Bases Biologicas y ecológicas de la Acuicultura. Editorial Acribia. Zaragoza – España. 1996; 519p. [ Links ]
20. Prieto G, Mogollon M, Castro A, Sierra L. Efecto del medio y condiciones de cultivo en la productividad de tres diatomeas marinas con potencial acuícola. Rev MVZ Córdoba 2005; 10:544-554. [ Links ]
21. Paniagua J, Buckles F, Granados C, Loya D. Manual de metodologías y alternativas para el cultivo de microalgas. CICESE. México. 1986; 93p. [ Links ]
22. González de Infante A. El Plancton de las aguas continentales. Secretaria general de la O.E.A. Serie de Biología. 1988; Monografía No. 33 Washington D.C. [ Links ]
23. Becker E. (Ed). Biotechnology and microbiology. Cambridge university press, Cambridge. 1994; 293p. [ Links ]
24. Pelczar M, Reid R. Microbiología. Cuarta Edición. 1993; México. [ Links ]
25. Espinosa F, Martínez J, Ramírez R. Filtration rate and culture of moina macrocopa (crustacea: cladocera) fed with scenedesmus incrassatulas (crlorophyceae) and digested cow manure. Anales del Instituto de Ciencias del Mar y Limnología 1992; 2:54-59. [ Links ]
26. Yufera M, Pascual E. Estudio del rendimiento de cultivos del rotífero B. Plicatilis O. F Müller alimentados con levadura de panificación. 1980. Inv Pesq 44:361-368p. [ Links ]
27. Malhotra Y, Langers S. Culture of Moína macropa , a food orgaanism for fish larvae in different nutrient media. En: Agrawal VP, Das P. (ed) Recent trends in Limnology. Muzaffarnager India Society of Bioscienccces 1990 (a); 485p. [ Links ]
28. Prieto M. Enriquecimiento de Zooplâncton com óleo de peixe na larvicultura de Pacu, Piaractus mesopotamicus e Curimbatá, Prochilodus lineatus. Lavras: UFLA, 2003. 106 p. Dissertação Mestrado- UFLA, Brasil. [ Links ]
29. Aloyso S, Ferra O, Fileto C, Norberto P, Lopes M, Arcifa M. Effects of essential fatty acids and N and P-limited algae on the growth rate of tropical cladocerans. Freshwater Biology 2003; 48:759–767. [ Links ]
30. Pagano M, Saint-Jean L, Arfi R, Bouvy M, Shep H. Population growth capacities and regulatory factors in monospecific cultures of the cladocerans Moina micrura and Diaphanosoma excisum and the copepod thermocyclops from Côte d’Ivoire (West Africa). Aquat Living Resour 2000; 13:163-172. [ Links ]
31. Bonou C, Saint-Jean L. The regulation mechanisms and yield of brackish water populations of Moina micrura reared in tanks. Aquaculture 1998; 160:67-79. [ Links ]
32. Adeymo A, Oladosu G, Ayinla A. Growth and survival of fry of African catfish species, Clareas gariepinus Burchell, Heterobranchus bidorsalis Geoffrey and Heteroclareas reared on Moina dubia in comparison with other first feed sources. Aquaculture 1994; 119:41-45. [ Links ]
33. Lopes C, Theis S. Demography of population of Moina micrura Kurz (Crustacea:cladocera) in a temporary pond, peninsula of Paraguana, Venezuela. Int Ver Ges Hydrobiol 1997; 82:341-350. [ Links ]
34. Rispe C, Pierre J. Coexistence between Cyclical Parthenogens\ Obligate Parthenogens\ and Intermediates in a Fluctuating Environment. Journal of Freswater Biology 1998; 195:97-110. [ Links ]
35. Kleiven O, Larson P, Hoback A. Sexual reprodution in Daphinia magna requires 3 stimuli. Oikos. 1992; 65:197-206. [ Links ]
36. Malhotra Y, Langers S. Biologycal aspcts of Moina macropa in relation to temperature variations. 1990 (b). Journal of Freswater Biology 2:111-115. [ Links ]
37. Crosetti D, Margaritora F. Distribution and life cycles of cladocerans in temporary pools from Central Italy. 1987. Journal of Freswater Biology 18:165-175 [ Links ]
38. Davis P, Ozburn G. The pH tolerance of Daphnia pulex (Leydig Emend Richard). Can J Zool 1969; 47:1173-1175. [ Links ]
39. Conklin D, Provasoli L. Bifhasic particulate media for the culture of filter-feeders. Biol Bull 1978; 154:47-54. [ Links ]
40. Ramírez E, Sarma S, Nadini S. Combined effects of algas (Chlorella vulgaris) density and ammonia concentration on the population dynamics of Ceriodaphinia dubia and Moina macrocopa (cladocera). Ecotoxicology and Environmental Safety 2002; 51:216-222. [ Links ]
41. Fermín A, Seronay G. Effects of different illumination levels on zooplakton abundace, feeding periodicity, growth and survival of the Asian sea bass, Lates calcarifer (Bloch), and fry in illuminated floating nursery cages. Aquaculture1997; 157:227-237 [ Links ]














