Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista MVZ Córdoba
Print version ISSN 0122-0268On-line version ISSN 1909-0544
Rev.MVZ Cordoba vol.12 no.2 Córdoba July/Dec. 2007
ORIGINAL
EFECTO DEL CO-CULTIVO SOBRE EL DESARROLLO TEMPRANO DE EMBRIONES BOVINOS PRODUCIDOS IN VITRO
CO-CULTURE EFFECT ON EARLY DEVELOPMENT OF IN VITRO BOVINE EMBRYOS
Angela López C1, Zoot, Martha Olivera A1, Dr. Sci. Agr, Tatiana Ruiz C1, Ph.D, Ariel Tarazona M1,2, M.Sc.
1Universidad de Antioquia. Facultad de Ciencias Agrarias. Grupo Reproducción Fisiología y Biotecnología Animal. AA 1226, Medellín, Colombia.
1,2DPA/FCA/BIOGEM Universidad Nacional de Colombia, Sede Medellín, Colombia. Correspondencia: angeladir7@gmail
RESUMEN
Objetivo. Estudiar el efecto del cocultivo con células oviductales sobre el porcentaje de clivaje 48 horas post inseminación (hpi) de embriones bovinos en bajas tensiones de oxígeno.
Materiales y métodos. Se recolectaron ovarios de matadero para la extracción de los ovocitos que fueron puestos en medio TCM 199 suplementado con hormonas, se fertilizaron con semen criópreservado y se cocultivaron en medio CR1aa con células de oviducto durante 48 horas. Se evaluó el porcentaje de clivaje total y el porcentaje de clivaje por estadios de 2-4 células y 5-8 células. La viabilidad de las células para el cocultivo se determinó por observación del movimiento ciliar y observación de monocapa. Los tratamientos fueron T1: células de oviducto + oxígeno 20%; T2: células de oviducto + oxígeno 7%; T3 y T4 fueron controles sin células para ambas concentraciones de oxígeno.
Resultados. En cuanto al porcentaje de clivaje no hubo diferencia significativa entre los cuatro tratamientos, pero hubo una tendencia a mayor clivaje para los embriones cocultivados con células y 20% oxígeno.
Conclusiones. La utilización de altas tasas de oxígeno 20% en los sistemas de cococultivo con células oviductales tienden a mejorar los porcentajes de clivaje a las 48 hpi.
Palabras clave: Cocultivo, embriones, bovinos, células oviductales.
ABSTRACT
Objective. To study the effect of co-culture with oviductal cells on the cleavage rate 48 hours post insemination (hpi) of bovine embryos in low oxygen tensions.
Materials and methods. Slaughterhouse ovaries were collected for the extraction of oocytes put on TCM 199 medium supplemented with hormones, fertilized with semen cryo-preserved and co-cultured in CR1aa medium with oviductal cells during 48 hours. Total cleavage rate and cleavage per stages of 2-4 cells and 5-8 cells were evaluated. The viability of cells for the co-culture was determined by observation of the ciliary movement and monolayer observation. Treatments were T1: oviduct cells + oxygen 20%; T2: oviduct cells + oxygen 7%; T3 and T4 were controls without cells for both oxygen concentrations.
Results. For cleavage rate there was not significant difference among the four treatments, but there was a tendency to more cleavage for co-cultured embryos with cells and 20% oxygen.
Conclusions. The use of high oxygen rates (20%) in co-culture systems with oviductal cells intend to improve the cleavage percentages to 48 hpi.
Key words: Co-culture, bovines, embryos, oviductal cells.
INTRODUCCIÓN
Entre las aplicaciones de la producción de embriones in vitro se encuentra el mejoramiento genético con fines productivos (1), la investigación con fines de conservación (2,3) y la generación de técnicas de reproducción asistida (4). Por estas razones la producción de embriones in vitro y en especial el modelo bovino ha sido motivo de múltiples investigaciones para mejorar las tasas de producción de blastocitos que siguen siendo variables de 5% a 30% (5,6). A nivel de laboratorio los procesos de maduración, fertilización y cultivo pueden ser complementados con otras técnicas como los cocultivos con células somáticas (7). En diversas investigaciones se han usado células de oviducto, Â ampolla oviductal, granulosa, células uterinas, y algunas líneas celulares como células Vero (8), obteniendo resultados controversiales que sugieren nuevas investigaciones en este campo para dilucidar las ventajas y desventajas que otorga esta técnica.
Uno de los eventos más estudiado sobrelos porcentajes y calidad de blastocitos es la detención del desarrollo en el estadio de 8-16 células de los embriones producidos in vitro (9), del cual se han postulado diferentes factores que involucran desórdenes en la cromatina, re-arreglos del citoesqueleto, daños mitocondriales y estrés oxidativo por especies reactivas de oxigeno (EROs) (10). Los EROs son producidos por la cadena respiratoria, estos son mediadores de procesos fisiológicos y estados patológicos (11). Las investigaciones actuales están orientadas a dilucidar el papel de la mitocondria y del estrés oxidativo en el desarrollo temprano. Se ha demostrado que bajo condiciones convencionales de cultivo se producen EROs (12), debido a la diferencia en la tensión de oxígeno que se presenta entre el fenómeno in vivo que se encuentra entre 3-9% (13) y la proporcionada in vitro del 20%. El cocultivo de embriones junto con otras líneas celulares puede disminuir el estrés oxidativo gracias a los barredores que estas células producen (10). El objetivo de este trabajo fue estudiar el efecto de los sistemas de cocultivo con células de oviducto sobre el desarrollo temprano de embriones bovinos producidos in vitro en condiciones de baja tensión de oxigeno y oxigeno ambiental, evaluando tasas de clivaje a las 48 y 72 hpi (horas pos inseminación).
MATERIALES Y MÉTODOS
Aislamiento de células de oviducto bovino. Los oviductos provenientes de ovarios con presencia de cuerpos hemorrágicos se obtuvieron en la planta de benéfico local y fueron transportados a 4°C en solución salina al 0.9%. En el laboratorio fueron debridados de su tejido exterior y lavados en solución salina estéril al 0.9%. Para la obtención de células sehizo un raspado externo del oviducto con una lámina estéril desde el extremo úterotubarico hacia el extremo ovárico obteniendo una sustancia de color amarillo la cual se disolvió en 7 mL de Hepes (medio compuesto por un balance de sales y pH entre 7.3-7.4) y se le realizó 1 minuto de vortex para disgregar y lavar las células.Se dejó decantar el tubo 10 min y se retiróel sobrenadante. Se agregó nuevamente7 mL de Hepes y el proceso se repitió dosveces más.
Siembra de células de oviducto bovino. Después de la última precipitación se tomaron 100ul del pellet de células y se colocaron en platos de cultivo de 65x10mm con 3.5 mL de medio de cultivo TCM-199 suplementado con 10% de SFB (Gibco 1704). La selección de células para la siembra se realizó teniendo en cuenta la presencia de movimiento ciliar en los cúmulos de células. El cultivo se realizó sincrónico con la producción de embriones.
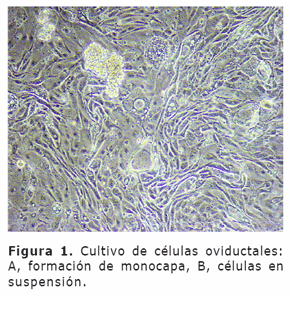
Verificación de viabilidad celular para su uso en cocultivo. Tres días postsiembra se evaluó la viabilidad de una pequeña muestra del cultivo de células oviductales donde se observó tanto la formación de monocapa como el movimiento ciliar de células en suspensión para ser utilizadas en el cocultivo embrionario (Figura 1).
Obtención de los complejos cúmulooocito (CCOs).
Para la producción de embriones, los ovocitos se obtuvieron a partir de ovarios de hembras bovinas sacrificadas en la planta de beneficio local. Los ovarios se lavaron en solución salina estéril al 0.9% a una temperatura de 35 a 38°C. La aspiración de folículos entre 2 y 7 mm de diámetro se realizó mediante una jeringa de 10 ml y aguja calibre 18G; el líquido folicular obtenido se depositó en un tubo Falcon de 50 ml y se dejó decantar por 20 minutos antes de hacer la selección de los CCOs aptos para maduración donde se tuvieron en cuenta tres parámetros: ooplasma homogéneo, morfología redonda y mínimo tres capas de células de granulosa compactas (14).Maduración de los CCOs. La maduración se realizó en microgotas de medio TCM- 199 suplementado con 10% SFB (suero fetal bovino), LH (0,005 mg/ml), FSH (0,02 mg/ml) y 17 â-estradiol (0,005 mg/ml) bajo aceite mineral, se colocaron 10 oocitos por gota con 50 μl y se llevaron a incubar por 24 h a 5% CO2, 38 ºC, 90% humedad y oxígeno ambiental 20%.
Fertilización in vitro. El semen criopreservado se descongeló a 37ºC por un minuto y se realizó una capacitación mediante un gradiente discontinuo de Percoll 90/45 (15), para separar la fracción motil o espermatozoides viables. Mediante conteo en cámara de Neubauer se ajustó la concentración final a 1x106 espermatozoides por ml. Después de 24 h de maduración los oocitos fueron lavados en Hepes de trabajo y puestos en medio de fertilización TALP (Tyrodeâs albumina lactato piruvato) (16). Se inseminó con 2μl del semen previamente seleccionado, 2μl heparina y 2μl PHE (penicilina, hipotaurina, epinefrina) y posteriormente se llevaron a incubación por 18 horas para la interacción de gametos con 5% CO2, 38ºC, 90% humedad y oxigeno ambiental 20%.
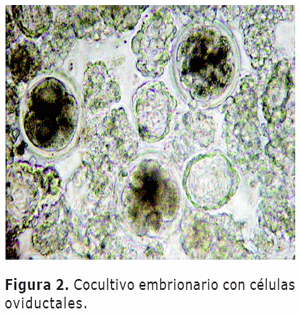
Cocultivo in vitro. Pasadas 18 horas los presuntos zigotos se lavaron con Hepes, por medio de una micropipeta para retirar las células de granulosa y se colocaron en medio de cultivo CR1 + aa (17). Posteriormente, se llevaron a incubación bajo la presencia o ausencia de células oviductales a 38ºC, 88% N, 5 % CO2, 7% O2 y 90 % de humedad ó 5% CO2, 38 ºC, 90% humedad y oxigeno ambiental 20% según el tratamiento. Para el cocultivo se utilizaron aproximadamente entre 10 y 12 cúmulos de células oviductales por embrión (Figura 2).
El porcentaje de clivaje se evaluó 48 hpi mediante observación directa por estereoscopio teniendo en cuenta embriones no clivados y estadíos de 2 a 4 y 5-8 células. Todos los medios utilizados fueron tratados con 1% de solución antibiótica compuesta por penicilina (Sigma P-4687) y estreptomicina (Sigma S-1277).
Análisis estadístico. Se utilizaron 4 tratamientos. En la etapa de cultivo de los embriones se consideró la presencia o ausencia de células de oviducto y cambios en la tensión de oxigeno así:
Tratamiento 1: Embriones + células oviductales en 20% de oxígeno.
Tratamiento 2: Embriones + sin células oviductales en 20% de oxígeno.
Tratamiento 3: Embriones + células oviductales en 7% de oxígeno.
Tratamiento 4: Embriones + células oviductales en 7% de oxígeno.
Se utilizó el programa STATISTICA versión 5.0 donde se probó la distribución normal de los datos mediante el test de Shapiro-Wilk´s y se realizó el test de Levene para la homogeneidad de varianzas. Se utilizó ANOVA y un nivel de significancía de p = 0.05 para el análisis de los datos.
RESULTADOS Y DISCUSIÓN
Una gran diversidad de factores pueden afectar la producción de embriones in vitro, hasta la obtención de blastocitos transferibles (18), la tasa de producción total puede verse reflejada a las 48 horas posinseminación donde la evaluación del número de embriones clivados y su estadio representa un estimativo de la eficiencia y calidad de los procesos de maduración, fertilización y primeros días de cultivo.
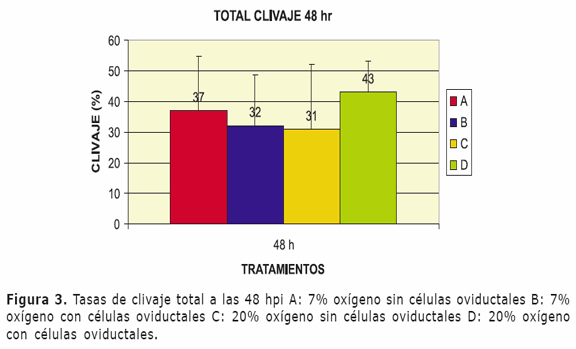
En este estudio se encontró que el porcentaje total de embriones clivados 48 hpi (37, 32, 31 y 43%) fue similar en los diferentes tratamientos debido a que no presentó diferencia estadística significativa (p> 0.05) (Figura 3).
Sin embargo, se encontró una tendencia de los embriones cocultivados con células de oviducto y 20% de oxígeno, a presentar mejores tasas de clivaje, lo que podría estar asociado a la disminución de la producción de EROs, que se da con altas tensiones de oxígeno causando daño a nivel del citoesqueleto y el ADN (10). La inclusión de células oviductales en el cultivo embrionariopermitiría que éstas metabolicen parte del oxígeno evitando que se de la producción de EROs. Además, las secreciones de las células oviductales como proteínas, carbohidratos y piruvato alteran la composición del medio (19) y actúan como factores embriotróficos para el embrión en desarrollo (20).
Por otra parte, al cocultivar los embriones con células oviductales a bajas concentraciones de oxígeno (7%), las células son enfrentadas a un estrés celular mayor donde no realizan su función adecuadamente y arrojan mayor cantidad de desechos que pueden resultar tóxicos para los embriones en desarrollo, lo que se ve reflejado en una disminución del clivaje.
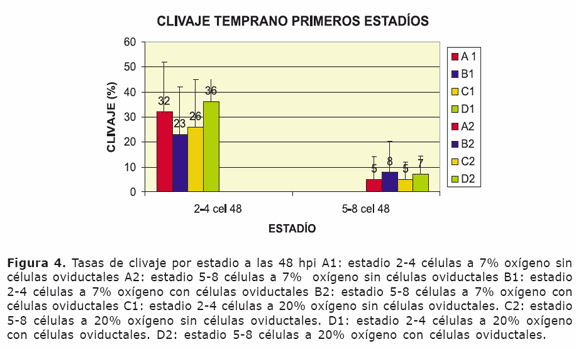
Al observar los clivajes por estadío no se encontraron igualmente diferencias significativas pero la tendencia de los embriones cocultivados a 20% de oxígeno sigue marcando una tendencia a mejorar el numero de embriones clivados con respecto a los demás tratamientos. En cuanto a la sincronía de clivaje se observó que en todos los tratamientos hubo presencia de embriones sincrónicos presentándose a las 48 hpi estadios de 2-4 células y de 5-8 células dentro de los parámetros normales.(Figura 4)
Se concluye que al utilizar sistemas de cocultivo con células oviductales a 20% de oxígeno hubo una tendencia al aumento de los porcentajes totales de clivaje a las 48 hpi, debido a la disminución en la producción de EROs que causan daño a nivel celular. Igualmente la secreción de sustancias embriotróficas al medio por parte de las células oviductales ayudan a mejorar el desarrollo de los embriones en sus primeros estadíos aumentando la tasa de clivaje total 48 hpi.
En términos de eficiencia biológica y en relación con la producción comercial de embriones bovinos in vitro, tanto las bajas tasas de oxigeno como el cocultivo con células del epitelio oviductal bovino permiten el desarrollo preimplantatorio en proporciones comparables.
Se sugiere realizar estudios con el fin de evaluar estadios de morula y blastocito en la producción in vitro que permita establecer si hay un efecto del cocultivo posterior a las 48 hpi, además de la realización de pruebas que permitan medir la calidad del embrión como morfología, celularidad, y apoptósis.
REFERENCIAS
1. Kruip Tham, Pieterse MC, VanBeneden ThH, Vos PLAM, Wurth YA, Taverne MAM. A new method for bovine embryo production: a potential alternative to superovulation Vet Rec 1991; 128: 208-210. [ Links ]
2. Goodrowe KL, SL, Walker DP, Ryckman GF, Mastromonaco MA, Hay HL, Bateman WT, Waddell. Piecing together the puzzle of carnivore reproduction. Anim Reprod Sci 2000; 61: 389-403. [ Links ]
3. Farstad W. Assisted Reproductive Technology in Canid Species. Theriogenology 2000; 53: 175-186 2000. [ Links ]
4. Hewitson Laura. Primate models for assisted reproductive technologiesReproduction 2004; 128: 293-299. [ Links ]
5. Merton JS, APW, de Roos, Mullaart E , de Ruigh L , Kaal L , PLAM Voa S. Dieleman Factors affecting oocyte quality and quantity in commercial application of embryo technologies in the cattle breeding industry. Theriogenology 2003; 59: 651-674. [ Links ]
6. Kruip TAM, MM, Bevers, B, Kemp. Environment of oocyte and embryo determines health of IVP offspring. Theriogenology 2000; 53: 611-618. [ Links ]
7. Goto KN, Iwai Y Takuma, Y Nakanishi. Co-culture of In Vitro Fertilized Bovine Embryos with Diferent Cell Monolayers. J Anim Sci 1992; 70:1149-1453. [ Links ]
8. Menck MC, Guayader-Joly C, Peynot N, Le bourhis D, Lobo RB, Renard JP, Heyman Y. Beneficial effects of vero cells for developing IVF bovine eggsin two different coculture systems. Reprod Nutr Dev 1997; 37:141-150. [ Links ]
9. Gardner DK, Lane M, Spitzer A, Batt PA. Enhanced rates of cleavage and development for sheep zygotes cultured to the blastocyst stage in vitro in the absence of serum and somatic cells: amino acids, vitamins, and culturing embryos in groups stimulat development. Biol Reprod 1994; 50: 390-400. [ Links ]
10. Mermillod P, Vansteenbrugge A, Wils C, Mourmeaux JL, Massip A, Dessy F. characterization of the embriotrophic activity of exogenous protein-free oviduct conditioned medium used in culture of cattle embryos. Biol Reprod 1993; 49: 582-587. [ Links ]
11. Brookes P. Mitochondrial H(+) leak and ROS generation: an odd couple. Free Radic Biol Med 2005; 38(1):12-23. [ Links ]
12. Tarazona AM, Rodriguez JI, Restrepo LF, Olivera-Angel M. Mitochondrial activity, distribution and segregation in bovine oocytes and in embryos produced in vitro. Reprod Dom Anim 2006; 41: 5-11. [ Links ]
13. Ali AA, JF Bilodeau, MA Sirard. Antioxidant requirements for bovine oocytes varies during in vitro maturation, fertilization and development. Theriogenology 2002; 59: 939-949. [ Links ]
14. Stojkovic M, Machado SA, Stojkovic P, Zakhartchenko V, Hutzler P, Goncalves PB, Wolf E. Mitochondrial distribution and adenosine triphosphate content of bovine oocytes before and after in vitro maturation: correlation with morphological criteria and developmental capacity after in vitro fertilization and culture. Biol Reprod 2001; 64(3): 904-909. [ Links ]
15. Parrish JJ, Krogenaes IA, Susko-Parrish JL. Effect of bovine sperm separation by either swim-up or percoll method on success of in vitro fertilization and early embryonic development. Theriogenology 1995; 44: 859-869. [ Links ]
16. Fukui Y. Effect of follicle cells on the acrosome reaction, fertilization, and developmental competence of bovine oocytes matured in vitro. Mol Reprod Dev 1990; 26(1): 40-46. [ Links ]
17. Rosenkrans C, Zeng G, MCNamara G, Schoff P, First N. Development of bovine embryos in vitro affected by energy substrates. Biol Reprod 1993; 49: 459-462. [ Links ]
18. WH Eyestone, NL First. Characterization of developmental arrest in early bovine embryos cultured in vitro. Theriogenology 1991; 35(3): 613-624. [ Links ]
19. Edwards LJ, PA Batt, F Gandolfi, DK Gardner. Modifications Made to Culture Medium by Bovine Oviduct Epithelial Cells: Changes to Carbohydrates Stimulate Bovine Embryo Development. Mol Reprod Dev 1997; 46: 146-154. [ Links ]
20. Nagao Y, Saeki K, Hoshi M, Kainuma H. Effects of oxygen concentration and oviductal epithelial tissue on the development of in vitro matured and fertilized bovine oocytes cultured in protein-free medium. Theriogenology 1994; 43 (4):751-759. [ Links ]