Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista MVZ Córdoba
Print version ISSN 0122-0268On-line version ISSN 1909-0544
Rev.MVZ Cordoba vol.13 no.3 Córdoba Sept./Dec. 2008
ORIGINAL
EFFICIENCY OF 2-PHENOXYETHANOL, BENZOCAINE, QUINALDINE AND TRICAINE METHASULPHONATE AS AN ANESTHESIA FOR Pirapitinga (Piaractus brachypomus) FINGERLINGS AND JUVENILE FISHES
Yohana Velasco-Santamaría,*1,4 Ph.D.(C), Camilo Palacios-Ruiz2, MVZ, Pablo Cruz-Casallas,3,4 Ph.D.
1 University of Southern Denmark Campusvej, Institute of Biology, Odense M, Dinamarca.
2 Ejercicio particular.
3 Universidad de los Llanos, Facultad de Ciencias Agropecuarias y Recursos Naturales, Instituto de Acuicultura, Villavicencio - Meta, Colombia.
4 Universidad de los Llanos, Facultad de Ciencias Agropecuarias y Recursos Naturales, Instituto de Acuicultura, Grupo de Investigación sobre Reproducción y Toxicología de Organismos Acuáticos - GRITOX, Villavicencio - Meta, Colombia.
*Correspondencia: Correo electrónico: ymvelasco@yahoo.com
Recibido: Mayo 6 de 2008 Aceptado: Diciembre 5 de 2008
RESUMEN
Objetivo. Evaluar la efectividad anestésica de 2-fenoxietanol, benzocaina, quinaldina y metanosulfonato de tricaina (MS-222) en alevinos y juveniles de cachama blanca (Piaractus brachypomus). Materiales y métodos. Alevinos (7.3 ± 6.8 g) y juveniles (49.6 ± 28.4 g) fueron expuestos a 2-fenoxietanol (200, 400 y 600 ppm), benzocaina (50, 100 y 150 ppm), quinaldina (7.5, 15 y 30 ppm) o MS-222 (100, 150 y 200 ppm) (n=12), para evaluar la duración de la inducción y recuperación, frecuencia opercular y la sobrevivencia postanestesia. Resultados. El desarrollo corporal y la concentración afectaron el periodo de inducción, siendo mayor en juveniles que en alevinos (p<0.05) y menor a medida que aumentó la concentración de anestésico; sin embargo, alevinos expuestos a MS-222 mostraron períodos de inducción más largos que los juveniles; y alevinos expuestos a 2-fenoxietanol mostraron períodos de inducción iguales con las tres concentraciones (p>0.05), mientras que juveniles expuestos a MS-222 mostraron el menor tiempo de inducción con la menor concentración (p<0.05). El tiempo de recuperación fue inferior a 2 min, con 2-fenoxietanol, MS-222, quinaldina y 50 ppm de benzocaina; pero altas concentraciones de benzocaina mostraron largos períodos de recuperación. No se observó tendencia en la variación de la frecuencia opercular ni mortalidad durante o después de la exposición a los anestésicos. Conclusiones. En alevinos el 2- fenoxietanol (400 ppm) y en juveniles el MS-222 (100 ppm), serían las sustancias de elección para procedimientos cortos, pero deberá recurrirse a altas concentraciones de benzocaina cuando el propósito de la anestesia sea un procedimiento prolongado.
Palabras clave: Anestésia, Piaractus brachypomus, frecuencia opercular.
ABSTRACT
Objective. To evaluate the efficiency of 2-phenoxyethanol, benzocaine, quinaldine and tricaine methasulphonate (MS-222) as an anesthesia for pirapitinga (Piaractus brachypomus) fingerlings and juvenile fishes. Materials and methods. Fingerlings (7.3 ± 6.8 g) and juveniles (49.6 ± 28.4 g) were exposed to 2-phenoxyethanol (200, 400 and 600 ppm), benzocaine (50, 100 y 150 ppm), quinaldine (7.5, 15 y 30 ppm) or MS-222 (100, 150 y 200 ppm) (n=12) in order to evaluate the induction and recovery time, opercular frequency and post-anesthesia survival. Results. Induction time was longer in juveniles than in fingerlings (p<0.05) and decreased in proportion to the increase in the concentration of anesthesia. However, induction time in fingerlings exposed to MS-222 was longer than in juveniles. Fingerlings exposed to 2-phenoxyethanol had similar induction times at the three concentrations (p>0.05), whereas the juveniles exposed to the low MS-222 concentration had lower induction time (p<0.05). The recovery time was less than 2 min. using 2- phenoxyethanol, MS-222, quinaldine and 50 ppm of benzocaine, but was longer with higher benzocaine concentrations. No variation in opercular frequency or mortality was observed during or after anesthesia. Conclusions. In fingerlings and juveniles, 2-phenoxyethanol (400 ppm) and MS-222 (100 ppm), respectively, are considered the anesthetics of choice for short procedures. Higher concentrations of benzocaine should be used for longer procedures.
Key words: Anaesthetic, Piaractus brachypomus, opercular frequency.
INTRODUCCIÓN
Para su reproducción en cautiverio y cultivo comercial, la mayoría de especies ícticas, son sometidas a condiciones de estrés como la pesca, manipulación y transporte, lo cual puede afectar su sistema inmune e incrementar la susceptibilidad a patógenos, causando morbilidad o mortalidad (1). Una gran variedad de compuestos han sido utilizados para anestesiar peces en prácticas de acuicultura, investigación y salud animal (2,3). Dentro de los compuestos más usados se encuentran, entre otros, 2-fenoxietanol, aceite de clavo, sulfato de quinaldina, benzocaina y metasulfonato de tricaina (MS- 222) (4-6). Sin embargo, algunos anestésicos son clasificados como tóxicos para varias especies acuáticas, lo que implica realizar una rigurosa evaluación de sus efectos antes de recomendar su uso como alternativa para reducir el estrés durante la manipulación (3). No obstante, la eficiencia de determinado anestésico dependerá del desarrollo corporal del individuo y de las condiciones ambientales (5).
Actualmente, MS-222 es el único anestésico aprobado por la FDA (Food and Drug Administration) y EPA (Environmental Protection Agency) para ser usado en peces de consumo (2). No obstante, otros anestésicos como el Aqui-S® están bajo revisión farmacológica por la FDA (3). Dentro de los parámetros que deben tenerse en cuenta para determinar la eficacia anestésica de una sustancia se encuentran: inducción de la anestesia en un periodo inferior a 3 min., tiempo de recuperación no mayor a 5 min., sin toxicidad para los peces ni para las personas que lo manipulan, no generar efectos fisiológicos prolongados ni residualidad en los tejidos, no causar mortalidad en el período post-anestésico, poseer alta solubilidad tanto en agua dulce como salada y finalmente ser económicamente asequible (5,7). En especies nativas colombianas de agua dulce no se conocen estudios de la efectividad ni de toxicidad de anestésicos y el uso de éstos se ha basado fundamentalmente en la extrapolación de estudios en otras especies.
El objetivo del presente estudio fue determinar la efectividad anestésica de cuatro anestésicos en dos etapas de desarrollo corporal (alevinos y juveniles) de la cachama blanca (Piaractus brachypomus), una de las especies ícticas nativas de la Orinoquia Colombiana, de gran importancia para la acuicultura nacional.
MATERIALES Y MÉTODOS
Sitio de Estudio. Estación Piscícola del Instituto de Acuicultura de la Universidad de los Llanos (IALL), localizado en la ciudad de Villavicencio - Meta, Colombia.
Especímenes y fase pre-experimental. Fueron empleados alevinos (7.3 ± 6.8 g) y juveniles (49.6 ± 28.4 g) (n=144) de cachama blanca (Piaractus brachypomus), clínicamente sanos, provenientes de un mismo desove. Alevinos (n = 12) y juveniles (n = 12) fueron sometidos a un período de aclimatación de 10 días en acuarios de vidrio (45 L) con aireación constante, cubiertos externamente con el fin de reducir el estrés. Durante la fase de aclimatación los individuos fueron alimentados con concentrado comercial dos veces al día a una proporción del 3% del peso vivo; sin embargo, 24 h previo a la fase de experimentación el alimento fue suspendido. Se empleó un sistema semi-estático con recambio de agua del 50% cada tercer día y diariamente, para las fases de aclimatación y de experimentación, respectivamente. En los dos grupos se utilizaron acuarios de vidrio para el periodo de anestesia y de recuperación, manteniendo las características físico químicas del agua similares a la usada en la fase de aclimatación. El agua del acuario de recuperación se mantuvo libre de sustancias anestésicas.
Anestésicos utilizados. Como sustancias anestésicas se emplearon 2-fenoxietanol (100% de pureza), benzocaina (100% de pureza), metanosulfonato de tricaina (MS- 222, 100% de pureza) y quinaldina (90% de pureza) (Sigma-Aldrich, Steinheim, Alemania) evaluando en cada grupo etáreo tres concentraciones diferentes de cada anestésico, así: 2-fenoxietanol (200, 400 y 600 ppm), benzocaina (50, 100 y 150 ppm), MS-222 (100, 150 y 200 ppm) y quinaldina (7.5, 15 y 30 ppm). Para facilitar una mayor absorción branquial de los anestésicos, se empleó el método de anestesia por inmersión.
La benzocaina se disolvió en etanol de 98% de pureza (Sigma-Aldrich, Steinheim, Alemania) y el MS-222 se disolvió en agua con el fin de preparar una solución stock al 10%. Por su parte, el 2-fenoxietanol y la quinaldina se adicionaron directamente al agua del acuario de anestesia sin previa dilución. Las diferentes concentraciones de anestésicos evaluados fueron adicionadas al agua de los acuarios experimentales antes de la inmersión de los peces, con el fin de garantizar la completa dilución de los anestésicos.
Con el fin de determinar si el etanol (solvente de la benzocaina) generaba efectos anestésicos, se preparó una solución al 10% en agua destilada y se evaluó en alevinos y juveniles (n=5), diferentes a los que se emplearon en la fase experimental, teniendo en cuenta las misma variables de respuesta estudiadas para los anestésicos.
Variables consideradas. En este estudio, las variables de respuesta evaluadas fueron el tiempo de inducción, tiempo de recuperación, frecuencia opercular (FO) y la sobrevivencia post-anestesia. Con el fin de establecer con exactitud el tiempo de inducción y de recuperación, así como la frecuencia opercular (FO), estos procedimientos se registraron con una videocámara. Posteriormente, los videos fueron observados en cámara lenta y los datos fueron registrados con un contador digital propio de la videograbación (Sony Slx500 VHS™).
Definición de variables. El tiempo de inducción fue definido como el período transcurrido desde el momento en que el pez fue puesto en contacto con la solución anestésica hasta que sus movimientos operculares disminuyeron y se presentó pérdida del eje de nado (característico de un plano 3 de anestesia) (8). Con el fin de determinar el anestésico y la concentración óptima de anestesia se definió un tiempo de inducción inferior a 3.30 min (1, 9).
El tiempo de recuperación se definió como el período transcurrido entre el retiro del pez de la solución anestésica y la recuperación total del eje de nado (8). Durante este período los peces fueron manipulados para determinar su peso y la longitud furcal. Siguiendo los criterios definidos por Soto y Burhanuddin (10) se seleccionó el anestésico y su concentración anestésica que produjo un tiempo de recuperación inferior a 5 min. Para determinar la variación de la FO durante el período de inducción, se analizaron tres periodos seguidos de filmación de un minuto cada uno, registrados a partir de los 30 seg después de entrar el pez en contacto con el anestésico. Lo anterior con el fin de reducir el error experimental debido a la excitación generada por la inmersión del pez en el acuario de anestesia. Debido al reducido tamaño de los alevinos, esta variable sólo fue posible determinarse en individuos juveniles.
Posterior al período de recuperación los peces fueron transferidos a acuarios de vidrio con agua libre de anestésicos, con aireación constante y mantenidos allí durante 5 días con el fin de determinar la sobrevivencia post-anestesia.
Análisis estadístico. Se empleó un diseño factorial 2x4x3, donde el factor 1 correspondió a los dos grupos etáreos (alevinos y juveniles), el factor 2 a las cuatro sustancias anestésicas (2-fenoxietanol, benzocaína, MS-222 y quinaldina) y el factor 3 a las tres concentraciones de cada anestésico. Para cada concentración anestésica, se llevaron a cabo 12 repeticiones (n=12) en alevinos y juveniles, siendo el pez la unidad experimental.
Los datos obtenidos fueron sometidos inicialmente a estadística descriptiva y expresados como media (±) error estándar (SEM). Para verificar la normalidad de los datos, se realizó la prueba de Bonferroni. Con el fin de detectar diferencias significativas entre tratamientos, se realizó la prueba de Scheffé. Todos los procedimientos estadísticos fueron realizados mediante el software Instat v.3.06 para Windows y en todos los casos p<0.05, fue suficiente para revelar diferencias significativas.
RESULTADOS
En los dos grupos etáreos, no se presentó mortalidad antes, durante, ni después de los experimentos de inducción y recuperación anestésica. Por su parte, a excepción del pH, los parámetros de calidad del agua utilizada en la fase experimental se mantuvieron estables, registrándose una temperatura del agua de 26.1 ± 1.3°C y concentración de oxígeno disuelto de 5.2 ± 1.0 mg.L-1; sin embargo, el pH varió considerablemente entre las cuatro soluciones de anestésicos evaluados, siendo las sustancias que provocaron mayor acidez del agua el MS-222 (3.6 ± 0.1) y la benzocaina (5.8 ± 0.3). A diferencia, en las soluciones de 2-fenoxietanol y de quinaldina, el pH del agua estuvo cercano a la neutralidad (6.2 ± 0.08 y 6.6 ± 0.07, respectivamente).
En los peces control que fueron expuestos al solvente de los anestésicos (etanol) no se observaron efectos anestésicos ni alteración de la reactividad a los estímulos aplicados. En los alevinos sometidos a las menores concentraciones de 2-fenoxietanol y quinaldina, no fue posible determinar el tiempo de inducción ni de recuperación, debido a la ausencia de efectos anestésicos observables.
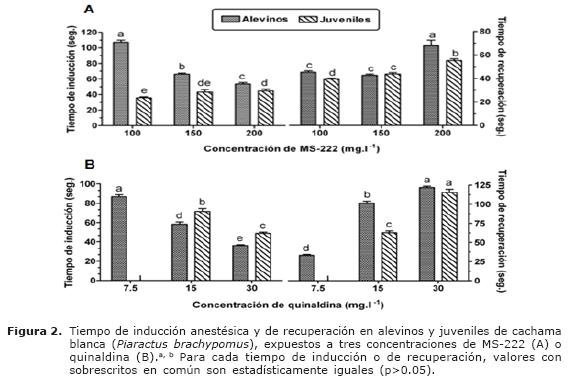
Tanto en alevinos como en juveniles, el tiempo de inducción de los cuatro anestésicos evaluados dependió de la concentración utilizada. En los juveniles expuestos a las dos concentraciones más altas de 2-fenoxietanol (400 y 600 ppm), benzocaina (100 y 150 ppm) y quinaldina (15 y 30 ppm), el tiempo de inducción fue significativamente mayor (c.a. 60 y 39 seg, 46 y 42 seg, 72 y 49 seg, respectivamente), cuando comparado con alevinos bajo las mismas condiciones experimentales (p<0.05, Figura 1A, 1B y 2B). Sin embargo, el tiempo de inducción de los alevinos expuestos a las tres concentraciones evaluadas de MS-222 fue significativamente mayor al ser comparado con el de los juveniles (p<0.05) (Figura 2A).
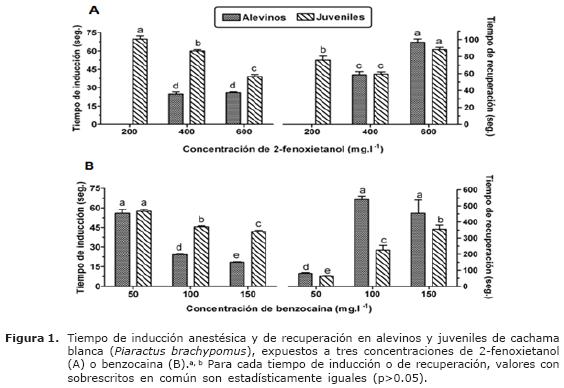
En los alevinos de cachama blanca expuestos a benzocaina, MS-222 y quinaldina se observó que a medida que la concentración anestésica se incrementó, el tiempo de inducción fue significativamente menor (p<0.05). Dicho hallazgo no fue observado en alevinos expuestos a 2-fenoxietanol, en el cual los tiempos de inducción no mostraron diferencias significativas en todas las concentraciones evaluadas (Figura 1B). Por su parte, los juveniles expuestos a 2-fenoxietanol, benzocaina y quinaldina mostraron el mismo comportamiento que los alevinos, en el cual el menor tiempo de inducción fue observado con la mayor concentración (p<0.05).
Finalmente, en juveniles expuestos a MS-222, el menor tiempo de inducción fue observado con la menor concentración (p<0.05).
Al comparar tiempos de inducción todas las soluciones anestésicas en un mismo grupo etáreo, se observó que los alevinos expuestos a una solución de 150 ppm de benzocaina presentaron el menor tiempo de inducción 19 seg, (p<0.05) al ser comparado con los demás tratamientos (Tabla 1). Las siguientes tres concentraciones que mostraron bajos tiempos de inducción (p<0.05) correspondieron a 400 y 600 ppm de 2-fenoxietanol (25 y 26 seg, respectivamente) y 100 ppm de benzocaina (24 seg.). Por su parte, juveniles expuestos a soluciones de 100 y 150 ppm de MS-222, 600 ppm de 2-fenoxietanol y 150 ppm de benzocaina mostraron los menores tiempos de inducción cuando comparados con las demás concentraciones anestésicas (entre 36 y 43 seg., p < 0.05). Por otro lado, los mayores tiempos de inducción en alevinos fueron observados con las concentraciones de 100 ppm de MS-222 (1.8 min) y 7.5 ppm de quinaldina (1.4 min). En los juveniles, el mayor tiempo de inducción fue observado en la concentración de 15 ppm de quinaldina (1.2 min).
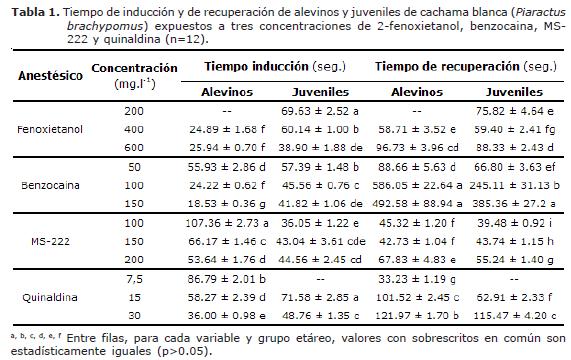
Al comparar tiempos de recuperación para todas las soluciones anestésicas, en alevinos y juveniles fue observado un tiempo de recuperación inferior a 2 min. cuando los peces fueron expuestos a las tres concentraciones de 2-fenoxietanol, MS-222 y quinaldina y a 50 mg.l-1 de benzocaina (Tabla 1). Sin embargo, las concentraciones más altas de benzocaina (100 y 150 mg.l-1) presentaron tiempos de recuperación significativamente prolongados (p<0.05) en ambos grupos etáreos, alcanzando en los alevinos tiempos de aproximadamente 10 min. (Figura 1B). El anestésico que presentó el menor tiempo (p<0.05) de recuperación fue MS-222 en las concentraciones de 100 y 150 mg.l-1 (45 y 42 seg., respectivamente) en alevinos y 100 mg.l-1 (39.5 seg.) en juveniles, comparado con las demás concentraciones anestésicas.
No se observó tendencia alguna en la variación de la frecuencia opercular de juveniles de cachama blanca expuestos a los cuatro anestésicos. En los peces anestesiados con 400 y 600 mg.l-1 de 2-fenoxietanol se observó menor (p<0.05) frecuencia opercular durante el segundo y tercer minuto (inferior a 90 respiraciones por min.) comparado con los primeros 60 seg. (entre 103 y 114 movimientos por min.). Con la menor concentración de 2-fenoxietanol no se observaron diferencias durante los tres minutos evaluados (p>0.05) (Figura 3A). En los peces anestesiados con benzocaina se observó disminución de la frecuencia opercular a medida que la concentración se incrementó (p<0.05). A este respecto, una dramática disminución (menos de 19 movimientos operculares por min.) en la FO fue observada en los peces expuestos a 100 y 150 mg.l-1 de benzocaina (p<0.05) (Figura 3B).
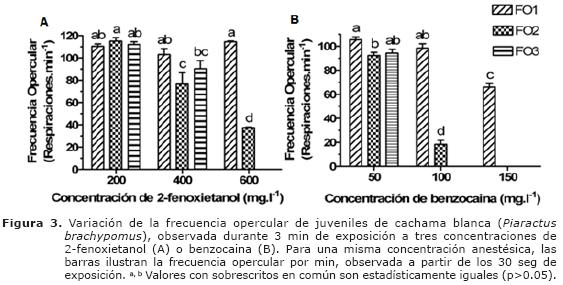
En contraste, los peces expuestos a MS- 222 tuvieron una tendencia diferente, siendo la mayor frecuencia opercular observada con la menor concentración anestésica (p<0.05). Sólo se observó variación significativa entre el primer minuto y los dos siguientes (97 vs. 89 y 86 movimientos operculares por min., respectivamente), cuando fueron expuestos a 100 mg.l-1. Finalmente, en los peces anestesiados con quinaldina no se observaron diferencias entre 15 y 30 mg.l-1 (p>0.05).
DISCUSIÓN
Los anestésicos han sido usados ampliamente en la acuicultura para inmovilizar animales en procedimientos de transporte, desove, vacunación o manipulación en general (5); sin embargo, para lograr resultados adecuados, debe determinarse para cada especie la eficiencia y el nivel de toxicidad de estos compuestos. A este respecto, los resultados obtenidos en el presente estudio en Piaractus brachypomus podrían considerarse como el primer reporte de anestésicos en esta especie. Estudios similares (11,12) se han llevado a cabo en Colossoma macropomum, un serrasálmido cercano a la cachama blanca, donde se reportaron la eficiencia del uso de benzocaina y de eugenol, respectivamente.
La definición de la efectividad de una sustancia anestésica se considera subjetiva ya que los criterios para definir un anestésico ideal varían entre autores (7). Según Burka et al (13), el 2-fenoxietanol tiene buenos márgenes de seguridad en aquellos individuos sometidos a procedimientos de anestesia, siendo la concentración efectiva entre 200 y 600 ppm (7, 14). Estas concentraciones fueron evaluadas en el presente estudio con alevinos y juveniles de Piaractus brachypomus, confirmándose su efectividad anestésica en los dos grupos etáreos. A pesar que en el presente estudio se observó una ligera acidificación de las soluciones de 2-fenoxietanol (6.2 ± 0.08), este hallazgo aparentemente no afectó la respuesta a la inducción anestésica. De manera similar, Hseu et al (15) reportaron que la adición de 2-fenoxietanol al agua durante el transporte de alevinos de Acanthopagrus schlegel generó acidificación del agua, sin efectos deletéreos. Finalmente, el 2-fenoxietanol mostró los menores tiempos de inducción anestésica sin las dosis más altas, tanto en alevinos como en juveniles. Estos resultados concuerdan con lo reportado por Hseu et al. (16) en Sparus sarba y por King et al (5) en Centropristis striata, en los cuales 400 y 300 mg.l-1 de 2-fenoxietanol fueron considerados suficientes para inducir una rápida anestesia y recuperación.
Tanto en alevinos como en juveniles, se observó que la benzocaina provocó los más largos periodos de recuperación. Estos resultados concuerdan con lo reportado por Gilderhus (17) en Oncorhynchus tshawytscha y Salmo salar, utilizando 30 mg.l-1 de benzocaina; bajo esas condiciones los peces recuperaron el eje de nado entre 10 a 15 min posteriores a la anestesia. De igual modo, Gomes et al (11) observaron que juveniles de Colossoma macropomum expuestos a concentraciones superiores a 200 mg.l-1 de benzocaina mostraron prolongados tiempos de recuperación (mayores a 15 min); por tanto, estos autores recomiendan el uso de benzocaina para realizar procedimientos que requieran tiempos de recuperación prolongados, sin someter los peces a un tiempo de anestesia mayor a 20 min. En el presente estudio se observó que la concentración de 150 mg.l-1 de benzocaina mostró el menor tiempo de inducción y el más largo período de recuperación. Por tanto, se puede inferir que el uso de benzocaina podría ser útil en procedimientos quirúrgicos de larga duración; no obstante, las dosis altas no se recomendarían para procedimientos de manipulación rutinaria, debido a su prolongado período de recuperación.
Debido a que el metasulfonato de tricaina es el único anestésico actualmente autorizado por la FDA para peces, múltiples estudios se han llevado a cabo en especies de agua dulce y salada. En el presente estudio, se observó que tanto en alevinos como en juveniles, el MS-222 induce anestesia en un tiempo menor a 2 min., con una pronta recuperación. Estos hallazgos concuerdan con los reportados para otras especies (5,18,19); sin embargo, la respuesta dependerá del procedimiento a realizar, de la especie, edad, condiciones físico-químicas del agua y demás factores que pueden afectar la respuesta. En el presente estudio se observó acidificación del agua (3.6 ± 0.2); sin embargo, estudios en especies marinas han demostrado que probablemente las sales disueltas en el agua de mar actúan como tampón evitando la acidificación (20, 21). A este respecto, Smit et al (22) reportaron que el uso de sustancias alcalinas como el NaHCO3, podrían usarse para neutralizar el pH de las soluciones de MS-222 en agua dulce y evitar abrasiones branquiales debido a la acidez del agua.
En este estudio, alevinos y juveniles de Piaractus brachypomus sumergidos en soluciones que contenían 7.5 a 30 mg.l-1 de sulfato de quinaldina tuvieron tiempos de inducción y de recuperación dentro de los límites inicialmente establecidos. Resultados similares han sido reportados en juveniles de carpas Koi (Cyprinus carpio), en los cuales la exposición a 50 ppm de sulfato de quinaldina durante 40 horas fue suficiente para inducir tranquilización sin causar mortalidad (23). De igual modo, Massee et al (4) reportaron que en alevinos de Sciaenops ocellatus y Carassius auratus, quinaldina a concentraciones entre 55 y 60 mg.l-1, fue efectiva para inducir la anestesia.
El incremento en los tiempos de inducción en los juveniles expuestos a las concentraciones más altas de 2-fenoxietanol, benzocaina y quinaldina puede estar relacionado con el peso corporal. Esta respuesta podría tener explicación basada en el hecho que individuos más grandes poseen un metabolismo menor y tardarían más tiempo en metabolizar los anestésicos. Resultados similares fueron reportados por Oikawa et al (20) en Pagrus major, quienes observaron una relación directa entre la concentración de MS-222 y el peso corporal, siendo la concentración efectiva y el tiempo de recuperación dependientes del desarrollo corporal.
Aunque no se evaluó la seguridad de los anestésicos usados en las personas que manipularon los anestésicos, se reporta que la benzocaina y el metasulfonato de tricaina poseen un mayor margen de seguridad comparado con los demás anestésicos. Según Summerfelt y Smith (24), la quinaldina y el 2-fenoxietanol son altamente irritantes para la mucosa ocular y del tracto respiratorio. Por otro lado, Morton (25) reporta que el uso sostenido y la exposición regular al 2-fenoxietanol causa un síndrome neurofisiológico en los usuarios que no utilizan guantes protectores. Por tanto, aunque pocos estudios al respecto se han llevado a cabo, el uso de cualquier sustancia química debe realizarse empleando siempre las normas de bioseguridad recomendadas para cada sustancia.
Aunque las cuatro sustancias anestésicas usadas mostraron tiempos de inducción dentro de los intervalos establecidos inicialmente, el tiempo de recuperación fue muy variable en los dos grupos etáreos, por tanto se estableció de acuerdo con los resultados obtenidos una sustancia anestésica y una concentración apropiada para alevinos y juveniles de cachama blanca (Piaractus brachypomus). En Conclusión se puede afirmar que en alevinos, se consideró al 2- fenoxietanol (400 ppm) como la sustancia de primera elección y en juveniles el metasulfonato de tricaina (100 ppm); no obstante, estos resultados deben ser complementados con estudios a nivel fisiológico y económico buscando optimizar la eficiencia y el uso de estas sustancias tanto en prácticas investigativas como en acuicultura.
Finalmente, las concentraciones anestésicas con tiempos de recuperación más prolongados serian adecuadas para realizar pruebas biométricas o cirugías de larga duración, teniendo siempre en consideración los posibles daños tisulares causados por hipoxia o acumulación de residuos debido a la exposición prolongada.
Agradecimientos
A Claudia Quesada Díaz por su colaboración en el desarrollo de la fase experimental. Igualmente, al Instituto de Acuicultura de la Universidad de los Llanos (IALL) por el apoyo logístico.
Referencias
1. Davis KB, Griffin BR. Physiological responses of hybrid striped bass under sedation by several anesthetics. Aquaculture 2004; 233(1-4): 531-548. [ Links ]
2. Bowser PR. Anesthetic options for fish. In: Gleed RD and Ludders JW (Ed), Recent Advances in Veterinary Anesthesia and Analgesia: Companion Animals, New York, USA: International Veterinary Information Service; 2001. [ Links ]
3. Davidson GW, Davie PS, Young G, Fowler RT. Physiological responses of rainbow trout Oncorhynchus mykiss to crowding and anesthesia with AQUI-S™. J World Aquac Soc 2000; 31(1): 105-114. [ Links ]
4. Massee KC, Rust MB, Hardy RW, Stickney RR. The effectiveness of tricaine, quinaldine sulfate and metomidate as anesthetics for larval fish. Aquaculture 1995; 134(3-4): 351-359. [ Links ]
5. King W, Hooper B, Hillsgrove S, Benton C, Berlinsky DL. The use of clove oil, metomidate, tricaine methanesulphonate and 2-phenoxyethanol for inducing anaesthesia and their effect on the cortisol stress response in black sea bass (Centropristis striata L.). Aquac Res 2005; 36(14): 1442-1449. [ Links ]
6. Jinn-Rong H, Shinn-Lih Y, Yeong-Torng C, Yun-Yuan T. Comparison of efficacy of five anesthetics in goldlined sea bream, Sparus sarba. Acta Zool Taiwanica 1998; 9(1): 35-41. [ Links ]
7. Gilderhus PA, Marking LL. Comparative efficacy of 16 anesthetic chemicals on rainbow trout. North American Journal of Fisheries Management 1987; 7(2): 288-292. [ Links ]
8. Marking LL, Meyer FP. Are Better Anesthetics Needed in Fisheries? Fisheries Sci 1985; 10(6):2-5. [ Links ]
9. Small BC. Anesthetic efficacy of metomidate and comparison of plasma cortisol responses to tricaine methanesulfonate, quinaldine and clove oil anesthetized channel catfish Ictalurus punctatus. Aquaculture 2003; 218(1-4): 177-185. [ Links ]
10. Soto CG, Burhanuddin. Clove oil as a fish anaesthetic for measuring length and weight of rabbitfish (Siganus lineatus). Aquaculture 1995; 136(1-2):149-152. [ Links ]
11. Gomes LC, Chippari-Gomes AR, Lopes NP, Roubach R, Araujo-Lima CARM. Efficacy of benzocaine as an anesthetic in juvenile tambaqui Colossoma macropomum. J World Aquac Soc 2001; 32(4):426-431. [ Links ]
12. Roubach R, Gomes LC, Leao Fonseca FA, Val AL. Eugenol as an efficacious anaesthetic for tambaqui, Colossoma macropomum (Cuvier). Aquac Res 2005; 36(11): 1056-1061. [ Links ]
13. Burka JF, Hammell KL, Horsberg TE, Johnson GR, Rainnie DJ, Speare DJ. Drugs in salmonid aquaculture - A review. J Vet Pharmaco Therap 1997; 20(5): 333-349. [ Links ]
14. Weyl O, Kaiser H, Hecht T. On the efficacy and mode of action of 2- phenoxyethanol as an anaesthetic for goldfish, Carassius auratus (L.), at different temperatures and concentrations. Aquac Res 1996; 27(10): 757-764. [ Links ]
15. Hseu JR, Yeh. SL, Chu YT, Ting YY. The Use of 2-phenoxyethanol as an anesthetic in the transport of black porgy Acanthopagrus schlegeli. J Taiwan Fish Res 1995; 3(1):11-18. [ Links ]
16. Hseu JR, Yeh SL, Chu YT, Ting YY. Comparison of efficacy of five anesthetics in goldlined sea bream, Sparus sarba. Acta Zool Taiwanica 1998; 9(1):35-41. [ Links ]
17. Gilderhus PA. Benzocaine as a fish anesthetic: efficacy and Safety for spawning-phase salmon. Prog Fish-Cult 1990; 52(3):189-191. [ Links ]
18. Wagner GN, Singer TD, Scott McKinley R. The ability of clove oil and MS-222 to minimize handling stress in rainbow trout (Oncorhynchus mykiss Walbaum). Aquac Res 2003; 34(13):1139-1146. [ Links ]
19. Cho GK, Heath DD. Comparison of tricaine methanesulphonate (MS222) and clove oil anaesthesia effects on the physiology of juvenile chinook salmon Oncorhynchus tshawytscha (Walbaum). Aquac Res 2000; 31(6):537-546. [ Links ]
20. Oikawa S, Takeda T, Itazawa Y. Scale effects of MS-222 on a marine teleost, porgy Pagrus major. Aquaculture 1994; 121(4):369-379. [ Links ]
21. Mattson NS, Riple TH. Metomidate, a better anesthetic for cod (Gadus morhua) in comparison with benzocaine, MS-222, chlorobutanol, and phenoxyethanol. Aquaculture 1989; 83(1-2): 89-94. [ Links ]
22. Smit GL, Hattingh J, Burger AP. Haematological assessment of the effects of the anaesthetic MS-222 in natural and neutralized form in three freshwater fish species: intraspecies differences. J Fish Biol 1979; 15(6): 645-653. [ Links ]
23. Hettiarachchi M, Senadheera S. Efficacy of quinaldine sulphate as an anaesthetic for the ornamental carp (Cyprinus carpio) in simulated packaging for long distance transport. Sri Lanka Journal of Aquatic Sciences 1999; 4(13-22). [ Links ]
24. Summerfelt RC, Smith LS. Anesthesia, surgery and related techniques. In: Schreck CB and Moyle PB (Ed), Methods for Fish Biology, Bethesda, MD. USA: American Fisheries Society, 1990. [ Links ]
25. Morton WE. Occupational phenoxyethanol neurotoxicity: a report of three cases. J Occup Med 1990; 32:42-45. [ Links ]














