Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista MVZ Córdoba
Print version ISSN 0122-0268On-line version ISSN 1909-0544
Rev.MVZ Cordoba vol.14 no.1 Córdoba Jan./Apr. 2009
ORIGINAL
TOXICIDAD AGUDA Y LESIONES HISTOPATOLÓGICAS EN CACHAMA BLANCA (Piaractus brachypomus) EXPUESTAS A LA MEZCLA DE HERBICIDA ROUNDUP® MÁS SURFACTANTE COSMOFLUX® 411F
ACUTE TOXICITY AND HISTOPATHOLOGICAL LESIONS IN SILVER PACU (Piaractus brachypomus) EXPOSED TO A MIXTURE OF THE HERBICIDE ROUNDUP AND THE SURFACTANT COSMOFLUX 411F
Wilson Ramírez D*, MVZ, Iang Rondón B, M.Sc, Hover Vidal B, MVZ, Pedro Eslava M, M.Sc.
Universidad de los Llanos, Instituto de Acuicultura, AA 110, km 4 vía Puerto López, Villavicencio, Meta, Colombia.
*Correspondencia: wramirezduarte@gmail.com
Recibido: Octubre 17 de 2008; Aceptado: Febrero 18 de 2009
RESUMEN
Objetivo. Determinar la concentración letal 50 (CL50) y lesiones anatomopatológicas inducidas por la exposición a la mezcla del herbicida Roundup® más el surfactante Cosmoflux® 411F en juveniles de cachama blanca (Piaractus brachypomus). Materiales y métodos. Ejemplares de 44.5 ± 3.7 g de peso fueron expuestos por 96 h a varias concentraciones de la mezcla herbicida más surfactante. Se registró la mortalidad al cabo de las 96 h y se tomaron muestras de tejidos para evaluación histopatológica. Resultados. La CL50 fue de 23.42 mg.l-1 para el Roundup® y de 0.19 mg.l-1 para el Cosmoflux® 411F (p<0.05) en la mezcla. En las branquias se hallaron lesiones necróticas proliferativas, y aneurismas y hemorragias en las lamelas. En el hígado se observaron procesos apoptóticos y necróticos de los hepatocitos, vacuolización lipídica y gotas hialinas citoplasmáticas en los mismos. En el telencéfalo se halló necrosis y apoptosis de cuerpos neuronales asociados y no asociados a células granulares eosinofílicas/células mast, y gliosis. En el intestino se evidenció vacuolización del borde apical de los enterocitos, e infiltración leucocitaria en la lámina propia. En la piel se halló hiperplasia e hipertrofia de células pavimentosas y células de moco, infiltración leucocitaria epidermal y acumulación subepidermal de pigmentos. En el riñón caudal se observaron hemorragias y lesiones necróticas multifocales. Conclusiones. La mezcla Roundup® más Cosmoflux® 411F ocasiona lesiones histopatológicas en branquias, piel, cerebro, hígado, intestino anterior y riñón caudal en juveniles de cachama blanca expuestos a las concentraciones y proporción evaluadas.
Palabras clave: Agroquímicos, lesiones anatomopatológicas, peces, toxicología acuática.
ABSTRACT
Objective. To determine the 50% lethal concentration (LC50) and anatomopathological lesions associated with exposure to a mixture of Roundup® herbicide and Cosmoflux® 411 surfactant in juvenile silver Pacu (Piaractus brachypomus). Materials and methods. Fish of 44.5 ± 3.7 g body weight were exposed for 96 h to several concentrations of herbicide plus surfactant mixture. Mortality was recorded at 96 h and tissue samples were collected for histopathological evaluation. Results. The LC50 was 23.42 mg.l-1 for Roundup® (p<0.05) and 0.19 mg.l-1 for Cosmoflux® 411F (p<0.05) in the mixture. Necrotic and proliferative lesions were seen in the gills as well as hemorrhages and aneurysms in lamellae. In the liver, apoptotic and necrotic processes, lipidic vacuolization and cytoplasmic hyaline droplets in the hepatocytes were observed. In the telencephalon, apoptosis and necrosis of associated and non-associated neuronal bodies to eosinophilic granule cells/mast cells, and gliosis were found. In the intestine, vacuolization in the apical border of enterocytes, and leukocyte infiltration in the lamina propia were detected. In the skin, hyperplasia and hypertrophy of pavimentous and mucous cells as well as epidermal leukocyte infiltration and subepidermal pigment accumulation were found. In the caudal kidney, hemorrhages and mild multifocal necrotic lesions were observed. Conclusions. The Roundup® herbicide plus Cosmoflux® 411F surfactant mixture in the concentrations and the ratio used caused histopathological lesions in the gills, skin, brain, liver, anterior intestine and caudal kidney in exposed juvenile silver pacu.
Key words: Agrochemicals, anatomopathological lesions, fish, aquatic toxicology.
INTRODUCCIÓN
El Roundup® (glifosato - N - fosfonometil glicina) es un herbicida de amplio espectro usado en actividades agrícolas. Además, en Colombia es usado bajo la formulación Roundup Ultra® (presentación comercial del Roundup® con variaciones leves en la concentración de sus componentes) mezclado con el surfactante Cosmoflux® 411F y agua en la proporción 44:1:55 volumen/volumen, respectivamente, para la erradicación de cultivos de coca y amapola por aspersión aérea, en una tasa de aspersión de glifosato (GP) de 10.4 l/ha. Estos parámetros exceden las concentraciones recomendadas por el fabricante del Roundup Ultra® de 1.6 a 7.7 % y una tasa de aspersión de un galón por acre (2.33 l/ha) (1). Esta práctica de aspersión está basada en estudios que reportan la toxicidad del glifosato, pero no del Roundup® (2) ni de la mezcla Roundup® más Cosmoflux® 411F.
El Roundup® está compuesto de sal isopropilamina de glifosato (48%), un surfactante catiónico denominado polioxietilamina (POEA, 15%) y agua. Estudios previos determinaron que la toxicidad del Roundup® en peces se debe al surfactante POEA y que la toxicidad de este herbicida se altera por algunos parámetros físico-químicos del agua, incluyendo pH, temperatura y dureza (3), así como por la especie del pez, presentando valores de CL50 en un rango de 2.3 a 97.4 mg.l-1 (3, 4). Estudios en teleósteos expuestos a Roundup® han reportado lesiones proliferativas en branquias, vacuolización lipídica y acumulación de gotas hialinas en el citoplasma de los hepatocitos, cambios proliferativos en la epidermis y neuronas apoptóticas y necróticas, así como infiltración de células granulares eosinofílicas / células mast en el telencéfalo (5, 4).
Respecto al Cosmoflux® 411F, este es un surfactante no iónico cuya composición exacta es desconocida. Sin embargo, está constituido por una mezcla de tensoactivos estereoespecíficos no iónicos basada en alcoholes propoxilados lineales con una baja proporción de compuesto aril etoxilado y aceite isoparafínico. Rondón-Barragán et al (6) reportaron un valor de CL50 para el Cosmoflux® 411F en cachama blanca de 4417.99 mg.l-1 y hallaron vacuolización lipídica de hepatocitos incrementada; hiperplasia de células epiteliales, moco en las branquias; vacuolización de enterocitos; mayor frecuencia de centros melanomacrófagos en el riñón caudal; gliosis, degeneración y muerte neuronal acompañado de infiltración de células granulares eosinofílicas / células mast en el telencéfalo.
Los surfactantes pueden influir en la toxicidad de los herbicidas a través de varios mecanismos: 1) reducción de la tensión superficial, 2) alteración de la permeabilidad de la barrera de difusión de membranas biológicas, 3) alteración de los procesos de transporte de membrana y 4) por interacción directa con el herbicida (7).
Se eligió la cachama blanca por ser una especie nativa que habita las cuencas de los ríos Amazonas y Orinoco, áreas que son afectadas por los cultivos de coca y amapola y en los cuales la fumigación con productos agroquímicos constituye una práctica común.
El presente estudio fue llevado a cabo con el fin de determinar la CL50 de la mezcla Roundup® más Cosmoflux® 411F en juveniles de cachama blanca y las posibles lesiones anatomopatológicas.
MATERIALES Y MÉTODOS
Sitio de estudio. El presente estudio fue realizado en el Laboratorio de Bioensayos del Instituto de Acuicultura de los Llanos (IALL) de la Universidad de los Llanos (Villavicencio, Meta - Colombia), a una altitud de 422 m y temperatura ambiental promedio de 25°C.
Sustancias experimentales. El herbicida Roundup® de grado técnico elaborado por MONSANTO Co., conteniendo 48% de GP, 15% de POEA y 37% de agua y el surfactante Cosmoflux® 411F de grado técnico elaborado por COSMOAGRO - Colombia fueron adquiridos de una fuente comercial. Aunque la composición del Cosmoflux® 411F no está descrita con exactitud, se sabe que contiene 170 g.l-1 de alcoholes etoxilados y propoxilados lineales y aril etoxilados.
Animales experimentales. Juveniles de cachama blanca, Piaractus brachypomus, (44.5 ± 3.7 g) clínicamente sanos, criados en estanque en tierra, procedentes del mismo desove del IALL, fueron aclimatados a condiciones experimentales en el Laboratorio de Bioensayos del IALL por 14 días usando agua de pozo profundo con las siguientes características: 6.6 ± 0.5 mg.l-1 de oxígeno disuelto; temperatura de 25.5 ± 0.1°C y pH 6.2 ± 0.1. Antes de iniciar la aclimatación, los peces fueron sometidos a un baño en solución de NaCl sin yodo ni fluor al 1% durante una hora para eliminar ectoparásitos.
Los peces fueron aclimatados en acuarios de 64 L, con ventilación constante, sin filtro y fueron alimentados dos veces al día con una dieta comercial al 30% de proteína y una ración del 2% de la biomasa de cada grupo. Los peces fueron mantenidos sin alimentación desde 24 horas antes de y durante la fase experimental. El pH (Pinpoint pH Monitor®, American Marine Inc. USA), oxígeno disuelto y temperatura del agua (Hach Portable LDO⢠HQ10 Dissolved Oxygen Meter®, USA) fueron registrados dos veces al día a las 7:00 y a las 18:00 h; adicionalmente, se determinaron las concentraciones de calcio y magnesio a las 24 y 96 h de la fase experimental por espectrofotometría de absorción atómica (AAnalist 100 Atomic Absortion Spectrometer®, Perkin Elmer Instrument). Para los procedimientos de medición, pesaje y sacrificio, los animales fueron tranquilizados por inmersión en agua fría (5°C).
Diseño experimental. Se implementó un sistema semi-estático con recambio diario del 50% del volumen de agua, manteniendo la concentración de las sustancias experimentales en cada grupo por medio de la adición de la mitad de la dosis correspondiente. Se realizó un diseño completamente al azar para cada tratamiento. Los animales fueron distribuidos en seis grupos: control (T0; n= 20) que corresponde al grupo libre de las sustancias experimentales; T1 (n=21), 7.5 y 0.06 mg.l1; T2 (n=21), 15 y 0.12 mg.l-1; T3 (n=21), 30 y 0.24 mg.l-1; T4 (n=20), 60 y 0.48 mg.l-1 y T5 (n=21), 120 y 0.96 mg.l-1 de Roundup® y Cosmoflux® 411F en la mezcla, respectivamente. Para cada tratamiento se realizaron 3 réplicas, de modo que por cada acuario se manejaron 6 ó 7 animales dependiendo del tratamiento. Las concentraciones de la mezcla experimental se determinaron con base en la proporción 44:1, volumen:volumen de Roundup® y Cosmoflux® 411F, respectivamente, usada en la mezcla para aspersión aérea en Colombia y con base en la CL50 a 96 h de 97.47 mg.l-1 para el Roundup® en juveniles de cachama blanca (4). La fase experimental tuvo una duración de 96 h tomando como hora 0 el momento en el cual se adicionó la sustancia experimental a los acuarios.
Necropsia e histopatología. Todos los peces muertos durante la fase experimental y los sobrevivientes al cabo de las 96 horas fueron desensibilizados mediante sección medular por corte dorsal al opérculo, se les realizó la necropsia y se tomaron muestras de branquias (segundo arco), hígado, riñón caudal, estómago, intestino anterior, piel y cerebro para examen histopatológico. Las muestras de tejidos fueron fijadas en formalina buferada al 3,7%, cortadas (4 a 5 µm de grosor) y teñidas con hematoxilina-eosina (H&E) tradicional. La evaluación histopatológica se llevó a cabo con un microscopio óptico Nikon ECLIPSE 80i (Nikon Corporation, Japan) usando una cámara DS-5M (DS Camera Head + DS Camera Control Unit DS-L1, Nikon Corporation, Japan). Los hallazgos de necropsia e histopatología son descritos con base en el grado de severidad de las lesiones, haciendo comparaciones entre tratamientos.
Determinación de la CL50. Se determinó usando el programa Trimmed Spearman-Karber (TSK) version 1.0.
Análisis estadístico. Los parámetros de calidad del agua se compararon mediante análisis de varianza de una vía (ANOVA) y posteriormente con una prueba de Tukey-Kramer usando el programa GraphPad Instat® (GraphPad Software, Inc.Version 3.06 for Windows). Los datos se expresaron como media, desviación estándar, con un valor p<0.05 considerado como significativo.
RESULTADOS
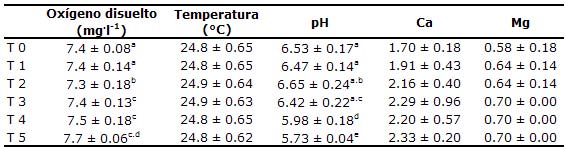
Parámetros de calidad del agua. Los parámetros de calidad de agua registrados durante la fase experimental se muestran en la tabla 1.
Tabla 1. Parámetros de calidad de agua durante la fase experimental.
Los datos son expresados como promedio ± desviación estándar. a,b,c,d Valores con letras distintas indican diferencias significativas (p<0.05).
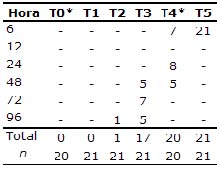
Concentración letal 50 (CL50). La tabla 2 registra la mortalidad observada durante la fase experimental. La CL50 fue de 23,42 mg.l-1 para el Roundup® (p<0.05) y 0.19 mg.l-1 para el Cosmoflux® 411F (p<0.05) en la mezcla. Estos valores fueron comparados con los obtenidos por Ramírez-Duarte et al (4) y Rondón-Barragán et al (6) para el Roundup® (97.47 mg.l-1) y el Cosmoflux® 411F (4417.99 mg.l-1), respectivamente, en juveniles de la misma especie, y se determinó el tipo de interacción entre estas dos sustancias aplicando la fórmula de Timbrell (8):
A: CL50 del Roundup®
B: CL50 del Cosmoflux® 411F
V: Coeficiente
De acuerdo con Timbrell (8), un coeficiente inferior a 0,7 indica antagonismo, entre 0,7 y 1,8 indica un efecto aditivo, y superior a 1,8 sugiere sinergismo o potenciación.
Tabla 2. Mortalidad durante la fase experimental.
*Los tratamientos T0 y T4 constaron de 20 animales.
Hallazgos de necropsia. En el T0 no se evidenciaron alteraciones macroscópicas. En T1, T2, T3, T4 y T5 se apreció un residuo grisáceo en el tercio distal de los filamentos branquiales, de mayor severidad en los tratamientos de concentraciones superiores. Del mismo modo se halló congestión, hemorragias e hipersecreción mucosa en las branquias. El hígado de los tratamientos T2 a T5 se halló completamente pálido con coloraciones blanquecinas multifocales. Igualmente, se observó hipersecreción mucosa en la piel de T4 y T5, y de forma infrecuente congestión en intestino, estómago, hígado y cerebro en los diferentes tratamientos.
HALLAZGOS HISPATOLÓGICOS.
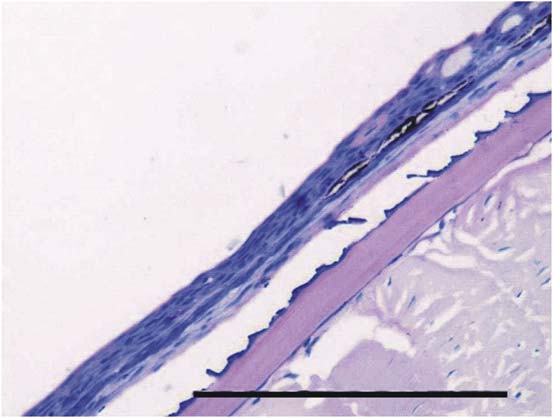
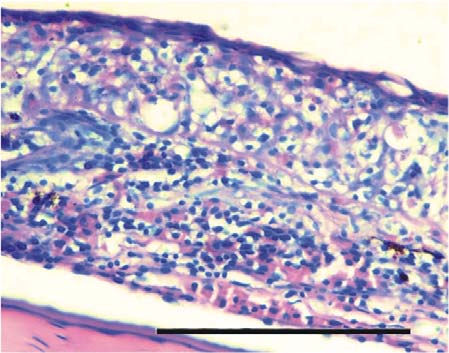
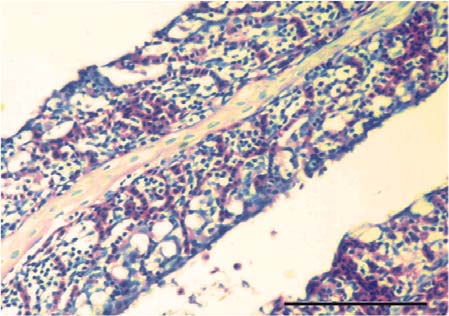
Piel. En el T0 la piel conservó la morfología normal con la epidermis y su superficie regular presentando acumulación multifocal de melanina a nivel subepidermal y epidermal (Figura 1). En los tratamientos T1 a T5 se apreció la epidermis de mayor grosor con hiperplasia de células pavimentosas y de moco, de mayor severidad a mayor concentración de las sustancias experimentales (Figura 2), así como acumulación de melanina a nivel subepidermal. Además, en los tratamientos T3 a T5 se observó infiltrado leucocitario, esponjiosis leve, cambios necróticos y un patrón festoneado de la superficie epidermal.
Figura 1. Piel del grupo control (T0). Se observa la morfología normal de la dermis y de la epidermis con la superficie regular y presencia de melanina epidermal. Escala de 100 µm (40x. Tinción con H&E).
Figura 2. Piel del tratamiento 4 (T4). Se aprecia incremento del grosor de la epidermis junto con infiltración de células inflamatorias. Barra de escala de 100 µm (40x. Tinción con H&E).
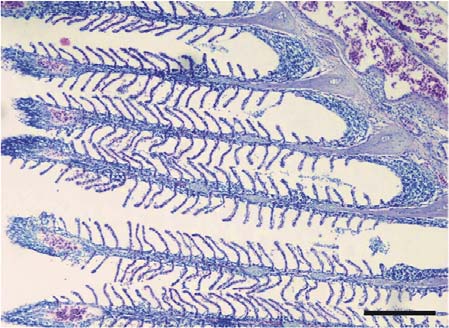
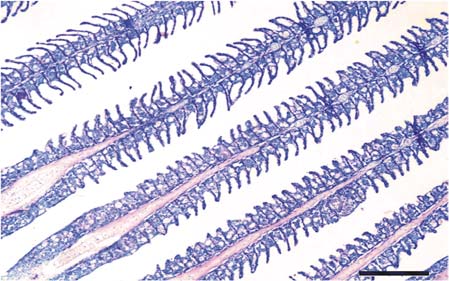
Branquias. En el T0, las lamelas se apreciaron largas y delgadas, con desprendimiento leve del epitelio e hiperplasia interlamelar multifocal poco frecuente, preservando la estructura normal de las células epiteliales y del órgano (Figura 3). En los tratamientos expuestos a las sustancias experimentales, la hiperplasia interfilamental proximal e interlamelar fue de mayor severidad a mayor concentración de las sustancias experimentales (Figura 4).
Figura 3. Branquias del grupo control (T0). Las lamelas están largas y delgadas con el epitelio lamelar e interlamelar delgado. Barra de escala de 100 µm (10x. Tinción con H&E).
Figura 4. Branquias del tratamiento 2 (T2). Se aprecia hiperplasia interlamelar generalizada. Barra de escala de 100 µm (10x. Tinción con H&E).
Esto estuvo acompañado de hiperplasia e hipertrofia de células de moco, infiltración de leucocitos y de células granulares eosinofílicas/células mast (CGE/CM) y levantamiento, festoneamiento e hipertrofia del epitelio lamelar. En los tratamientos T2 a T5, se halló unión de los extremos distales de las lamelas por medio de un pseudoepitelio sin hiperplasia lamelar y con cambios necróticos generalizados leves del epitelio lamelar, áreas de denudación lamelar, congestión, aneurismas y hemorragias de mayor severidad y frecuencia a las concentraciones más altas. En los tratamientos T3 a T5, la hiperplasia interlamelar progresó hacia fusión lamelar (Figura 5) principalmente en la porción distal de los filamentos con hemorragia multifocal en estas zonas, y en la porción proximal se halló necrosis lamelar severa, la cual en algunos casos progresó hacia denudación lamelar. Adicionalmente, se hallaron de forma esporádica quistes de myxosporidios.
Figura 5. Branquias del tratamiento 4 (T4). Se presentan fusión lamelar, microhemorragias e infiltración de células inflamatorias en filamentos. Barra de escala de 100 µm (40x. Tinción con H&E).
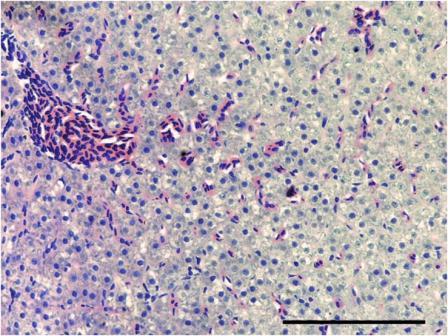
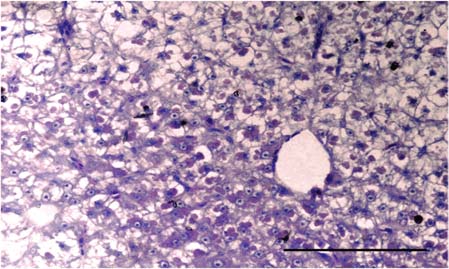
Hígado. El T0 preservó la morfología normal excepto por vacuolización lipídica generalizada leve de los hepatocitos (Figura 6). En los tratamientos expuestos a las sustancias experimentales, se evidenció el hígado congestionado (así como en T0), vacuolización lipídica de hepatocitos y material eosinofílico reticular o gotas hialinas en casos de mayor severidad en el citoplasma de los hepatocitos, alternando con zonas de vacuolización lipídica. Estás lesiones fueron de mayor severidad en los grupos expuestos a las concentraciones más altas (Figura 7).
Figura 6. Hígado del grupo control (T0). Se observa la morfología normal de los hepatocitos con vacuolización lipídica citoplasmática y homogeneidad en el tamaño de los mismos. Barra de escala de 100 µm (40x. Tinción con H&E).
Figura 7. Hígado del tratamiento 4. En los hepatocitos se observan gotas hialinas citoplasmáticas y vacuolización lipídica severa. Barra de escala de 100 µm (40x. Tinción con H&E).
Adicionalmente, se halló anisocitosis, necrosis multifocal y apoptosis de hepatocitos de mayor severidad a mayor concentración de las sustancias experimentales. De modo semejante, se hallaron algunos centros melanomacrófagos (CMM) dispersos en el parénquima.
Riñón caudal. En el T0, el riñón preservó la morfología normal. También se hallaron CMM pequeños dispersos en el parénquima. En los tratamientos expuestos a las sustancias experimentales se evidenció necrosis multifocal de túbulos renales, de mayor severidad y frecuencia en las concentraciones más altas. Adicionalmente, se observaron CMM asociados y no asociados a esporas de myxosporidios dispersos en el parénquima renal.
Intestino. En el T0, el intestino estaba normal. Los grupos expuestos a las sustancias experimentales presentaron vacuolización de los enterocitos, hiperplasia leve de células de moco, infiltrado leucocitario en la mucosa, necrosis y desprendimiento leve de los enterocitos.
Estómago. En el T0 se halló normal y los tratamientos T1 a T5 presentaron congestión de la lámina propia e hiperplasia leve de células de moco. Además, en el T5 se presentó infiltrado de células mononucleares en la mucosa y la submucosa, y procesos necróticos multifocales en la mucosa.
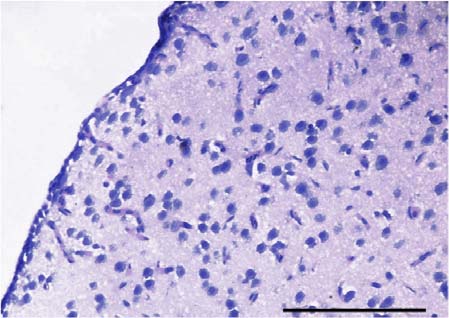
Cerebro. En el T0 el cerebro no presentó alteraciones histopatológicas (Figura 8).
Figura 8. Cerebro del grupo control (T0). Se aprecia la estructura normal del cerebro y de las meninges. Barra de escala de 100 µm (40x. Tinción con H&E).
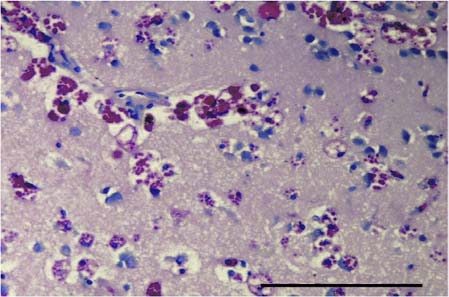
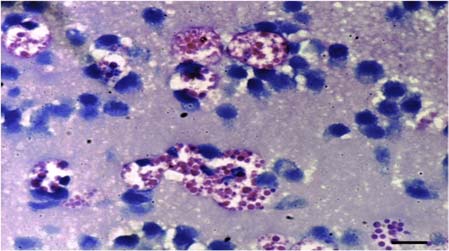
En los tratamientos expuestos, se presentó necrosis, apoptosis y procesos degenerativos de cuerpos neuronales con gliosis y/o infiltración de CGE/CM asociada en el telencéfalo (incluyendo meninges) (Figura 9 y 10).
Figura 9. Cerebro del tratamiento 4. En el telencéfalo se aprecian CGE/CM asociadas a cuerpos neuronales y gliosis. Barra de escala de 100 µm (40x. Tinción con H&E). CGE/CM: células granulares eosinofílicas/células mast.
Figura 10. Cerebro del tratamiento 5 (T5). Se aprecian cuerpos neuronales apoptóticos asociados a CGE/CM y gotas hialinas citoplasmáticas en estas células. Barra de escala de 10 µm (100x. Tinción con H&E). CGE/CM: células granulares eosinofílicas/células mast.
Las CGE/CM se observaron hipertrofiadas y llenas de material eosinofílico en el citoplasma de tamaño variable (gotas hialinas y granulaciones finas). Adicionalmente, se observó edema perivascular y perineural acompañado de congestión cortical y de las meninges.
DISCUSIÓN
Parámetros de calidad del agua. No se hallaron diferencias significativas en la temperatura y concentraciones de calcio y magnesio. Las diferencias significativas entre tratamientos en el oxígeno disuelto y el pH no fueron consideradas relevantes dado que en todos los tratamientos se hallaron dentro del rango descrito para esta especie (9). Por tanto estas variables no influyeron en la presentación de las lesiones reportadas. El pH fue progresivamente más bajo con el incremento de la concentración de las sustancias experimentales. Esta reducción del pH es ocasionada por la naturaleza ácida del GP (Tabla 1).
Concentración letal 50 (CL50). Los valores de CL50 del Roundup® y del Cosmoflux® 411F en la mezcla son inferiores a los obtenidos por Ramírez-Duarte et al (4) y Rondón-Barragán et al (6) para el Roundup® y el Cosmoflux® 411F, respectivamente. El coeficiente de 191.2 sugiere un efecto sinérgico o de potenciación (8). Puesto que la mortalidad registrada fue ocasionada por las lesiones braquiales y dado que estas son comunes a las dos sustancias experimentales (4, 6) se presentó un efecto sinérgico entre el Roundup® y el Cosmoflux® 411F.
Para el Roundup® se ha descrito un rango de CL50 en teleósteos de 2.3 a 97.4 mg.l-1 (3, 4). La toxicidad aguda del Roundup® en peces ha sido asociada con el surfactante POEA. La CL50 del Cosmoflux® 411F en la mezcla es inferior al rango descrito para surfactantes no iónicos (6, 10); sin embargo, la escasez de información sobre su composición limita el análisis de su toxicidad basado en relaciones estructura/actividad.
HALLAZGOS DE NECROPSIA E HISPATOLOGÍA.
Piel. La piel y las branquias están en contacto directo con el ambiente acuático y son, de este modo, un blanco primario de xenobióticos irritantes.
El festoneado y la necrosis de células epidermales son ocasionados por el efecto citotóxico del GP (11). El POEA y el Cosmoflux® 411F pueden incrementar estos efectos sobre la epidermis al ocasionar cambios estructurales en la membrana de las células epiteliales (12, 13).
Los cambios proliferativos y la hiper-reactividad de células de moco con cambios degenerativos leves en la epidermis indican una fase reactiva la cual constituye una respuesta general a condiciones de estrés ambiental (14).
La acumulación de melanina, el infiltrado leucocitario en la epidermis y los procesos degenerativos en la superficie de las células epidermales de mayor severidad en los tratamientos expuestos a las sustancias experimentales están asociados a estrés y a procesos inflamatorios (15). La acumulación de melanina está relacionada con su capacidad depuradora de radicales libres, además de sus propiedades bactericidas que junto con el infiltrado leucocitario, constituye una barrera de defensa en la piel. Las alteraciones estructurales en la piel y la hipersecreción mucosa predisponen a la proliferación de microorganismos y procesos infecciosos (16).
Los procesos degenerativos en las células pavimentosas fueron más severos que los encontrados en estudios previos ante la exposición individual al Roundup® (4) y al Cosmoflux® 411F (6), lo cual se debe al sinergismo entre los componentes de estas dos sustancias. El surfactante POEA y el Cosmoflux® 411F incrementan la permeabilidad de la membrana celular por procesos de desnaturalización proteica (12), facilitando la pérdida de electrolitos intracelulares (13) y el acceso del GP al interior de la célula.
Branquias. El incremento de la producción de moco en las branquias y la piel es una respuesta descrita en peces sometidos a ambientes contaminados (16, 17). La hipersecreción mucosa en las branquias mejora la remoción, dilución y/o neutralización de compuestos tóxicos y patógenos (17) reduciendo la difusión de agentes nocivos hacia la sangre. Sin embargo, este proceso dificulta el intercambio gaseoso al incrementar la distancia de difusión a través de las branquias (16).
El residuo grisáceo (observado macroscópicamente) y el acortamiento de los filamentos pudo ser ocasionado por la acción irritante de los surfactantes POEA del Roundup® y del Cosmoflux® 411F, por el efecto citotóxico del GP, así como por una reducción de la irrigación al extremo distal de lo filamentos branquiales para disminuir la absorción de las sustancias experimentales y la pérdida de electrolitos por difusión hacia el agua (17).
La necrosis del epitelio branquial ha sido descrita como un efecto directo de sustancias irritantes en el agua. El desprendimiento del epitelio, edema, fusión y plegamiento lamelar podrían corresponder a adaptaciones fisiológicas del pez que le permiten reducir el área superficial con el fin de preservar la homeostasis hidro-electrolítica (18). Estas modificaciones incrementan la distancia de difusión entre el ambiente acuático y la sangre. La necrosis del epitelio branquial puede ocurrir por la citotoxicidad ejercida por el GP (11) o por alteraciones de la membrana celular ocasionadas por los surfactantes (12, 13, 19).
La hiperplasia de células de moco reduce la difusión de xenobióticos a través del epitelio branquial y constituye una respuesta a un posible desequilibrio electrolítico ocasionado por las lesiones branquiales (20). El incremento en el tamaño de las células compatibles con células de cloro puede constituir una respuesta compensatoria al estrés osmótico (20).
La formación de pseudoepitelio es una respuesta adaptativa rápida frente a un estímulo irritante severo cuando la hiperplasia interlamelar no es lo suficientemente rápida para proteger las lamelas, el epitelio lamelar se fusiona y establece una barrera entre el plasma y el agua disminuyendo la superficie expuesta.
Los aneurismas y las hemorragias podrían resultar de un incremento en la presión venosa y del efecto irritante de los surfactantes sobre la células pilar y los senos venosos lamelares (12, 13, 19). Los aneurismas lamelares ocurren por ruptura de células pilar (17). La necrosis lamelar severa podría resultar de la acción citotóxica del Roundup® (11), de la alteración de la membrana por desnaturalización de proteínas (12) y de la formación de canales de conducción catiónica inducida por los surfactantes (13) así como por la acción de sustancias líticas liberadas por los leucocitos infiltrados.
Las lesiones branquiales descritas en el presente trabajo alteran los procesos de respiración, osmorregulación, balance ácido-básico y excreción de desechos nitrogenados. Exposiciones prolongadas o transitorias a concentraciones subletales tóxicas, aun cuando no induzcan efectos agudos, pueden predisponer al desarrollo de procesos infecciosos (16).
Hígado. La vacuolización lipídica, común a todos los tratamientos, pudo ser inducida por el periodo de supresión alimenticia al que fueron sometidos los animales. Sin embargo, los cambios lipídicos fueron de mayor severidad en los grupos expuestos a las sustancias experimentales. Las gotas hialinas descritas han sido reportadas por otros autores en peces expuestos a Roundup® (5, 4) y pueden representar la acumulación de proteínas mal plegadas o subunidades proteicas no ensambladas (21) relacionadas con fallos en el proceso de transcripción ocasionado por el Roundup® (22) o con la acumulación de material proteico debido a un desequilibrio entre la síntesis y liberación de proteínas hacia la sangre sistémica o hacia la bilis (5). Fallos en el proceso de transcripción y en la síntesis de proteínas podrían estar relacionados con la vacuolización lipídica más severa en los peces expuestos a la mezcla experimental debido a una alteración en la síntesis de lipoproteínas requeridas para la liberación y trasporte de lípidos desde los hepatocitos (23). La vacuolización lipídica también puede corresponder a una estrategia fisiológica para concentrar xenobióticos liposolubles, como los surfactantes, con el objetivo de reducir su disponibilidad (24). Las lesiones hepáticas fueron más severas que las halladas por nuestro grupo en exposiciones al Roundup® sin Cosmoflux® 411F (4).
Riñón caudal. Las lesiones necróticas multifocales no asociadas a esporas de myxosporidios en estructuras tubulares pueden corresponder al efecto citotóxico del GP descrito por Monroy et al (11) o a un efecto de los surfactantes o de sus metabolitos. La asociación frecuente de CMM a esporas de myxosporidios (25) hace difícil distinguir entre una respuesta a las esporas, una respuesta a las sustancias experimentales, y una posible influencia de los componentes del Roundup® y el Cosmoflux® 411F a favor de los parásitos.
Intestino. La vacuolización de los enterocitos puede corresponder a surfactante, dado que su lipofilicidad le permite atravesar membranas celulares. La necrosis y desprendimiento de enterocitos pueden resultar de la citotoxicidad del GP (11) y del efecto de los surfactantes sobre las membranas celulares (12,13,19).
Estómago. La ausencia de cambios deletéreos considerables como los hallados en la piel y las branquias puede esta relacionada con el pH bajo del contenido gástrico, el cual reduce la toxicidad del POEA (3), y con la secreción de moco en la mucosa gástrica, lo cual tiene un efecto removedor y/o neutralizante (17).
Cerebro. Las lesiones cerebrales fueron semejantes a las halladas por Ramírez-Duarte et al (4) y por Rondón-Barragán et al (6) en cachama expuestas a Roundup® y Cosmoflux® 411F, respectivamente. Los componentes del Roundup® y el Cosmoflux® 411F, podrían tener acceso al sistema nervioso central (SNC) a través del epitelio olfatorio y desde allí al telencéfalo, donde se focalizaron las lesiones, y/o a través de la barrera hematoencefálica, donde los surfactantes, en virtud de su naturaleza anfifílica podrían co-acceder con el GP al SNC. La predisposición del telencéfalo a los procesos degenerativos puede resultar de su comunicación con el epitelio olfatorio y/o se puede deber a la presencia de centros de proliferación y regeneración neuronal (26) donde los componentes del Roundup® pueden alterar los puntos de control del ciclo celular o el proceso de transcripción, durante la neurogénesis, como fue demostrado por Marc et al (22, 27). Los surfactantes pueden ejercer un efecto directo al alterar la integridad de la membrana celular (12, 13, 19). Estas lesiones en el telencéfalo pueden constituir una explicación al bloqueo reversible en los procesos olfatorios reportados en salmón del Atlántico (Salmo salar) por Lewis (28) ante la exposición a surfactantes catiónicos y al surfactante aniónico alquilbenceno sulfonado. La reversibilidad de dicho proceso puede deberse a la reposición neuronal llevada a cabo en los centros de proliferación neuronal.
Las CGE/CM siguen un patrón de satelitosis en torno a neuronas con procesos degenerativos (Figura 9), por lo que pueden estar involucradas en estos cambios neuronales. El patrón observado indica procesos focales entre las neuronas y las CGE/CM, donde la degranulación de estás células no induce una reacción generalizada del parénquima. Las CGE/CM descritas en teleósteos están relacionadas con las células mast de los vertebrados superiores (29). Las células mast sintetizan y liberan factor de crecimiento neural (30). Esta habilidad y su implicación en los procesos de reparación neural está por ser evaluada en CGE/CM. Un proceso de hipoxia tisular inducida por las lesiones branquiales pudo haber contribuido al desarrollo de las lesiones neuronales.
Las lesiones neuronales evidenciadas pueden alterar procesos de olfacción, el comportamiento individual y grupal, el desempeño reproductivo y dinámicas poblacionales.
En conclusión, juveniles de cachama blanca expuestos a la mezcla Roundup® más Cosmoflux® 411F, en la proporción y concentraciones evaluadas, desarrollaron lesiones anatomopatológicas en piel, branquias, hígado, riñón caudal, intestino y cerebro. La CL50 de la mezcla sugiere una interacción sinérgica entre estas sustancias.
Agradecimientos
Esta investigación fue soportada por el Instituto de Investigaciones de la Orinoquía Colombiana (IIOC), Universidad de los Llanos, Villavicencio, Colombia. Los autores agradecen al personal del IALL por el apoyo técnico.
REFERENCIAS
1. Oldham J, Massey R, Cryan P. Aerial spraying in Colombia: health and environmental effects. The Institute for Science & Interdisciplinary Studies. Fact Sheet; 2002. 4 p. [ Links ]
2. Solomon KR, Anadón A, Cerdeira AL, Marshall J, Sanín LH. Estudio de los efectos del programa de erradicación de cultivos ilícitos mediante la aspersión aérea con el herbicida glifosato (PECIG) y de los cultivos ilícitos en la salud humana y en el medio ambiente. Informe preparado para la Comisión Interamericana para el Control del Abuso de Drogas (CICAD). Washington, D.C., Estados Unidos de América: División de la Organización de los Estados Americanos (OEA); 2005. [ Links ]
3. Folmar LC, Sanders HO, Julin AM. Toxicity of the herbicide glyphosate and several of its formulations to fish and aquatic invertebrates. Arch Environ Contam Toxicol 1979; 8: 269-278. [ Links ]
4. Ramírez-Duarte WF. Evaluación anatomopatológica de los efectos tóxicos agudos del Roundup® en juveniles de cachama blanca (Piaractus brachypomus). [Trabajo de grado] Villavicencio, Colombia: Universidad de los Llanos, Escuela de Medicina Veterinaria y Zootecnia, Facultad de Ciencias Agropecuarias y recursos naturales; 2006. [ Links ]
5. Jiraungkoorskul W, Upatham ES, Kruatrachue M, Sahaphong S, Vichasri-Grams S, et al Biochemical and histopathological effects of glyphosate herbicide on Nile tilapia (Oreochromis niloticus). Environ Toxicol 2003; 18: 260-267. [ Links ]
6. Rondón-Barragán IS, Ramírez-Duarte WF, Eslava-Mocha PR. Evaluación de los efectos tóxicos y concentración letal 50 del surfactante Cosmoflux® 411F sobre juveniles de cachama blanca (Piaractus brachypomus). Rev Col Cienc Pec 2007; 20:431-446. [ Links ]
7. Devendra R, Umamahesh V, Ramachandra Prasad TV, Prasad TG, Asha ST, et al. Influence of surfactants on efficacy of different herbicides in control of Cyperus rotundus and Oxalis latifolia. Current Science 2004; 86: 1148-1151. [ Links ]
8. Timbrell J. Principles of biochemical toxicology. 3rd ed. London/Philadelphia: Taylor & Francis; 1999. p. 7-23. [ Links ]
9. Sastre OF, Hernández G, Cruz-Casallas P. Influencia del peso corporal y de la temperatura del agua sobre el consumo de oxígeno de la cachama blanca (Piaractus brachypomus). Rev Col Cienc Pec 2004; 17:1-16. [ Links ]
10. Wong D, Dorn P, Chai E. Acute toxicity and structure-activity relationships of nine alcohol ethoxylate surfactants to fathead minnow and Daphnia magna. Environ Toxicol Chem 1997; 16:1970-1976. [ Links ]
11. Monroy CM, Cortés AC, Sicard DM, Groot de Restrepo H. Citotoxicidad y genotoxicidad en células humanas expuestas in vitro a glifosato. Biomédica 2005; 25: 335-345. [ Links ]
12. Abel PD. Toxic action of several lethal concentrations of an anionic detergent on the gills of the brown trout (Salmo trutta L). J Fish Biol 1976; 9: 441-446. [ Links ]
13. Stagg RM, Shuttleworth TJ. Surfactant effects on adrenergic responses in the gills of the flounder (Platichthys flesus L.). J Comp Physiol [B] 1986; 156:727-733. [ Links ]
14. Wendelaar Bonga SE, van der Meij JC, van der Krabben WA, Flik G. The effect of water acidification on prolactin cells and pars intermedia PAS-positive cells in the teleost fish Oreochromis (formerly Sarotherodon) mossambicus and Carassius auratus. Cell Tissue Res 1984; 238: 601-609. [ Links ]
15. Slominski A, Tobin D, Shibahara S, Wortsman J. Melanin pigmentation in mammalian skin and its hormonal regulation. Physiol Rev 2004; 84:1155-1228. [ Links ]
16. Bols NC, Brubacher JL, Ganassin RC, Lee LE. Ecotoxicology and innate immunity in fish. Dev Comp Immunol 2001; 25: 853-873. [ Links ]
17. Speare DJ, Ferguson HW. Gills and pseudobranchs. In: Ferguson HW, editor. Systemic pathology of fish. A text and atlas of normal tissues in teleost and their responses in diseases. 2nd ed. London: Scotian Press; 2006. p. 24-62. [ Links ]
18. Mallatt J. Fish gill structural changes induced by toxicants and other irritants: A statistical review. Can J Fish Aquat Sci 1985; 42: 630-648. [ Links ]
19. Dayeh VR, Chow SL, Schirmer K, Lynn DH, Bols NC. Evaluating the toxicity of Triton X-100 to protozoan, fish, and mammalian cells using fluorescent dyes as indicators of cell viability. Ecotoxicol Environ Safety 2004; 57: 375-382. [ Links ]
20. Lin H, Randall D. Proton pumps in fish gills. In: Hoar WS, Randall DJ, Farrell AP, editors. Fish Physiology. New York: Academic Press; 1995. p. 229-55. [ Links ]
21. Papadimitriou JC, Drachenberg CB, Brenner DS, Newkirk C, Trump BF, et al. "Thanatosomesâ: A unifying morphogenetic concept for tumor hyaline globules related to apoptosis. Hum Pathol 2000; 31: 1455-1465. [ Links ]
22. Marc J, Le Breton M, Cormier P, Morales J, Bellé R, et al. A glyphosate based pesticide impinges on transcription. Toxicol Appl Pharmacol 2005; 203: 1-8. [ Links ]
23. Jones TC, Hunt RD, King NW. Veterinary pathology. 6th ed. Maryland: Lippincott Williams & Wilkins; 1997. p. 25. [ Links ]
24. Sarkar B, Chatterjee A, Adhikari S, Ayyappan S. Carbofuran- and cypermethrin-induced histopathological alterations in the liver of Labeo rohita (Hamilton) and its recovery. J Appl Ichthyol 2005; 21: 131-135. [ Links ]
25. Figueroa J, Martínez E, Iregui CA, Eslava PR. Descripción de un caso de myxosporidiasis clínica en cachama blanca, Piaractus brachypomus. Dalia. Revista de la Asociación Colombiana de Ictiólogos 1999; 3: 17-29. [ Links ]
26. Zupanc GK. Neurogenesis and neuronal regeneration in the adult fish brain. J Comp Physiol [A] 2006; 7:1-22. [ Links ]
27. Marc J, Mulner-Lorillon O, Bellé R. Glyphosate-based pesticides affect cell cycle regulation. Biol Cell 2004; 96: 245-249. [ Links ]
28. Lewis MA. Chronic and sublethal toxicities of surfactants to aquatic animals: a review and risk assessment. Water Res 1991; 25: 101-113. [ Links ]
29. Reite OB. Mast cells/eosinophilic granule cells of teleostean fish: a review focusing on staining properties and functional responses. Fish Shellfish Immunol 1998; 8: 489-513. [ Links ]
30. Williams RM, Bienenstock J, Stead RH. Mast cells: The neuroimmune connection. Chem Immunol 1995; 61:208-235. [ Links ]