Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista MVZ Córdoba
Print version ISSN 0122-0268On-line version ISSN 1909-0544
Rev.MVZ Cordoba vol.14 no.1 Córdoba Jan./Apr. 2009
ORIGINAL
INFLUENCIA DE LA TEMPERATURA EN EL COMPORTAMIENTO ALIMENTARIO DE Peltocephalus dumerilianus (TESTUDINES PODOCNEMIDAE)
THE INFLUENCE OF TEMPERATURE ON THE FEEDING BEHAVIOR OF Peltocephalus dumerilianus (TESTUDINES PODOCNEMIDAE)
Jaime De La Ossa V, 1 Ph.D, Richard C. Vogt, 2 Ph.D, Larissa Schneider, 2 M.Sc, Alejandro De La Ossa L, 3 Ecólogo.
1Universidad de Sucre. Facultad de Ciencias Agropecuarias. Barrio Puerta Roja. Sincelejo, Sucre, Colombia.
2INPA/BADPI. Av. André Araújo 2936 Campus II, Petrópolis 69083-970. Manaus, Amazonas, Brasil.
3Universidad Javeriana, Bogotá, Colombia.
*Correspondencia: jaimedelaossa@yahoo.com
Recibido: Agosto 4 de 2008; Aceptado: Febrero 18 de 2009
RESUMEN
Objetivo. Analizar los comportamientos de alimentación bajo diferentes condiciones de temperatura en un grupo de neonatos de Peltocephalus dumerilianus (Testudines Podocnemididae). Materiales y Métodos. Los individuos experimentales fueron obtenidos mediante incubación en el laboratorio, se dividieron en 5 grupos al azar. Durante 2 meses con tres repeticiones a la semana se hicieron pruebas de temperatura utilizando dentro de las bandejas calentadores eléctricos, con registro continuo de temperatura mediante termómetro digital - 10 a + 60°C (± 0.1°C), procurando mantener un ritmo constante de incremento equivalente a 0,25°C cada 10 minutos, hasta llegar a la temperatura seleccionada, que fue mantenida por 60 minutos en cada ensayo. Las temperaturas seleccionadas para cada ensayo, fueron: 26°C, 30°C, 34°C, 38°C y ambiente que fue de 26,8°C en promedio. Fueron evaluados los siguientes parámetros: duración en minutos de la ingesta, tiempo de inicio de comportamientos agonísticos, presencia de dos tipos de despliegues característicos: morder y disputa por alimento. Resultados. En general todos los parámetros fueron significativos, a mayor temperatura el tiempo de ingestión fue mayor, a menor temperatura el volumen de consumo fue menor, a menor temperatura el inicio de los despliegues agonísticos fue mayor y se mantuvo una relación inversamente proporcional. Conclusiones. Los resultados mostraron que existe relación directamente proporcional entre la temperatura ambiental y los procesos de alimentación, además que se relacionaron con aspectos básicos del comportamiento lo cual se manifestó en los despliegues agonísticos observados.
Palabras clave: Peltocephalus dumerilianus, temperatura, alimentación, Brasil.
ABSTRACT
Objective. To analyze the feeding behavior of 50 Peltocephalus dumerilianus hatchlings (Testudines Podocnemididae) under different temperature conditions in laboratory. Materials and methods. The individuals for this experiment were obtained by incubation in the laboratory. They were divided randomly into 5 groups. Temperature trials were conducted for 2 months with 3 repetitions per week, using electric heaters. Temperatures were recorded continuously using a digital thermometer - 10 to + 60°C (± 0.1°C). Temperatures were increased 0.25°C every 10 minutes until reaching the selected temperature, which was then maintained for 60 minutes for each test. The temperatures selected for tests, were 26°C, 30°C, 34°C, 38°C, with an ambient temperature of 26.8°C. We evaluated: feeding duration (in minutes), consumption (in volume), the time which turtles began agonistic behavior, and two characteristic displays: biting and disputes over food. Results. In general all parameters were significant, the higher the temperature the longer the time of ingestion; the lower the temperature the lower the consumption volume; the lower the temperature the greater the time to initiation of agonistic behavior, demonstrating an inverse relationship. Conclusions. There was a direct relationship between environmental temperature and feeding processes. Temperature was also related to basic aspects of behavior during agonistic displays.
Key words: Peltocephalus dumerilianus, temperature, feeding, Brazil.
INTRODUCCIÓN
El ambiente físico de los organismos no es constante, posee cambios temporales y espaciales, los cambios ambientales drásticos causan stress, daño y a veces la muerte, pero los cambios menores impulsan la capacidad fisiológica de los organismos para crecer, reproducirse e interactuar socialmente, no es sorprendente que los organismos envuelvan una variedad de ajustes que responden con comportamientos de adaptación, entre ellos la aclimatación, y que ayudan como mecanismos de ajuste a soportar los impactos fisiológicos que generan los cambios ambientales (1).
Los patrones de actividad de los quelonios en general están íntimamente asociados a condiciones climáticas, siendo el índice de precipitación pluviométrica y la temperatura, los principales factores ambientales que modelan el ritmo de comportamiento. Los regímenes de lluvia y la temperatura delimitan periodos estaciónales; frecuentemente se observa que muchas especies de quelonios, en razón de estos factores, exhiben diferentes picos de actividad a lo largo del año (2).
Procesos fisiológicos como la tasa metabólica, generalmente se incrementa con la temperatura (3); pocas especies de reptiles son conocidas en cuanto a mantener una tasa metabólica independiente del pico máximo de temperatura (4). Algunos estudios han probado directamente el incremento de la tasa de consumo de oxigeno con la temperatura en quelonios, entre ellos Trachemys scripta y Terrapene ornata (5), Kinixys spekii (6), y en neonatos de Chelydra serpentina (7), mostrando que existe una correlación fuerte y positiva; además, la temperatura posee un efecto significativo en la tasa metabólica de Kinosternon subrubrum, siendo más activa a temperaturas mayores (8).
Un aumento en las tasas de crecimiento y diferencias significativas en el tamaño corporal se hallaron en poblaciones de Chrysemys scripta, cuyos hábitat habían sido impactados térmicamente. Se atribuyen estos resultados a la diferencia presentada en la calidad de la dieta y a la elevada temperatura del medio que fue comparada con poblaciones naturales no sometidas a elevaciones variadas de temperatura (9).
En algunos reptiles como Python molurus existe una marcada inhibición del apetito y de la tasa de digestión a bajas temperaturas (10). Los procesos digestivos parecen más sensibles a las bajas temperaturas que cualquier otro proceso fisiológico o etológico como la movilidad (11). La inhabilidad para digerir a bajas temperaturas puede explicar la gran reducción del apetito a bajas temperaturas (10), por ejemplo, algunos lagartos a temperatura corporal fría reducen la capacidad locomotora, pero pueden desplegar comportamientos de defensa más agresivos, tales como abrir la boca y morder (12-15). La capacidad locomotora en serpientes se reduce substancialmente durante el período postprandial (16, 17), lo que se considera un factor adaptativo que reduce la duración de la digestión haciendo más eficiente el ahorro de energía (10).
El rango de temperatura dentro del cual un ectotermo puede vivir es reconocido como zona de tolerancia, dentro de esta zona el organismo tiene la capacidad de incrementar su temperatura hasta un máximo valor aprovechable. Esto se conoce como temperatura optima corporal y cuando esta decrece rápidamente el organismo aprovecha este valor máximo para adelantar sus procesos metabólicos y sobrevivir. Además, tiene la facultad conexa de mantener un proceso de ajuste a mejores condiciones térmicas, denominado termorregulación, que es evolutivamente adaptativo (1).
Fluctuaciones de poca intensidad horaria, no desestabilizan a los animales corpulentos, el tamaño corporal actúa como un buffer térmico, regulando la pérdida o ganancia de calor por cambio en el ambiente (1, 11, 18). Sin embargo. en animales de pequeña masa corporal, esta facultad no existe o es limitada, su temperatura corporal se equilibra rápidamente con el ambiente, requiriéndose algunos ajustes comportamentales. Entre ellos entan las regulación del tiempo de exposición, cambio o mantenimiento de posturas corporales, búsqueda de refugio, y/o ajustes fisiológicos como vasoconstricción, vasodilatación y termogénesis, para dar una rápida respuesta en función del tiempo. Sin embargo, en algunos casos solo es necesario el ajuste de comportamiento para equilibrar o minimizar el impacto de la temperatura ambiental no prolongada (1).
La capacidad de comportamientos, puede asumirse como el esfuerzo máximo que un animal es capaz de ejecutar, dentro de su repertorio de comportamientos (19). Si esta capacidad es termosensible, el potencial de comportamientos se expandirá o contraerá con los cambios de temperatura corporal (19, 20). En algunas especies, decrece la capacidad locomotora a bajas temperaturas corporales pero se incrementa su agresividad, creándose una dicotomía térmica, el efecto de la temperatura en la actividad fisiológica y sus manifestaciones en los movimientos es bien conocida (21). Entre ellos los mecanismos fisiológicos asociados a las tasas metabólicas y actividad muscular determinan la actividad inicial del animal, especialmente su locomoción (19, 20). En el caso de Crocodylus porosus la capacidad de movimiento relacionada con la temperatura tiene significativo valor adaptivo y se relaciona con aspectos ontogénicos y comportamentales (22).
El presente trabajo tuvo como objetivo analizar en el laboratorio el comportamiento alimentario de un grupo de neonatos de Peltocephalus dumerilianus (cabezudo) sometidos a diferentes temperaturas.
MATERIALES Y MÉTODOS
Sitio de estudio. El estudio fue realizado en las instalaciones del INPA, Manaus, Brasil, Laboratorio de Quelonios, con apoyo del Proyecto "Ecología e Conservação de Quelônios de Interesse Econômico no Estado de Amazonas, Brasil" Financiado por FAPEAM (Fundação de Amparo a Pesquisa do Estado de Amazonas).
Obtención de animales. La población experimental fue de 50 neonatos, los cuales fueron obtenidos mediante incubación en el laboratorio, en un proceso controlado que tuvo una temperatura media de 30.16°C, (mínima 28.6°C y máxima de 31.5°C, y DS = 0.60042), humedad relativa media del 90% y una duración media del proceso igual a 97 días.
Periodo de incubación. La incubación se llevó a cabo en cuarto con aire acondicionado permanente, utilizando una caja térmica plástica y como fuente de calor y distribución de temperatura un termostato y una bomba de aireación de acuario. La temperatura fue mantenida con un diferencia de más o menos 1°C y registrada en Data Loggers (Hobo®) (23). Los neonatos al eclosionar fueron marcados por cortes en las escamas marginales (24-26), además de identificarlos mediante el número correspondiente pintado en la parte superior del carapax con tinta indeleble no tóxica.
Manejo de los animales. Los animales fueron separados al azar en 5 grupos de 10 individuos cada uno, cada grupo fue mantenido en una bandeja plástica de 55 cm de largo, 35 cm de ancho y 19 cm de profundidad, estó equivalió a 1925 cm2 de área y 36575= cm3 de volumen, con densidad media de 0.0052 ind/m2. Se suministró como dieta ración comercial para perros, tres veces a la semana, equivalente al 8% de su masa corporal semanal, con recambio de agua 6 veces al mes.
Prueba térmicas. Se realizaron durante 8 semanas en los meses de junio y julio, cada prueba se llevó a cabo 3 veces a la semana. Para los ensayos se utilizaron dentro de las bandejas calentadores eléctricos, con registro continuo de temperatura mediante termómetro digital (C/MEM B3 - Termomed®) de - 10 a + 60°C (± 0.1°C), procurando mantener un ritmo constante de incremento equivalente a 0.25°C cada 10 min. Una vez obtenida la temperatura seleccionada, se mantuvo por un máximo de 60 min en cada ensayo. Las temperaturas seleccionadas para cada ensayo, fueron: 26°C, 30°C, 34°C, 38°C y ambiente que fue de 26.8°C en promedio. Durante los ensayos fueron evaluados los siguientes parámetros: duración en minutos del proceso de ingesta, consumo en volumen de la misma, tiempo de inicio de comportamientos agonísticos, presencia de dos tipos de despliegues característicos: morder y disputa por alimento.
Análisis estadistico. Se realizó ANOVA de medidas repetidas y se hicieron interpretaciones de los gráficos resultantes previa comprobación de la normalidad de los datos analizados (27).
RESULTADOS
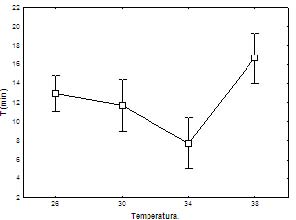
Al aplicar la prueba ANOVA, se obtuvo que en general todos los parámetros fueron significativos (p<0.05) F (15, 1096.3=8.8047). Al analizar independientemente cada parámetro se obtuvo que la relación entre tiempo de ingestión y temperatura fue significativa (p<0.05). Mostró que el tiempo de ingestión fue directamente proporcional a la temperatura, pero esta relación proporcional no fue totalmente creciente en función de la temperatura, ya que a 34°C se obtuvo el valor mínimo de tiempo de ingestión y con un incremento de 4°C estuvo cerca de la duplicacion del tiempo de este proceso (Figura 1).
Figura 1. Relación entre tiempo de ingesta y temperatura en neonatos de Peltocephalus dumerilianus.
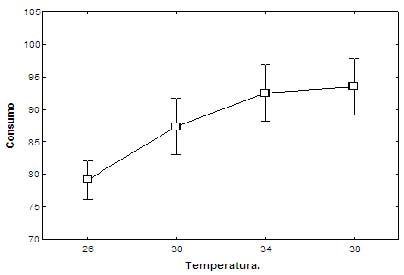
Para la relación entre volumen de consumo y temperatura, con valor significativo (p<0.05), se observó que a menor temperatura el volumen de consumo fue menor, se presentó una relación directamente proporcional (Figura 2).
Figura 2. Relación entre el volumen de ingesta y temperatura en neonatos de Peltocephalus dumerilianus.
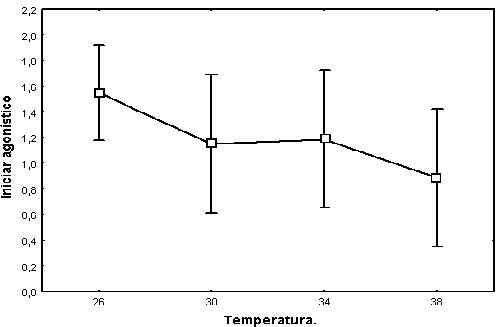
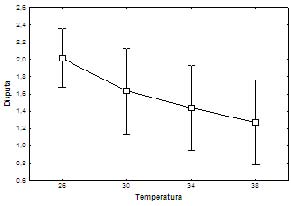
La interacción entre inicio agonístico en función del tiempo, y disputa en función del tiempo no fueron significativas, respectivamente presentaron: F (1.47041) p = 0.222 y F(2.4625) p = 0.062. No obstante, al analizar las figuras 3 y 4 se pudó evidenciar que a menor temperatura el inicio de los despliegues agonísticos fue mayor y se mantuvo una relación inversamente proporcional (Figura 3); lo cual también fue gráficamente apreciable para disputa en función del tiempo (Figura 4).
Figura 3. Relación entre inicio de despliegues agonísticos y temperatura en neonatos de Peltocephalus dumerilianus.
Figura 4. Relación entre disputa de ingesta y temperatura en neonatos de Peltocephalus dumerilianus.
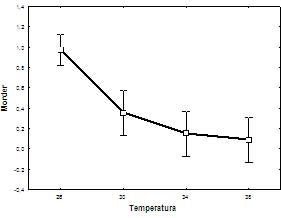
Existió una relación significativa (p<0.05), para el comportamiento morder en función de la temperatura, con un comportamiento gráfico inversamente proporcional y bien definido (Figura 5).
Figura 5. Relación entre morder y temperatura en neonatos de Peltocephalus dumerilianus.
DISCUSIÓN
Es evidente que los cambios presentados en la temperatura ambiental, como se observó en este estudio, incentivan respuestas de tipo etológico, que se pueden relacionar con comportamientos agonísticos al momento de la ingesta concordando con los señalado por Huey y Bennett (1). Por otro lado, dado que se trataba de animales jóvenes, de talla corporal pequeña, los cambios térmicos suscitarían respuestas adaptativas más rápidas y notorias, que pueden representarse en despliegues agresivos evidentes y mensurables, lo cual estaría de acuerdo con lo planteado por Stevenson (11) para ectotermos.
Los comportamientos analizados poseen un carácter termosensible, ya que se manifiestan como un repertorio que se expresa con los cambios de temperatura ambiental, con manifestación sobre capacidad de ingestión y despliegues de agresividad, generando una dicotomía térmica. Esto puede asimilarse con lo planteado por Huey (21) para locomoción y agresividad en función de la temperatura. Estos cambios y sus respuestas son productos de cambios fisiológicos, como lo manifiesta Bennett (1,20), y se relacionan con la tasa metabólica y la actividad muscular, especialmente con la capacidad de locomoción, que en principio permite desplazamientos para poderse alimentar y para desenvolver comportamientos agonísticos en un mismo contexto, pero con diferencias de intensidad en función de la temperatura.
La presencia de inhibición del apetito a los 26°C, medida por el volumen de ingesta, sugiere la existencia de una inhabilidad para digerir a temperatura baja, caso similar a lo hallado por Stevenson et al (11). Sin embargo, no inhibe otros comportamientos de tipo agonístico o etologico de como el despliegue de morder, observado en otras especies de reptiles y apreciado de manera significativa en el presente estudio (12-15).
La presencia de un rango de temperatura, que puede tomarse como normal para el desenvolvimiento de un animal, y que se reconoce como zona de tolerancia, se asocia internamente a una óptima temperatura corporal (1). En este estudio estuvo ubicada comparativamente y con valor significativo estadísticamente en 34°C, en donde se obtuvo un mínimo tiempo de ingesta, consumo adecuado de la ración ofrecida y niveles de agresividad intraespecíficos significativamente menores.
En conclusión, existió una relación directamente proporcional entre la temperatura ambiental y los procesos de alimentación, que se relacionaron con comportamientos agonisticos.
RERERENCIAS
1. Huey RB, Bennett AF. Stress Proteins in Biology and Medicine: Physiological Adjustments to Fluctuating Thermal Environments an Ecological and Evolutionary Perspective. Cold Spring Harbor Laboratory Press. 1990; 37-42. [ Links ]
2. Souza LF. Uma revisão sobre padrões de atividade, reprodução e Alimentação de cágados brasileiros (Testudines, Chelidae). Phyllomedusa 2004; 3(1): 15-27. [ Links ]
3. Bennett AF, Dawson WR. 1976. Biology of the Reptilia: Metabolism. New York; New York Academic Press: 1976. [ Links ]
4. Waldschmidt SR, Jones SM, Porter WP. Animal Energetics: Reptilia Vol. 2. New York; New York Academic Press: 1987. [ Links ]
5 Gatten RE Jr. Effects of temperature and activity on aerobic andanaerobic metabolism and heart rate in the turtles Pseudemys scripta and Terrapene ornata. Comp Biochem Physiol 1974; 48A:619-648. [ Links ]
6. Hailey A, Loveridge JP. Metabolic depression during dormancy in the African tortoise Kinixys spekii. Can J Zool 1997; 75:1328-1335. [ Links ]
7. Steyermark AC, Spotila JR. Effects of maternal identity and incubation temperature on snapping turtle (Chelydra serpentina) metabolism. Physiol Biochem Zool 2000; 73:298-306. [ Links ]
8. Litzgus DJ, Hopkins WA. Effect of temperature on metabolic rate of the mudturtle (Kinosternon subrubrum). J Therm Biol 2003; 28:595-600. [ Links ]
9. Parmenter RR. Effects of Food Availability and Water Temperature on the Feeding Ecology of Pond Sliders (Chrysemys s. scripta). Copeia 1980; 3:503-514. [ Links ]
10. Wang TM, Zaar S, Arvedsen C, Vedel-Smith C, Overgaard J. Effects of temperature on the metabolic response to feeding in Python molurus. Comparative Biochemistry and Physiology 2003; 133(A):519-527. [ Links ]
11. Stevenson RD, Peterson CR, Tsuji JS. The thermal dependence of locomotion, tongue flicking, digestion, and oxygen consumption in the wandering garter snake. Physiol Zool 1985; 58:46-57. [ Links ]
12. Crowley SR, Pietruszka RD. Aggressiveness and vocalization in the leopard lizard (Gambelia wislizennii): The influence of temperature. Anim Behav 1983; 31: 1055-1060. [ Links ]
13. Greene HW. 1988. Biology of the Reptilia. Antipredator mechanism in reptiles Vol. 16. New York: Liss Editorial; 1988; 26-34. [ Links ]
14. Hertz PE, Huey, RB, Nevo E. Fight versus flight: body temperature influences defensive responses of lizards. Anim Behav 1982; 30:676-679. [ Links ]
15. Mautz JW, Daniels CB, Bennett AF. Thermal dependence of locomotion and aggression in a xantusiid lizard. Herpelologica. 1992; 48 (3):271-279. [ Links ]
16. Garland T, Arnold SJ. Effects of a full stomach on locomotory performance of juvenile garter snakes (Thamnophis elegans). Copeia 1983; 3:1092-1096. [ Links ]
17. Huey RB, Bennett AF, John-Alder H, Nagy K A. Locomotor capacity and foraging behaviour of Kalahari lacerid lizards. Anim Behav 1984; 32:41-50. [ Links ]
18. Spotila JR, Lomrnen PW, Bakken GS, Gales DM. A mathematical model for body temperatures of large reptiles: Implications for dinosaur ecology. Am Nut 1973; 107:391-404. [ Links ]
19. Bennett AF. 1989. Complex Organism Functions: Integration of Evolution in Vertebrates. Integrated studies of locomotor performance. Chichester, UK. Wiley. 1989; 191-202. [ Links ]
20. Bennett AF. Thermal dependence of locomotor capacity. News Physiol Sci 1990; 259: R253-R258. [ Links ]
21. Huey RB. 1982. Biology of the Reptilia. Temperature, physiology and the ecology of reptiles Vol. 12. London: Academic Press; 1982; 25-92. [ Links ]
22. Elsworth GP, Seebacher F, Franklin CE. Sustained Swimming Performance in Crocodiles (Crocodylus porosus): Effects of Body Size and Temperature. Journal of Herpetology 2003; 37(2):363-368. [ Links ]
23. Vogt RC. Turtles of the Río Negro. Pp. 245-262, in: Chao, N. L.; Petry, P.; Prang, G.; Sonneschien, L. & Tlusty, M (eds). Amazonia, Brazil: Conservation and Management of Ornamental Fish Resources of the Río Negro Basin; 2001. [ Links ]
24. Cagle F R. A system for marking turtles for future identification. Copeia 1939; 3: 170-173. [ Links ]
25. Zweifel RG. Long-term ecological studies on population of painted turtle, Chrysemys picta on Long Island, N.Y: Amer Muss Nov; 1989; 2952: 1-55. [ Links ]
26 Gibbons J W. Life history of the slider turtle. Recommendations for future research on freshwatwers turtles: What are the question?. Washington. Smiths: Inst. Press; 1990. [ Links ]
27 Zar JH. Bioestatistical analysis, Englewood Cliff, N.J: Prentice-Hall, Inc; 1996; 65-112. [ Links ]