Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares en
SciELO
Similares en
SciELO -
 Similares en Google
Similares en Google
Compartir
Revista MVZ Córdoba
versión impresa ISSN 0122-0268versión On-line ISSN 1909-0544
Rev.MVZ Cordoba v.14 n.1 Córdoba ene./abr. 2009
ORIGINAL
CARACTERIZACIÓN FITOQUÍMICA DE FACTORES ANTINUTRICIONALES EN LAS HOJAS DE UVITO (Cordia dentata Poir)
PHYTOCHEMICAL CHARACTERIZATION OF THE ANTINUTRITIONAL FACTORS IN THE UVITO LEAVES Cordia dentata Poir)
Andrea E. García1, Lic Quimica, Beatriz Abadia1, M.Sc, Rolando Barahona2, Ph.D, Solange Sánchez3*, I.A.
1Laboratorio de Nutrición, CBB, CORPOICA, Km 14 Vía Mosquera, Colombia.
2Universidad Nacional de Colombia, sede Medellín, AA1779, Medellín, Colombia.
3Pontificia Universidad Javeriana, Pontificia Universidad Javeriana, Carrera 7 No. 40 - 62 Bogotá, Colombia
*Correspondencia: sanchez.mariasolange@gmail.com
Recibido: Dicembre 3 de 2008; Aceptado: Marzo 5 de 2009
RESUMEN
Objetivo. Establecer factores antinutricionales en la biomasa de uvito (Cordia dentata Poir), y su valor nutricional e impacto en el bienestar animal, mediante experimentos de producción de gas. Materiales y Métodos. La recolección de hojas de C. dentata se llevó a cabo en dos épocas del año, correspondientes al periodo de verano (marzo) y lluvioso (septiembre), en el municipio de Codazzi (Cesar). Adicionalmente se realizó un muestreo de pasto Colosuana (Bothriochloa pertusa) que fue utilizado como forraje control. En las diferentes muestras se determinó la concentración de taninos, saponinas, alcaloides, nitratos y nitritos. Posteriormente, en ensayos de producción de gas in vitro, se cuantificó el impacto nutricional de diferentes concentraciones de los componentes antinutricionales mayoritarios identificados en la primera fase. Resultados. Los análisis realizados en este estudio indicaron que el uvito es un forraje degradable y una buena fuente de proteína aprovechable (16.8%) y que los contenidos de saponinas, alcaloides y taninos no deben ser considerados factores antinutricionales en esta especie. Sin embargo, la concentración de nitratos fue catalogada como potencialmente tóxica, condición que debe ser un factor a tener en cuenta al momento de incluir esta especie en la dieta de rumiantes. La cantidad de gas producido en los experimentos se vio afectada negativamente por la presencia de los nitratos contenidos en las hojas de C. dentata. Conclusiones. El uvito () puede ser incluido en la dieta de bovinos, teniendo muy en cuenta el control de los nitratos en el total de la dieta.
Palabras clave: Forrajes, metabolitos secundarios, nitratos, nitritos, producción de gas, Cordia dentata Poir.
ABSTRACT
Objective. To establish antinutritional factors in uvito (Cordia dentata Poir), and the effect of its dietary inclusion in animal’ health as assessed by gas production experiments. Materials and Methods. Leaves of C. dentata were collected at the Codazzi municipality, Cesar, Colombia during the dry (March) and rainy (September) seasons. Leaves of Colosuana (Bothriochloa pertusa), a grass widely available in the region, were also collected and used as control diet. The content of tannins, saponins, alkaloids, nitrates and nitrites was determined in all samples. Gas production experiments were carried out in order to assess dry matter degradability and the nutritional impact of nitrates, a major dietary component in uvito. Results. Our results suggest that uvito is a degradable forage and a good protein source (crude protein content = 16.8%); the content of saponins, alkaloids and tannins should not be considered as antinutritional factors in this species. However, nitrate content were high enough that they could be classified as potentially toxic and thus this condition should be monitored if uvito is to be included in the diet of ruminants. Conclusions. We show that gas production was increased by the addition of nitrates present in C. dentata leaves.
Key words: Forages, nitrates, nitrites, secondary metabolites, gas production, Cordia dentata Poir.
INTRODUCCIÓN
Las explotaciones ganaderas en Colombia dependen de la utilización de pastos y forrajes para la alimentación de sus animales. Esto obedece a que los pastos constituyen el alimento más económico y de mayor disponibilidad en las diferentes regiones ganaderas del país; en donde la diversidad de los ecosistemas presentes permite la utilización de un gran número de especies de pastos y leguminosas adaptadas a los diferentes pisos térmicos en los que se desarrolla la actividad ganadera (1). En contraposición a su diversidad, los sistemas de producción ganadera del Caribe colombiano presentan baja eficiencia biológica y económica, lo cual obedece en parte a la baja calidad nutricional y disponibilidad de las gramíneas nativas o introducidas principalmente durante la prolongada estación seca (1). El problema es agravado por el avanzado estado de degradación que es común a la mayoría de las áreas de pastoreo. Esta limitación conlleva a que los hatos ganaderos de la región presentan bajos índices productivos y reproductivos. A medida que la estación seca va progresando y la disponibilidad de gramíneas en las praderas va disminuyendo, el ganado suele cambiar la composición de su dieta y consumir plantas que en otras condiciones no consumiría, incluyendo especies con altos contenidos de factores tóxicos o antinutricionales. Dichos factores antinutricionales o metabolitos secundarios pueden afectar las características bromatológicas de las plantas como consecuencia de su actividad bioquímica y/o su influencia sobre la microbiología del ecosistema ruminal (1).
En ganaderías ubicadas en la zona de bosque seco tropical de la región Caribe Colombiana, la especie Cordia dentata Poir es una de las plantas que por su abundancia en épocas de sequía puede considerarse una potencial fuente de alimentación para rumiantes. El objetivo del presente trabajo fue determinar la presencia de los principales componentes fitoquímicos que puedan estar asociados a factores antinutricionales en la especie C. dentata Poir.
MATERIALES Y MÉTODOS
Sitio de estudio y recolección de la muestra. Las hojas de C. dentata se recolectaron en el municipio de Codazzi, departamento del Cesar, en dos ocasiones durante el año 2005 (uvito de marzo, correspondiente al periodo seco y uvito de septiembre, denominado lluvioso). Un espécimen completo de la especie se envió al Herbario de la Universidad Nacional para confirmar su clasificación taxonómica. Además del muestreo de C. dentata, se obtuvieron muestras de hojas de la especie forrajera colosuana (Bothriochloa pertusa), las que se incluyeron en algunos de los experimentos de este estudio.
Manejo de la muestra. El material recolectado se envió a los laboratorios de Nutrición y Fisiología Animal, en la Corporación Colombiana de Investigación Agropecuaria CORPOICA, para su posterior tratamiento y análisis. En el laboratorio, las muestras se llevaron a sequedad constante (60°C) y se trituraron con un molino de martillo con criba de 2 mm.
Análisis bromatológico. Este incluyó las siguientes determinaciones: contenido de ceniza y materia orgánica, materia seca, extracto etéreo, fibra detergente neutra, fibra detergente ácida, lignina y celulosa, de acuerdo con procedimientos estándares (2).
Análisis Fitoquímico. El estudio fitoquímico de las muestras de C. dentata, incluyó los siguientes análisis: Saponinas, con determinaciones del índice de espuma e índice de hemólisis (3), alcaloides (4) y taninos (5). Además, se realizó determinación del contenido de nitratos y nitritos.
Nitratos. El contenido de nitratos en tejido vegetal, se determinó por el método reportado en la literatura (2). Para este análisis se utilizaron los siguientes forrajes: Kikuyo (Pennisetum clandestinum, como control positivo), colosuana (Bothriocloa pertusa, control negativo), y las muestras de uvito (C. dentata lluvioso y verano). Una muestra de 2.5 g de materia seca de cada uno de los forrajes utilizados se licuó por cuatro minutos con 100 ml de agua desmineralizada. La mezcla se llevó a un volumen final de 250 ml, utilizando carbón activado para lograr transparencia de la solución. En la determinación de nitratos se utilizaron mezclas de ácido fenoldisulfónico (2:1 fenol blanco en H2SO4 (16.6% p/v) y H2SO4 fumante caliente, que se enfrió y llevó a un volumen final de un litro con H2SO4, y solución Estándar (solución acuosa de NaNO3 al 0.137% p/v (Merck 106535).
El residuo obtenido a partir de una muestra de 25 ml de filtrado, se mezcló con 1 ml de ácido fenoldisulfónico y 4 ml de agua. La mezcla se alcalinizó con NH4OH o NH3 y se llevó a volumen de 10 ml con agua, se dejó en reposo durante 10 minutos y las lecturas de absorbancia se realizaron a 405 nm, longitud de onda de mayor absorbancia en el espectro del compuesto, previamente realizado (datos no reportados). El color amarillo de la muestra indicó la presencia de nitratos. La determinación incluyó el uso de un blanco, (soluciones 1:1 de agua destilada y cada uno de los estándares). La curva de calibración se obtuvo a partir de diluciones de una solución estándar de 1000 ppm de nitratos.
Nitritos. El contenido de nitritos en tejido vegetal, se determinó por el método reportado en la literatura (2) incluyendo los mismos forrajes descritos para nitratos, utilizando la misma solución de material vegetal para nitratos. En la determinación de nitritos se utilizaron soluciones de ácido sulfanílico (0.8% p/v, en solución de acido acético 5N), α naftol acetato (0.5% de a naftilamina en solución de acido acético 1N) y estándar: (solución acuosa de 2000 ppm de NO2). Una vez preparadas las soluciones, se tomaron 5 ml del filtrado de material vegetal y se mezclaron con 3 ml de agua, 1 ml de ácido sulfanílico y 1.5 ml de α naftol acetato. La mezcla se dejó en reposo para posterior lectura de las muestras en el espectrofotómetro. La curva de calibración incluyó diluciones del estándar de 10 ppm.
Nitratos en un medio de fermentación con fluido ruminal. Para realizar este ensayo fue necesario adaptar la metodología planteada para forrajes (2) de manera que se evitaran posibles interferencias de la matriz del medio de fermentación en la lectura de nitratos. El licor ruminal se recolectó y se conservó simulando las condiciones de anaerobiosis y temperatura del rumen (39°C). El medio de fermentación se compuso de las soluciones micromineral (0.05% Na4EDTA, 0.02% FeSO4*7H2O, 0.02% MnCl2*4H2O, 0.01%ZnSO4 * 7 H2O, 0.03% H3BO3, 0.02% CoCl2*6H2O, 0.01% CuCl2*2 H2O, 0.02% NiCl2*6H2O, y 0.03% NaMoO4*2 H2O, macromineral (0.62% Na2HPO4, 0.62% KH2PO4 y 0.06% de MgSO4*7 H2O.) y de un buffer (6). Dichas soluciones se refrigeraron hasta el momento de la preparación del medio de incubación (caseína 0.5%, 125 µl de solución micromineral, 250 ml de solución buffer y 250 ml de solución macromineral). El buffer contenía NH4HCO3 (0.4%) y NaHCO3 (3.5%).
El método reportado para este trabajo incluía la adición de resarzurín y cisteína, sin embargo, estos compuestos no fueron adicionados al medio ya que por sus propiedades de color y agente reductor impiden la lectura de nitratos especialmente en el proceso de revelación de color.
El medio para incubación se llevó a pH de 7.2 y se gasificó con CO2. Asimismo se preparó una solución de NaNO3 220 mM para ser adicionada en cada una de las botellas. La concentración final de nitrato en el medio fue 10 mM, con el fin de realizar lecturas de absorbancia dentro del rango óptimo de la curva de calibración.
A cada uno de los tubos que contenían el medio de cultivo se le adicionaron 0.5 ml de fluido ruminal y lectura de nitratos que se llevó a cabo durante seis horas, incubando las botellas a una temperatura de 39°C y realizando mediciones de nitratos en las horas 2, 4 y 6. En cada uno de los muestreos, los tubos seleccionados recibieron 0.5 ml de la solución de NO3. Los tubos se centrifugaron a 2000 g, y de cada uno de los tubos se tomó una alícuota de 0.1 ml, que se mezcló con 0.4 ml de ácido fenoldisulfónico, 5 ml de H2O destilada y 3 ml de NH4OH. La mezcla se llevó a un volumen final de 10 ml con H2O destilada. Debido a las concentraciones de NO3 utilizadas en este análisis, se realizó una curva de calibración a partir de la solución 100mM de NO3, preparando las diluciones entre 0 y 15mM, rango óptimo de lectura.
Primer experimento de producción de gas. Este experimento determinó la cinética de producción de gas a partir de sustratos altamente degradables y concentraciones de nitratos conocidas. Se midieron los parámetros de producción de gas reportados (7,8) y el contenido de nitratos y nitritos durante las diferentes horas de la fermentación.
Preparación de las muestras. El medio de cultivo se preparó como se describió anteriormente. En este ensayo se incluyeron cuatro tratamientos correspondientes a cuatro concentraciones de nitratos: 0, 2, 4 y 8 milimoles, utilizando 4 repeticiones por tratamiento. En frascos de vidrio de 50 ml se mezclaron 0.3 g de almidón y 21 ml del medio de cultivo. Los frascos se sellaron con herméticamente y en cada frasco se inyectaron 6 ml de fluido ruminal conservado (CO2 y 39°C). Los frascos se incubaron a 39°C en agitación constante durante todo el periodo de medición de gas. El periodo de incubación se inició con una presión cero y con la adición de 1.5 ml de las soluciones de nitratos para cada uno de los tratamientos. La fermentación se llevó a cabo en un periodo de 12 horas realizando medición de los parámetros en las horas 2, 4, 6, 9 y 12.
Medición de gas. La lectura del volumen de gas en los diferentes muestreos se determinó de acuerdo al método reportado (9,10) en un transductor Balley y Mackey Ltd, serie No 60922.4.
Determinación del contenido de nitratos durante la fermentación. Para esta determinación, las muestras se trataron según la metodología reportada para la determinación de nitratos en materia seca, utilizando la curva de calibración previamente establecida en este estudio (11).
Determinación del contenido de nitritos durante la fermentación. Con el líquido sobrenadante de las muestras centrifugadas se preparó una solución stock acuosa que contenía 50% de sobrenadante, 10% ácido sulfanílico y 10% de α- naftil acetato. De esta solución se prepararon diluciones de concentraciones desde 0 hasta 0.015mM con las que se realizó la curva de calibración.
Segundo experimento de producción de gas. Este experimento se llevó a cabo siguiendo el método reportado (12, 7) y para el análisis de las variables medidas, se utilizó el modelo estadístico completamente al azar, utilizando el programa SAS (Statistics Análisis System).
En este experimento los sustratos para la fermentación (tratamientos) fueron las especies C. dentata y colosuana (B. pertusa), incluyendo 4 repeticiones por tratamiento.
En frascos de vidrio de 50 ml se mezclaron 0.3 g de forraje, 21 ml de medio de incubación y 6 ml de fluido ruminal recientemente colectado. Los frascos se sellaron herméticamente. La fermentación se llevó a cabo por un periodo de 48 horas. El volumen de gas producido se midió de acuerdo con el sistema manual descrito anteriormente a las 2, 4, 6, 9, 12, 18, 24 y 48 horas de incubación.
Además de la producción de gas, se analizó el contenido de nitratos y nitritos, desaparición de materia seca (DMS), fibra detergente neutra (FDN) y proteína cruda (PC). Las determinaciones de nitratos y nitritos se llevaron a cabo en forma similar a la descrita para el primer experimento, realizando muestreo a las 0, 1, 2, 4, 6, 9, 12, 24 y 48 horas.
RESULTADOS
Caracterización química de C. dentata.
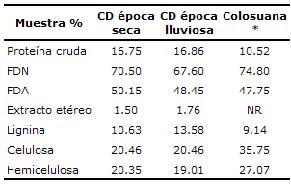
Análisis bromatológico. Como se observa en la tabla 1, la especie C. dentata presenta un alto contenido de proteína cruda. LA FDN registró valores entre 67 y 70 y la FDA valores entre 48 y 50 para las épocas lluviosa y seca respectivamente. El contenido de grasa observado en esta especie es bajo (1.50-1.76%), lo que se considera normal en una especie arbórea. El contenido de lignina es alto (10-13%). El valor observado de hemicelulosa se considera ligeramente alto (19-20%).
Tabla 1. Caracterización nutricional de Cordia dentata(CD) y Bothriocloa pertusa
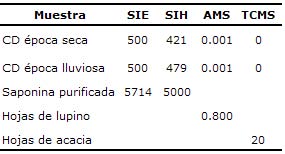
Análisis fitoquímico. En el análisis de saponinas, alcaloides y taninos condensados (Tabla 2), no se encontraron cantidades importantes de estos metabolitos secundarios.
Tabla 2. Determinación del contenido de saponinas, alcaloides y taninos condensados en la especie Cordia dentata
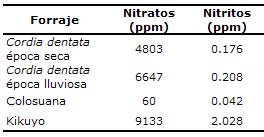
Determinación de nitratos y nitritos en materia seca. En la tabla 3 se resumen los resultados obtenidos en la determinación de nitratos y nitritos en la materia seca de C. dentata. El contenido de nitratos en las hojas de la especie C. dentata fue 4803 ppm para la época seca y 6647 ppm para la época lluviosa. Los contenidos observados para el kikuyo y el pasto colosuana, estuvieron en el rango de contenido reportado previamente (13).
Tabla 3. Determinación del contenido de nitratos y nitritos (ppm) en materia seca en tres forrajes
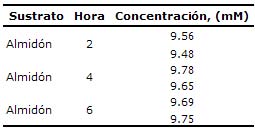
Determinación del contenido de nitratos en un medio de fermentación con fluido ruminal. La tabla 4 muestra los valores de concentración de nitratos (ppm) obtenidos mediante la curva de calibración. Como puede observarse, los contenidos registrados se encuentran muy cercanos a la concentración inicialmente adicionada (10mM) al medio de fermentación, y esta condición se presentó en todas las horas de muestreo.
Tabla 4. Recuperación de nitratos, determinados en el medio de fermentación con fluido ruminal, por el método colorimétrico
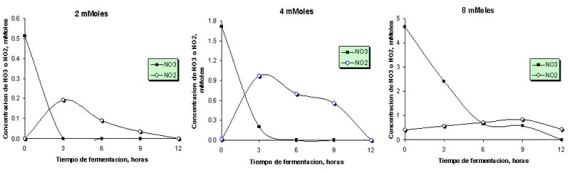
Dinámica de la concentración de nitratos y nitritos durante la fermentación. (Primer experimento de producción de gas). Para esta determinación, se añadieron al medio cantidades de nitratos dentro de un rango de concentraciones cercano a lo observado en materia seca de C. dentata. La figura 1 a, b y c muestra la dinámica del contenido de nitratos y nitritos a través del período de fermentación. La desaparición de nitratos se relacionó con la cantidad adicionada del mismo. Así, para la mínima concentración empleada (2 mMoles) se observó una reducción total de nitratos hacia la hora 3, mientras que en el tratamiento de 4 mMoles solo se observó una reducción completa hacia la hora 7. Por su parte, en el tratamiento de máxima concentración de nitratos (8 mMoles), la disminución en las concentraciones de nitratos fue más lenta, lo que pudo estar asociado con la cantidad de bacterias reductoras en el medio de fermentación.
Figura 1. Cambios en el contenido de nitratos (NO3) y nitritos (NO2, moles) durante el primer experimento de producción de gas en los tratamientos recibiendo adiciones de 2, 4 y 8 mMoles de nitratos.
La acumulación de nitritos a través del tiempo de fermentación también varió de acuerdo con la adición de nitratos al medio. En el tratamiento de menor adición de nitratos (2 mMoles), la concentración máxima de nitritos se alcanzó a las 3 horas, donde se registró un valor máximo de 0.2 milimoles, mientras que los tratamientos con adiciones de 4 y 8 mMoles de nitratos, mostraron mayor acumulación de nitritos alrededor de la hora 6 (0.97 mMoles) y 9 (0.84 mMoles), respectivamente.
En todos los casos, la disminución en el contenido de nitratos fue muy rápida durante las primeras horas de fermentación. Sin embargo, al aumentarse la adición de nitratos, dicha velocidad tendió a disminuir. Así, después de 3 horas de incubación, 0, 12 y 52% de los nitratos inicialmente presentes se encontraban todavía en el medio de cultivo para los tratamientos con adición de 2, 4 y 8 mMoles de nitratos, respectivamente. De otro lado, la desaparición de nitritos en el medio de fermentación fue más lenta, con sus concentraciones mostrando mayor persistencia en la medida que se aumentó la concentración de nitratos agregada al medio.
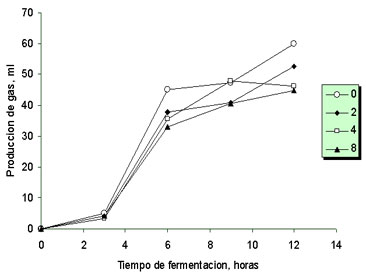
Producción de gas. Los resultados obtenidos en el primer experimento de producción de gas, para el que se escogió un sustrato altamente degradable y se usaron concentraciones conocidas de nitratos, se muestran en la figura 2. Como se puede apreciar, se presentaron diferencias (p<0.05) entre la producción de gas de los tratamientos utilizados en este experimento. En general, la adición de nitratos estuvo asociada con una reducción de la producción de gas, siendo esta diferencia mayor a medida que se aumentó el nivel de adición de nitratos. Por ejemplo, a la hora 12 de fermentación, la producción de gas observada en las botellas recibiendo la adición de 2, 4 y 8 mMoles de nitratos fue 88, 77 y 75% de la observada con el tratamiento control (p<0.05), respectivamente. A su vez, el tratamiento recibiendo 2 mM de nitratos, tuvo una producción de gas mayor que la observada con los tratamientos de 4 y 8 mM (p<0.05).
Figura 2. Producción de gas durante la fermentación de almidón en la presencia de 0, 2, 4 y 8 mM de nitratos agregados al medio de cultivo
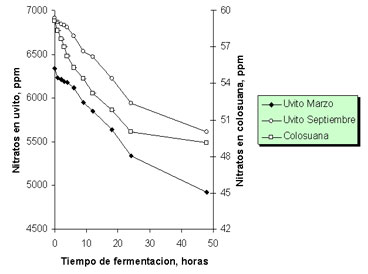
Variación en el contenido de nitratos durante la fermentación (Segundo experimento de producción de gas). En todos los forrajes evaluados, se observó una desaparición de nitratos a medida que avanzó el tiempo de fermentación. Sin embargo, debe recordarse que existieron grandes diferencias en la concentración de nitratos entre los tres tratamientos (p< 0.001), diferencia que se mantuvo en todas las horas de muestreo. Al final de la fermentación, en las muestras de pasto colosuana (B. pertusa), se registró una disminución entre 16 y 18% en contenido de nitratos, mientras que en las dos muestras de uvito, se observó una disminución de 20 a 22%. A pesar de las diferencias apreciables en la figura 3, el comportamiento de los tres tratamientos en las últimas horas del ensayo, es similar y la tasa de disminución de nitratos se fue haciendo menor a medida que aumentó el tiempo de fermentación.
Figura 3. Desaparición de nitratos durante la fermentación in vitro de Cordia dentata (uvito de época seca y lluviosa, marzo y septiembre, respectivamente) y Bothriochloa pertusa (colosuana) en el segundo experimento de producción de gas.
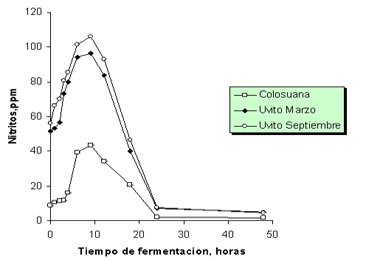
Variación en el contenido de nitritos durante la fermentación. Se registró un mayor contenido de nitritos en las fermentaciones en donde se usó uvito como sustrato que en aquellas donde se utilizó B. pertusa (p<0.001, Figura 4). Durante los primeros estadios de la fermentación y con todos los forrajes evaluados se observó una acumulación progresiva de nitritos en el medio, cuya concentración alcanzo su valor máximo a la hora 9 de fermentación.
Figura 4. Aparición de nitritos durante la fermentación in vitro de Cordia dentata (uvito época seca y lluviosa, marzo y septiembre, respectivamente) y Bothriochloa pertusa (colosuana) en el segundo experimento de producción de gas.
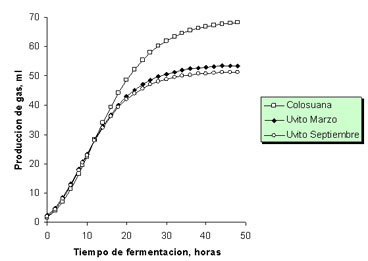
Producción de gas. Durante las primeras seis horas de fermentación, la producción de gas a partir de muestras de C. dentata fue al menos 11% mayor que la observada con colosuana, teniendo este pasto una fase lag mayor que la observada con C. dentata (p<0.05). Sin embargo, hacia la hora 24 de fermentación, en las botellas con C. dentata se había producido solamente el 85% del gas producido con pasto colosuana (p<0.05) y esta diferencia fue aumentando a medida que se incrementó el tiempo de fermentación de tal manera que hacia la hora 48, la producción acumulada de gas fue de 69.3, 53.89 y 51.63 ml para los tratamientos de colosuana, C. dentata de marzo y C. dentata de septiembre, respectivamente (Figura 5). Es necesario aclarar que la producción de gas reportada en la figura 5 es la asociada con la fermentación de una muestra promedio de 0.3 g de materia seca de cada pasto.
Figura 5. Producción de gas durante la fermentación in vitro de Cordia dentata (uvito época seca y lluviosa, marzo y septiembre, respectivamente) y Bothriochloa pertusa (colosuana) en el segundo experimento de producción de gas.
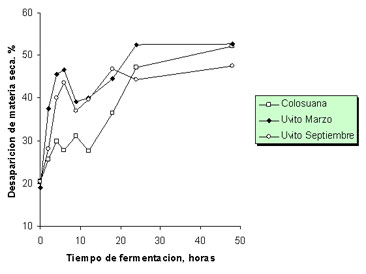
Desaparición in vitro de la materia seca, fibra en detergente neutro y proteína cruda. Durante la fermentación, la desaparición de materia seca aumentó desde un valor inicial cercano al 20% en todas las muestras hasta un valor final de 52% en muestras de colosuana y uvito de marzo y de 47% en muestras de C. dentata de septiembre (Figura 6).
Figura 6. Desaparición de materia seca durante la fermentación in vitro de Cordia dentata (uvito época seca y lluviosa, marzo y septiembre, respectivamente) y Bothriochloa pertusa en el segundo experimento de producción de gas.
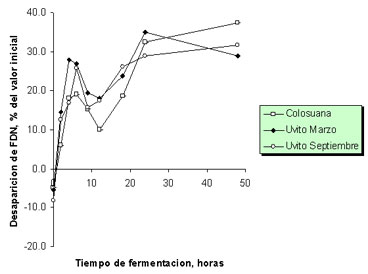
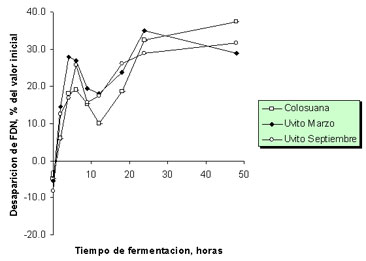
Por su parte, la desaparición de FDN después de 48 horas de fermentación, expresada como porcentaje del contenido de FDN fue de 28.9 y 31.7% en las muestras de colosuana, C. dentata de marzo y C. dentata de septiembre, respectivamente (Figura 7).
Figura 7. Desaparición de la fibra en detergente neutra durante la fermentación in vitro de Cordia dentata (uvito época seca y lluviosa, marzo y septiembre, respectivamente) y Bothriochloa pertusa (colosuana) en el segundo experimento de producción de gas.
Finalmente, la desaparición de proteína, aunque errática durante las primeras horas, hacia las 48 horas de fermentación alcanzó valores de 59.8, 66.2 y 52.5% en las muestras de colosuana, C. dentata de marzo y C. dentata de septiembre, respectivamente (Figura 8).
Figura 8. Desaparición de la proteína cruda durante la fermentación in vitro de Cordia dentata (uvito época seca y lluviosa, marzo y septiembre, respectivamente) y Bothriochloa pertusa (colosuana) en el segundo experimento de producción de gas.
DISCUSIÓN
El análisis bromatológico sugiere que el contenido de nutrientes de C. dentata la convierte en una especie con potencial forrajero, especialmente en lo que se refiere a contenido de proteína, el cual podría contribuir a solucionar el déficit de proteína que suele suceder cuando la base alimenticia de los animales son las gramíneas tropicales, especialmente durante la época seca (14-17), situación de primordial importancia para los ganaderos de la región Caribe colombiana. Sin embargo, el contenido de FDN y FDA observados en la especie se considera alto, lo que sugiere que la disponibilidad de energía puede ser limitada. Un alto contenido de FDN y FDA se asocia con un menor consumo de alimento (18) al ser estos componentes de lenta degradación en el rumen. Como con la mayoría de las forrajeras tropicales, el alto contenido de FDN y de lignina debe considerarse como una limitante nutricional al uso de C. dentata (uvito) en la alimentación de bovinos. Los altos contenidos de estos dos componentes podrían estar asociados con un consumo reducido de C. dentata, al aumentar el tiempo de residencia en el rumen de la materia seca de esta planta (19).
El contenido de metabolitos secundarios en C. dentata sugiere que éstos no deben ser considerados como factores antinutricionales. Sin embargo, resulta necesario determinar si en el tejido de C. dentata se acumulan otros elementos antinutricionales no evaluados en este ensayo. Solo después de realizar estos análisis se puede descartar la posibilidad de que el consumo de C. dentata por rumiantes conlleve efectos adversos en la nutrición del animal o en su metabolismo y bienestar en general.
Uno de los metabolitos que debe recibir especial atención en C. dentata son los nitratos. Estos compuestos en si, no son tóxicos para el ganado, pero si lo son los productos intermediarios de su degradación, los nitritos. Una parte de los nitritos puede ser absorbida, siendo estos metabolitos llevados hacia el flujo sanguíneo del animal donde actúan cambiando la hemoglobina en metahemoglobina, disminuyendo la capacidad de transportar oxigeno de la sangre (20).
Aunque se considera que los contenidos de nitratos encontrados en el uvito en este estudio pueden ser considerados moderadamente seguros en la mayoría de las ocasiones, existen varias condiciones que pueden conllevar a que la presencia de estos niveles de nitratos cause efectos negativos para los rumiantes. Por ejemplo, animales en diferentes estados fisiológicos difieren en susceptibilidad, habiéndose reportado que aquellos sufriendo de estrés fisiológico (enfermos, hambrientos, lactantes o preñados) muestran mayor susceptibilidad al consumo de nitratos (21). De otro lado, en condiciones de escasez de forraje, como sucede durante el verano en gran parte de la región Caribe colombiana, los animales cambian sus patrones de consumo pudiendo llegar a ingerir una gran cantidad de plantas tóxicas, aunque estas sean poco apetecibles. Este mismo efecto se observa cuando los animales han sido mantenidos por mucho tiempo en los corrales sin acceso a agua y/o alimento. Frecuentemente, la falta de sal mineralizada o la deficiencia de minerales, especialmente fósforo, conlleva a que los animales consuman plantas tóxicas en mayores cantidades que lo habitual (22).
Finalmente, se deben considerar factores que pueden resultar en cambios en el contenido de nitratos en el tejido vegetal. Por ejemplo, las plantas jóvenes tienden a tener mayor contenido de nitratos que las plantas maduras. Otros factores como la aplicación de fertilizante nitrogenado (23), altas temperaturas de crecimiento (24), el uso de herbicidas, el estrés hídrico y la presencia de enfermedades pueden contribuir a un aumento en la acumulación de nitratos en el tejido vegetal (25). Asimismo, se ha reportado que plantas creciendo en lugares donde las excretas de los animales se acumulan, por ejemplo un saladero o un bebedero, tienden a acumular mayor cantidad de nitratos que aquellas creciendo bajo condiciones normales (25).
El uso del método colorimétrico para la determinación de nitratos en el fluido ruminal fue adecuado ya que se observó un porcentaje de recuperación entre 94.8 y 97.8% en todas los muestreos durante el periodo de incubación, lo que sugiere que el método puede utilizarse en estudios de nitratos con fluido ruminal.
En el primer experimento de producción de gas, la adición de nitratos al medio de fermentación estuvo relacionada con una acumulación de nitritos, lo que ocurrió en forma diferencial para los diferentes tratamientos. La desaparición total de los nitratos en los tratamientos de 2 y 4 mMoles de nitratos se observó a la quinta hora después el inicio de la fermentación, mientras que la desaparición de los nitritos se llevó a cabo de forma más lenta. Estos datos concuerdan con lo reportado en la literatura en cuanto a que la reducción de nitratos a nitritos es más rápida que la de nitrito a amonio (26), condición que causa la acumulación de los últimos y genera los problemas metabólicos arriba mencionados.
La adición de nitratos estuvo asociada con una reducción en la producción de gas en el primer experimento. El nitrato ha sido considerado como un modificador de la fermentación ruminal al poder actuar como receptor de electrones dentro del rumen, ya que se requieren ocho electrones para su reducción hacia amonio (27). Por esta misma razón, el aumento de la desaparición in vitro de nitritos ocasionado por la presencia de una cepa modificada de Escherichia coli estuvo asociada con una reducción en la producción de metano (28)
Al comparar las tasas de reducción de nitratos del primer y segundo experimento de producción de gas se observan grandes diferencias. En el primero, los nitratos se redujeron a altas tasas desapareciendo del medio de cultivo durante las primeras 5 y 6 horas de fermentación. En el segundo, no se aprecia una tendencia general para los tres tratamientos, sin embargo es claro que la reducción de nitratos ocurrió a tasas más bajas que la reducción observada en el primer experimento. En el primer experimento una adición de 8 mMoles de nitratos estuvo asociada con una rápida desaparición de los mismos. Por el otro lado, en la segunda fermentación, la concentración inicial de nitratos solo se redujo en 15% después de 24 horas de incubación. Estas diferencias pueden estar asociadas a diferencias en disponibilidad de los nitratos en ambos experimentos. Así, mientras en el primer experimento los nitratos se encontraban en solución en el medio de cultivo y además asociados a una fuente energética de rápida degradación como el almidón, en el segundo experimento los nitratos estaban asociados al material vegetal de C. dentata y colosuana, lo que implicó un mayor esfuerzo de los microorganismos para romper la pared celular de estas especies vegetales, por lo que en este experimento la liberación de nitratos al medio y por tanto su reducción, fue más lenta.
Las plantas como la gramínea colosuana o arbóreas como C. dentata presentan una mayor cantidad de tejido vascular y esclerénquima en sus hojas, las cuales están rodeadas por una doble capa de células con paredes gruesas y suberizadas que la hacen más resistentes al rompimiento mecánico y al ataque microbiano. Estas propiedades afectan la tasa de degradación, presentándose un mayor tiempo de retención ruminal y, por ende, menor consumo. Estos datos confirman observaciones anteriores sobre la importancia del control sobre el uvito al ser suministrada; los niveles de nitrito pueden llegar a ser considerables y las consecuencias podrían ser enfermedades del animal por intoxicación.
En cuanto a la toxicidad que puede presentarse por acumulación de nitratos y nitritos, los nitratos son considerados poco tóxicos mientras que los nitritos son 2.5 veces más tóxicos para rumiantes y 10 veces más tóxicos para monogástricos (29), cuando estos son acumulados. De acuerdo con lo anterior, la especie C. dentata puede ser utilizada cuando las concentraciones de nitratos en materia seca sean menores de 5000 ppm, previendo una concentración de nitritos en el rumen menor que 110ppm. La máxima acumulación de nitritos para todos los tratamientos se presentó a la hora 9, aumentando progresivamente desde la primera hora, datos que se presentaron de acuerdo a lo esperado. Las cantidades observadas de nitritos podrían no ser suficientes para causar una intoxicación en el animal, ya que la literatura cita como concentración deletérea en el rumen una de 150 a 170 ppm (30). En el segundo experimento de producción de gas, los niveles máximos de nitritos variaron entre 100 y 110 ppm. Sin embargo, dadas las diferencias entre las condiciones in vitro y las que cabrían esperar in vivo, deben verificarse estas aseveraciones en experimentos con animales, especialmente por los factores arriba mencionados.
Por lo anteriormente expuesto, se concluyó que las concentraciones de nitratos encontradas en C. dentata son medianamente altas y potencialmente tóxicas. Por lo tanto es posible que con un consumo alto se presente enfermedad del animal. La técnica espectrofotométrica para la determinación de nitratos y nitritos en fluido ruminal demostró ser adecuada. En cuanto a la técnica de producción de gas, se concluyó que ésta fue de gran utilidad para evaluar diferentes parámetros nutricionales de interés en este estudio y que la producción de gas cambió bajo la presencia de nitratos C. dentata en el muestreo de la época de lluvia.
Finalmente se concluyó que la especie C. dentata debido a sus características bromatológicas y su bajo contenido de metabolitos secundarios como factores antinutricionales, puede ser incluida en la dieta de bovinos, sin embargo, el contenido de nitratos debe ser controlado por parte del ganadero.
Agradecimientos
Los autores expresan su agradecimiento al Médico Veterinario Belisario Roncallo, de la Corporación colombiana de Investigación Agropecuaria CORPOICA, quien gentilmente colaboró en la recolección de las muestras de C. dentata.
REFERENCIAS
1. Díaz R. F. Alimentación y manejo del bovino en desarrollo. Producción bovina sostenible. Cuba: Ed. ACPA y Asociación Nacional de amistad Italia; 1998. [ Links ]
2. AOAC. Official Methods of Analysis. Association of Official Agricultural Chemists (P.A. Cunnif, editor). Arlington: JAOAC International; 1995. [ Links ]
3. Calderón E. Guía para el análisis de plantas y notas practicas sobre fitoquimica. Facultad de ciencias, depto de Farmacia, Universidad Nacional de Colombia. 1963; 141-145. [ Links ]
4. Bruneton J. Alcaloides de los frutos de Caryomene Olivascens. Acta Farm Bonarense 1987; 6(3): 163-165. [ Links ]
5. Barahona R, Lascano C, Narvaez N, Owen E, Theodorou M. in vitro degradability of mature and immature leaves of tropical forage legumes differing in condensed tannin and non-starch polysaccharide content and composition. JSFA 2003; 83(12):1256 - 1266. [ Links ]
6. Goering H. K, Van Soest P. J. Forage fiber analysis: Apparatus, reagents, procedures, and some applications. Agric. Handbook 1970; AH379. [ Links ]
7. Pell A. N, Schofield P. Computarized monitoring of gas production to measure forage digestion in vitro. J Dairy Sci 1993;76:1063-1073. [ Links ]
8. Barahona R, Theodorou M, Kingston-Smith A, Sánchez S, Owen E, Phillip M.New perspectives on the degradation of plant biomass in the rumen in the absence and presence of condensed tannins. In: Brooker, J.D. (ed.): Tannins in Livestock and Human Nutrition 92. Australia ed. Adelaide, ACIAR Books Online, 2000. [ Links ]
9. Cone, J.W, Van Gelder A.H, Visscher G.J.W, Oudshoorn L. Influence of rumen fluid and substrate concentration on fermentation kinetics measured with a fully automated time related gas production apparatus. Anim Feed Sci Technol 1996; 61: 113-128. [ Links ]
10. Davies D R, Theodorou M K, Baughan J, Brooks A E, Newbold J R. An automated pressure evaluation system (APES) for determining the fermentation characteristics of ruminant feeds. Ann Zootech 1995; 44: 36- 45. [ Links ]
11. Allison C, McFarlane G.T. Dissimilatory nitrate reduction by Proìonibacterium acnes. Appl Environ Microbiol 1989; 55: 2899-2903. [ Links ]
12. Theodorou M.K, Williams B.A, Dhanoa M.S, Mcallan A.B, France J. A simple gas production method using a pressure transducer to determine the fermentation kinetics of ruminant feeds. Anim Feed Sci Technol 1994; 48: 185-197. [ Links ]
13. Hopkins W. G . Introduction to plant physiology. New York: John Wiley and Sons, Inc; 1995, 117-118. [ Links ]
14. McIvor J.G, Chen C.P. Tropical grasses: their domestication and roles in animal feeding systems1.In: G. J. Blair, D. A. Ivory, and T. R. Evans (eds.). Forages in Southeast Asia and South Pacific Agriculture. Proceedings of an international workshop held at Cisarua. Indonesia: ACIAR; 1986. [ Links ]
15. National Academy of Sciences.Tropical legumes: Resources for the future. Washington D.C: NAS; 1979. [ Links ]
16. Ranjhan S.K. Sources of feed for ruminant production in Southeast Asia. In: B. J. Blair, D. A. Ivory and T. R. Evans (eds.). Forages in Southeast Asia and South Pacific Agriculture. Proceedings of an international workshop held at Cisarua, Indonesia: ACIAR; 1986. [ Links ]
17. Schultze-Kraft R. Exotic and native legumes for forage production in Southeast Asia. In: G. J. Blair, D. A. Ivory, and T. R. Evans (eds.). Forages in Southeast Asia and South Pacific Agriculture. Proceedings of an international workshop held at Cisarua, Indonesia: ACIAR; 1986. [ Links ]
18. Fahey G, BERGER L. Los carbohidratos en la nutrición de rumiantes. En: Church, D. (editor). El rumiante fisiología digestiva y nutrición. Zaragoza, España: Editorial ACRIBIA, S.A.; 1988. [ Links ]
19. Barahona R, Sánchez S. Limitaciones físicas y químicas de la digestibilidad de pastos tropicales y estrategias para aumentarla. Revista CORPOICA - Ciencia y Tecnología Agropecuarias 2006; 6(1): 69 - 82. [ Links ]
20. Yaremcio B. Nitrate Poisoning and Feeding Nitrate Feeds to Livestock. Alberta Agriculture and Rural Development 1991. (En línea) Julio 1 2008, Disponible en http://www1.agric.gov.ab.ca/$department/deptdocs.nsf/all/agdex851. [ Links ]
21. Fjell D, Blasi D, Towne G. Nitrate and Prussic Acid Toxicity in Forage Causes, Prevention, and Feeding Management. KSTATE 1991;r 1. Publication MF 1018. [ Links ]
22. James L. F, Johnson A. E. Some major plant toxicities of the western United States. JRM 1976; 29 : 356-363. [ Links ]
23. Gomm B. Correlation of Environmental Factors with Nitrate Concentration in Meadow Plants. JRM 1980; 33(3): 223 - 228. [ Links ]
24. Duncan C, Schupp M,. Mckell C. M. Nitrogen Concentration of Grasses in Relation to Temperature. JRM 1969: 430 - 432. [ Links ]
25. McKee, H.S. Nitrogen Metabolism in plants. Oxford University Press 1962: 728. [ Links ]
26. Ray I.M, Sisson W.B. Nitrate reductase activity of Kleingrass (Panicum coloratum L.) during drought in yh norther Chichuahuan desert. JRM 1986; 39(6). [ Links ]
27. Farra P. A,Satter L. D. Manipulation of the Ruminal Fermentation. III. Effect of Nitrate on Ruminal Volatile Fatty Acid Production and Milk Composition. J Dairy Sci 1971; 54: 1182 - 1024. [ Links ]
28. Sar C, Mwenya B, Santoso B, Takaura K et al. Effect of Escherichia coli wild type or its derivative with high nitrite reductase activity on in vitro ruminal methanogenesis and nitrate/nitrite reduction. J Anim Sci 2005; 83(3): 644-652. [ Links ]
29. Bruning -Fann C, Kaneene J. B. The effects of nitrate,nitrite and nitroso compounds on animal health. Vet Hum Toxicol 1993; 35 (3):237-250. [ Links ]
30. El Bahri, L', Belguith J, Blouin A.Toxicology of Nitrates and Nitrites in Livestock. Food Animal practice1997; 19(5): 643-648. [ Links ]