Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista MVZ Córdoba
Print version ISSN 0122-0268On-line version ISSN 1909-0544
Rev.MVZ Cordoba vol.14 no.1 Córdoba Jan./Apr. 2009
ORIGINAL
EVALUACIÓN HISTOLÓGICA DE BIOCOMPATIBILIDAD Y BIOCONDUCCIÓN DEL COMPUESTO HIDROXIAPATITA - LIGNINA IMPLANTADO EN TIBIA DE CONEJOS
HISTOLOGICAL EVALUATION OF THE BIOCOMPATIBILITY AND BIOCONDUCTION OF A HYDROXYAPATITE-LIGNIN COMPOUND INSERTED IN RABBITS’ SHINBONES
Mastoby Martinez M, 1* M.Sc, Andrea Pacheco B, 2 Ph.D, Marlene Vargas V, 2 Ph.D.
1Universidad de Córdoba, Facultad de Medicina Veterinaria y Zootecnia, Departamento de Ciencias Pecuarias, A.A. 354, Montería, Colombia.
2Universidad Federal de Viçosa, Departamento de Veterinaria, CEP 36570-000, Viçosa-MG, Brasil.
*Correspondencia: mastobymvz@hotmail.com
Recibido: Abril 25 de 2008; Aceptado: Enero 28 de 2009
RESUMEN
Objetivo. Evaluar histologicamente la biocompatibilidad y propiedad óseoconductora del compuesto de hidroxiapatita - lignina implantado en tibias de conejos. Material y métodos. Se utilizaron 20 conejos de raza nueva Zelanda, en cada uno, la tibia izquierda fue tratada con el compuesto y la tibia derecha no fue tratada y sirvió como control. Con la ayuda de taladro manual y una broca se realizó un defecto óseo de aproximadamente 4 mm de diámetro en la superficie lateral proximal tibial, hasta alcanzar el canal medular. Dos comprimidos del compuesto (400 mg), se utilizaron para rellenar el defecto. El mismo procedimiento quirúrgico se realizó en el grupo control, sin la utilización del compuesto. Las evaluaciones histológicas se realizaron a los 8, 30, 60, 90 y 120 días postcirugía, para lo que fue necesaria la eutanasia de 4 animales por fecha de evaluación. Resultados. En las evaluaciones de 30, 60, 90 y 120 días se observó una formación ósea más acelerada y extensa en el grupo tratado al compararse las lecturas histológicas con el grupo control. Conclusiones. El compuesto hidroxiapatita-lignina permitió el crecimiento de tejido óseo desde los bordes hasta el centro del defecto a un ritmo de crecimiento mayor, con formación de hueso mas organizado que en el grupo control. Además se observó su integración al tejido óseo; lo que sugiere su biocompatibilidad y propiedad óseoconductora, hecho que permite recomendarlo como substituto.
Palabras clave: Biocompatibilidad, óseo, conducción, integración, hidroxiapatita, lignina.
ABSTRACT
Objective. To evaluate the bio-compatibility and bone-conductivity properties of a hydroxyapatite-lignin compound implanted in rabbit’s shinbone. Material and methods. 20 rabbits (New Zealand race) were used for the experiments. In each animal, the left tibia was treated experimentally whereas the right tibia was used as experimental control. Using a manual drill, we bore a hole approximately 4mm diameter that reached the medullar canal. Each of these was subsequently treated with two tablets of the hydroxyapatite-lignin compound equivalent to 400 mg which were used to fill up the bone damage. The same surgical procedure was performed in the group of control, without using the compound. The histological evaluations were conducted at 8, 30, 60, 90 and 120 days post surgery based on four animals each time. Results. Comparison between experimental and control groups evidenced that at 30, 60, 90 and 120 days post-surgery there was an accelerated bone formation and extensive bone healing in the treated group. Conclusions. The hydroxyapatite-lignin compound allowed the growth of bone tissue from the edges to the center of the bone damage at a higher and more organized rate than in the control group. We also found the hydroxyapatite-lignin compound integrate well into the bone tissue, which -in addition to the observations presented above - allowed us to recommend it as a biocompatible and oseoconductor substitute in the case of bone damage.
Key words: Biocompatibility, bone, conduction, integration, hydroxyapatite, lignin.
INTRODUCCIÓN
Los substitutos óseos deben ser bio-activos, bio-compatibles, bio-degradables o bio-absorbidos, además de favorecer el crecimiento óseo por conducción y si es posible por inducción. Estas características dependen de las propiedades físicas y químicas de los biomateriales, los cuales deben ser compatibles con las reacciones fisiológicas del hueso (1-3). En la actualidad, uno de los biomateriales más investigados es la hidroxiapatita que puede ser obtenida de corales marinos, del propio hueso o sintetizada en laboratorio (4-6). Esta bio-cerámica ha sido utilizada en la corrección de defectos óseos en el hombre y en varias especies animales, con resultados satisfactorios, lo suficiente para ser indicada en la rutina clínica como alternativa en la realización de injertos óseos (7-10).
La superficie porosa de la hidroxiapatita parece proveer un substrato adicional para la proliferación del tejido óseo. Además, permite la unión, proliferación, migración y expresión fenotípica de células óseas, lo que resulta en formación de nuevo hueso en aposición directa al biomaterial (8,10-12). La lignina es un componente de la pared celular de las plantas leñosas que les provee rigidez y actúa como agente permanente de unión entre las células. Es un polímero complejo de elevado peso molecular constituido por unidades de fenilpropano (10,13,14). Un compuesto de hidroxiapatita asociado a la lignina, podría unir la excelente bio-actividad de la primera que no posee cohesión y resistencia suficiente, con las propiedades mecánicas y de adhesión celular de la última (10).
El objetivo del presente trabajo fue evaluar histológicamente la biocompatibilidad y bioconductividad del compuesto de hidroxiapatita (HAP-91) asociada a lignina e implantado en tibias de conejos.
MATERIAL Y MÉTODOS
Animales. Se utilizaron 20 conejos machos de raza Nueva Zelanda, esqueléticamente maduros a la confirmación radiográfica, con edades entre 10 y 12 meses con rango de peso entre 4-5 kg. Los conejos fueron aclimatados durante 2 meses en jaulas individuales, donde recibieron una dosis única de ivermectina 0.2 mL a 1% vía subcutánea, alimento 2 veces al día y agua a voluntad.
Compuesto. La hidroxiapatita sintética (HAP-91®), fue producida por precipitación, después de adicionar fosfato (H3PO4) gota a gota sobre el hidróxido de calcio [Ca(OH)2] obtenido a partir de la calcinación de la calcita (900°C) y su posterior hidratación por agitación constante. El Ca de la HAP-91 fue determinado por volumetría y espectroscopia (1). Después de este proceso, de acuerdo con el fabricante fue adicionado a la HAP-91, 1% de lignina derivada del eucalipto para formar el compuesto de HAP-91 - L. Con este material se obtuvieron bloques circulares de 4.5 mm de diámetro con peso de 200 mg con proporción de 99% de HAP-91 y 1% de lignina, que después fueron esterilizados en oxido de etileno a 10% y embalados en material plástico.
Procedimiento quirúrgico. En el preoperatorio, los animales fueron mantenidos en ayuno hídrico de 12 horas y recibieron 40.000UI/kg de penicilina sódica y procaínica, por vía intramuscular, 30 minutos antes de la inducción anestésica. Después fueron sedados con levopromacina en dosis de 2 mg/kg y anestesiados con tiletamina/zolazepam en dosis de 20 mg/kg, ambos por vía intramuscular. El tercio proximal del fémur hasta el tercio distal de la tibia fueron depilados y la grasa removida con éter.
La anestesia disociativa se complementó con la técnica epidural lumbo-sacra mediante lidocaina al 2% con epinefrina a dosis de 1 mL/4 kg. Los animales fueron posicionados en decúbito lateral izquierdo y preparados de manera aséptica para cirugía. El abordaje quirúrgico se basó en la técnica descrita por Piermattei (15) para perros y gatos y constó de los siguientes tiempos:
1. Incisión cutánea parapatelar lateral del tercio distal del fémur hasta la diáfisis proximal de la tibia.
2. Incisión del tejido subcutáneo y fascia lata en la misma línea que la incisión cutánea.
3. Desbridamiento de la musculatura cráneo-lateral de la tibia y separación caudal de la misma.
4. Incisión del periostio en la superficie lateral de la porción proximal de la tibia extendiéndose hasta el final de la cresta tibial.
Posteriormente se realizó en todos los animales un defecto circular de profundidad suficiente para alcanzar el canal medular en la parte central de la faceta lateral proximal de la tibia, a 2 cm de la meseta tibial. El defecto de aproximadamente 4 mm de diámetro, se consiguió con el auxilio de un taladro manual y broca de igual diámetro.
En cada animal se consideró la tibia izquierda como experimental y la tibia derecha como control. En el defecto cortical del grupo experimental se introdujeron mediante presión digital, dos comprimidos del compuesto (400 mg) y seguidamente los tejidos separados fueron suturados. Las tibias del grupo control fueron sometidas al mismo procedimiento a excepción de la introducción del compuesto de HAP-91 - L en el defecto cortical. En su lugar los defectos fueron ocupados por los coágulos que se formaron durante la cirugía.
En el posoperatorio los animales recibieron morfina 3 mg/kg/12h/2días/sc y 40.000 UI/kg/24h/2días/im de penicilina sódica y procaínica. Las heridas fueron curadas con alcohol iodado por 10 días.
Estudios histologicos. Para los estudios histológicos a los 8, 30, 60, 90 y 120 días posteriores a las cirugías, fue necesario la eutanasia de 4 conejos por fecha de evaluación con sobredosis de tiopental sódico por vía intravenosa, previa tranquilización con levopromacina por vía intramuscular.
Para el análisis histológico, fue removido de cada tibia tratada y control, un bloque de 2 cm de ancho y 0.5 cm de largo conteniendo en el centro, el local del defecto. Las muestras se fijaron en formol al 10% tamponado por 20 días. Una vez completa la fijación, las muestras se descalcificaron en ácido fórmico al 10% tamponado con citrato de sodio para pH 4,5 bajo vacio moderado por 25 días. Luego, las muestras fueron lavadas con agua corriente y deshidratadas en alcohol etílico a 70, 80, 90 y 100% durante 24 h., en cada etapa. Después, fueron diafanizadas en 2 baños de xilol por 30 min., cada una e inmersas en parafina en estufa a 58°C por 1 h. Posteriormente, se realizaron cortes de 7 µm mediante micrótomo rotativo y montadas en láminas de vidrio. De cada bloque de parafina fueron obtenidos por lo menos dos cortes histológicos, que se sometieron a las técnicas de coloración con hematoxilina-eosina y tricrómico de Gomori, para posterior observación con microscopio óptico.
Los resultados histológicos fueron interpretados y presentados por análisis descriptivo; donde se evaluó la regeneración tisular con base en la proliferación y diferenciación celular en el tejido cicatrizal, de neoformación ósea, integración del compuesto al nuevo hueso y de maduración del hueso neoformado, regeneración de la medula ósea y la fagocitosis del compuesto experimentado.
RESULTADOS
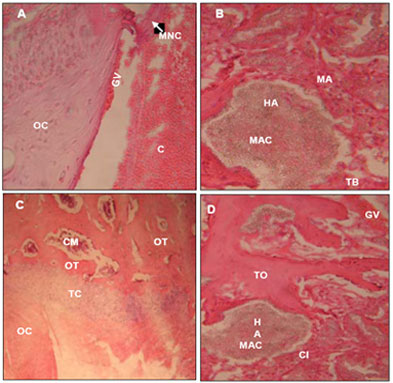
Los sitios de los defectos óseos quirúrgicamente inducidos en ambos grupos de tibias, no presentaron evidencias de infección posquirúrgica. Además, en el grupo experimental no se observó reacción al compuesto. En el octavo día posoperatorio en el grupo control, fue observado reabsorción de los bordes del defecto y presencia de tejido conjuntivo desorganizado en su superficie, y en el centro; extravasación de eritrocitos y fibrina, proliferación de fibroblastos y formación de capilares predominantes en el área hemorrágica con tejido de granulación. También se evidenciaron matriz no calcificada y el inicio de formación de trabéculas con migración de células osteogénicas y muchos capilares. Además, escasos osteocitos y conductos óseos (Havers) revestidos por endostio que caracterizó un proceso normal de regeneración ósea (Figura 1A).
Figura 1. Fotomicrografías de regiones del defecto cortical realizado en tibias de conejos. A- Grupo control a los 8 días post cirugía. Se nota inicio de formación de hueso trabecular con adherencia de glóbulos rojos. HE, 40x. B- Grupo tratado con HAP-91®-L a los 8 días post cirugía. Se nota material amorfo al rededor de la HAP-91-L como también material acidófilo en su localización. HE, 40x. C- Grupo control a los 30 días post cirugía. Se nota un proceso de osificación endocondral. HE, 20x. D- Grupo tratado con HAP-91®-L a los 30 días post cirugía. Se notan células indiferenciadas al rededor de la HAP-91-L. HE, 40X. C: coágulo, CI: células indiferenciadas, CM: cavidad medular, GV: glóbulos rojos, E: endostio, HA: compuesto de hidroxiapatita y lignina, MA: material amorfo, MAC: material acidófilo, MNC: material no calcificado, OC: hueso compacto, OT: hueso trabecular, TB: tejido blástico, TC: tejido condroíde, TO: tejido osteoíde.
En el grupo experimental, a los 8 días posoperatorio se observó la presencia de una masa amorfa que llenó el defecto y que fragmentó al compuesto de HAP-91-L. Se observaron fibroblastos alrededor del compuesto, localizados en la parte central de la lesión con poca extravasación de eritrocitos y presencia de tejido adiposo. Además, en los bordes de la lesión no se observó crecimiento de tejido óseo (Figura 1B).
A los 30 días posoperatorio, las tibias de ambos grupos mostraron tejido óseo trabecular que llenó parcialmente la falla ósea. En el grupo control, se observaron reabsorción de los bordes del defecto y en su centro tejido condroíde, colágeno y fibroblastos con formación de tejido osteoíde caracterizado por gran actividad de osteoblastos y menor cantidad de osteocitos, además trabéculas óseas espesas (Figura 1D), que formaron cavidades medulares revestidas por endostio con presencia de osteoblastos y tejido adiposo. El hueso trabecular estaba en contacto con el hueso compacto en los bordes de la lesión, característico de un proceso normal de reparación.
En el grupo experimental, a los 30 días posoperatorio se observó un proceso regenerativo muy activo, caracterizado por reabsorción de los bordes del defecto y en su centro presencia de osteoblastos y formación de capilares y células indiferenciadas que englobaron y contenían al compuesto de apariencia granular y con tendencia a colorearse de rosado (Figura 1D); no se visualizaron osteoclastos.
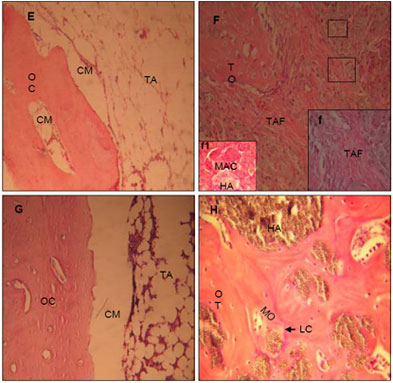
A los 60 días postoperatorio, tanto en el grupo control como en el experimental, se observó una extensa formación ósea que continuó más acentuada en el segundo grupo. En esta fecha, el tejido óseo formado en el grupo experimental presentó, en algunos animales, características de hueso compacto lamelar con ostiones bien definidos y actividad celular presente, además, tejido conectivo y escaso tejido adiposo. Algunas partículas de HAP91-L fueron circundadas por tejido óseo trabecular, probablemente debido a su propiedad óseoconductora.
En algunas muestras a los 60 días posoperatorios se observó tejido osteoíde y presencia de un material amorfo de aspecto fibrilar (Figura 2F-f) con depósitos de matriz ósea, lo que dio la impresión de actuar como señalizador de la misma. En algunos locales de la HAP-91-L se visualizó material acidófilo (Figura 2F-f1) que tal vez fue matriz orgánica no mineralizada y vascularizada. En algunos campos se observó formación de hueso con ostiones primarios y secundarios, así como también, hueso trabecular en contacto directo con hueso compacto.
Figura 2. Fotomicrografías de regiones del defecto cortical realizado en tibias de conejos. E- Grupo control a los 60 días post cirugía. HE, 10x. F- Grupo tratado con HAP-91-L a los 60 días post cirugía, f-f1- Detalle del área demarcada en F. Se nota en f material amorfo de aspecto fibrilar y en f1 se nota HAP-91-L con material acidófilo. HE, 40x (F), 40x (f1) e 100x (f). G- Grupo control a los 90 días post cirugía. HE, 20x. H- Grupo tratado con HAP-91-L a los 90 días post cirugía. HE, 40x. CG: CM: cavidad medular, E: endostio, HA: compuesto de hidroxiapatita y lignina, LC: línea cimentante, MA: matriz acidófila, MO: matriz ósea, OC: hueso compacto, OT: hueso trabecular, TA: tejido adiposo, TAF: tejido de aspecto fibrilar, TO: tejido osteoíde.
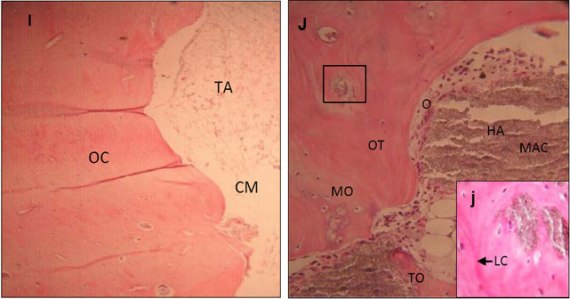
A los 90 y 120 días posoperatorios, en ambos grupos se apreció una formación ósea más extensa que la observada a los 60 días posoperatorios. Esto fue más evidente en el grupo experimental.
En el grupo control dentro del defecto se observó formación de tejido óseo trabecular y un espacio visible entre el hueso compacto y el hueso neoformado que estaba ocupado por tejido adiposo (Figuras 2G y 3I). En los defectos del grupo experimental se observó, hueso compacto caracterizado por gran cantidad de trabéculas óseas maduras y espesas interconectadas con el hueso periférico, cavidades medulares de menor tamaño revestidas por endostio que contenía tejido adiposo, eritrocitos y depósitos de HAP-91-L (Figuras 2H y 3J-j).
Figura 3. Fotomicrografías de regiones del defecto cortical realizado en tibias de conejos. I- Grupo control a los 120 días post cirugía. HE, 10x. J- Grupo tratado con HAP-91-L a los 120 días post cirugía. j- Detalle del área demarcada en J. Se nota actividad osteoblástica al rededor de la HAP-91®-L con material acidófilo. HE, 20x e 40x respectivamente. CM: cavidad medular, HA: compuesto de hidroxiapatita y lignina, LC: línea cimentante, MAC: material acidófilo, MO: matriz ósea, O: osteoblasto, OC: hueso compacto, OT: hueso trabecular, TA: tejido adiposo, TO: tejido osteoíde.
DISCUSIÓN
La presencia de hidroxiapatita en el defecto cortical tibial se caracterizó histologicamente por la presencia de un material refringente, amorfo, acelular, bien delimitado y sin afinidad por el colorante utilizado (Hematoxilina y Eosina), semejante a lo reportado por Borges (1), Vital et al (10) y Vital (14).
Al comparar a los 8 días el proceso regenerativo entre los grupos, el experimental presentó atraso cuando fue comparado con el control; el cual se pudo deber a la inhibición inicial de la formación ósea por el compuesto, que probablemente actuó como cuerpo extraño, descrito previamente por Borges (1), Vital et al (10) y Duarte (16) o tal vez a una probable inhibición mecánica ejercida sobre los bordes de la lesión. Este hallazgo difiere de lo reportado por Tampiere et al (17), quienes observaron presencia de hueso nuevo alrededor y en el interior de la hidroxiapatita. Además, Vital et al (10) observaron intensa formación ósea con vestigio de cartílago que fue substituido por tejido conjuntivo. En investigación realizada por Franco et al (7), donde utilizaron hidroxiapatita asociada a liposoma, se observó a los 8 días, formación de hueso trabecular alrededor del implante, con numerosos osteoblastos en la superficie trabecular.
A los 30 días postcirugía, los animales de ambos grupos mostraron tejido óseo trabecular que llenó parcialmente la falla ósea. Estas observaciones están de acuerdo con lo descrito por Borges (1), Franco et al (7), Vital et al (10) y Duarte (16) quienes observaron un proceso de reparación activo caracterizado por la formación de trabéculas óseas y sistemas de Havers. Sin embargo, la formación ósea fue más evidente en el grupo experimental que en el grupo control, en el que se evidenciaron trabéculas más espesas con cavidades medulares amplias y sistemas Haversianos más organizados, hecho que confirma lo descrito por otros autores (1, 10, 18 -20), que también indican la característica óseo-conductiva de la hidroxiapatita, que sugiere un proceso de reparación ósea más avanzado.
A los 60, 90 y 120 días posoperatorios, la regeneración ósea continuó más avanzada en el grupo experimental que en el grupo control, semejante a lo descrito por Vital et al (14) y diferente de lo observado por Franco et al (7) y Onishi (21) quienes no observaron diferencias marcadas en la formación ósea de los dos grupos, lo que sugiere que el proceso de reparación fue completo a los 60 días.
Al día 120 de evaluación aun se observó presencia del compuesto en las fallas óseas tibiales (Figura 2f-f1), a diferencia del reporte de Duarte (16) quien observó presencia del implante hasta el día 60. Esta diferencia puede ser explicada por el hecho que en el trabajo supracitado, el autor usó hueso alveolar como modelo experimental, el cual tiene un metabolismo celular más intenso que en la tibia, lo que tal vez explica el hecho de una absorción más rápida del implante.
Durante la evolución del experimento, se observó disminución de la cantidad de HAP-91-L, que también fue reportado por Borges (1) y Vital et al (14). Además, no se presentó cierre completo de la falla en ninguno de los defectos corticales en ambos grupos. Sin embargo, se puede presumir que en el experimental, el proceso regenerativo fue más avanzado y hubo más formación de tejido óseo que en el control.
En el presente experimento no se observó presencia de partículas en el interior de macrófagos, a pesar de estos haber sido visualizados en gran número, este hallazgo; fue semejante a lo observado por Vital et al (14) y diferente de lo reportado por Borges (1), Jarcho (22), Bloebaum et al (23), Benahmed et al (24) y Frayssinet et al (25). Este hecho no descarta la bio-degradación del implante cerámico por la vía fagocitaria, que fue observada por Borges (1). Además, las controversias relacionadas a la bio-degradación de la hidroxiapatita encontrada en varios experimentos pueden ser justificadas por la diferencia de las características físicas de los tipos de hidroxiapatita empleados en cada estudio (10, 17, 26 - 28).
Aunque en la presencia de HAP-91-L la respuesta ósea haya sido más evidente durante los 30, 60, 90 y 120 días de posoperatorio, el tiempo necesario para la regeneración ósea fue el mismo tanto para el grupo control como en el experimental. Este hecho está de acuerdo con la observación de Franco et al (7) y Vital et al (10), y es indicativo de la característica óseo-conductora de la hidroxiapatita que es capaz de guiar el crecimiento de tejido nuevo, incluso hasta el canal medular.
Un hallazgo en las muestras del grupo control fue la tendencia de separación del tejido óseo nuevo del hueso compacto en algunos sitios. Esta observación no se dio en las muestras del grupo experimental, semejante a lo reportado por Carlo (29), quien evaluó polihidroxibutirato asociado a hidroxiapatita en diferentes concentraciones y observó que existía más integración del compuesto al tejido óseo cuando trabajó con mayores concentraciones de HAP-91.
En ninguna de las evaluaciones del experimento en el grupo experimental, se evidenció cambio en el tejido fuera de los parámetros normales de respuesta ósea, ni áreas de osteonecrosis circundando al compuesto, situación que coincide con los resultados obtenidos por otros investigadores (10,16), pero que difiere con los resultados de Borges (1), quien reportó transformación de tipo sarcomatoso del periostio, necrosis ósea con desintegración de la matriz e intensa actividad osteoclástica en las áreas de implantación de la HAP-91.
Con base en los resultados histológicos se puede concluir que la hidroxiapatita asociada a lignina se muestra biocompatible, óseoconductora y favorece la oseointegración; por lo que podría ser un substituto óseo eficiente.
Agradecimientos
Al laboratorio JHS por proporcionar el compuesto experimentado, a la Universidad de Córdoba - Colombia y a la Universidad Federal de Viçosa - Brasil. Esta investigación de tipo descriptiva fue aprobada por la comisión de ética del Departamento de Veterinaria de la UFV (proceso N° 58/2007).
REFERENCIAS
1. Borges, A.P.B. O efeito da hidroxiapatita sintética na regeneração óssea de defeito provocado experimentalmente no terço proximal da tíbia, de cães (Canis familiares). Estudo clínico-cirúrgico, radiológico e histológico por microscopia de luz e microscopia eletrônica de retrodispersão. [Tese Doutoral]. Belo horizonte, Brasil: Universidade Federal de Minas Gerais, Departamento de Medicina Veterinária, Escola de veterinária da UFMG; 1998. [ Links ]
2. Fehlberg, A.F. Hidroxiapatita sintética na regeneração da falha óssea provocada em fratura completa de terço intermédio de tíbia imobilizada pela fixação percutânea em cães. [Tese Mestrado]. Viçosa, MG, Brasil Universidade Federal de Viçosa, Departamento de Medicina Veterinária; 2001. [ Links ]
3. Monchau F, Lefèvre A, Descamps M et al. In Vitro studies of human and rat osteoclast activity on tricalcium phosphate, calcium carbonate. J Biomolecular Eng 2002; 19 (269): 143-152. [ Links ]
4. Hemmerlé J, Cuisinier G, Schultz P, Voegel C. Study of biological crystal growth mechanisms in the vicinity of implanted synthetic hydroxyapatite crystals. J Dental Res 1997; 76 (2): 682-687. [ Links ]
5. Ayers R, Simske S, Nunes C, Wolford L. Longterm bone ingrowth an Residual microhardness of porous block hydroxyapatite implants in humans. J Oral Maxilofac Surg 1998; 56 (6): 297-1301. [ Links ]
6. Bostrom MP. Expression of bone morphogenetic proteins in fracture healing. J Clinic Orthop 1998; 335: 116-123. [ Links ]
7. Franco KL, Borges APB; Vilória MIV et al. Hidroxiapatita sintética pura, hidroxiapatita associada ao colágeno e hidroxiapatita sintética associada ao lipossoma como substitutos ósseos em defeitos provocados na tíbia de cães: aspectos da osteointegração à microscopia de luz transmitida. Arq Bras Med Vet Zootec 2001; 53: 431-436. [ Links ]
8. Legeros RZ. Properties of osteoconductive biomaterials: calcium phosphates. Clin Orthop Res 2002; 395: 81-98. [ Links ]
9. Pérez á, Ortega V et al. Implante óseo de la espuma de hidroxiapatita-09 Estudio experimental en conejos. Rev Esp Patología 2005; 38 (1): 14-20. [ Links ]
10. Vital CC, Borges APB, Fonseca CC et al. Biocompatibilidade e comportamento de compósitos de hidroxiapatita em falha óssea na ulna de coelhos. Arq Bras Med Vet Zootec 2006; 58 (2): 175-183. [ Links ]
11. VidigaL JGM, Goisman M. Osseointegração x biointegração: uma análise crítica. Ver Bras Odontol 1997; 4: 54. [ Links ]
12. Sakano H, Koshino T, Takeuchi R et al. Treatment of the instable distal radius fracture with external fixation and a hydroxyapatite spacer. J H Surg 2001; 26: 923-929. [ Links ]
13. Sjöström E. Wood chemistry: fundamentals and applications. San Diego, Academic Press, 293p, 1993. [ Links ]
14. Vital CC. Hidroxiapatita sólida associada ao carbono e associada ao carbono e fosfato biácido de sódio como substituto em falha óssea na ulna de coelhos. [Monografia Especialização]. Viçosa-MG: Universidade Federal de Viçosa, 2003. [ Links ]
15. Piermattei DL, Flo GL, Decampo CE. Handbook of Small Animal Orthopedics and Fracture Repair, Missour, Saunders Elsevier, 2006, p. 139-140. [ Links ]
16. Duarte TS. Osseointegração da hidroxiapatita sintética no processo alveolar da mandíbula de cães. [Tese Mestrado]. Viçosa, MG, Brasil: Universidade Federal de Viçosa; 2003. [ Links ]
17. Tampiere A, Celloti.G, Sprio S, Delcogliano A, Ranzese S. Porosity-graded hydroxyapatite ceramics to replace natural bone. J Biomaterials 2001; 22 (11): 1365- 1370. [ Links ]
18. López SA, Val BJ, Gonzalo OJ, Gorrochategui SI Buelta C L. La influencia del revestimiento de hidroxiapatita y biovidrio en la oseointagración de implantes de titanio. Rev Ortop y Traumatol 1997; 41: 173-181. [ Links ]
19. Pollick S, Shors EC, Holmes RE et al. Bone formation and implant degradation of coralline porous ceramics placed in bone and ectopic sites. J Maxillofac Surg 1995; 53: 915-922. [ Links ]
20. Yasunaga T, Matsusue Y, Furukawa T et al. Bonding behavior of ultrahigh strength unsintered hydroxiapatite particles/poly (L-lactide) composites to surface of tibial cortex in rabbits. Bioceramics 1999; 9: 391-394. [ Links ]
21. Onishi H, Kushitani S, Yasukawa E et al. Particulate bioglass compared with hydroxiapatite as a bone graft substitute. J Clinic Orthop Res 1997; 334: 316-325. [ Links ]
22. Jarcho M. Calcium phosphate ceramics as hear tissue prosthetics. Clinic Orthop 1981; 157: 259-278. [ Links ]
23. Bloebaum RD, Beeks D, Dorr ID, Savory CG, Dupont JA e Hofman AA. Complications with hydroxiapatite particulate separation in total hip arthroplasty. J Clinic Orthop 1994; 298: 19-26. [ Links ]
24. Benahmed M, Heyman D, Berreur M, Cottrel M, Godard A, Daculs GE, Pradal G. Ultraestructural study of degradation of calcium phosphate ceramic hy munan monocytes and modulation of this activity by HILDA/LIF cytokine. J Histochem 2005; 4: 1131-1140. [ Links ]
25. Frayssinet P, Vidalain J, Ranz X, Cartillier JE, Rouquet N. Hydroxiapatite particle migration. J Orthop Surg Traumatol 1999; 9: 95-98. [ Links ]
26. Parks J. and Lakes R. Biomaterials: an introduction. New York, Plenum PRESS 1992; 212-216. [ Links ]
27. Ratner B e Hoffman A. An introduction to materials in medicine. Biomaterials Sc Academic Press 1996; 473. [ Links ]
28. Geesink R, De Groot K, Klein CP. Boding of bone to apatite-coated implants. J Bone Joint Surg Br 1998; 70: 17-22. [ Links ]
29. Carlo EC. Compósitos de hidroxiapatita e polihidroxibutirato em defeitos ósseos experimentais na ulna de coelhos. [Tese Mestrado]. Viçosa, MG, Brasil: Universidade Federal de Viçosa, Departamento de Medicina Veterinária: 2007. [ Links ]