Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista MVZ Córdoba
Print version ISSN 0122-0268On-line version ISSN 1909-0544
Rev.MVZ Cordoba vol.14 no.2 Córdoba May/Aug. 2009
ORIGINAL
INMUNOGENICIDAD DE LA PROTEÍNA RECOMBINANTE ASP1R DE Ancylostoma caninum EN UN MODELO MURINO
IMMUNOGENICITY OF THE PROTEIN RECOMBINANT ASP1R OF A caninum IN A MURINE MODEL
María Giraldo G, M.Sc, Jhon C Castaño O, Ph.D.
Universidad del Quindío, Facultad Ciencias de la Salud, Grupo de Inmunología Molecular, Armenia, Quindio, Colombia. Correspondencia:
*Correspondencia: gymol@uniquindio.edu.co
Recibido: Mayo 15 de 2009; Aceptado: Agosto 19 de 2009
RESUMEN
Objetivo. Construir un plásmido recombinante que exprese la proteína ASP1r de Ancylostoma caninum y evaluar su capacidad inmunogénica en un modelo murino. Materiales y métodos. Se realizó extracción de ARN de parásitos adultos de Ancylostoma caninum, se amplificó por RT-PCR el gen de la proteína ASP1. Este gen fue insertado en el vector pcDNA3. El inserto fue digerido con Bamh1 y EcoR1 y clonado direccionalmente. Posteriormente, se llevó a cabo transformación y selección de las células de E. coli DH5a competentes con el producto de la ligación. Se realizó un tamizaje por PCR confirmando la presencia del gen ASP1. El vector pcDNA3-ASP1 fue administrado vía intraglandular en la parotida e intramuscular en ratones Balb/c. En estos animales se les realizó determinación de anticuerpos en suero y saliva mediante las técnicas de ELISA e inmunohistoquímica. Resultados. Se determinó que el plásmido pcDNA3-ASP1 fue incorporado y expresado células E. coli DH5a. Este plásmido recombinante indujo la producción de anticuerpos Anti-ASP1 específicos en ratones Balb/c. Conclusiones. Se logró demostrar que la utilización de pcDNA3-ASP1 no produjo reacciones desfavorables en ratones Balb/c, además indujo respuesta humoral contra la proteína pcDNA3-ASP1 de excreción/secreción de Ancylostoma caninum en ratones.
Palabras clave: Ancylostoma caninum, proteína ASP1, inmunohistoquímica, vacunas, ADN, clonación.
ABSTRACT
Objective. To construct a recombinant plasmid expressing the ASP1r protein of A. caninum and evaluate its immunogenic capacity in a murine model. Materials and methods. RNA of adults of Ancylostoma caninum was amplified by reverse transcription polymerase chain reaction. The ASP1 protein gene was inserted into the pcDNA3 vector. Plasmid was digested with Bamh1 and EcoR1 and cloning was performed directionally. Later a transformation and selection of E. coli DH5a cell competent with the product for the ligation was made. Then, a screening by PCR was carried out to confirm the presence of ASP1 gene. PcDNA3-ASP1 was inoculated by intraglandular parotide and intramuscular route in Balb/c mice. Antibodies in these animals was measured in serum and saliva by ELISA and immunochemistry. Results. PcDNA3-ASP1 was incorporated and expressed in E. coli DH5a cell. This recombinant plásmid was able to produce antibodies anti-ASP1 specific in Balb/c mice. Discussion. It was possible to demonstrate that using of pcDNA3-ASP1 did not display reactogenicity and it did not produce unfavorable reactions, futhermore, it induced a humoral response against the excreción/secretion protein of Ancylostoma caninum in mice.
Key words: Ancylostoma caninum, ASP1 protein, immunohistochemistry, DNA vaccines, Cloning Molecular.
INTRODUCCIÓN
Ancylostoma spp, es un helminto redondo que se localiza en el intestino delgado de perros, y otros carnívoros silvestres. Dentro de esta familia se distinguen tres especies de importancia: A. braziliense, A. caninum y A. tubaeforme, los cuales se caracterizan por su hematófagia. A. caninum macho miden de 11 a 13 mm y la hembra de 14 a 20 mm (1).
Presentan un ciclo de vida directo, teniendo dos vías de entrada al hospedero: la más frecuente es la ingestión de la larva (L3) encapsulada; la segunda en orden de importancia, es por penetración a través de la piel, también se transmiten por ingestión de L3 presentes en la leche materna. Después de ingresar, la L3 se transporta rápidamente al intestino, por vía sanguínea, ingresa a los pulmones y luego continúa hacia la tráquea.
El principal signo de la infección por los ancilostómidos es la anemia (1). En el humano y en el perro en la forma crónica se presenta emaciación, pérdida del apetito y debilitamiento. También, se presenta diarrea ligera y heces oscuras, algunas veces teñidas con sangre. En infecciones masivas produce edema en las partes bajas del cuerpo y la piel de estas áreas puede ulcerarse. En las últimas etapas puede presentarse epistaxis y el índice de coagulación sanguínea baja. La reacción intensa que manifiestan los animales a la superinfección consiste en hemorragias del intestino delgado, reacción vesicular grave y, a veces, desprendimiento de tejido necrótico.
Las larvas infectivas L3 de A. caninum cuando se cultivan in vitro en condiciones favorables liberan dos proteínas secretorias ricas en cisteina (CRISPs), las cuales son conocidas como proteínas de secreción/excreción ASP-1 y ASP-2 (2,3). Por otro lado, estas larvas cuando son incubadas bajo condiciones de un probable hospedero en cultivos de tejido liberan continuamente ASP1 y ASP2 en cantidades pequeñas, pero cuando este medio es suplementado con fracciones de suero del hospedero y análogos de glutatión, la larva L3 experimenta un cambio fenotípico caracterizado por la adaptación al medio (2-6).
Este fenómeno coincide con la liberación de ASP1 Y ASP2, las cuales son moléculas predominantemente producidas por L3 in vitro (2,7). La larva L3 de A. caninum también libera menor cantidad de macromoléculas adicionales bajo esas condiciones incluyendo una metaloproteasa de zinc las cuales podrían ser utilizadas como posibles blancos terapeuticos (8,9).
La función de la ASPs de las larvas no están bien definidas aunque, han sido descritas en otros nemátodos, incluyendo parásitos de animales y plantas (4,10-11). Las ASPs exhiben propiedades angiogénicas que son importantes durante la transición del estadio larval de forma libre en el suelo lo que facilita su ingreso al hospedero mamífero (2, 12) y posee homología con regiones de aminoácidos de alergénos del veneno del reptil vestid (2-3), sugiriendo que estas ASP pueden tener un papel importante en la patogénesis de infecciones causadas por nemátodos en animales y humanos (13). Sin embargo, esto puede ser dispuesto por la presencia de al menos 17 genes diferentes relacionados a ASPs encontrados en el nematodo de vida libre Caenorhabditis elegans (3), proponiendo que la familia de proteínas ASP cumplen un papel importante en la biología y no en el parasitismo.
Las ASPs son de interés terapéutico por que tienen potencialidad como candidato vacunal contra infecciones por nemátodos en humanos y animales (13,14). Además han demostrado ser inmunodominantes y por lo tanto son fácilmente reconocidos por el sistema inmune de los rumiantes vacunados con ASPs y retados con larvas L3 (15,16). Las ASPs recombinantes de Larvas L3 y producidas naturalmente son antígenos efectivos para vacunas establecidos en modelos animales de laboratorio probados con L3 de A. caninum (17-19), Haemonchus contortus (20), Brugia Malawi (21) y Onchocerca volvulus (22). Similarmente, las ASPs aisladas de H. contortus adultos han demostrado ser altamente efectivos en la protección de ovejas contra infecciones (23-26).
Hasta el momento no hay reportes en la literatura de la utilización de vacunas de ácidos nucleicos desnudos con los genes de las proteínas ASP1 de A. caninum, por ello, el objetivo del presente trabajo fue construir un sistema de expresión plasmídico recombinante con pcDNA3 para expresar la proteína ASP1 de A. caninum, evaluando su capacidad inmunogénica en un modelo murino
MATERIALES Y MÉTODOS
Animales. Se utilizaron ratones Balb/c endocriados del bioterio de la Universidad Nacional de Colombia (Bogotá) libres de infecciones por helmintos verificada por examen coprológico. Los ratones se mantuvieron en la unidad de experimentación animal del CIBM-UQ, siguiendo las normas de utilización de animales de la convención de Helsinki. En el estudio se utilizó un total de 16 ratones hembras de 20 gramos distribuidos en 3 grupos para los estudios de inmunización.
El proyecto y los procedimientos del mismo fueron aprobados por el comité de bioética de la facultad de ciencias de la salud de la Universidad del Quindío.
Parásitos: Obtención de larvas L3 y adultos de A. caninum y preparación de productos de excreción / secreción. Las larvas L3 y adultos fueron obtenidos de intestinos delgado de perros sacrificados en el centro de zoonosis de la ciudad de Armenia dentro del programa de control de animales callejeros y/o terminales, siguiendo las normas estipuladas para estos procedimientos por la sociedad protectora de animales.
Los intestinos se transportaron al laboratorio en solución salina estéril en una nevera a 4°C, una vez en el laboratorio se disecaron y se tomaron las larvas de aquellos que estaban parasitados, después se lavaron con PBS varias veces y fueron cultivadas en 1000 ml de RPMI 1640( Gibco, USA), suplementado con 25 mM HEPES, 100 U/ml de penicilina y 100 mg/ml de estreptomicina y se incubaron a 37°C por 15 horas. Posteriormente se filtró la suspensión en un filtro de policarbonato de 0.2 µm. (Nucleopore.Inc, Cambridge, USA), finalmente la suspensión se concentró por medio de evaporación y se guardó igual que los ancylostomas a -70°C hasta su uso.
Extracción de ARN. La extracción de ARN se realizó a partir de una suspensión de larvas L3 y adultos de A. caninum las cuales se maceraron; la extracción total del ARN de las L3 se realizó con el kit comercial de extracción SV isolation Promega®.
RT-PCR. A partir de ARN obtenido de larvas L3, se realizó el procedimiento de retrotranscripcion y PCR en un sólo paso, mediante el kit comercial de Promega ®.
Las secuencias de iniciadores fueron las siguientes: ASP1:
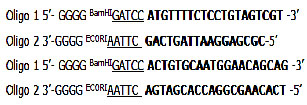
Los Primers se diseñaron utilizando el programa Primer-3 y genruner, usando la secuencia para ASP1 de A. caninum reportada en el Gen Bank (AF132291). Se utilizó la siguiente mezcla para un volumen final de 50µl: Tampón 10 X, dNTPs 100 µM, 2.5 mM cloruro de magnesio, cebadores 0.2µM, 1U Taq polimerasa (Invitrogen,Carlsbad,Ca,USA). Con el siguiente ciclo térmico: Un ciclo de 37°C/50 min para Rt, predenaturación 95°C x 5 min y 35 ciclos de denaturación 94°C x 45 seg, templado 49°C x 1 min, extensión 72°C x 1:30 min, y una extensión final a 72°C x 10 min.
Los productos de amplificación se verificaron por electroforésis en gel de agarosa al 1% (p/v) teñido con 1µl de bromuro de etidio al 0.0004% (v/v) y visualizado en transiluminación con luz ultravioleta. Se consideró como amplificación positivas para A. caninum la visualización de una única banda de 1079 pb para ASP1.
Clonaje de los fragmentos amplificados usando el Plásmido pcDNA3. El clonaje del producto de RT-PCR de ASP1 se hizo directamente en el plásmido pcDNA3 (Invitrogen,Carlsbad,Ca,USA) con la enzima T4 ADN ligasa (Promega, Madison, WI, USA), realizando la reacción con el plásmido y el inserto previamente digeridos con las enzimas de restricción BamH1 (Promega, Madison, WI, USA) y ECOR1 (Promega, Madison, WI, USA), obteniendo un clonaje direccional con los dos fragmentos adherentes.
Transformación de células de E. coli DH5a con plásmido-inserto. El crecimiento bacteriano de la cepa DH5 a de E. coli se realizó en medio LB (Oxoid,Lenexa,Ks,USA) sin ampicilina y posteriormente se trató con CaCl2 (Sigma,St.Louis,MO,USA) para obtener células competentes (27). Se realizó la transformación y se incubó a 37°C con agitación por 1.5 horas, luego se sembraron 100µl de esta solución con células en LB-agar (1.5%)- ampicilina a una concentración de 50ug/ml (Invitrogen, Carlsbad,Ca,USA) y se incubó toda la noche a 37°C.
Selección de las colonias de E. coli DH5a recombinantes y purificación del plásmido recombinante. El primer tamizaje de las colonias se hizo mediante la presión de selección de la ampicilina presente en los platos de cultivo, se cultivaron en medio líquido LB-ampicilina a 37°C y se realizó la purificación de los plásmidos por lisis osmótica con H20d y choque térmico a 100°C por 2 min, luego se procedió a centrifugar a 14.000 g por 1 min para recuperar el sobrenadante. A partir de esta purificación se realizó un tamizaje secundario por PCR usando los cebadores con que se realizó la amplificación primaria, buscando la presencia del gen de ASP1. Las colonias seleccionadas como positivas por PCR se repicaron a 15 ml de medio LB/ampicilina 50µg/ml y se incubaron a 37°C toda la noche, posteriormente se cosechó y se purificó el plásmido PcDNA3 con el inserto ASP1 mediante el método de lisis alcalina y limpieza con PEG 8000 (27).
La determinación de la concentración y pureza del ADN plásmidico se hizo mediante espectrofotometría a 260 y 280 nm. Posteriormente se procedió a eliminar las endotoxinas con el Kit removal endotoxin (Sigma, USA) siguiendo las especificaciones del fabricante.
Inmunización intramuscular e intraglandular de ratones (Balb/c endocriados) con pcDNA3-ASP1. 3 grupos de ratones de 20 gramos se inocularon en la glandula parotida y vía intramuscular con 2 dosis a intervalos de 15 días con 50 µl de suspensión de pcDNA3-ASP1(50µg/ml) en solución salina libre de pirógenos. Se formaron los grupos 1 inoculado intramuscular con pcDNA3-ASP1, grupo 2 intraglandular con pcDNA3-ASP1 y el grupo control con pcDNA3 resuspendido en solución salina libre de pirógenos.
Obtención de muestras de saliva y sangre de los ratones inmunizados. Previa a cada inoculación se tomaron muestras de sangre así: días 1, 15, 30; se indujo la salivación con pilocarpina 5% 40 µl por ratón. Después de 5 min de inyectar intraperitonealmente la pilocarpina, se procedió a la obtención de muestras de saliva con el objetivo de determinar la presencia de anticuerpos contra el antígeno de A. caninum mediante ELISA.
Determinación de anticuerpos en sangre y saliva mediante ELISA de los animales inmunizados. Para determinar la presencia de anticuerpos murinos séricos y en saliva contra la proteína ASP1 de A. caninum se diseñó la siguiente ELISA. Los pozos de placas maxisorpTM se recubrieron con 100 µl de solución a 5 µg/ml del antígeno en buffer de recubrimiento pH 9.6 (Na2CO3: 0.159 g/100 ml, NaHCO3:0.293 g/100ml) se incubaron a 37°C por 2 horas al cabo de las cuales se realizaron 3 lavados con PBS-Tween 20 (0.05% v/v), posteriormente se adicionaron 300 µl de solución de bloqueo con albúmina sérica bovina(Sigma,St.Louis,MO,USA) al 1% (p/v), al cabo de dos horas se lavó varias veces, luego se adicionaron 100 µl las muestras a una dilución de 1:20 para la saliva y 1:50 para los sueros en PBS-tween 20 (0.05% v/v).
Se incubó la placa en cámara húmeda a 37°C por 2 horas , luego se realizaron 3 lavados con PBS -Tween20 (0.05% v/v). Posteriormente se añadieron 100 µl de solución de conjugado anti-IgG de ratón- fosfatasa alcalina (Sigma,St.Louis,MO,USA) para suero y anti- IgA ratón-fostatasa alcalina (Sigma,St.Louis,MO,USA) a una dilución 1:30.000 en PBS- tween 20. Se incubó a 37°C por una hora, luego se realizaron 3 lavados con PBS-tween 20 y se adicionó 200µl por pozo de la solución sustrato p-Nitrophenyl phosphate (pNPP- Sigma,St.Louis,MO,USA). La reacción se detuvo a los 30 min con 25 µl de NaOH 3N. Se leyó la reacción a una longitud de onda de 410 nm con un lector de ELISA Dynatech 5000.
Inmunohistoquímica. Con el fin de determinar la especificidad de los anticuerpos desarrollados por los animales inmunizados con el plásmido recombinante, se realizó una prueba de inmunolocalización de los parásitos, para ello los Ancylostomas que fueron recuperados se fijaron con formaldehído al 10%, se incluyeron en bloques de parafina a partir de los cuales se realizaron cortes histológicos longitudinales con el micrótomo. Primero se fijaron tres láminas con acetona, se realizaron lavados suaves, luego se sensibilizaron las láminas, dos con el anticuerpo primario (suero de ratones inmunizados con los plásmidos recombinantes) a una dilución 1:10 en PBS-Tween20 y una con PBS-Tween20 (control negativo) y se incubó por 24 horas en cámara húmeda, después se retiró el anticuerpo primario lavando 3 veces suavemente con PBS Tween20, posteriormente se aplicó como anticuerpo secundario conjugado anti-IgG de ratón-peroxidasa en una dilución 1:30.000. Se incubó por 24 horas en cámara húmeda, se lavó 3 veces suavemente con PBS Tween20, la inmunoreacción fue revelada con nitroblue tetrazolium (NBT) como substrato; se interrumpió la reacción con agua corriente, por último se deshidrató la lámina con alcohol al 70% y se aclaró con Xilol. Finalmente se procedió a observar en el microscopio óptico.
RESULTADOS
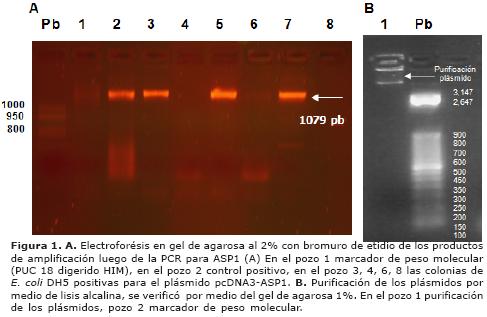
Clonación del gen de la proteína ASP1 de A. caninum en el plásmido PCDNA3. Se recuperaron plásmidos recombinantes que contenían el inserto del gen de la proteína ASP1 a partir de las bacterias E.coli DH5a competentes y transformadas con el plásmido, adquirieron la capacidad de ser resistentes a la ampicilina, lo que les permitió crecer en medio LB agar suplementado con 50µg/ml de ampicilina. Esto fue evidenciado mediante electroforésis en gel de agarosa al 1% coloreado con bromuro de etidio de los productos amplificados mediante PCR del ADN molde obtenido luego de la lisis osmótica de las colonias de E. coli DH5a transformadas obtenidas del LB-agar ampicilina y observado mediante transiluminador con luz ultravioleta (Figura 1A).
Figura 1. A. Electroforésis en gel de agarosa al 2% con bromuro de etidio de los productos de amplificación luego de la PCR para ASP1 (A) En el pozo 1 marcador de peso molecular (PUC 18 digerido HIM), en el pozo 2 control positivo, en el pozo 3, 4, 6, 8 las colonias de E. coli DH5 positivas para el plásmido pcDNA3-ASP1. B. Purificación de los plásmidos por medio de lisis alcalina, se verificó por medio del gel de agarosa 1%. En el pozo 1 purificación de los plásmidos, pozo 2 marcador de peso molecular.
Al purificar los plásmidos por medio de lisis alcalina y limpieza con PEG 8000, se verificó por medio del gel de agarosa 1% (Figura 1B). La concentración final del ADN plasmídico obtenida fue de 700 µg/ml cuantificado por espectrofotometría a 260nm/280nm. A partir de esta concentración de ADN plasmídico, y después de remover las endotoxinas, las concentraciones finales de ADN plasmídico se midieron nuevamente, se ajustó la solución a una concentración de 50 µg/ml y se inocularon los ratones.
Reactogenicidad de los animales inmunizados. Los animales que se inmunizaron con los diferentes esquemas utilizados hasta el día 30 de observación presentaron en buen estado de salud aparente. No se presentó ninguna muerte luego de la inmunización, ni se observaron efectos adversos durante el seguimiento.
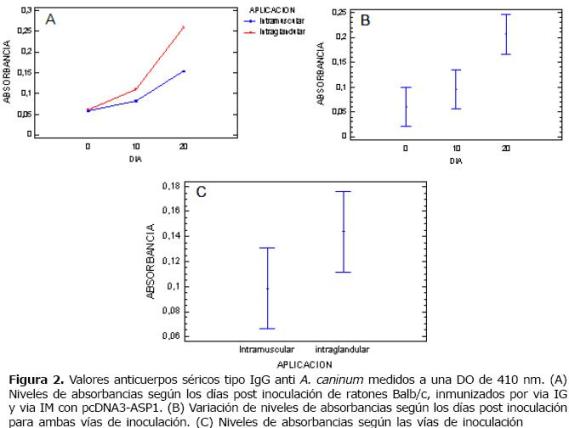
Resultados de anticuerpos anti A. caninum en ratones Balb/c. Los valores de anticuerpos determinados mediante la técnica ELISA, mostraron valores de absorbancia para IgG anti- A. caninum en los animales preinmunizados que oscilaron entre 0.059 y 0.077; mientras la cuantificación en los sueros de los mismos animales después de la inmunización muestra claramente un incremento muy marcado de los ratones que se inmunizaron con pcDNA3-ASP1r utilizando cualquiera de las dos vías de inmunización intramuscular o intraglandular comparados con los sueros de ratones sanos (Figuras 2A), también se encontró una diferencia estadísticamente significativa entre los días de inoculación con una p=0.0018, indicando que los refuerzos son importantes para obtener un fuerte respuesta inmune, pero no se presentaron diferencias estadísticamente significativas entre las vías de inoculación (Figura 2B, C y Figura 3).
Figura 2. Valores anticuerpos séricos tipo IgG anti A. caninum medidos a una DO de 410 nm. (A) Niveles de absorbancias según los días post inoculación de ratones Balb/c, inmunizados por via IG y via IM con pcDNA3-ASP1. (B) Variación de niveles de absorbancias según los días post inoculación para ambas vías de inoculación. (C) Niveles de absorbancias según las vías de inoculación
No fue posible detectar anticuerpos tipo IgA secretorios en saliva Anti- A. caninum en los animales preinmunizados debido a la escasa cantidad de saliva que se obtuvo.
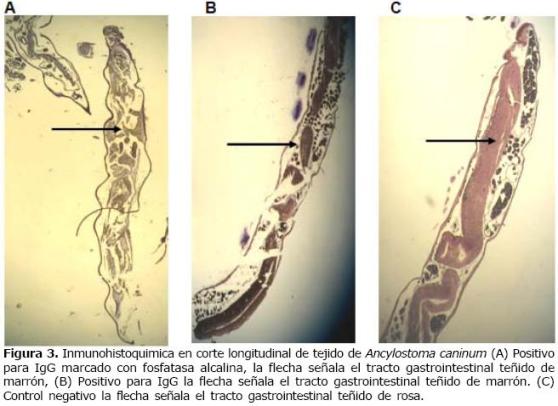
Inmunohistoquímica. La interpretación de la inmunoreacción de marcaje tisular, fue considerada positiva cuando se presentó un color marrón en el tejido, indicativa de la expresión de la proteína ASP1, en este estudio correspondió hasta el 100% y en el control negativo se obtuvo un color rosa lo que corresponde a una ausencia de expresión. La inmunoreactividad fue claramente identificada al microscopio óptico (Figura 3).
Figura 3. Inmunohistoquimica en corte longitudinal de tejido de Ancylostoma caninum (A) Positivo para IgG marcado con fosfatasa alcalina, la flecha señala el tracto gastrointestinal teñido de marrón, (B) Positivo para IgG la flecha señala el tracto gastrointestinal teñido de marrón. (C) Control negativo la flecha señala el tracto gastrointestinal teñido de rosa.
DISCUSIÓN
A. caninum es un parásito que tiene una amplia distribución mundial, tiene un ciclo de vida directo y no tiene hospedero intermediario, posee una proteína llamada ASP1 que es liberada durante la infección del hospedero. Esta molécula juega un papel importante en el establecimiento de la invasión, se expone directamente al sistema inmune del hospedero y puede inducir inmunidad protectora.
La proteina de excreción/ secreción ASP1 es predominante, bajo la activación in vitro en condiciones similares a las que existen en el hospedero, la cual presenta un peso molecular de 42kDa, esta desempeña un papel importante en la patogénesis de infecciones causadas por helmintos en animales y humanos (8).
En trabajos realizados con proteínas recombinantes de A. caninum y su utilización como vacuna en ratones, han demostrado dificultades debido a los problemas en probar este candidato en modelos murinos ya que el estado infectivo de A. caninum no se desarrolla en este hospedero y por lo tanto no se puede realizar un reto con larvas infectivas L3 (28). Por esta razón muchos investigadores consideran que este modelo para A. caninum no es fisiológico, en cambio la prueba preclínica del candidato requiere la vacunación de perros antes de hacer un reto (29).
Estudios realizados en ratones BALB/c al ser inmunizados con Ac-asp-1 recombinante precipitada con sal de aluminio obtuvieron una protección de 58% y 72%, pero no midieron los niveles de anticuerpos de los animales inmunizados que pudieran ser comparados con lo obtenido en el presente estudio (30).
Otros trabajos se han realizado utilizando proteínas de excreción / secreción de Ancylostoma sp como posible candidato vacunal, se han medido los efectos de la combinación de antígenos ASP2 y la metaloproteasa 1 en hámsters infectados y enfermos con Ancylostoma ceylanicum, estas fueron clonadas y expresadas en Pichia pastoris y cuando se inmunizaron animales con esta proteína se encontraron altos títulos de IgG para ASP-2 (1:62,850) y anti MTP1 (1:151,356) los cuales disminuyeron a través del tiempo. La combinación de estos dos antígenos no presentaron efectos significativos, pero si presentaron protección en la reducción de la carga parasitaria y mejoraron perceptiblemente los parámetros clínico-patológicos asociados a enfermedad aumentando valores de la hemoglobina y pesos corporales en hámsters infectados (31).
En este estudio se encontró que la concentración de anticuerpos de tipo IgG aumentó desde la primera inmunización, gracias a que el plásmido persistió en el tiempo. Esto se pudo confirmar por medio de ensayos ELISA anti-ASP-1 realizados en los días 0, 10 y 20 postinmunización. Por otro lado, se utilizó la técnica de inmunohistoquímica para confirmar que ASP-1 se encuentra localizada en el intestino del adulto de A caninum. Un trabajo similar fue realizado por Zhan et al (9) utilizando como blanco una glutation S-tranferasa (Ac-GST-1), y por medio de inmunolocalización y ELISA confirmaron que Ac-GST-1 se localiza en la hipodermis, tejido muscular e intestino de adultos de A. caninum (32). Lo anterior permite concluir que por medio de la utilización de la inmunohistoquímica, que tiene el mismo principio de la inmunolocalización, para determinar la ubicación de la ASP-1 en el nematodo reconocida por los anticuerpos desarrollados durante la inmunización con el plásmido recombinante lo que muestra la especificidad de la respuesta suscitada por la proteína expresada por el plásmido inoculado por vía intramuscular e intraglandular en el modelo murino.
En este trabajo se obtuvo un plásmido pcDNA3-ASP1 que no presentó reacciones desfavorables en ratones BALB/c al ser administrado por vía intraglandular e intramuscular, además se indujo una respuesta de tipo humoral contra la proteína de excreción/secreción ASP1 de A. caninum.
El plásmido persistió en el tiempo y la respuesta del sistema inmune mejoró con el refuerzo de la inmunización, lo que permitió la localización del antígeno y su fuerte reconocimiento por los anticuerpos producidos mediante la inmunización con el plásmido.
En conclusión, se demostró que la utilización de pcDNA3-ASP1 no produjo reacciones desfavorables en ratones BALB/C y concomitantemente indujo respuesta humoral contra la proteína pcDNA3-ASP1 de excreción/secreción de Ancylostoma caninum en ratones.
Con la obtención de estos resultados se pretenderá probar el plásmido recombinante en un modelo canino y de igual manera saber si se genera una respuesta inmune que permita obtener un nuevo candidato a vacuna.
REFERENCIAS
1. Cordero Del Campillo, M et al. Parasitología veterinaria. Madrid, España; McGraw-Hill: 2000. [ Links ]
2. Hawdon JM, Hotez PJ.Hookwoorm: developmental biology of the infectious process. Curr Opin Gen Surg 1996; 6:618-23. [ Links ]
3. Hawdow JM, Narasimhan S, Hotez PJ. Ancylostoma secreted protein 2: Cloning and characterization of a second member of a family of nematode secreted proteins from Ancylostoma caninum. Mol Biochem parasitol 1999; 99:149-65. [ Links ]
4. Hawdon JM, Schad GA.Serum stimulated feeding in vitro by 3 stage infective larvae of canine hookworm Ancylostoma caninum. J Parasitol 1990;76:394-8. [ Links ]
5. Hawdon JM, Jones BF, and Hotez PJ.. Cloning and characterization of a cDNA encoding the catalytic subunit of a c AMP-dependient protein kinase from Ancylostoma caninum third-stage infective larvae. Mol Biochem Parasitol 1995;69 :127-30. [ Links ]
6. Hawdom JM, Jones BF, Perre gaux MA, Hotez PJ. Ancylostoma caninum metaloprotease release coincides with activation of infective larvae in vitro. Exp Parasitol 1995;80: 2005-11. [ Links ]
7. Zhan B, Hawdon J, Shan Q, Ren HN, Quiang HQ, Hu W, et al. Ancylostoma secreted protein 1 (ASP-1) homologues in human hook worms. Mol Biochem Parasitol 1999; 98:143-9. [ Links ]
8. Hawdow JM, Jones Bf, Hoffman DR, Hotez PJ. Cloning and characterization of Ancylostoma secreted protein: a novel protein associated with the transition to parasitism by infective hookworm larvae. J Biol Chem 1996;271:6672-8. [ Links ]
9. Zhan B, Hotez PJ, Wang Y, Hawdon J. A developmentally regulated metalloproteasa secreted by host-stimulated Ancylostoma caninum third- stage infective larvae is a member of the astacin family of proteases. Mol Biochem Parasitol 2002; 120: 291-6. [ Links ]
10. Ding X, Shields J, Allen R, Hussey RSMolecular cloning and caracterization of a vemon allergen AG5- like cDNA from Meloidogyne incognita. Int J Parasitol 2000; 30: 77-81. [ Links ]
11. Gao B, Allen R, Maier T, Davis EL, Braum TJ, Hussey RS. Molecular characterization and expression of two venom allergen-like protein genes in Heterodera glycines. Int Parasitol 2001; 31: 1617-25. [ Links ]
12. Tawe W, Pearlman E, Unnasch TR, Lustigman SAngiogenic activity of Onchocerca volvulus recombinant proteins similar to vespid venom antigen 5. Mol Biochem Parasitol 2000; 109:91-9. [ Links ]
13. Hotez PJ, Ghosh K, Hawdon JM, Narasimhan S, Jones B, Xiao SH, et alExperimental approaches to the development of a recombinant hookworm vaccine. Immunol Rev 1999; 171: 163-71. [ Links ]
14. Hotez PJ , Zhan B , Bethony J M , Loukas A , Williamson A , Goud G N , et al. Progress in the development of a recombinant vaccine for human hookworm disease: the Human Hookworm Vaccine Initiative. Int J Parasitol 2003; 33:1245-58. [ Links ]
15. Schalling H, Va Leewen M, Verstrepen B, Cornelissen A. Molecular characterization and expression of two putative protective excretory secretory proteins of Haemonchus contortus. Mol Biochem Parasitol 1997; 88:203-13. [ Links ]
16. De Maere V, Vercauteren I, Saverwyns H, Claerebout E, Bern G, Vercruysse J. Identification of potential protective antigens of Ostertagia ostertagi with local antibody probes. Parasitology 2002;125: 383-91. [ Links ]
17. Ghosh K, Hawdon J, Hopez P. Vaccinacion with alum-precipitated recombinant Ancylostoma secreted protein 1 protects mice against challenge infeccion with infective hookworm (Ancylostoma caninum) larvae. J Infect Dis 1996;174: 1380-3. [ Links ]
18. Ghosh K, Hopez JP. Antibody- dependent reduccion in mouse hookworm burden after vaccination with Ancylostoma caninum secreted protein 1 (Ac- ASP-1). J Infect Dis 1999; 180: 1674-81. [ Links ]
19. Liu S, Gosh K; Zhan B, Shan Q, Thompson MG, Hawdon J, et al. Hookworm burden reductions in Balb/c mice vaccinated with Ancylostoma secreted protein 1 (ASP-1) from Ancylostoma duodenale, A. caninum and Necator americanus. Vaccine 2000;18: 1096-02. [ Links ]
20. Sharp PJ, Wagland BM, inventors. Nematode vaccine.US Patent 5 734 035, 1998 March 31. [ Links ]
21. Murray J, Gregory WF, Gomez- Escobar N, Atmadja AK, Maizels RM. Expression and immune recognition of Brugia malayi VAL-1, a homologue of vespid venom allergens and Ancylostoma secreted proteins. Mol Biochem Parasitol 2001;118: 89-96. [ Links ]
22. Lustigman S, James ER, Tawe W, Abraham D. Towards a recombinant antigen vaccine against Onchocerca volvulus. Trends Parasitol 2002; 18:135-41. [ Links ]
23. Sharp PJ, Wagland BM (Biotech Australia and CSIRO). Nematode Vaccine. International Patent Application Number PCT/AU92/00041. International Publication Number WO 92/13890. [ Links ]
24. Schalling H, Va Leewen M, Hendrikx W. Immune responses of sheep to excretory/secretory products of adult Haemonchus contortus. Parasitol 1994; 108:351-7. [ Links ]
25. Schallig H, Van Leeuwen M.Protective immunity to the blood-feeding nematode Haemonchus contortus induced by vaccination with parasite low molecular weight antigens. Parasitology 1997; 114:293-99. [ Links ]
26. Kooyman F, Schallig H, Van Leewen M, Mackellar A, Huntley JF, Cornelissen A, et al. Protection in lambs vaccinated with Haemonchus contortus antigens is age related, and correlated, with IgE rather than IgG1 antibody. Parasite Immunol 2000; 22:13-20. [ Links ]
27. Sambrook J, Fritsch EF, Maniatis T. Molecular Cloning: A Laboratory Manual 3a edition, Vol. 1, 2 and 3. USA: Cold Spring Harbor Laboratory Press; 2001. [ Links ]
28. Kerr KB. Studies on acquired immunity to the dog hookworm Ancylostoma caninum. Am J Hyg 1936; 23:381-406. [ Links ]
29. Miller TA. Immunity to hookworm. In: Souls by EJL. ed, Immune responses in parasitic infections: immunology, immunopathology and immunoprophylaxis, Vol I, Nematodes, Boca Raton, FL: CRC Press; 1981. [ Links ]
30. Sen L, Ghosh K, Bin Z, Qiang S, Thompson M, Hawdon J , et al. Hookworm burden reductions in BALB/c mice vaccinated with recombinant Ancylostoma secreted proteins (ASPs) from Ancylostoma duodenale, Ancylostoma caninum and Necator americanus. Vaccine 2000; 18:1096-1102. [ Links ]
31. Mendez S, Zhan B, Goud G, Ghosh K, Dobardzic A, Wu W, et al. Effect of combining the larval antigens Ancylostoma secreted protein 2 (ASP-2) and metalloprotease 1 (MTP-1) in protecting hamsters against hookworm infection and disease caused by Ancylostoma ceylanicum. Vaccine 2005;23: 3123-30. [ Links ]
32. Zhan B, Liu S, Perally S, Xue J, Fujiwara R, Brophy P et al. Biochemical Characterization and Vaccine Potential of a Heme Binding Glutathione Transferase from the Adult Hookworm Ancylostoma caninum. Infect immun 2005; 75:6903-6911. [ Links ]