Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista MVZ Córdoba
Print version ISSN 0122-0268On-line version ISSN 1909-0544
Rev.MVZ Cordoba vol.14 no.2 Córdoba May/Aug. 2009
ORIGINAL
RESISTENCIA A ANTIBIOTICOS DE BACTERIAS AISLADAS DE BIOPELÍCULAS EN UNA PLANTA DE ALIMENTOS
ANTIBIOTIC RESISTANCE OF BACTERIA ISOLATED FROM BIOFILMS IN A FOOD PROCESSING PLANT
María Vanegas L1*, M.Sc, Nancy Correa C1, Microbióloga, Ana Morales M2, Microbióloga, Aída Martínez L1, M.Sc, Laura Rúgeles G1, M.Sc, Francy Jiménez I1, Microbióloga.
1Universidad de los Andes, Facultad de Ciencias, Departamento de Ciencias Biológicas, Laboratorio de Ecología Microbiana y de Alimentos, Cra. 1
2Bioquilab. Carrera 47 A. No 91-85, Bogotá Colombia. *Correspondencia: mvanegas@uniandes.edu.co
Recibido: Enero 16 de 2009; Aceptado: Julio 14 de 2009
RESUMEN
Objetivo. Evaluar la resistencia a antibióticos y la capacidad de formación de biopelículas de bacterias aisladas en una planta de producción de alimentos. Materiales y métodos. Se tomaron muestras de 3 zonas diferentes, en una planta procesadora de alimentos; en la lavadora de canastas, la mesa de producción y en la banda empacadora. Se aislaron e identificaron las bacterias presentes en cada una de las tres zonas y se determinó la capacidad formadora de biopelículas por medio de cuantificación celular. Asimismo se evaluó la resistencia de cada una de las bacterias aisladas frente a ocho diferentes antibióticos. Resultados. Se recuperaron 29 cepas, correspondientes a 13 géneros diferentes, los cuales fueron todos formadores de biopelículas. Se encontró que cerca del 50% de las bacterias aisladas fueron resistentes a antibióticos como la penicilina G y vancomicina. Adicionalmente se evidenció un alto grado de multirresistencia a los diferentes antibióticos. Conclusiones. La alta multirresistencia encontrada a antibióticos entre las bacterias analizadas podría ser un problema para salud pública ya que pueden ser transmitidas por alimentos. De igual manera es de gran importancia la capacidad de producción de biopelículas de la microbiota analizada así como la alta concentración de bacterias entéricas y ambientales, lo que sugiere deficiencia del programa de limpieza y desinfección de la planta.
Palabras clave: Biopelículas, adhesión bacteriana, resistencia, antimicrobianos, contaminación alimentaria..
ABSTRACT
Objective. To assess the antibiotic resistance and the ability to produce biofilms in bacteria isolated from a food processing plant. Materials and methods. Samples from 3 different zones from a food processing plant were analyzed: Baskets washers, production table and baler band. The bacteria were isolated and identified in each of three zones and biofilm forming capacity was measured for all the isolates by quantifying the cells present in the biofilm. Subsequently, a test of resistance to eight different antibiotics was assessed. Results. From a total of 29 isolates,13 different genres were identified. All of these genres were biofilm- formers. About 50% of the isolated bacteria were resistant to antibiotics such as penicillin G and vancomycin. Similarly, a high degree of antibiotic multiresistance was demonstrated in the bacteria isolated. Conclusions. Multi-resistance to antibiotics was observed in many of the isolates. Since these bacteria can be transmitted through food, this could be a problem for public health. Aso, it is important the biofilm forming capacity in the analyzed bacteria, as well as the wide number of enteric and environmental bacteria found in this study which suggests inefficiency on food processing plant cleanliness and disinfection program.
Key words: Biofilms, bacterial Adhesion, drug resistance, food contamination.
INTRODUCCIÓN
Las biopelículas son comunidades complejas de microorganismos presentes en ambientes naturales formadas por asociaciones de una o múltiples especies con una organización semejante a la de los organismos multicelulares (1). Están compuestas principalmente por polisacáridos, proteínas y algunas veces pueden contener lípidos, ácidos nucléicos y otros biopolímeros (1-4). Su formación se considera como un proceso dinámico y complejo y la adhesión de los microorganismos a las diferentes superficies está influenciada por diferentes variables que incluyen la especie de bacteria, composición de la superficie celular, naturaleza de las superficies, disponibilidad de nutrientes, hidrodinámica y comunicación célula-célula (1,3,4). Las bacterias llegan a las plantas de producción, se adhieren, se multiplican y algunas dan lugar a la formación de biopelículas en donde las bacterias están embebidas en una matriz de polímeros extracelulares producidos por ellas mismas (1,5). Estas biopelículas sirven que son una fuente constante de bacterias causantes de deterioro de las maquinarias o de los alimentos y de bacterias patógenas para humanos de importancia en salud pública. (1,6-8).
Entre las bacterias patógenas formadores de biopelículas con importancia en la industria de alimentos se encuentran Listeria monocytogenes, Escherichia coli, Streptococcus suis, Salmonella spp, Yersinia enterocolitica, Campylobacter jejuni, Pseudomonas spp, Staphylococcus aureus y Bacillus cereus entre otros (9-11).
Las biopelículas y sus microorganismos son muy difíciles de erradicar debido a que son extremadamente resistentes a los desinfectantes (11,12). Por lo anterior las industrias deben tener implementados muy buenos programas de limpieza y desinfección para su eliminación. (13)
Por otro lado, las bacterias formadoras de biopelículas tienen mayor resistencia a antibióticos debido a varios factores, por ejemplo se ha demostrado que las bacterias muestran varios fenotipos con una amplia de reservorio para la liberación continuada de bacterias a los alimentos procesados que están en contacto con las superficies. La formación de biopelículas bacterianas o "biofilms" afectan la industria alimenticia en la producción y calidad de sus productos ya heterogeneidad replicativa y metabólica, lo cual afecta la acción del antibiótico, así como la composición de la biopelícula y su estructura hace más difícil la acción del antimicrobiano (7).
En Colombia se han realizado muy pocos estudios sobre la importancia de las bacterias resistentes a antibióticos transmitidas por alimentos, tema que en la actualidad está siendo evaluado por los países en desarrollo desde la producción primaria hasta el producto terminado, así como a nivel clínico, dedicando especial atención a la resistencia por parte de entero-patógenos (14). El objetivo de este estudio fue evaluar la resistencia a antibióticos y la capacidad formadora de biopelículas de bacterias aisladas de una planta de producción de alimentos.
MATERIALES Y MÉTODOS
Recolección de muestras y sitio de estudio. La recolección de muestras se realizó en una planta procesadora de alimentos ubicada en la ciudad de Bogotá, Colombia. Se llevó a cabo un frotis con hisopos en tres zonas diferentes de producción de alimentos: Zona 1: Lavadora de canastas de acero inoxidable, Zona 2: mesa de producción de acero inoxidable, y zona 3: banda empacadora en material plástico. En todas había evidencia visible de formación de biopelículas.
La zona 1 se encuentra alejada de la zona 2 y 3, la cuales comparten el mismo espacio. De cada zona se tomaron 5 muestras para un total de 15 muestras que fueron transportadas en agua peptonada al 0.1% (Oxoid,Lenexa,KS,USA) en condiciones de refrigeración.
Aislamiento e identificación de la microbiota bacteriana. Los análisis microbiológicos realizados se basaron en los protocolos del INVIMA(15) y FDA(16) para la búsqueda y el recuento de los siguientes microorganismos: Staphylococcus aureus, Enterococcus sp, Pseudomonas sp, bacterias acido lácticas (BAL), coliformes totales, sulfito reductores, aerobios mesófilos y búsqueda de Listeria monocytogenes y Salmonella spp. Adicionalmente para cada una de las colonias aisladas en VRBA (Agar violeta cristal rojo neutro bilis, OXOID) para Coliformes totales, SPC (Sthandar plate count, Sharlau) para aerobios mesófilos, y en Agar MRS (Man Rogosa sharpe, Sharlau) para bacterias acido lácticas, se realizó la identificación mediante métodos rápidos como API (Biomerieux), Crystal (BD) y Remel (Oxoid). Todas las cepas identificadas fueron conservadas en caldo de infusión cerebro-corazón (BHI, Oxoid, ).
Evaluación y cuantificación de biopelículas. Para la identificación y cuantificación de las biopelículas se llevó a cabo el procedimiento realizado por OâToole et al (17). La cuantificación de la formación de biopelículas se realizó por medio de un espectrófotometro BioMate3 Thermo Spectronic.
Evaluación de resistencia a antibióticos. Todas las cepas recuperadas e identificadas se evaluaron frente a diferentes antibióticos siguiendo el método de Bauer et al (18). Se sembró una concentración aproximada de 6x108 células/mL (patrón MacFarland #2.0) en un medio de cultivo agar Muller-Hinton (Sharlau). Se colocaron sobre el agar inoculado sensidiscos (OXOID y BBL) con ocho diferentes antibióticos: estreptomicina (S), cefalotina (KF), penicilina G (P), vancomicina (VA), ácido nalidíxico (NA), ampicilina (AMP), kanamicina (K), gentamicina (CN), tetraciclina (TE). Se incubaron las cajas a 37+/-2°C por 24 horas en condiciones de aerobiosis. Pasado el tiempo de incubación se procedió a la medición de los halos de inhibición presentados como zonas claras alrededor del sensidisco. Se calculó el índice de resistencia múltiple a antibióticos (MAR), el cual se define como a/b, donde "a" representa el número de antibióticos para los cuales determinada cepa presenta resistencia, y "b", el número de antibióticos al cual se expuso dicha cepa. Un índice mayor a 0.2 indica que la bacteria presenta resistencia múltiple.
RESULTADOS
Caracterización e edentificación de la microbiota. Los resultados de los recuentos se basaron en la homogenización de las 5 muestras que se habían tomado separadamente de cada una de las zonas para al final tener resultados representativos (Tabla 1).
Tabla 1. Recuento/Busqueda de bacterias en 3 zonas diferentes.
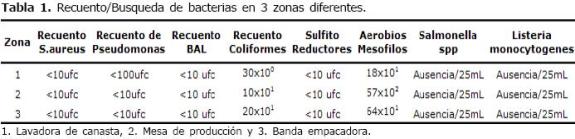
1. Lavadora de canasta, 2. Mesa de producción y 3. Banda empacadora.
Un total de 29 bacterias fueron aisladas e identificadas a partir de los medios de cultivo VRBA, y agar nutritivo utilizados para coliformes totales y aerobios mesófilos respectivamente (Tabla 2).
Tabla 2. Cuantificación celular de biopeliculas por densidad optica (D.O)
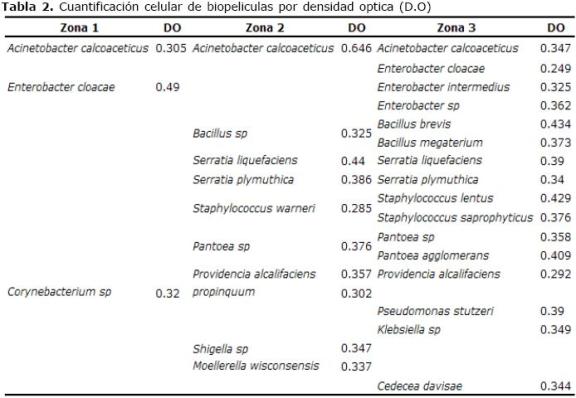
De 29 aislamientos identificados en total se diferenciaron 13 géneros: Acinetobacter, Bacillus, Corynebacterium, Cedecea, Enterobacter, Klebsiella, Moellerella, Pantoea, Providencia, Pseudomonas, Serratia, Shigella y Staphylococcus. No se encontraron bacterias patógenas transmitidas por alimentos como S. aureus, L. monocytogenes, Salmonella spp, sulfito reductores y Enterococcus spp.
Se encontraron géneros compartidos en al menos dos de las zonas (Tabla 2), como es el caso de Acinetobacter calcoaceticus presente en las tres zonas, y diferentes especies de Serratia, Enterobacter, Bacillus, entre otros, presentes en la zona 2 y 3 las cuales se encontraban localizadas en una misma área.
Evaluación y cuantificación de biopelículas. La prueba de biopelículas y la cuantificación de las células bacterianas mediante la medición de densidad óptica fue realizada a las bacterias identificadas (17). Respecto a la capacidad de formación de biopelículas en este estudio se encontró que todas las bacterias aisladas fueron productoras de biopelículas, algunas con mayor capacidad que otras, lo cual se evidenció con los resultados de las diferentes densidades ópticas (Tabla 2). La mayor cuantificación celular fue presentada por Enterobacter cloacacae, Acinetobacter calcoaceticus, Serratia liquefaciens y Bacillus brevis, Bacillus sp, C. davisae y Shigella sp.
Ensayo de resistencia a antibióticos. Penicilina y vancomicina fueron los antibióticos en los cuales se encontró mayor resistencia, con porcentajes del 50 y 46,43% respectivamente (Tabla 3). No se encontró ningún tipo de resistencia frente a gentamicina y kanamicina.
Tabla 3. Porcentaje de cepas resistentes a ocho antibióticos evaluados.

Estreptomicina (S), Cefalotina (KF), Penicilina G (P), Vancomicina (VA), Ãcido Nalidixico (NA), Ampicilina (AMP), Kanamicina (K), Gentamicina (CN). Tetraciclina (TE).
Se estableció el índice de resistencia múltiple, en el cual se demostró que de las 29 bacterias aisladas y caracterizadas, 16 presentaron coeficientes mayores a 0.2, lo que indica resistencia múltiple. S. liquefaciens, E. cloacae, Enterobacter fueron las bacterias multirresistentes con mayor índice de resistencia (MAR) (Tabla 4). Las restantes, presentaron valores menores a 0.2 (datos no mostrados).
Tabla 4. Indice de resistencia multiple (MAR).
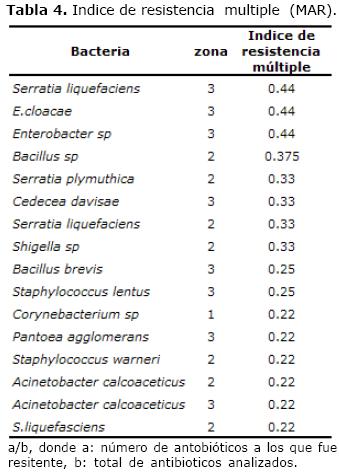
a/b, donde a: número de antobióticos a los que fue resitente, b: total de antibioticos analizados
DISCUSIÓN
Aislamiento e identificación de la microbiota bacteriana. Se lograron identificar en las diferentes zonas estudiadas (Tabla 2) las mismas especies como es el caso de Acinetobacter calcoaceticus, Enterobacter cloacae presentes en la zona 1 y 3, Pantoea spp en la zona 2 y 3 y Providencia alcalifaciens en la 2 y 3, lo cual sugiere una misma fuente de contaminación o contaminación cruzada. Para verificar que realmente las bacterias presentes en las diferentes zonas tienen un mismo origen de contaminación se sugiere realizar técnicas moleculares especializadas.
Se aislaron aerobios mesófilos y coliformes totales en los tres puntos de muestreo, de los cuales el segundo (banda empacadora) y tercer punto (mesa de producción), presentaron una alta contaminación. Lo anterior es importante desde el punto de vista de inocuidad alimentaria, debido a que los alimentos están expuestos a contaminación en diferentes puntos del proceso de producción (1), a pesar de que no se encontraron bacterias patógenas transmitidas por alimentos. En este estudio se encontró un gran número de bacterias de la familia enterobacteriaceae como Pantoea, Providencia, Serratia, Shigella, etc., las cuales son indicadores de contaminación fecal. Estos resultados coinciden con lo reportado por otros autores (14,19), en donde los géneros más comunes de formación de biopelículas tanto a nivel clínico como en diferentes industrias, suelen ser las enterobacterias. En las tres zonas evaluadas se encontraron bacterias por contaminación ambiental, demostrando deficiencia en el programa de limpieza y desinfección, lo cual explica la presencia de biopelículas.
Evaluación y cuantificación de biopelículas. Enterobacter cloacacae, Acinetobacter calcoaceticus, Serratia liquefaciens y Bacillus brevis fueron las bacterias que presentaron mayor capacidad de formación de biopelículas, lo cual explica la presencia de este tipo de microorganismos en al menos dos de las tres zonas muestreadas. (Tabla 3). Es importante resaltar que la mayoría de las bacterias aisladas e identificadas además de ser microbiota ambiental, también son frecuentemente reportadas como microorganismos importantes a nivel hospitalario, es decir que son agentes causantes de enfermedades nosocomiales precisamente por la capacidad de producir biopelículas y la alta resistencia a desinfectantes y antibióticos.
Este es el caso de Acinetobacter calcoaceticus, por ejemplo, con uno de los datos de cuantificación más altos reportados en este estudio. Asimismo, según estudios anteriores (20), es uno de los microorganismos más abundantes encontrados en biopelículas asociadas al empacado industrial de bebidas. Adicionalmente, este tipo de agentes están involucrados en la colonización e infección en pacientes inmuno-comprometidos, son patógenos oportunistas y por lo tanto no deberían estar presentes en una planta de alimentos procesados listos para el consumo (20,21).
Ensayo de inhibición por antibióticos. Se pudo observar una importante resistencia a una amplia gama de antibióticos, por parte de las bacterias formadoras de biopelículas. Se encontró alto porcentaje de cepas resistentes a la penicilina G y vancomicina lo cual podría ser una consecuencia del alto contacto con este tipo de antibióticos, y a la posible presión de selección debido al uso indiscriminado de los mismos, hecho que es preocupante hoy en día debido a la problemática creciente de farmacorresistencia (14).
Por otro lado, se observó una relación entre la formación de biopelícula y la resistencia a antibióticos, ya que la mayoría de los representantes de resistencia múltiple, son los mismos que presentaron densidades ópticas más altas por la formación de biopelículas. La presencia de estas bacterias multirresistentes a diversos antibióticos es un punto crítico a tratar no sólo a nivel industrial, sino a nivel clínico.
Este es uno de los primeros estudios que se ha realizado en Colombia sobre el conocimiento de la formación, composición y resistencia a antibióticos de bacterias cultivables en las biopelículas en plantas de alimentos, por lo tanto la metodología y la información suministrada en esta investigación es muy útil como un punto de partida para continuar abordando y profundizando en este tema de gran importancia e impacto tanto en la parte industrial y de salud pública.
En conclusión, la alta multirresistencia encontrada a antibióticos entre las bacterias analizadas podría ser un problema para salud pública ya que pueden ser transmitidas por alimentos. De igual manera es de gran importancia la capacidad de producción de biopelículas de la microbiota analizada así como la alta concentración de bacterias entéricas y ambientales, lo que sugiere deficiencia del programa de limpieza y desinfección de la planta.
Agradecimientos
Los autores agradecen a la Facultad de Ciencias de la Universidad de los Andes, Bogotá-Colombia por el apoyo y financiamiento para la realización de este proyecto.
REFERENCIAS
1. Kumar CG, Anand SK. Significance of microbial biofilms in food industry: a review. Int J Food Microbiol 1998; 42:9-27. [ Links ]
2. Kropfl K, Vladár P, Szabó K, ács E, Borsodi A, Szikora S, et al. Chemical and biologic characterization of biofilms formed on different substrata in Tisza river (Hungary). Environ pollut 2006; 144: 626-631. [ Links ]
3. Lee Wong AC. Biofilms in food Processing Environments. J Dairy Sci 1998; 81(10): 2765-2770. [ Links ]
4. Pace JL, Rupp ME, Finch RG. Biofilms, Infection, and Antimicrobial Therapy. Boca Raton: Taylor & Francis; 2005. [ Links ]
5. Jessen B, Lammert L. Biofilm and desinfection in meat processing plants. Int Biodet 2003; 51(4): 265-269. [ Links ]
6. Joseph B, Otta SK., Karunasagar I, Biofilm formation by Salmonella spp. on food contact surfaces and their sensitivity to sanitizers. Int J Food Microbiol 2001; 64:367-372. [ Links ]
7. Gunduz GT, Tuncel G. Biofilm formation in an ice cream plant. Antonie Van Leeuwenhoek 2006; 89:329-336. [ Links ]
8. Sharma M, Anand SK. Characterization of constitutive microflora of biofilms in dairy processing lines. Food Microbiol 2002; 19:627-636. [ Links ]
9. Rivas L, Fegan N, Dykes GA. "Attachment of Shiga toxigenic Escherichia coli to stainless steel". Int J Food Microbiol 2007; 115(1):89-94. [ Links ]
10. Wilks SA, Michels HT, Keevil CW. "Survival of Listeria monocytogenes Scott on a metal surfaces: Implications for cross-contamination". Int J Food Microbiol 2006; 111(2):93-98. [ Links ]
11. Harvey J., Keenan K.P, Gilmour A. Assessing biofilm formation by Listeria monocytogenes strains. Food Microbiol 2007; 24:380-392. [ Links ]
12. Lebert I, Leroy S, Talon R. Effect of Industrial and natural biocides on spoilage, pathogenic and technological strains grown in biofilm. Food Microbiol 2007; 24:281-287. [ Links ]
13. Gandhi M, Chikindas ML. Listeria: a foodborne pathogen that knows how to survive. Int J Food Microbiol 2007; 113 (1):1-15. [ Links ]
14. Organización panamericana de la Salud (OPS): Farmacorresistencia a los antimicrobianos; 2008. [Citado en Septiembre de 2008]. URL Disponible en: http://www.paho.org/Spanish/HCP/HCT/antimicrob_index.htm [ Links ]
15. Hernandez M, Rozo M, Ricaurte B, Llamosa, Cajiao Ana, Figueroa Graciela. Manual de técnicas de análisis para control de calidad microbiológica de alimentos para consumo humano. Instituto de vigilancia de medicamentos y alimentos INVIMA, 1998. [ Links ]
16. FDA U.S. Food and Drug administration. BAM: Staphylococcus aureus. Bacteriological Analytical Manual. Chapter 12. Staphylococcus aureus (En linea) Enero 2001. Fecha de acceso Enero 28 de 2010. URL disponible en: http://www.fda.gov/Food/ScienceResearch/LaboratoryMethods/BacteriologicalAnalyticalManualBAM/ucm071429.htm#authors. [ Links ] [ Links ]
18. Bauer AW, Kirby WM, Sherris JC, Turck M. Antibiotic susceptibility testing by a standardized single disk method. Am J Clin Pathol 1966; 45(4):493-496. [ Links ]
19. Universidad Complutense de Madrid. Sondas FISH para el control de biopelículas en la industria papelera. Sistema Madrid; 2008. [Citado en Septiembre de 2008] Disponible en http://www.madrimasd.org/noticias/Sondas-FISH-control-biopeliculas- industria-papelera/33624 [ Links ]
20. Dominguez M, Sepulveda M, Bello H, Gonzalez G, Mella S, Zemelman R. Aislamiento de Acinetobater spp. desde muestras clínicas en el Hospital Clínico Regional "Guillermo Grant Benavente", Concepción. Rev Chil Infect 2000; 17(4): 321-325. [ Links ]
21. Fernandez S, Orozco C, Martinez J. Caracterización parcial de los Polisacáridos excretados por una cepa nativa de Enterobacter cloacae. Revista Biología 2005; 19(1-2):74-80. [ Links ]














