Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista MVZ Córdoba
Print version ISSN 0122-0268On-line version ISSN 1909-0544
Rev.MVZ Cordoba vol.14 no.2 Córdoba May/Aug. 2009
ORIGINAL
CARACTERIZACIÓN DE BACTERIAS PROBIÓTICAS AISLADAS DEL INTESTINO GRUESO DE CERDOS COMO ALTERNATIVA AL USO DE ANTIBIÓTICOS
CHARACTERIZATION OF ISOLATED PROBIOTIC BACTERIA OF THE LARGE INTESTINE OF PIGS AS ALTERNATIVE TO USING ANTIBIOTICS
Henry Jurado G1*, M.Sc, Diana Aguirre F2, Biol, Cristina Ramírez T3, Ph.D.
1Universidad de Nariño, Facultad de Ciencias Pecuarias, Departamento de Producción y Procesamiento Animal, Programa de Zootecnia. Pasto, Colombia.
2Universidad del Valle.
3Universidad del Valle, Escuela de Ingeniería de Alimentos. Cali, Colombia.
*Correspondencia: henryjugam@hotmail.com
Recibido: Junio 23 de 2009; Aceptado: Agosto 25 de 2009
RESUMEN
Objetivo. Caracterizar bacterias ácido lácticas probióticas aisladas del intestino grueso de cerdos adultos como posible alternativa al uso de antibióticos. Materiales y métodos. Se incluyeron muestras de intestino grueso de 20 cerdos adultos, para el aislamiento de bacterias lácticas (BAL). La caracterización de los parámetros bioquímicos-fisiológicos de las BAL contemplo la evaluación del pH del fermento, determinación de ácidos orgánicos por HPLC y detección de isómeros de ácido láctico. Los procedimientos microbiológicos evaluaron la capacidad de inhibición del crecimiento de patógenos y la actividad antagónica del probiótico vs antibiótico con su interacción competitiva. Se utilizaron pruebas API CHL 50 para la identificación de las BAL que se complementaron con la producción de gas, actividad de catalasa y viabilidad a diferentes concentraciones de sales biliares y temperaturas. Resultados. El plan de análisis permitió seleccionar dos aislados que se identificaron como: Lactobacillus plantarum 1 H1 y Lb. plantarum 1 H2. Las pruebas microbiológicas evidenciaron que las BAL seleccionadas inhibieron principalmente los enteropatógenos: Escherichia coli, Salmonella typhimurium y Clostridium perfringens. Las pruebas bioquímicas fueron compatibles con el género Lactobacillus, mostrando el siguiente perfil: Catalasa negativas; no productoras de gas; productoras de isómeros DL; resistentes a sales biliares y pH óptimo de crecimiento 3.5 a 38°C. Conclusiones. Los dos aislados de Lactobacillus plantarum 1 reunieron las características para el uso potencial como probióticos. Se recomienda su uso como complemento de terapias con antibióticos y en la elaboración de inóculos para aplicación en raciones alimenticias de lechones destetos, sin embargo, estudios complementarios se requieren para evaluar el efecto directo del probiótico como sustituto del uso de antibióticos in vivo.
Palabras clave: Lactobacillus plantarum, probióticos, antibióticos.
ABSTRACT
Objective. To characterize probiotic lactic acid bacteria isolated from adult pig intestine as an alternative to antibiotics. Materials and methods. For isolation of lactic acid bacteria, samples of large intestine of 20 adult pigs were included. The characterization of biochemical and physiological parameters of the lactic acid bacteria (LAB) required an evaluation of the pH of the ferment, determination of organic acids by HPLC and detection of lactic acid isomers. Microbiological processes assessed the capacity of inhibiting the growth of pathogenic and antagonistic activity of probiotic antibiotic vs competitive interaction. We used API CH 50 test to identify the LAB supplemented with gas production, catalase activity and viability at different concentrations of bile salts and temperatures. Results. The analysis plan allowed selection of two isolates that were identified as: Lactobacillus plantarum 1 H1 y L. plantarum 1 H2. Microbiological testing showed that the lactic bacteria selected inhibited the enteropathogens Escherichia coli, Salmonella typhimurium and Clostridium perfringens. The biochemical tests were consistent with the genus Lactobacillus, showed the following profile: catalase negative, non- gas producing, producing isomers DL; resistant to bile salts and pH optimum for growth of 3.5 to 38°C. Conclusions. The two isolates of L. plantarum 1 were considered eligible for potential use as probiotics. Its use is recommended in addition to antibiotic therapy and the development of inoculum for use in food rations for weaned piglets, however, additional studies are needed to assess the direct effect of probiotics as a substitute for antibiotics in vivo.
Key words: Lactobacillus plantarum, probiotics, antibiotics.
INTRODUCCIÓN
Una de las etapas de la vida del cerdo que más retos presenta a nivel sanitario es la de precebo, en la cual es común la presentación de diarreas ocasionadas por Escherichia coli, Clostridium perfringens, Salmonella typhimurium, produciendo deficientes ganancias de peso, pobre conversión alimenticia, trastornos en su sistema inmunológico y en casos severos la muerte del animal, llegando alrededor del 41% (1).
Uno de los procedimientos tradicionalmente utilizados consiste en el suministro de antibióticos, sin embargo, han sido empleados de modo y en dosis inadecuadas, generando la aparición de cepas resistentes, cada vez más patógenas y con implicaciones negativas en la salud humana y animal (2). Por este motivo, la Unión Europea ha prohibido su utilización, impulsando la investigación en aplicación de probióticos (3).
Una alternativa al uso de antibióticos son las bacterias lácticas probióticas suministradas a través de inóculos, con el propósito de equilibrar la microbiota intestinal (4). Los probióticos usados en cerdos reducen o eliminan los patógenos en el tracto gastrointestinal, así como residuos de antibióticos y otras sustancias análogas en productos finales, mejorando el índice de conversión y reduciendo la incidencia de diarreas (5).
La utilización de probióticos en la dieta depende en parte de la cepa utilizada; pues, no todas las cepas tienen la misma capacidad de modulación de la microflora intestinal o de unirse a las células intestinales (6). Los mejores probióticos son aislados de los intestinos de los cerdos, motivo por el cual este estudio pretendió buscar una alternativa para reducir o eliminar el uso de antibióticos en cerdos mediante la caracterización de bacterias lácticas aisladas del intestino grueso de porcinos adultos y verificar su desempeño in vitro para el tratamiento de infecciones bacterianas durante el destete.
MATERIALES Y MÉTODOS
Sitio de estudio. El presente estudio se realizó en el laboratorio de Microbiología y Biotecnología Aplicada de la sección de Biología Marina de la Facultad de Ciencias Naturales y Exactas y en el laboratorio de Biocatálisis y Fermentación de la Escuela de Ingeniería de Alimentos de la Universidad del Valle, sede de Meléndez, Cali, Colombia.
Recolección de muestras. Procedentes del intestino grueso (parte inicial, media y parte final) de 20 cerdos adultos tomados aleatoriamente para un total de 60 submuestras, en un número representativo y recolectadas en el matadero del municipio de Yumbo, de la finca “Flores Amarillas”, y del matadero de CAVASA ubicado en la vía Cali – Candelaria (Valle del Cauca).
Se incluyeron cerdos adultos para aumentar la viabilidad de los aislamientos de BAL en comparación de lechones destetos donde su edad y alimentación dificulta el éxito del cultivo in vitro.
Obtención y almacenamiento de microorganismos. Las muestras fueron sembradas por dilución en agar MRS (7), y azul de anilina para ayudar al reconocimiento de los microorganismos lácticos según Giraud (8) y Ramiréz, (9), incubándose por 48 horas a 32°C para seleccionar los microorganismos facultativos. Después del crecimiento de colonias, se realizó la coloración de Gram para verificar la pureza y seleccionar aquellas colonias con características similares. Finalmente se sembraron en caldo MRS, y criopreservaron en glicerol al (25%) a -20°C.
Selección de cepas
Análisis de producción de ácidos orgánicos por cromatografía líquida de alta eficiencia (HPLC) como método de diferenciación de cepas. Permitiendo caracterizar las bacterias en cuanto a la producción de ácido láctico determinando si son homo o hetero-fermentativas, estableciendo un perfil característico para cada especie (6), descartando fácilmente cepas con perfiles idénticos. Así, el caldo de crecimiento se centrifugó a 8500 r.p.m., filtrando el sobrenadante por membrana de 0.45 m.
La ácidos orgánicos fueron determinados por HPLC así: Solvente de fase móvil, ácido sulfúrico a pH 1.5; presión 800-900 PSI; volumen inyectado: 20 L; temperatura del horno: 65°C; columna BIORAD aminex HPX 87 H con soporte de resina transplantada H+ (copolímero de estireno y bisulfato de divinilbenzeno).
Poder de inhibición frente a patógenos y comparación frente a antibióticos.
Ensayos de inhibición in vitro. La selección de cepas inhibidoras de patógenos, se hizo siguiendo la métodología de Tagg y Mc Given (10) y Ramírez (9), utilizando bacterias de referencia como: Salmonella typhimurium ATCC 14028, Pseudomonas aeruginosa ATCC 9027, Staphylococcus aureus ATCC 25923, Escherichia coli ATCC 25922, Clostridium perfringens ATCC 13124, Serratia marcensces ATCC 13280, Klebsiella pneumoniae ATCC 700603, Proteus hauseri ATCC 13315, Yersinia enterocolitica ATCC 23715, Shigella flexneri ATCC 12022 y Vibrio spp. La determinación de la acción inhibitoria por sobrenadantes del cultivo, neutralizados y concentrados hasta el 10%, 25%, 50% frente a bacterias patógenas, se realizó por el método de difusión en pozos. El volumen de inoculo del sobrenadante fue de 200 mL a una densidad celular de acuerdo con la evaporación del mismo. El diámetro del pozo fue de 4 mm. El ensayo se hizo en agar CASO (Peptona de caseína, peptona de harina de soya, USP para microbiología).
En el caso de C. perfringens se probaron los sobrenadantes hasta el 75% y 100% de concentración. De igual manera, se aplicaron los ensayos de inhibición frente a los antibióticos: ampicilina (AMP) 10 µg, penicilina G (P) 10 µg, carbecinicilina (CAR) 100 µg,vancomicina (VA) 30 µg, amoxicilina (AML) 10 µg, aztreonam (ATM) 30 µg, tetraciclina (TE) 30 µg, eritromicina (E) 15 µg, oxitetraciclina (OT) 30 µg, y cloranfenicol (C) 30 µg, mediante la metodología de Dopazo et al (11) y Jorgensen et al (12), con el propósito de comparar la acción de las bacterias.
Finalmente se efectuaron ciclos de siembra de las bacterias lácticas seleccionadas frente a patógenos con una frecuencia determinada hasta cuando se presentara resistencia por parte de las patógenas frente a las bacterias lácticas.
Así, después de cada siembra, se observó la resistencia o sensibilidad de la bacteria patógena por la acción de la bacteria láctica. Si se presentaba sensibilidad, de ese mismo agar donde se había hecho la prueba se tomaba la bacteria patógena y se volvía a repetir la prueba en una frecuencia hasta cuando presentara resistencia.
Ensayos de interacción competitiva in vitro con aplicación de los probióticos seleccionados. Se probaron dosis de 1.0, 0.5 y 0.25 ml de los patógenos con cada una de las bacterias lácticas seleccionadas (dosis de 1.5, 1.0 y 0.5 ml) y concentración de 107 UFC/ml correspondiente a un Estándar Mc Farland 2, disponible en el kit API 50 CHL para bacterias lácticas. El inoculo se ajustó por espectrofotometría a una longitud de onda de 650 nanómetros, comparando la densidad óptica del inóculo hasta llegar a 0.243 equivalente a la densidad óptica del estándar 2.0 en la escala de Mc Farland.
Los inóculos de las bacterias patógenas fueron desarrollados en caldo TSA (Caldo Triptona Soja) a 30°C por 24 horas y ajustada la concentración a 107 UFC/ml. Los resultados de interacción competitiva fueron cuantificados por el método de conteo en placa, sembrando cada bacteria láctica con cada patógena en caldo TSA (Triptona soya), por un periodo de incubación por 24 horas. Posteriormente fueron sembrabas en agar Mac Conkey, agar Baird Parker y en agar MRS respectivamente, para determinar la presencia de crecimiento o de inhibición. Se evaluó por tinción de Gram morfología de la bacteria láctica.
Estudio de viabilidad frente a concentración de sales biliares. Utilizando el método de Yimin et al (13), probando concentraciones de 5 y 10% de sales biliares p/v, y efectuando la prueba de viabilidad.
Producción de gas. Siguiendo la metodología de Yimin et al (13).
Actividad de catalasa. Mediante la utilización de peróxido de hidrógeno sobre las colonias de las bacterias lácticas seleccionadas (14).
Viabilidad a diferentes concentraciones de pH. Según metodología de Yimin et al (13), con pH de 2, 3, 4 y 6.5.
Detección de los isómeros del ácido láctico. Según metodología de Jehanno et al (15).
Resistencia a diferentes niveles de temperatura. Según metodología de Yimin et al (13) y a temperaturas de 35, 40 y 45°C.
Análisis estadístico. Basado en la exploración de datos y una estadística descriptiva con métodos gráficos y estimativos.
Identificación bioquímica de las bacterias lácticas. Utilizando galerías API 50 (Biomereux) De Roissart y Luquet (16).
RESULTADOS
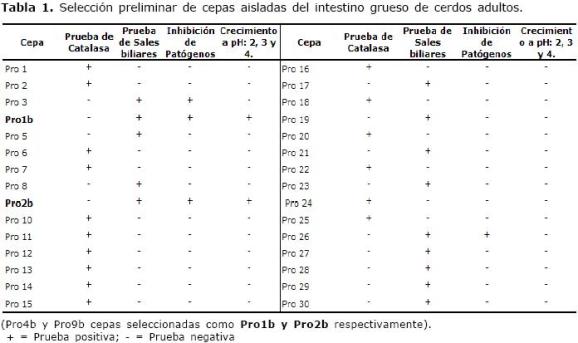
En la selección de las cepas, se aislaron 30 microorganismos con características de bacterias lácticas, utilizando el medio MRS con azul de anilina, presentando características diferentes en tamaño, borde, elevación y topografía entre otras. Los resultados de la caracterización de los microorganismos, muestran que las cepas (Pro 1b y Pro 2b), cumplieron con las características deseadas para microorganismos probióticos (Tabla 1).
Tabla 1. Selección preliminar de cepas aisladas del intestino grueso de cerdos adultos.
(Pro4b y Pro9b cepas seleccionadas como Pro1b y Pro2b respectivamente). + = Prueba positiva; - = Prueba negativa
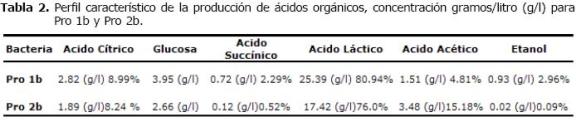
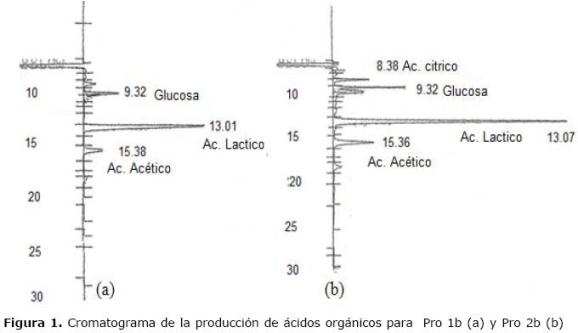
El analísis por HPLC, indica que la cepa Pro 1b fue homofermentativa, presentando una producción de ácido láctico del 80% y Pro 2b es heterofermentativa con presencia de ácido cítrico y acético (Tabla 2 y Figura 1).
Tabla 2. Perfil característico de la producción de ácidos orgánicos, concentración gramos/litro (g/l) para Pro 1b y Pro 2b.
Figura 1. Cromatograma de la producción de ácidos orgánicos para Pro 1b (a) y Pro 2b (b)
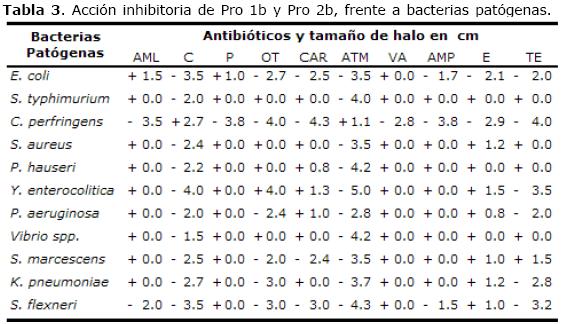
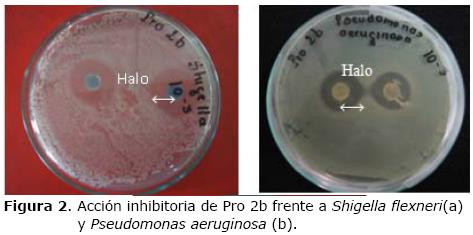
En la prueba de acción inhibitoria, Pro 1b y Pro 2b, presentaron inhibición frente a E. coli, S. aureus y P. aeruginosa, Shigella flexneri hasta el cuarto ciclo (Tabla 3 y Figura 2).
Tabla 3. Acción inhibitoria de Pro 1b y Pro 2b, frente a bacterias patógenas.
Figura 2. Acción inhibitoria de Pro 2b frente a Shigella flexneri(a) y Pseudomonas aeruginosa (b).
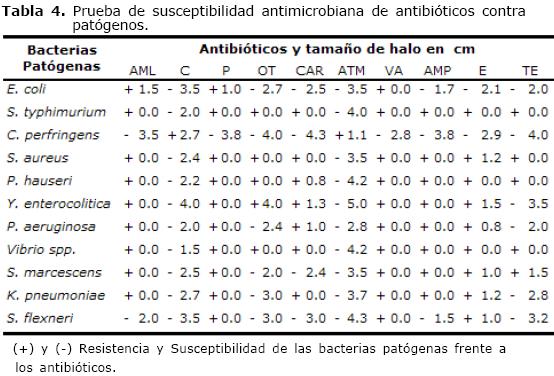
Los resultados de la prueba de susceptibilidad antimicrobiana de antibióticos frente a bacterias patógenas aparecen en la tabla 4.
Tabla 4. Prueba de susceptibilidad antimicrobiana de antibióticos contra patógenos.
(+) y (-) Resistencia y Susceptibilidad de las bacterias patógenas frente a los antibióticos.
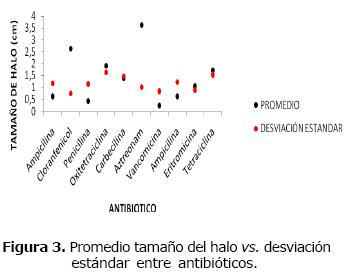
La figura 3 explica la relación del tamaño del halo promedio asociado a cada antibiótico (puntos negros) y la desviación promedio de los tamaños con respecto al tamaño promedio (puntos rojos).
Figura 3. Promedio tamaño del halo vs. desviación estándar entre antibióticos.
Se observa que los tamaños de halo de los antibióticos aztreonam con un promedio de halo más alto y una varianza considerablemente pequeña corroboran lo presentado en la tabla 4 donde se muestra una mayor susceptibilidad por parte de las bacterias patógenas a este antibiótico; el antibiótico vancomicina su promedio fue menor que la varianza y el coeficiente de variación es mayor que la unidad, donde las bacterias patógenas fueron resistentes; indicando que existe mucha variabilidad entre de los antibióticos.
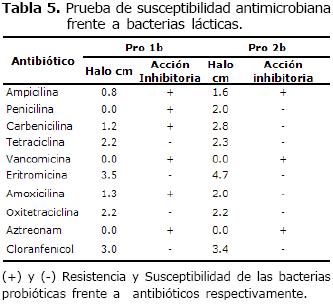
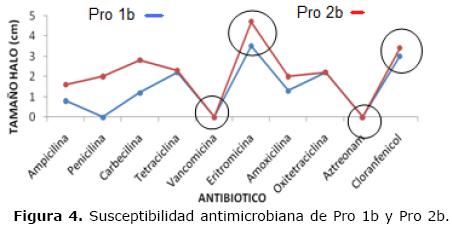
La prueba de susceptibilidad antimicrobiana frente a bacterias lácticas probióticas, indica Pro 1b mostró resistencia a la ampicilina, carbenicilina, vancomicina, ampicilina y amoxicilina; y fue sensible a la tetraciclina, eritromicina. En cambio, Pro 2b mostró ser resistente a la ampicilina, vancomicina y amoxicilina; y fue sensible a la tetraciclina, eritromicina, oxitetraciclina, carbecinicilina, penicilina, cloranfenicol y ampicilina (Tabla 5).
Tabla 5. Prueba de susceptibilidad antimicrobiana frente a bacterias lácticas.
(+) y (-) Resistencia y Susceptibilidad de las bacterias probióticas frente a antibióticos respectivamente.
La figura 4 explica como Pro 1b y Pro 2b presentaron la mayor susceptibilidad para el antibiótico eritromicina y cloranfenicol; mientras que la mayor resistencia se presentó para los antibióticos vancomicina y aztreonam. Para el antibiótico penicilina, Pro 1b mostró resistencia, en cambio para Pro 2b presentó susceptibilidad a este antibiótico.
Figura 4. Susceptibilidad antimicrobiana de Pro 1b y Pro 2b.
La aplicación de los sobrenadantes de Pro 1b al 90% de evaporación inhibieron a E. coli, S. typhimurium, S. flexneri, S. aureus y P. hauseri. A una evaporación del 50%, inhibieron el crecimiento de S. aureus, S. flexneri y P. hauseri. Además, a una evaporación del 25% inhibieron a S. aureus. Finalmente a un 25% y a 0% de evaporación inhibieron a C. perfringens. Las diferentes concentraciones de los sobrenadantes no inhibieron el crecimiento de P. aeruginosa, S. marcescens y K. pneumoniae. La aplicación de los sobrenadantes al 90% de evaporación para Pro 2b, inhibieron a P. aeruginosa y S. aureus; a una evaporación del 25% inhibieron a E. coli, S. typhimurium, P. hauseri, S. aureus y K. pneumoniae, y a una evaporación del 50% para S. aureus, S. flexneri y P. hauseri inhibieron su crecimiento. Para S. marcescens los diferentes niveles de evaporación no ejercieron efecto inhibitorio. A niveles de evaporación de 25% y 0% Pro 2b inhibieron a C. perfringens. Los ensayos de interacción competitiva in vitro entre Pro 1b y Pro 2b presentaron efecto de inhibición de su crecimiento entre sí, indicando que no se pueden usar las dos cepas conjuntamente.
En la interacción competitiva de Pro 2b (1ml) contra E. coli, S. typhimurium, C. perfringens y S. aureus (0.25, 0.50 y 1 ml), esta dosis inhibieron el crecimiento de estos patógenos. A una dosis de 0.5 ml Pro 2b inhibió el crecimiento de E. coli, S. typhimurium, C perfringens y S. aureus (0.25, 0.50 y 1 ml), excepto para un valor de 1 ml usado en C. perfringuens, S. typhimurium y para 0.5 ml usado en E. coli. Los resultados de la interacción competitiva de Pro 2b (1.5 ml) inhibió el crecimiento de E. coli, S. typhimurium, C. perfringens y S. aureus (0.25, 0.50 y 1 ml), excepto para 0.5 ml usado en S. typhimurium.
La interacción competitiva de Pro 1b (1ml) inhibió el crecimiento de E. coli, S. typhimurium, C. perfringens y S. aureus (0.25, 0.50 y 1 ml), excepto para 1 ml usado en S. typhimurium. Los resultados de Pro 1b (0.5 ml) inhibieron a E. coli, S. typhimurium, C perfringens y S. aureus (0.25, 0.50 y 1 ml). Finalmente, Pro 1b a una dosis de 1.5 ml inhibió el crecimiento de E. coli, C. perfringens, S. typhimurium y S. aureus (0.25, 0.50 y 1 ml).
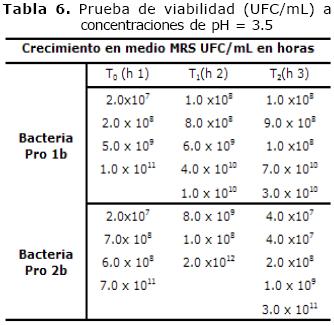
La viabilidad a diferentes tiempos en pH= 3.5 aparece en la Tabla 6. La prueba de catalasa para Pro 1b y Pro 2b fue negativa.
Tabla 6. Prueba de viabilidad (UFC/mL) a concentraciones de pH = 3.5
Los resultados de la prueba de crecimiento a 50°C por 24 horas, no presentaron crecimiento, para Pro 1b y Pro 2b. A 45°C por 24 horas, Pro 1b y Pro 2b presentaron un crecimiento de 1.0 x107 UFC/ml y 3.0 x 1011 UFC/ml respectivamente. Finalmente a 38°C por 24 horas, Pro 1b y Pro 2b mostraron un crecimiento de 4.0 x 108, 5.0 x 109 UFC/ml, y de 1.0 x 108, 6.0 x 108 y 1.0 x 109 UFC/ml respectivamente.
La prueba de producción de gas para Pro 1b y Pro 2b fue negativa (ausencia de crecimiento).
A una concentración del 10% de sales biliares Pro 1b y Pro 2b mostraron un crecimiento de 9.0 x 107, 2.0 x 108 y 2.0 x 1010 UFC/ml, y de 1.0 x 108, 1.0 x 107 y 1.0 x 108 UFC/ml respectivamente.
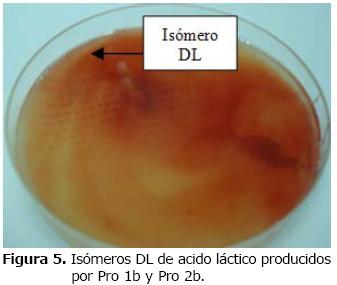
Pro 1b y Pro 2b a una concentración del 5% de sales biliares indicaron un crecimiento de 2.0 x 106 UFC/ml, y de 4.0 x 107, 2.0 x 108 y 3.0 x 1010 UFC/ml respectivamente. Las bacterias Pro 1b y Pro 2b fueron productoras del isómero DL (Tabla 7 y Figura 5), que según la FAO/WHO (10) no produce efectos tóxicos en la salud humana o animal.
Tabla 7. Cepas Pro 1b y Pro 2b productoras de isómeros DL del acido láctico.
Figura 5. Isómeros DL de acido láctico producidos por Pro 1b y Pro 2b.
Por medio de la galería API 50 CHL, fueron identificadas bioquímicamente las cepas Pro 1b y Pro 2b como Lactobacillus plantarum 1, las cuales presentaron como característica especial un comportamiento bioquímico igual al fermentar el azúcar 2-cetogluconato potásico y se diferenciaron en la fermentación del azúcar D-sorbitol, ya que Pro 1b presentó una fermentación positiva y Pro 2b fue negativa. Para diferenciarlas se nombraron como L. plantarum 1 H1 (Pro 1b) y L. plantarum 1 H2 (Pro 2b).
DISCUSIÓN
La importancia de aislar bacterias lácticas probióticas del cerdo, para utilizarlas en la misma especie es fundamental por la especificidad del hospedero, fortaleciendo su sistema inmunológico, facilitando la colonización de las bacterias lácticas y su acción probiótica. Esto constituye una alternativa basada en la limitación del crecimiento de patógenos en el intestino, fomentando el crecimiento de otras bacterias que compitan contra estas en la colonización de los nichos intestinales, es decir la “exclusión competitiva” (17).
Los probióticos puede sustituir las terapias con antibióticos como un método menos agresivo, siendo una nueva visión en la industria farmacéutica, desde el aislamiento de probióticos de ecosistemas específicos tales como un hato o región geográfica, caracterizar las bacterias responsables de la acción probiótica, producirlas a escala industrial, procesarlas y reintroducirlas a la dieta del animal. En muchos casos el uso no selectivo de probióticos distribuidos por casas comerciales ha resultado baja o nula eficiencia en el aumento de la producción, debido a que los probióticos adquiridos proceden de otras regiones geográficas o incluso de otras especies animales (18).
Los resultados de cromatografía líquida (HPLC), demostraron que L. plantarum 1 H1 presenta un comportamiento homofermentativo con producción del 80% de ácido láctico, existiendo una diferencia entre las dos cepas. La presencia de ácido láctico podría actuar como inhibidor de microorganismos patógenos debido a su mayor prevalencia. Además, las bacterias con una alta producción de ácido láctico, disminuyen el pH del medio (9).
La prueba de susceptibilidad antimicrobiana entre antibióticos y bacterias patógenas, indicó que los antibióticos con mejores resultados fueron oxitetraciclina, aztreonam y cloranfenicol, este último por su toxicidad en animales y humanos, ha sido prohibido. Estos resultados son importantes porque uno de los problemas más significativos en la producción porcina es la alta mortalidad (41%), especialmente en la lactancia y destete ocasionada por diarrea bacteriana (1,2).
En la prueba de susceptibilidad antimicrobiana entre antibióticos y bacterias lácticas probióticas, L. plantarum 1 H1 presenta resistencia a la mayoría de antibióticos utilizados, mostrando sensibilidad a tetraciclina, eritromicina, oxitetraciclina y cloranfenicol. Lo anterior permite predecir que de las dos BAL seleccionadas en esta investigación (L. plantarum 1 H1 y L. plantarum 1 H2), se recomienda el uso de L. plantarum 1 H1 como coadyuvante en la terapia antibiótica ya que según los resultados de la prueba in vitro el microorganismo presenta resistencia a la mayoría de antibióticos utilizados, en contraste con la sensibilidad observada de L. plantarum 1 H2. Mientras que L. plantarum 1 H2 fue resistente a ampicilina, vancomicina y aztreonam, por lo cual L. plantarum 1 H1 sería recomendable estudios previos fase III (modelo animal in vivo), para evidenciar su uso como alternativa a antibióticos en cerdos. La sensibilidad de las cepas podría depender de la resistencia a ciertas concentraciones de antibióticos, debido a la presencia de algunos plásmidos, o a propiedades particulares de la pared y membrana de estos microorganismos haciéndolos impermeables a antibióticos. Además, el género Lactobacillus es sensible a penicilina y coincidieron con la susceptibilidad de L. plantarum 1 H2 (19).
Según este comportamiento y los resultados estadísticos, estas bacterias lácticas generan mucha variabilidad frente a la aplicación de los 10 antibióticos, es decir, no existe un comportamiento constante que determine con certeza el grado de susceptibilidad o resistencia de una bacteria, aunque el promedio de L. plantarum 1 H1 indicó más resistencia a los 10 antibióticos que L. plantarum 1 H2.
En las pruebas de acción inhibitoria de L. plantarum 1 H1 y L. plantarum 1 H2 frente a las bacterias patógenas presentaron actividad antimicrobiana hasta un cuarto ciclo de siembra. Esta acción pudo ser por la producción de substancias inhibitorias como: ácido láctico, peróxido de hidrógeno y los sobrenadantes, posiblemente bacteriocinas, característico del metabolismo de las bacterias lácticas (20).
En el caso de los sobrenadantes producidos por L. plantarum 1 H1 se presentó su mayor acción inhibitoria a un nivel de concentración del 10%, en contraste para L. plantarum 1 H2 fue al 25% de concentración del sobrenadante, lo que indica que si bien son muy eficaces estas 2 bacterias probióticas contra la mayoría de patógenos, estos niveles de concentración tan altos resultan ser muy costosas y de difícil obtención. Sin embargo, no debe olvidarse cuál puede ser el tipo de compuesto inhibitorio que producen estos dos microorganismos y se recomendaría efectuar estudios referentes a la identificación de ellos.
Un resultado importante se obtuvo cuando los dos microorganismos seleccionados a niveles de evaporación del 0 y 25% de los sobrenadantes inhibieron el crecimiento de C. perfringens. Esto puede ser debido a la acción de las biocinas (20).
En la interacción competitiva de L. plantarum 1 H2 (1ml) contra E. coli, S. typhimurium, C. perfringnes y S. aureus, fue capaz de inhibir su crecimiento; y para L. plantarum 1 H1 (0.5 y 1.5 ml) contra E. coli, S. typhimurium y S. aureus también fue capaz de inhibir su crecimiento. Según lo anterior, L. plantarum 1 H2 resulta ser el más indicado para su uso debido que se requiere una dosis menor de aplicación para su acción inhibitoria obteniendo como resultado un menor costo en su producción (21).
En la prueba de interacción competitiva entre L. plantarum 1 H1 y L. plantarum 1 H2, se observó que se inhiben entre sí, por lo tanto, para este estudio no sería viable una mezcla de estos microorganismos para la elaboración de inóculos.
Los resultados de la prueba de viabilidad a diferentes concentraciones de pH, son de gran importancia para saber si las bacterias probióticas a utilizar presentan una viabilidad alta a pH bajo, como es el caso del que se presenta en el estómago del lechón, donde puede alcanzar valores hasta de pH 2.0, indicándo que los probióticos seleccionados son los apropiados para favorecer los procesos de fermentación, en la producción de inóculos. La tolerancia a ácidos es una de las primeras propiedades evaluadas al seleccionar cepas probióticas (22).
Los resultados obtenidos demostraron la capacidad de las cepas para sobrevivir en condiciones drásticas de acidez. De otro modo, esta resistencia a pH bajos, favorece la inhibición de patógenos a lo largo del tracto intestinal, favoreciendo los sitios de adhesión de los microorganismos lácticos (23). Además, se pudo observar que en la prueba de pH a 3.5 las viabilidades en el tiempo T0, T1 y T2 de L. plantarum 1 H2 y L. plantarum 1 H1, los resultados fueron similares excepto con una pequeña variación en el tiempo T2, indicando, que si el lechón consume el alimento, hasta las tres horas las bacterias lácticas del inóculo mantienen una viabilidad alta (mayor a 3.0 x 108 UFC/ml), por lo tanto su acción probiótica será eficaz contra los microorganismos patógenos presentes en el intestino del animal.
La prueba de catalasa de las dos cepas fueron negativas, característica general del genero Lactobacillus, y concuerda con Roissart y Luquet (16), quienes describen que las cepas lácticas carecen de la enzima.
Los resultados de la producción de gas para L. plantarum 1 H1 y L. plantarum 1 H2 fueron negativos, constituyendo una importante característica probiótica de las bacterias lácticas utilizadas en la alimentación animal y que pueden evitar que el animal presente enfermedades como el meteorismo, que en casos severos llevan a la muerte del mismo.
Al analizar el efecto de diferentes temperaturas en el crecimiento de las cepas de bacterias lácticas se observó que además de la temperatura óptima de crecimiento (32°C), las 2 bacterias seleccionadas presentaron una termotolerancia con un gran crecimiento a una temperatura de 38°C (24).
L. plantarum 1 H1 y L. plantarum 1 H2 demostraron que son capaces de crecer a altas concentraciones de sales biliares (5 y 10%). Según Brizuela (6) esta capacidad de crecer en presencia de altas concentraciones de bilis a las que pueden encontrarse en el intestino (0.15%) es un parámetro importante (25-26), para los microorganismos que componen los preparados probióticos para ser administrados por vía oral a animales. Esto les permite pasar a través del tracto gastrointestinal sin sufrir alteraciones en su comportamiento fisiológico. Así, para que una cepa probiótica ejerza una óptima actividad es imprescindible que sea capaz de manifestar una actividad metabólica que le permita colonizar el intestino delgado; por lo que la tolerancia a bilis, es un criterio esencial de selección de bacterias lácticas (27).
Las dos bacterias seleccionadas presentaron producción de isómeros DL de acido láctico, lo cual constituye una importante característica probiótica, ya que según la FAO (3) y Jehanno et al (15), recomiendan para uso humano o animal y para la elaboración de los inóculos los isómeros DL o L+ de ácido láctico, rechazando el uso del ácido láctico D (-) por sus efectos secundarios.
En conclusción, Lactobacillus plantarum 1 H1 y Lactobacillus plantarum 1 H2 mostraron un gran perfil de bacterias lácticas con características probióticas, siendo una alternativa para sustituir las terapias con antibióticos como un método menos agresivo y una nueva visión en la industria farmacéutica. Además, estos microorganismos serían utilizados en la fabricación de inóculos y posterior aplicación mediante el procesamiento e introducción en la ración para los lechones destetos.
Agradecimientos
A la empresa CERDOS DEL VALLE S.A. (CERVALLE), de la ciudad de Cali, por la financiación de esta investigación que constituyen los resultados preliminares del trabajo de tesis doctoral desarrollado en la Universidad del Valle. A la Escuela de Ingeniería de Alimentos y al personal del laboratorio de Microbiología y Biotecnología Aplicada de la sección de Biología Marina de la Facultad de Ciencias Naturales y Exactas. A todas personas que de una u otra manera colaboraron para el desarrollo de esta investigación.
REFERENCIAS
1. Mejía-Silva W, Rubio-Guillén J, Calatayud-Márquez D, Rodríguez-Caldera A, Quintero-Moreno A. Evaluación de dos probióticos sobre parámetros productivos en lechones lactantes. Zoot Trop 2007; 25:301-306. [ Links ]
2. Pérez N, Fajardo P, Mendez J, Cachaldora P, Pastrana CL. Production of four potentially probiotic lactic acid bacteria and their evaluation as feed additives for weaned piglets. Anim Feed Sci Technol 2006; 134: 89-107. [ Links ]
3. FAO/WHO Working Group. Guidelines for the evaluation of probiotics in food, 2002 (Fecha de acceso 5 de enero de 2005) URL disponible en: ftp://ftp.fao.org/es/esn/food/wgreport2.pdf. [ Links ]
4. Oyetayo VO, Oyetayo FL. Potential of probiotics as biotherapeutic agents targeting the innate immune system. Afr J Biotechnol 2005; 4: 123-127. [ Links ]
5. Figueroa J, Chi E, Cervantes M, Dominguez A. Alimentos funcionales para cerdos al destete. Vet Méx 2006; 37: 117-136. [ Links ]
6. Briizuela MA. Selección de cepas de bacterias ácido lácticas para la obtención de un preparado con propiedades probióticas y su evaluación en cerdos. [Tesis doctoral] La Habana: Instituto Cubano de los Derivados de la Caña de Azúcar, ICIDCA, Facultad de Ciencias Veterinarias; 2003. [ Links ]
7. De man JC, Rogosa M. and Sharpe, M.E. A medium for the Cultivation of Lactobacilli. J Appl Bact 1960 ; (23) : 130-135. [ Links ]
8. Giraud E. Contribution a l'etude physiologique et ezimologique d'une nouvelle souche de Lactobacillus plantarum amylolytique isolee du mandioc fermente. [Thése] Marseille: Université demProvence aix; 1992. [ Links ]
9. Ramírez C. Uso de bactérias lácticas probióticas na alimentação de camarões Litopenaeus vannamei como inibidoras de microrganismos patogênicos e estimulantes do sistema imune. [Tese de doutorado]. Curitiba: Universidade Federal do Paraná, Setor de Tecnología; 2005. [ Links ]
10. Tagg JR, Mc. Given AR. Assay sistem for bacteriocins. J Appl Microbiol 1971; 21:943. [ Links ]
11. Dopazo CP, Lemos ML, Lodeiros C, Bolinches J, Barja L, Toranzo AL. Inhibitory activity of antibiotic-producing marine bacteria against fish pathogens. J Appl Bacteriol 1998; 65: 97-101. [ Links ]
12. Jorgensen JH, Turnidge JD, Washington JA. Antibacterial susceptibility tests: dilution and disk diffusion methods. In: Myrray, PR, Pfaller MA, Tenover FC, Baron EJ, Yolken RH. Manual of clinical microbiology. 7th ed. Washington, DC: ASM Press; 1999. [ Links ]
13. Yimin C, Yoshimi B, Takashi N, Tae-Kwang O. Specific probiotic characterization of Weissella hellenica DS-12 isolated from flounder intestine. In: Ramírez C. Uso de bactérias lácticas probióticas na alimentação de camarões Litopenaeus vannamei como inibidoras de microrganismos patogênicos e estimulantes do sistema imune. [Tese de doutorado]. Curitiba: Universidade Federal do Paraná, Setor de Tecnología; 2005. [ Links ]
14. Dahl TA, Midden WE, Hartman DE. Comparation of killing of Gram-negative and Gram-positive Bacteria by Pure Singlet Oxygen. In: Ramírez C. Uso de bactérias lácticas probióticas na alimentação de camarões Litopenaeus vannamei como inibidoras de microrganismos patogênicos e estimulantes do sistema imune. [Tese de doutorado]. Curitiba: Universidade Federal do Paraná, Setor de Tecnología; 2005. [ Links ]
15. Jehanno D, Thuault D, Bourgeois C. M. Development of a Method for Detection of Lactic Acid Bacteria Producing Exclusively the L (+) Isomer of Lactic Acid. J Appl Environ Microbiol 1992; 58:4061-4067. [ Links ]
16. De Roissart H, Luquet FM. Bacteries lactiques Aspects Fondamentaux et Technologiques. 2 Ed. France: Lorica; 1994. [ Links ]
17. Pluske J, Pethick D. El impacto de la nutrición sobre desórdenes y enfermedades de tipo entérico en porcino. Australia: Murdoch University; 2005. [ Links ]
18. Schrezenmeir J, De Vrese, M. Probiotics, prebiotics and symbiotics: approaching a definition. Am J Clinical Nutr 2001; 73 (2):361-364. [ Links ]
19. Ramayoni S, Chivas M. Estudio de la actividad antimicrobiana de extractos naturales y ácidos orgánicos. Posible alternativa a los antibióticos promotores de crecimiento. [Tesis de maestría]. Barcelona: Universitat Autònoma de Barcelona, Departament de sanitat i anatomia animals; 2007. [ Links ]
20. Savadogo A, Ouattara CA, Bassole IH, Traore AS. Bacteriocins and lactic acid bacteria: a mini review. Afr J Biotechnol 2006; 5 (9):678-683. [ Links ]
21. Finegold SM and Baron EJ. Bailey and Scott's Diagnostic Microbiology. 7 th ed. St Louis: C.V. Mosby; 1986. [ Links ]
22. Tuomola EM, Crittenden R, Playne M, Isolauri E, Salminen SJ. Quality assurance criteria for probiotic bacteria. Am J Clin Nutr 2001; 73: 393-398. [ Links ]
23. Iñiguez C, Perez R, Acedo E. Evaluation of probiotics properties in Lactobacillus isolated from small intestine of piglts. Latinoam Microbiol 2007; 49:3-4. [ Links ]
24. Taras D, Vahjen W, Simon O. Probiotics in pigs - modulation of their intestinal distribution and of their impact on health and performance. Liv Sc 2007; 108:229-231. [ Links ]
25. Carr FJ, Chill D, Maida N. The lactic Acid Bacteria: A Literature. Crit Rev Microbiol 2001; 28:281-370. [ Links ]
26. Pieper R, Janczyk P, Urubschurov V, Korn U, Pieper B, Souffrant WB. Effect of a single oral administration of Lactobacillus plantarum DSMZ 8862/8866 before and at the time point of weaning on intestinal microbial communities in piglets. Int J Food Microbiol 2009; 130 (3):227-232. [ Links ]
27. Maré L, Wolfaardt GM, Dicks LM. Adhesion of Lactobacillus plantarum 423 and Lactobacillus salivarius 241 to the intestinal tract of piglets, as recorded with fluorescent in situ hybridization (FISH), and production of plantaricin 423 by cells colonized to the ileum. J Applied Microbiol 2006; 100(4):838-845. [ Links ]