Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista MVZ Córdoba
Print version ISSN 0122-0268On-line version ISSN 1909-0544
Rev.MVZ Cordoba vol.14 no.2 Córdoba May/Aug. 2009
REVISIÓN DE LITERATURA
ZOONOSIS TRANSMITIDAS POR ANIMALES SILVESTRES Y SU IMPACTO EN LAS ENFERMEDADES EMERGENTES Y REEMERGENTES
ZOONOTIC TRANSMITTED BY WILD ANIMALS AND ITS IMPACT ON EMERGING AND RE-EMERGING DISEASES
Santiago Monsalve B*, M.Sc, Salim Mattar V, Ph.D, Marco González T, M.Sc.
Universidad de Córdoba, Facultad de Medicina Veterinaria, Departamento de Ciencias Pecuarias. Instituto de Investigaciones Biológicas del Trópico. Montería, Córdoba, Colombia.
*Correspondencia: santiagomonsalve@hotmail.com
Recibido: Enero 28 de 2009; Aceptado: Julio 15 de 2009
RESUMEN
Las enfermedades emergentes y reemergentes originadas desde animales de vida silvestre, pueden ser transmitidas a las poblaciones humanas por contacto directo o por vectores. Las zoonosis determinan una gran problemática social epidemiológica. La relación que tiene las enfermedades emergentes y reemergentes está ligada a la pérdida de la biodiversidad por factores antropogénicos, debido a la destrucción de hábitats naturales, el tráfico de fauna y a la pérdida de diversidad genética. Todos estos aspectos juegan un papel en la aparición de las patologías de origen infeccioso. Esta revisión intenta acercarse al conocimiento de las zoonosis transmitidas por animales silvestres y su impacto en las enfermedades emergentes y reemergentes.
Palabras clave: Zoonosis, animales salvajes, enfermedades emergentes y reemergentes.
ABSTRACT
Emerging and re-emerging infectious diseases originated in wild life animals can be transmitted to human population either by direct contact or by vectors. Zoonosis are of big social and epidemiological concern. The arising of emerging infectious diseases is linked to loss of biodiversity by anthropogenic factors due to destruction of natural habitats, fauna and flora smuggling and the loss of genetic diversity. All this aspects play a role in the arising of reemerging infectious diseases. This review approaches to the knolewdge of zoonosis transmitted by wild animals to human beings and the impact of these conditions in the epidemiology of emerging and re-emerging infectious diseases.
Key words: Zoonoses, wild animals, emerging diseases, re-emerging infectious diseases.
INTRODUCCIÓN
Los patógenos de animales silvestres contribuyen al incremento de las enfermedades emergentes y re-emergentes como una amenaza para la salud pública. La emergencia de estas y otras enfermedades humanas ocurren cuando los gérmenes de los hospedadores pueden saltar y mutar en la especie humana. Los patógenos pueden seguir transfiriéndose entre diferentes especies animales, y continuar siendo reservorios, convirtiéndose así en enfermedades epizoóticas (1).
La importancia de las enfermedades emergentes y reemergentes ha sido documentada, por ejemplo, los datos epidemiológicos sugieren que una alta mortalidad en la población humana se podría presentar si los virus AH1N1 y AH5N1 adquirieran una eficiente transmisibilidad de humano a humano y simultáneamente mantuvieran una alta patogenicidad. Una evidencia contundente de este caso lo constituye el virus de la influenza en la gran epidemia española de 1918, la más devastadora en la historia de la humanidad que causó la muerte de más de 40 millones de personas (2). La habilidad de infección del virus H5N1, se da en un amplio rango de especies de aves y mamíferos, causando pandemias zoonóticas periódicas (1). La actual amenaza de enfermedades emergentes como la nueva influenza A es motivo de alarma epidemiológica.
Factores de expansión de las enfermedades emergentes y reemergentes y alteración del ecosistema. Los cambios antrópicos en la vida silvestre, el aumento demográfico y la mayor tasa de contacto entre seres humanos, vida silvestre y animales domésticos es posible que hayan conducido a la aparición de nuevas enfermedades en humanos y animales (3). También los cambios climáticos en el planeta han producido alteraciones en los patrones de comportamiento de los huéspedes y vectores. Igualmente la entrada abrupta del humano al ecosistema de los bosques y llanuras, otrora habitadas por animales e insectos que vivían en equilibrio. El incremento de casos de dengue, malaria, rabia y fiebre amarilla y su paso de la selva a la ciudad, es un hecho dramático que se padece en la actualidad.
La alteración en los ecosistemas puede crear condiciones que facilitan la aparición o dispersión de nuevas enfermedades. Los patógenos emergentes son aquellas que surgen en una población por primera vez, o que han existido y que rápidamente incrementan su prevalencia. Las enfermedades emergentes han estado relacionadas con grandes mortalidades en la vida silvestre. Un ejemplo de esto se dio en el año 2003 cuando se confirmó la presencia de fiebre amarilla por histopatología en el hígado de monos aulladores (Alouatta seniculus) procedentes del Parque Ecológico Los Besotes (municipio de Valledupar, Cesar) (4).
También existen factores de riesgo que incrementan las enfermedades infecciosas emergentes y reemergentes, como los vectores de fauna silvestre. Los cambios repentinos en el medio ambiente o en las características de los huéspedes o de los agentes pueden alterar el estado de equilibrio. Es posible entonces que las enfermedades, por ejemplo las tropicales, sean producto algunas veces de la alteración de los patógenos, los vectores y el medio ambiente (1, 5).
Otras formas de expansión en las enfermedades infecciosas emergentes y reemergentes, surgen de los mecanismos de transmisión de ciertas patologías, que inicialmente fueron originadas desde una especie animal, en la cual la zoonosis a humanos aparece como un evento raro. Esta se da por un salto del patógeno al hombre, que es poco frecuente, pero que perpetúa la enfermedad temporal o permanentemente. Como consecuencia, el ciclo humano-humano mantiene la infección en algunos periodos de tiempo, como el caso del VIH, influenza A, virus del Ébola y el virus del síndrome agudo respiratorio severo (SARS) (3).
De igual manera existen formas de expansión como las zoonosis en los cuales se encuentran involucrados directamente los vectores animales como factores desencadenantes de infección humana (pulgas, garrapatas, mosquitos, etc). En este caso, las especies animales son los principales reservorios de los patógenos y la transmisión horizontal de humano a humano es rara, esta se da en enfermedades como lyssavirus, enfermedad de Lyme (borreliosis), plaga, tularemia, leptospirosis, leishmaniosis, ehrlichiosis, virus Nipah, virus del oeste del Nilo y hantavirus (6,7).
Además de la alteración de ecosistemas, de origen natural o antropogénico; que conlleva a la aparición de las enfermedades emergentes, también participan en el incremento de estas patologías los movimientos de patógenos o de vectores que se dan por vías humanas o por factores fisiológicos normales de fauna silvestre (migraciones animales). También predisponen los cambios mutagénicos en patógenos o en la capacidad de métodos modernos del diagnóstico de los mismos.
Las enfermedades emergentes y reemergentes tiene su origen principalmente en bacterias y rickettsias (54.3%), La coexistencia de estas con los vectores, los animales reservorios, y la entrada abrupta del hombre al ciclo con la consecuente adquisición de la infección hacen de este tipo de patógenos las principales enfermedades en el mundo, basado en el porcentaje de origen en su etiología. Luego en importancia es seguida por virus y priones (25.4%) (53). La emergencia o reemergencia de las enfermedades virales puede deberse, entre otros muchos factores, a cambios del virus originados en mutaciones o recombinaciones genéticas, o bien a alteraciones ambientales que afectan la relación virus-huésped. Con relación a este último aspecto, las zoonosis son el origen más frecuente de la emergencia de las infecciones virales: virus que naturalmente no infectan al ser humano pero que son transmitidos accidentalmente de otras especies. Entre las enfermedades parasitarias es posible encontrar varios ejemplos de patologias emergentes, algunas de las cuales han aumentado su prevalencia radicalmente, como la malaria y la leishmaniosis.
Hay factores específicos precipitantes, ecológicos, ambientales y demográficos que exponen al hombre en estrecho contacto con patógenos que originan enfermedades emergentes o reemergentes, con sus reservorios o sus vectores. A esto se suma la evolución, siempre en acción de los microorganismos, combinando variantes particularmente virulentas con elementos selectivos (8).
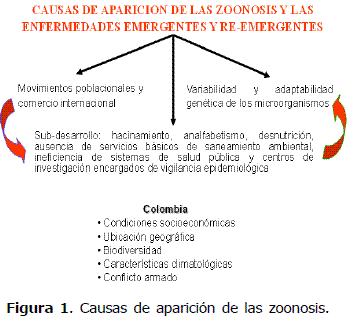
Muchas infecciones corresponden a zoonosis, debido a que el hombre penetra en los hábitats de diferentes animales normalmente lejanos a centros y cabeceras urbanas. La mayoría de las enfermedades parecen originarse con patógenos ya presentes en el medio, y que emergen por presiones selectivas o por factores favorecedores, entre los cuales, las condiciones socio-geográficas, de orden público y de marginalidad en Colombia ofrecen predisposición a la aparición de patologías (Figura 1).
Mecanismos de aparición de las enfermedades relacionadas con alteraciones antrópicas de los ecosistemas. La aparición de enfermedades zoonóticas, emergentes y reemergentes relacionadas con la sustentación de los recursos naturales; no está separada del uso sostenible de los mismos, ni aislada de los cambios sociales, económicos y políticos que afectan a los países ni a los seres humanos que en ellos habitan. Olvidar las demandas impuestas por las necesidades, pone en riesgo a la conservación misma al intentar implementar políticas que no atienden las necesidades de todos los sectores involucrados. La medicina de la conservación y la epidemiología se valen también de la experiencia y conocimientos de investigadores provenientes de disciplinas como las ciencias sociales, ciencias políticas y ciencias económicas (9).
Otro mecanismo de transmisión de patógenos zoonoticos es la vía de contagio por transmisión de animal a hombre, directa o mediada por vectores, en donde la fauna silvestre es el principal reservorio actuando como hospedador de estos agentes causales, y estableciendo que rara vez se den transmisiones entre las personas. Entre los ejemplos de patógenos que actúan de este modo figuran el de la rabia y otros lyssavirus, el virus Nipah, el virus del oeste del Nilo, el hantavirus o los agentes de la enfermedad de Lyme, la peste, la tularemia, la leptospirosis y la erlichiosis. En general, en todas las enfermedades emergentes y reemergentes potencialmente zoonóticas, la vida silvestre y los vectores transmisores de enfermedad, juegan un rol determinante con una tendencia a aumentar en el tiempo (1, 10).
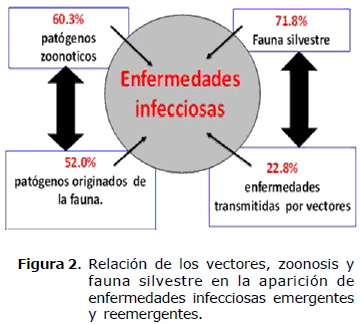
La aparición de enfermedades emergentes se origina algunas veces de la fauna silvestre. Estas son coadyuvadas cuando existen alteraciones antrópicas o naturales del medio natural donde surge el desplazamiento de los microorganismos. También los cambios espontáneos en la estructura genética de los microorganismos, o en las pautas epidemiológicas de su reconocimiento. Asimismo, el movimiento de patógenos o de vectores, el mayor acercamiento a las zonas donde habita la fauna silvestre, dada por destrucción de los hábitats naturales (11) (Figura 2).
Situación en Colombia. La aparición de las enfermedades emergentes y reemergentes, guarda estrecha relación entre los agentes patógenos causales que se encuentran potencializados por el aumento demográfico y por ende la explotación y aumento en las actividades forestales (11).
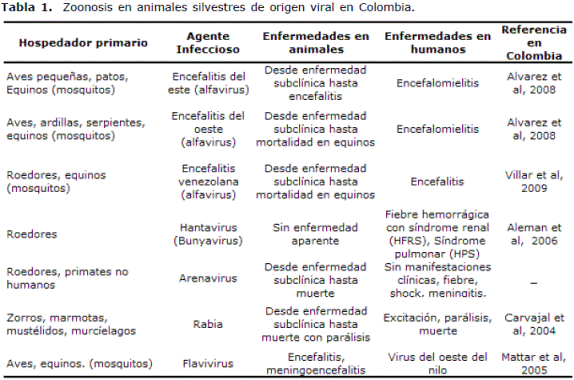
Colombia es uno de los países con mayor diversidad en el planeta, las condiciones geoclimáticas permiten que se encuentre un gran número de diferentes especies de vida silvestre con amplia distribución. En Colombia existen diversos centros en donde entran en contacto directo los animales silvestres que permanecen en condiciones ex situ y profesionales del área (biólogos, veterinarios, microbiólogos, médicos entre otros) (11). Los centros de conservación ex situ varían desde zoológicos, centros de atención y valoración de fauna, centros de rehabilitación, institutos de investigaciones biomédicas, zoocriaderos y hasta circos que mantienen animales exóticos en confinamiento (Tabla 1).
Hantavirus. Un estudio realizado en el departamento de Córdoba en el año 2004 logró evidenciar la circulación de anticuerpos contra hantavirus en una población de trabajadores del campo, con una seroprevalencia del 13.5% con diferencias significativas entre grupos de diferentes edades (12). Tambien se demostró la seroprevalencia del 2.1% en roedores de Córdoba; esto indica que al menos un hantavirus es endémico en roedores del norte colombiano y está frecuentemente trasmitido a residentes humanos rurales. Dada la alta prevalencia de anticuerpos para hantavirus encontrada en humanos del norte colombiano, es controversial que no existan antecedentes clínicos de enfermedad.
Virus del oeste del Nilo (VON). En 2004 se determinó la primera evidencia de transmisión del VON en Sur América. Se demostró la presencia del virus en el 9% de equinos en los departamentos de Sucre y Córdoba, en el norte de Colombia, de una muestra de 130 animales sanos (13). La negatividad de seropositividad en estudios realizados en ejemplares de aves migratorias en San Andrés Islas (14) y en el departamento de Córdoba, no significa que el virus no esté circulando en Cólombia, la complejidad de los ciclos de transmisión de los arbovirus y los múltiples factores por los cuales son influenciados hacen difícil la aproximación sero-epidemiológica del VON. En los últimos años, se realizaron recolecciones de muestras entre el 2006 y el 2007, se demostró una seroprevalencia inicial de 4.43%, y una seroconversión final de 3.1% para el virus del oeste del Nilo (16). Los resultados de las investigaciones demuestran que existe una circulación del virus del oeste del Nilo, al menos, en el Caribe Colombiano (15, 16).
Rabia. En Colombia se empezaron a registrar casos de rabia, diagnosticados clínicamente, desde mediados del siglo pasado. Según el INS (17), Colombia fue el país en América que más casos de rabia humana informó, con un total de 656 muertes por rabia en el decenio 1957-1966, el cual correspondió al 29% de total de defunciones humanas por este virus en todo el continente. En los años 2004 y 2005 en el Bajo y Alto Baudó en el departamento del Chocó, se presentaron 14 y 3 casos respectivamente y en donde los más vulnerables fueron los niños, que fueron mordidos por murciélagos hematófagos (Desmodus rotundus) (18).
Fiebre amarilla. Tiene un comportamiento edemo-epidémico en el país. Desde la introducción de la vacuna en 1936 la incidencia ha disminuido gradualmente, sin dejar de presentarse picos aproximadamente cada cinco años. Las investigaciones de campo realizadas en los casos permiten corroborar que la presentación de la fiebre amarilla en Colombia es la de una forma selvática, donde el hombre irrumpe en el ciclo selvático de la transmisión el riesgo de la urbanización permanece latente. El virus de la fiebre amarilla es un regulador natural de ejemplares de primates, por lo que la tenencia de fauna silvestre en condiciones ex situ podría ser un riesgo de infección en el país (19). En Colombia, en el año 2002 se tuvo noticia de la ocurrencia de casos compatibles con fiebre amarilla, en la frontera Colombo Venezolana y Santander. Durante las 50 semanas que duró el brote se presentaron 93 casos humanos con un número de 41 fallecidos con una tasa de letalidad del 44% (20). Durante este lapso de tiempo hasta octubre de 2003 se identificaron 82 pacientes, de los cuales fallecieron 35 (21). En 2003 se detectó molecularmente el virus en tejido hepático de casos fatales humanos y de monos aulladores con el cual se determinó la evidencia de actividad selvática en Colombia (22). En 2004 se confirmaron casos en Riohacha (Guajira) y Santa Marta (Magdalena) (21).
Dengue. En Colombia es una enfermedad endemo-epidémica. Entre los años 2004 y 2006, fue el país de América con mayores casos de dengue hemorrágico y muertes por esta causa (23). Según el Instituto Nacional de Salud (INS), la tasa de incidencia de dengue clásico, desde 1978 ha sido fluctuante con tendencia al incremento a través del tiempo. De igual forma, desde el primer caso de dengue hemorrágico en diciembre de 1989, en Puerto Berrio (Antioquia) se ha observado en el país una tendencia al rápido incremento en el número de casos, al pasar de 5.2 casos por 100.000 habitantes en la década de los 1990 a 18.1 casos por 100.00 habitantes en los años 2003 a 2007. Situación que se observa de igual manera en el comportamiento de la mortalidad, la cual pasó de 0,07 defunciones por 100.000 habitantes en los noventas, a 0,19 defunciones por 100.000 habitantes en la presente década. En el periodo de 1978 a 2007 se ha registrado un total acumulado de 753.848 casos de dengue clásico, para un promedio de 25.128 casos anuales (24). La identificación de los serotipos circulantes en el país muestra un aumento en la circulación del serotipo 1 y disminución del serotipo 3. En el país han circulado los 4 serotipos simultáneamente. En abril de 2003; en el municipio de Chimá (Córdoba) se presentó un brote de fiebre de origen desconocido. Los casos se recopilaron de un grupo de 209 pacientes sintomáticos que asistieron a la consulta. La positividad de anticuerpos anti-dengue IgM fue del 45% (25).
Malaria. Un 85% del territorio colombiano está ubicado a menos de 1600 metros sobre el nivel del mar donde viven aproximadamente de 18 a 24 millones de personas expuestas al riesgo de contraer la enfermedad o morir a causa de ella. Aunque la mortalidad por malaria ha disminuido en forma significativa en los últimos decenios, la morbilidad reveló una tendencia creciente durante los últimos cuarenta años. En los países que comparten la selva amazónica, el 91% de los casos de paludismo se dan en esta área; de igual forma el 87% de las muertes. En la década del noventa, la malaria se incrementó con más de 160.000 casos promedio por año, luego de este decenio se observó una moderada disminución en el número de casos (90.000 en 2006), del cual el Plasmodium vivax fue el mayor causante de enfermedad (26). Las regiones con el riesgo más alto de transmisión de la malaria en Colombia son: la costa del Pacífico, Urabá, río Cauca bajo y río Sinú alto; además, los territorios de Orinoquia y Amazonia. Estas regiones y territorios son del tipo selva tropical y se encuentran habitadas principalmente por personas de descendencia africana o por poblaciones de indígenas, aunque recientemente han sido objeto de colonización por otros grupos de poblaciones atraído por otras actividades.
Leishmania. En Colombia, la presentación clínica más común es la cutánea con el 95% de los casos sintomáticos en todo el país (27). La enfermedad geográficamente se distribuye en todo el territorio nacional (27), con excepción del departamento del Atlántico, las islas de San Andrés y Bogotá. Se estima que, en el país, existen alrededor de 10 millones de personas en riesgo y la transmisión es principalmente rural; El Ministerio de la Protección Social informó de 6.000 casos anuales de leishmaniasis, excluidos los casos que se presentan en el ejército (28). Esta parasitosis es un problema importante para la sanidad militar en regiones endémicas como el departamento de Córdoba, el cual es considerado una zona de conflicto donde es necesaria la presencia de las tropas en zonas rurales. En el personal militar se presenta la leishmaniasis en una proporción de 20 a 65 veces mayor que en la población civil, situación que significa un alto riesgo para este grupo de contraer la enfermedad. En un estudio realizado entre octubre de 2001 a octubre de 2002 en 67 soldados acantonados en el departamento de Córdoba se encontró una frecuencia de casos de leishmaniasis cutánea del 2.3% (29). Según el INS para la década del 2000 se han notificado en promedio 14.000 casos, lo cual evidencia un incremento inusitado durante los últimos años. La leishmaniasis visceral es endémica principalmente en el Valle del Río Magdalena y sus afluentes, existen focos que corresponden con la distribución de Lutzomyia longipalpis en el Tolima, Huila, Cundinamarca, Bolívar, Córdoba, Sucre, Santander y Norte de Santander. En una encuesta serológica realizada en ejemplares caninos de Colombia y Brasil se determinó que existen seropositividad a Leishmania infantum en el 1.6% de los ejemplares estudiados (30).
Leptospira. Es cada vez mayor el número de personas con mascotas silvestres en las casas de forma ilegal por culpa del tráfico de fauna, en donde no hay cuidados profilácticos para su mantenimiento, haciendo predisponente la contaminación con el patógeno. La variabilidad de las prevalencias encontradas en Colombia (Don Matías, Antioquia, 22.8%, Cali 6.4%, y Ciénaga de Oro, Córdoba, 13.1%) posiblemente se explican por las condiciones de saneamiento básico y el perfil ocupacional de las poblaciones estudiadas (31). Entre los años 1999â2002, en el departamento de Córdoba se realizó un estudio de 600 ejemplares de porcinos, de los cuales se determinó una seropositividad del 43%. (32).
En un estudio en 2004, se obtuvo una seroprevalencia de leptospirosis a 344 trabajadores agrícolas, carniceros y recolectores de basuras, De los sueros estudiados, el 47% correspondieron a personas que vivían en la zona del Bajo Sinú y el 53% al Medio Sinú, la seropositividad fue similar en ambas zonas con prevalencia de 13.1% (31). De igual forma en 2004 un estudio en el departamento de Sucre demostró que en 90 muestras de trabajadores rurales, 12 (13,3%) fueron positivas para Leptospira sp (33). En bovinos en la región Caribe se reportó una positividad del 38.2%, en el Pie de Monte Llanero 24.8%, y Región Andina 14.4%. El promedio para el país se estima en 21.7%. Durante los meses de noviembre de 2007 y marzo de 2008, se evaluó la existencia de anticuerpos contra 14 serovares de Leptospira interrogans en 248 muestras de suero de porcinos de los municipios de Ciénaga de Oro, Cereté y Montería, el 87.90% (n=218) de las muestras, mostraron seropositividad a dicho patógeno (34). Durante los meses de noviembre de 2007 y marzo de 2008, se estudiaron 60 sueros humanos y 17 de roedores capturados en granjas porcinas de los municipios de Ciénaga de Oro, Cereté y Montería de Córdoba. El 74.57% (n=44) de los humanos mostraron una seropositividad a Leptospira sp., Todos los roedores estudiados fueron seronegativos (35).
Bartonela. La primera epidemia se originó en la región del río Putumayo en 1939, que ocasionó 1448 muertos y afectó el 1% de esta población. Se han reportado casos en los departamentos de Bolivar y Valle del Cauca. En un estudio realizado en poblaciones urbanas y rurales del departamento de Córdoba se encontró una seroprevalencía total de anticuerpos IgG anti-bartonella de 48.7% (39/80), de los cuales el 77% fueron hombres (36). Para Bartonella quintana la seropositividad fue de 45% (36/80), para Bartonella henselae del 30% (24/80) y en 26.2% se hallaron anticuerpos para ambas especies. Aunque existió seropositividad en sujetos en contacto permanente con animales, no se encontraron diferencias significativas con las personas que no tuvieron contacto con animales 48.4% (16/33) (36).
En un estudio realizado en el año 2003, se analizaron sueros representativos de un sector de la población que trabajan en actividades del campo en los departamentos de Córdoba y Sucre, la seroprevalencia de anticuerpos contra Bartonella fue de 37.7% (37).
Borrelia. En Colombia se llevó a cabo un estudio de seroprevalencia contra Borrelia burgdorferi en caninos del área rural en el municipio de Montería (Córdoba), en donde utilizaron 200 animales de diferentes edades, sexo, raza y actividad. Los animales fueron evaluados mediante el diagnóstico serológico de ELISA. Los resultados demostraron una seropositividad del 16% (32/200). Igualmente se demostró reacción cruzada con Leptospira sp., en 10 muestras (31.25%). Los seronegativos a leptospira y seropositivos a Lyme se reconfirmaron con Western Inmunoblot, y se encontraron 4 seropositivos (12.5%) (38).
Se estableció la seroprevalencia en 152 sujetos de los municipios de Montería, Cereté, Lorica y Cotorra, del departamento de Córdoba. Por medio de la prueba de ELISA se detectaron 30 (20%) sueros con anticuerpos IgG para Borrelia. Los 30 sueros fueron RPR negativos. Por Western Blot se escogieron al azar 25 sueros positivos, siete se confirmaron como positivos para Borrelia burgdorferi, con una seroprevalencia del 4.6% (39).
Salmonela. Los reptiles son portadores asintomáticos de un gran número de serovariedades de Salmonela (40). Según la Corporación del Valle del Rio Sinú y San Jorge (CVS), en el departamento de Córdoba el 65% de la población se alimenta en la temporada de cuaresma y semana santa de hicotea del Caribe (Trachemys callirostris) como plato tradicional. Igualmente los huevos de iguana (Iguana iguana) son consumidos durante la época seca. En un estudio se estableció la frecuencia de Salmonella spp. En alimentos del Caribe colombiano. Se analizaron 636 muestras de alimentos obtenidas en ventas de comidas rápidas callejeras y en plazas de mercados, los resultados del total de muestras de carne de res, 9.3% fueron positivas para Salmonella spp., 12.6% de chorizo, 7.9% de queso, 5.2% de carne de cerdo, 1.6% de pollo y 10.5% de arepa con huevo. Los principales serotipos encontrados fueron S. Anatum (26%), S. Newport (13%), S. Typhimurium (9%), S. Gaminara (9%) y S. Uganda (9%) (41).
En un estudio se determinaron veintinueve aislamientos de Salmonella enterica subsp. Entérica las cuales fueron obtenidas de 10 pacientes pediátricos en Bogotá, D.C., 10 a partir de diferentes tipos de alimentos y 9 a partir de pollos (42). En otro estudio reciente se analizaron 331 muestras de alimentos, 256 de ventas callejeras en la vía pública y 55 de una planta de beneficio animal. Se determinó una positividad del 68% con PCR en tiempo real, mientras que con los métodos convencionales un 48% (43). Según el INS, ha existido un aumento en la distribución de los aislamientos de Salmonella sp. Para el año 1997 se reportaron 100 casos, mientras que para el 2008 se determinaron 452 casos.
E. coli. En Colombia, en 1996 se reportó por vez primera la presencia de E.coli O157:H7. Es importante resaltar la intervención de E.coli enterohemorrágica como agente causal de la EDA en Colombia como patógeno emergente y casi nunca investigado en alimentos de origen animal. En Colombia un estudio reveló una incidencia de E.coli O157:H7 en bovinos sanos de 6.5%. (44). En el 2001 se realizó un estudio en poblaciones porcinas, canal bovina y productos cárnicos en el departamento de Córdoba, y se determinó que en el 4.6% de las muestras fecales porcinas, 2% de canales bovinas y 10% de carne molida, resultaron positivas al serotipo O157:H7 (44).
Listeria. En Colombia existen pocos datos sobre la epidemiología de la listeriosis debido a que no se diagnostica con frecuencia y, por lo tanto, presenta subregistro epidemiológico; uno de los estudios epidemiológicos más conocidos fue el realizado en 1994 en un hospital de tercer nivel (Cali, Valle), en el cual se informó sobre 19 casos clínicos de listeriosis (45). En Colombia los estudios de este patógeno se han concentrado en la leche de vaca, debido al volumen de producción y a la comercialización. Un reporte publicado señala incidencias de 34% y 2% para leches crudas y pasteurizadas respectivamente (46). Entre los años 2002 y 2005 se realizó un estudio en varios departamentos del país, y se encontró que en alimentos de origen animal había una prevalencia del 16% del patógeno (47). En el 2005, se encontró un 22.2% de L. monocytogenes en leches crudas obtenidas en el departamento de Boyacá (48). La incidencia de este microorganismo en quesos y leche no pasteurizada distribuida en Boyacá es muy alta (29.6 y 16%, respectivamente) (49); en derivados cárnicos listos para el consumo también se ha encontrado una alta incidencia (49).
Micobacterias. Los primates del viejo y del nuevo mundo son susceptibles a diferentes tipos de micobacterias, de manera semejante a los humanos. Existen numerosos reportes de la presencia de micobacterias patógenas en primates, especialmente Micobacterium bovis, Mycobacterium tuberculosis y Mycobacterium avium. En un estudio realizado en el año 2005, en dos centros de rehabilitación de fauna silvestre en la ciudad de Bogotá se encontró una prevalencia de micobacterias del complejo Mycobacterium tuberculosis del 2.4% en primates del nuevo mundo (50). La micobacteriosis aviar ha sido reportada en varias especies de aves que presentan signos variables (51). En el año 2009 se realizó un estudio en 163 ejemplares aviares en condiciones in situ y 87 de centros de conservación ex situ (Zoológicos y centros de atención y valoración) y se determinó la ausencia del patógeno en el 100% de las aves que provenían de vida silvestre, mientras que en un 9.2% se encontró seropositividad a hallazgos macroscópicos compatibles con micobacteriosis (52). La especie identificada, M. avium, se ha reportado afectando humanos, otros mamíferos y aves. Además, las aves bajo condiciones inadecuadas de cautiverio o estrés pueden contraer la micobacteriosis de humanos (52).
En conclusión, aproximadamente el 60% de los patógenos reconocidos como causantes de enfermedad humana son zoonóticos, y el 75% de las enfermedades que se consideran como emergentes en las últimas dos décadas provienen de fuentes de animales silvestres (53). Por lo tanto, se justifica la importancia del incremento referente a la gestión de recursos para aumentar la investigación con el fin de establecer primero la problemática real a traves de la incidencia, la prevalencia, y conocer la relación directa entre pérdida ecosistémica con respecto a la aparición de las enfermedades emergentes y reemergentes en Colombia(53).
Los protocolos de manejo médico-biológicos deben ser sugeridos para el mantenimiento de la fauna silvestre que permanece en condiciones ex situ, y mejorar así el bienestar animal, con el fin de ahondar sobre el conocimiento de los riesgos epidemiológicos a los que los profesionales que laboran con fauna silvestre, se puedan ver enfrentados. El impacto antropogénico del cambio ambiental sobre poblaciones de fauna está claramente reconocido, con una tasa sin precedentes de pérdida de hábitat de fauna, la usurpación creciente del territorio in situ en las zonas donde habita fauna silvestre, la fragmentación de hábitat significativa y la pérdida de diversidad biológica .
Entender el papel de los diferentes cambios ambientales y establecer la relación con la aparición de enfermedad requiere una integración de las diferentes ramas del conocimiento como la ecología, la zoología, la biología de la conservación, la biodiversidad, la medicina de fauna silvestre y la microbiología; con el fin de establecer patrones en los estudios de incidencia de enfermedad humana y de animales domésticos ofreciendo los estimativos en pérdidas económicas.
REFERENCIAS
1. Morse, S.S. Examining the origins of emerging viruses. In: Morse, S.S. (Ed.), Emerging Viruses. New York: Oxford University Press; 1993. [ Links ]
2. Cheng M. Comunicación sobre brotes epidémicos. Pandemia de gripe, manual de la OMS para periodistas. Actualización 2005. [ Links ]
3. Krause, R.M. The origins of plagues: old and new. Science 1992; 257:1073â1078. [ Links ]
4. SIVIGILA. Fiebre amarilla Colombia 2003 â 2004. Boletín epidemiológico semanal. Sistema de vigilancia en salud pública. Enero 18 â 24 de 2004. [ Links ]
5. Daszak, P., Cunningham, A.A., Hyatt, A.D.,. Emerging infectious diseases of wildlife - threats to biodiversity and human health. Science 2000; 287:443â449. [ Links ]
6. Bender J. B. Reports of zoonotic disease outbreaks associated with animal exhibits and availability of recommendations for preventing zoonotic disease transmission from animals to people in such settings. JAVMA 2004; 224(7). [ Links ]
7. Colin R. Parrish, Edward C. Holmes, David M. Morens, Eun-Chung Park. Donald S. Cross-Species Virus Transmission and the Emergence of New Epidemic Diseases. Microbiol Mol Biol Rev 2008; 457â470. [ Links ]
8. Weissenbacher, M, Salvatella R, Hortal, M. El desafío de las enfermedades emergentes y reemergentes. Rev Med Urug 1998; 14: 34-48. [ Links ]
9. Saggese M. D. Medicina de la conservación, enfermedades y aves rapaces. Hornero 2007; 22(2):117-130. [ Links ]
10. R. Higgins. Emerging or re-emerging bacterial zoonotic diseases: bartonellosis, leptospirosis, Lyme borreliosis, plague. Rev sci tech Off int Epiz 2004, 23(2):569-581. [ Links ]
11. Pereira V. Enfermedades emergentes y vida silvestre. Jornada Nacional de Zoonósis y enfermedades emergentes y reemergentes. Cartagena, Colombia. Agosto 2008. [ Links ]
12. Aleman A, Iguarán H, Puerta H, Cantillo C, Mills J, Ariz W y Mattar S. Primera Evidencia Serológica de Infección por Hantavirus en Roedores, en Colombia. Rev salud pública 2006; 8(1):1-12. [ Links ]
13. Mattar S, Edwards E, Laguado J, González M, Alvarez J, y Komar N. West Nile virus Antibodies in Colombian Horses. Emerg infect dis 2005; 11(9):1497â1498. [ Links ]
14. Soler D & Vera VJ. Intento de detección del virus del oeste del nilo en aves silvestres de San Andrés Isla, Colombia. Colombia, Bogotá D.C: Universidad nacional de Colombia. Asociación de Veterinarios de Vida Silvestre; 2007. [ Links ]
15. Jaramillo M, Peña J, Berrocal L, Komar N, González M, Ponce C, Ariza K. y Máttar S. Vigilancia centinela para el virus del oeste del nilo en culicidos y aves domésticas en el departamento de córdoba. Rev MVZ Córdoba 2005; 10(2):633-638. [ Links ]
16. Máttar S, Arrieta G, Álvarez J. Virus del oeste del Nilo en el Caribe colombiano. Infectio 2008; 12(1):25â27. [ Links ]
17. Instituto nacional de salud. Rabia: Serie de Notas e Informes Técnicos, No.4. Quinta edición. Santafé de Bogotá, D.C.; 1995. [ Links ]
18. Valderrama J, García I, Figueroa G. Brotes de rabia humana transmitida por vampiros en los municipios del alto y bajo Baudó, departamento del Chocó, Colombia, 2004-2005. Biomédica 2006; 26(3):387â396. [ Links ]
19. Nassar F. La fiebre amarilla como posible reguladora de poblaciones de primates. Colombia: Congreso Internacional de Medicina y Aprovechamiento de Fauna Silvestre. Universidad Nacional de Colombia; 2005. [ Links ]
20. Velandia M. La re-emergencia de la fiebre amarilla en Colombia, 2003. memorias del I simposio internacional de enfermedades emergentes y re-emergentes, Rev MVZCórdoba 2004; 9(2):459. [ Links ]
21. Villar L.A. Editorial: Epidemia de fiebre amarilla: ¿Trazando las condiciones de la actual salud pública Colombiana?. Infectio 2004; 8(1). [ Links ]
22. Mendez J.A, Rodriguez G, Boshell J. Detección molecular del virus de la fiebre amarilla en tejido: Evidencia de actividad selvática en Colombia. Instituto Nacional de Salud. Laboratorio de Virología â Patología. Infectio 2003; 7(2). [ Links ]
23. Méndez J, Bernal MP. Serotipos de dengue aislados por semana epidemiológica dentro de la vigilancia de enfermedades febriles. Bogotá: Laboratorio de Virología, Instituto Nacional de Salud; 2002. [ Links ]
24. Padilla J.C, Dengue en Colombia: una prioridad en salud pública. Infectio 2008; 12(S1):1-2. [ Links ]
25. Laguado J, Alvis N, Máttar S. Investigación de un brote de fiebre de origen desconocido en una localidad colombiana del Caribe. Colomb Méd 2005; 36(4). [ Links ]
26. Padilla J.C, Paludismo: epidemiología, clínica, diagnostico y tratamiento. Infectio 2008; 12(S1):1-2. [ Links ]
27. Instituto nacional de salud. Informe ejecutivo semanal. Sistema nacional de vigilancia en salud pública (SIVIGILA). Hechos en vigilancia en salud pública. Semana epidemiológica número 45, 4 al 10 de noviembre de 2001. Bogotá: SIVIGILA; 2001. [ Links ]
28. Zambrano P, Ayala M, Fuya O, Ballesteros C, Torres G, Bruzon l. Brote de leishmaniasis cutánea en La Guajira. Inf Quinc Epidemiol Nac 2005; 10:177-90. [ Links ]
29. Amador C, Máttar S, Arrieta G, Vargas C, Sánchez I, Pacheco I, Arteaga D, Sánchez I. Estudio prospectivo de casos de leishmaniasis cutánea en soldados acantonados en Montería, 2002. Infectio 2005; 9(2):63-69. [ Links ]
30. Rosypal, A, Cortés-Vecino J, Gennari S, Dubey J, Tid-well R, Lindsay D. Encuesta serológica de Leishmania infantum y Trypanosoma cruzi en perros de áreas urbanas de Brasil y Colombia. Infectio 2008 12(S1):1-2. [ Links ]
31. Nájera S, Alvis N, Babilonia D, Álvarez L, Máttar S. Leptospirosis ocupacional en una región del Caribe colombiano. Salud pública de México 2005; 47(3): 240-244. [ Links ]
32. Almenteros C, Arrieta G, Máttar S, Barguil A, Tamayo L, Padilla T, Bedoya Z, Mendoza S, et al. Seroprevalencia de leptospirosis porcina en el departamento de Córdoba. Rev Col Cienc Pec 2004; 17(2): 141-147. [ Links ]
33. Ríos R, Franco S, Mattar S, Urrea M, Tique V. Seroprevalencia de Leptospira sp., Rickettsia sp. y Ehrlichia sp. en trabajadores rurales del departamento de Sucre, Colombia. Infectio 2008 12(2):90-95. [ Links ]
34. Álvarez L, Calderón A, Rodríguez V, Arrieta G, Miranda L, Ochoa J, Palencia S, Posada M, Máttar S. Infecciones por Leptospira spp en caninos de granjas porcícolas del departamento de Córdoba. Infectio 2008; 12(S1):1-2. [ Links ]
35. Rodríguez V, Calderón A, Arrieta G, Álvarez L, Palencia S, Posada M, Ochoa J, Miranda L, Máttar S. Seroprevalencia de Leptospira spp en humanos y roedores en explotaciones porcícolas del departamento de Córdoba. Infectio 2008; 12(S1):1-2. [ Links ]
36. Buelvas F, Alvis N, Buelvas I, Miranda J y Mattar S. Alta Prevalencia de Anticuerpos contra Bartonella y Babesia microti en Poblaciones Rurales y Urbanas en dos Provincias de Córdoba, Colombia. Rev MVZ Córdoba 2006 11(2): 781-789. [ Links ]
37. Máttar S, Parra M. Detección de anticuerpos contra anaplasma, bartonella y coxiella en habitantes rurales de un área del caribe colombiano. Rev.MVZ Córdoba 2006;11 (2): 781-789. [ Links ]
38. Buitrago F, Toloza R, Mestra A, Jaramillo P. Determinación de anticuerpos para Borrelia burgdorferi en perros mediante técnica de elisa en el área rural del municipio de Montería â Córdoba. Rev MVZ Córdoba 2003; 8(1):282. [ Links ]
39. Miranda J, Mattar S, Perdomo K, Palencia L. Seroprevalencia de Borreliosis o enfermedad de Lyme en una población rural expuesta de Córdoba Colombia. Rev Salud Publica 2009; 11(3):480-9. [ Links ]
40. LeJeune J.T., Davis M.A. Outbreaks of zoonotic enteric disease associated with animal exhibits. JAVMA 2004; 224(9). [ Links ]
41. Durango J, Arrieta G, Máttar S. Presencia de Salmonella spp. en un área del Caribe Colombiano: Un riesgo para la salud pública. Biomédica 2004; 24:89-96. [ Links ]
42. Mendez I, Mossos N, Mogollon D, Poutou R, Máttar S. Epidemiological relationship among strains of Salmonella enterica subsp. enterica, isolated from humans, poultry and food. Universitas Scientiarum. 2006; 11(1):5-13. [ Links ]
43. Yánez E, Máttar S, Durango A. Determinación de Salmonella spp. por PCR en tiempo real y método convencional en canales de bovinos y en alimentos de la vía pública de Montería, Córdoba. Infectio 2008; 12(4):246-254. [ Links ]
44. Mattar S, Visbal J. Arrieta G. E.coli 0157:H7 enterohemorrágico: un agente etiológico de diarrea en colombia subestimado. Rev MVZ CÓRDOBA 2001; 6(2):81-86. [ Links ]
45. Castañeda C, Hoyos F. Aislamiento de Listeria monocytógenes en un hospital de tercer nivel. Colombia Médica 1999; 30: 89-98. [ Links ]
46. Díaz G, Muñoz AI. Incidencia de Listeria monocytogenes en leches crudas y pasteurizadas en el Altiplano Cundiboyacense. Biomedica 1998; 14(1): 58. [ Links ]
47. Gallegos J, Vanegas M, Albarracín Y, Máttar S, Poutou S, Carrascal A. Frequency of isolation of listeria species in different retail foods in Colombia. Animal Production Research Advances 2008; 4(1):9-18. [ Links ]
48. Rueda AM. Utilización de la Reacción en Cadena de la Polimerasa (PCR) en Tiempo Real para determinar la incidencia de Listeria monocytogenes en leches crudas en el Departamento de Boyacá. [Tesis de maestría]. Bogotá, Colombia: Universidad de Los Andes; 2005. [ Links ]
49. Albarracín Y, Poutou R, Carrascal A. Listeria spp., y L. monocytogenes en leche cruda de cabra. Rev MVZ Córdoba 2008; 13(2):1326-1332. [ Links ]
50. Barragan K. Estudio preliminar de especies de micobacterias en primates Colombianos no humanos en cautiverio en dos centros de rescate de fauna silvestre de Bogotá. [Tesis de maestría]. Bogotá, Colombia: Universidad Nacional de Colombia; 2005. [ Links ]
51. Soler D, Brieva C y Ribón W. Mycobacteriosis in Wild Birds: the Potential risk of Disseminating a Little-known Infectious Disease. Rev salud pública 2009; 11(1):134-144. [ Links ]
52. Soler D. Evaluación de la presencia de especies de micobacterias en aves silvestres de vida libre y cautivas en Colombia. [Tesis de maestría]. Bogotá, Colombia: Universidad Nacional de Colombia; 2009. [ Links ]
53. Máttar S, Arrieta G. Enfermedades emergentes y reemergentes: importancia de las enfermedades transmitidas por vectores. Infectio, 2008; 12(S1):1-2. [ Links ]