Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista MVZ Córdoba
Print version ISSN 0122-0268On-line version ISSN 1909-0544
Rev.MVZ Cordoba vol.15 no.3 Córdoba Sept./Dec. 2010
ORIGINAL
Seroprevalencia de Leptospira spp en caninos y humanos de tres barrios de Tunja, Colombia
Seroprevalence of in canines and humans Leptospira spp in three neighborhoods of Tunja, Colombia
1Universidad Pedagógica y Tecnológica de Colombia, Escuela de Medicina Veterinaria y Zootecnia, Grupo de Investigación GIDIMEVETZ, Tunja, Colombia.
*Correspondencia: sunshine2805@hotmail.com
Recibido: Diciembre 15 de 2009; Aceptado: Agosto 2 de 2010.
Resumen
Objetivo. Establecer la seroprevalencia de Leptospira spp., en la población canina y humana de barrios marginados en la ciudad de Tunja. Materiales y métodos. Se muestrearon 61 sueros caninos en los barrios marginales de la ciudad, parlelamente se muestrearon y encuestaron 46 humanos propietarios de las mascotas. Para el procesamiento de las muestras se empleó la técnica de microaglutinación-lisis (MAT) para seis serotipos de Leptospira spp. Resultados. Se encontró una seropositividad del 67.2% en la población de caninos muestreada, la seroprevalencia por serovares arrojada fue del 14.8% para L. icterohemorrágica; 8.2% para L. pomona; 9.85% para L. hardjo; 18% para L. canicola y 6.6% para L. automnalis y 9.8% para L. sejroë. Para los humanos la prevalencia fue del 21.7%, por serovares se encontró que L. automnalis tiene 4.35%; L. hardjo 2.17%, L. sejroë tiene 6.52%, L. icterohaemorragiae 6.52% y L. canicola 2.17%. Conclusiones. Estos resultados demostraron una gran problemática de alto impacto ya que en contraste con prevalencias de otros municipios de Colombia, mostró una elevada positividad en esta zona y dejan una gran preocupación por una rápida diseminación que podria suceder debido al contacto entre los diferentes vectores como lo roedores y caninos.
Palabras clave: Leptospira, salud pública, animales, humanos.
Abstract
Objective. To establish the seroprevalence of Leptospira spp in the canine and human populations of slum neighborhoods in the city of Tunja. Materials and methods. Sixty-one canine serums were obtsined in slum neighborhoods of the city, sera of 46 human pet owners were also obtained, an interview was done as well. The microagglutination-lysis (MAT) technique was used to process the samples for six serotypes of Leptospira spp. Results. 67.2% of the canine population tested was found to be seropositive, the seroprevalence by serovars resulted in 14.8% for L. icterohemorragica; 8.2% for L. pomona; 9.85% for L. hardjo; 18% for L. canicola, 6.6% for L. automnalis and 9.8% for L. sejroë. Humans showed a prevalence of 21.7%, the distribution was as follow: L. automnalis (4.35%); L. hardjo (2.17%), L. sejroë (6.52%), L. icterohaemorragiae (6.52%) and L. canicola (2.17%). Conclusions. These results showed a great problem with high impact, in contrast with prevalence rates in other municipalities in Colombia, revealed a high positivity rate in this area and produces big concern because of its rapid dissemination, which may be caused by the close contact between vectors, such as rodents and canines.
Key words: Leptospira, public health, animals, humans.
Introducción
La Leptospirosis es una enfermedad infecciosa letal que puede causar grandes epidemias. Aunque es curable, la inespecificidad de los síntomas hace que se confunda con patologías que presentan las mismas características sintomatológicas, permitiendo que la enfermedad evolucione hasta llegar a graves complicaciones como el daño renal y hepático, los cuales acarrean secuelas irreversibles en el organismo. Así mismo los reservorios de la enfermedad son un gran número de mamíferos (ratas, perros, entre otros.)(1), la mayoría de los cuales está en contacto permanente con la población humana.
Debido a que las leptospiras realizan su ciclo de transmisión a través de aguas contaminadas con orina de estos mamíferos (2), uno de los sectores de la población más susceptible a contraer leptospirosis es la de pocos recursos, ya que en la mayoría de los casos las zonas donde residen las personas de este sector, no cuentan con un control adecuado de basuras. Igualmente en la mayoría de los casos los sistemas de acueducto y alcantarillado son deficientes. La importancia de realizar estudios de prevalencia en esta población radica en que, una vez se identifique el foco de infección, se podrán ejecutar planes de control adecuados que presenten medidas sanitarias concretas y eficientes, encaminadas a evitar la diseminación de la enfermedad en la población humana susceptible de la ciudad de Tunja.
La leptospirosis es una zoonosis de amplia distribución, causada por especies patógenas de leptospira. El espectro de la enfermedad humana causada por leptospiras es extremadamente amplio, variando de infección subclínica a síndrome severo con infección multiorgánica y alta mortalidad. Este síndrome, leptospirosis ictérica con falla renal aguda, fue reportado por primera vez hace unos cien años por Weil (3). Sin embargo, un síndrome aparentemente idéntico ocurrido en trabajadores de alcantarillas fue descrito muchos años antes. Las descripciones previas de enfermedades que probablemente correspondían a leptospirosis fueron recientemente revisadas (4).
Estos microorganismos, se encuentran dentro del orden Spirochaetales, al que pertenecen otras bacterias patógenas como Treponema y Borrelia; pertenecientes a la familia Leptospiraceae y en el género Leptospira. Existe una clasificación genotípica y una clasificación serológica del género Leptospira, la primera aunque es la correcta taxonómicamente, resulta tediosa para el microbiólogo clínico, por tal motivo usualmente se opta por la clasificación serológica la cual las agrupa en dos especies de acuerdo a su patogenecidad, Leptospira interrogans (patógenas) y Leptospira biflexa (no patogenas (5-8). Estas dos se subdividen a su vez en múltiples serovares (7,8). La especie L. interrogans contiene aproximadamente de 200 a 280 serovares, mientras que la especie L. biflexa posee más de 60 serovares (6,8,9). Los serovares se organizan a su vez en 23 serogrupos de L. interrogans y 28 grupos de L. biflexa, basándose en la antigenicidad compartida (6).
Son espiroquetas enrolladas herméticamente, usualmente de 0.1 µm por 6 a 0.1 por 20 µm, pero en algunas ocasiones los cultivos pueden tener células más grandes. La amplitud helicoidal es aproximadamente de 0.1 a 0.15 µm y su longitud es aproximadamente de 0.5 µm (10). Morfológicamente, todas las leptospiras son indistinguibles, pero la morfología individual de los aislamientos varía con el subcultivo in vitro. La leptospira tiene una estructura típica de doble membrana, común con otras espiroquetas (11). Los lipopolisacáridos leptospíricos tienen una composición similar a los de las otras bacterias Gram-negativas (12), pero tienen menor actividad endotóxica. Estos microorganismos pueden ser teñidos usando contratinción carbol-fuschina (10).
Las leptospiras son anaerobios obligados con una temperatura óptima de crecimiento de 28 a 30ºC. Producen catalasa y oxidasa. Crecen en medio simple enriquecido con vitaminas (las vitaminas B2 y B12 son factores de crecimiento), ácidos grasos de cadena larga, y sales de amonio (8). Los ácidos grasos de cadena larga son utilizados como fuente de carbono y son metabolizados mediante β-oxidación (13).
La leptospirosis como enfermedad, es una zoonosis causada por la infección con especies patógenas de leptospira. En humanos, varía desde una infección subclínica hasta un síndrome severo con infección multiorgánica y alta mortalidad. Este síndrome, es conocido como leptospirosis ictérica con falla renal aguda (3,14). La enfermedad fue reconocida como un riesgo ocupacional de los recolectores de arroz en la antigua China (10) y el nombre japonés de Akiyami, o fiebre de otoño, persiste en la medicina moderna. El papel de la rata como fuente de infección humana fue descubierto en 1917 (15).
La vía de ingreso usualmente son las abrasiones o cortes en la piel y mucosas nasal y conjuntival. La transmisión a través del agua contaminada ha sido documentada; la contaminación de los abastecimientos de agua ha resultado en numerosos brotes de leptospirosis. La inhalación de agua o aerosoles también resulta en infección mediada a través de las membranas mucosas del tracto respiratorio. Raramente la infección se puede dar a través de mordedura de animales (16-18). La transmisión directa entre humanos es infrecuente. Sin embargo, la excreción de leptospiras en la orina humana meses después de la recuperación ha sido reportada (19,20). Se piensa que el bajo pH de la orina humana limita la supervivencia de las leptospiras después de la excreción. La transmisión sexual durante la convalescencia ha sido reportada (21,22).
Los animales, incluyendo los humanos, pueden ser divididos en hospedadores de mantenimiento o en hospedadores accidentales. La enfermedad es mantenida por infección crónica de los túbulos renales de los hospedadores de mantenimiento (23) y usualmente es adquirida a una edad joven, permitiendo que la excreción crónica en la orina incremente con la edad del animal.
Los animales se pueden comportar como hospedadores de mantenimiento o accidentales dependiendo de los serovares que los infecten, generalmente cuando un serovar de leptospira infecta un animal el cual no corresponde a su hospedador de mantenimiento la infección puede causar enfermedad fatal. Los más importantes hospedadores de mantenimiento son los pequeños mamíferos, los cuales pueden transferir la infección a animales domésticos de granja, perros, y humanos. Diferentes especies de roedores pueden ser reservorios de distintos serovares, pero las ratas son generalmente hospedadores de mantenimiento para serovares de los serogrupos icterohaemorrhagiae y ballum y los ratones son los de mantenimiento del serogrupo ballum, siendo por lo tanto la orina de las ratas y ratones, fuente importante de infección de estos serovares para los demás animales, incluido el hombre.
Los animales domésticos son también hospedadores de mantenimiento, el ganado lechero puede albergar serovares hardjo, pomona, y grippotyphosa; los cerdos pueden alojar pomona, tarassovi, o bratislava; las ovejas pueden albergar hardjo y pomona; mientras que los perros pueden albergar principalmente canicola (24). Distintas variaciones en los hospedadores y en los serovares que ellos poseen ocurren alrededor del mundo. Un conocimiento de los serovares prevalentes y sus huéspedes de mantenimiento es esencial para conocer la epidemiología de la enfermedad en cualquier región.
Las ratas son consideradas el reservorio más importante, sin embargo, no todos los roedores tienen el mismo potencial epidemiológico en ese respecto. Para convertirse en una fuente de infección de otros animales, incluyendo a los humanos; los roedores tienen que ser infectados, de esta forma la cepa patogénica puede multiplicarse y estimular una respuesta patogénica. Muchos estudios muestran que cerca del 50% de las ratas (Rattus norvegicus), coipo (Myocastor coypu) y almizcleras (Ondatra zibethicus) son seropositivas. Sin embargo, para ser un reservorio eficiente, cada especie tiene que expulsar la bacteria y en este respecto los roedores no son idénticos en términos de transporte renal. Casi el 30% de las ratas y almizcleras son transportadoras renales de leptospiras (especialmente icterohaemorrhagiae para ratas y grippotyphosa para almizcleras) mientras que solo el 5% de los coipos transportan; particularmente sejroë (25).
Esta enfermedad, puede manifestarse por una amplia variedad de síntomas y signos, así como con diferentes formas clínicas, por eso es frecuente que se confunda con muchas otras enfermedades y se haya denominado “la gran simuladora” (19).
En caninos, afecta animales de cualquier edad con mayor incidencia en machos. Los casos graves se caracterizan al principio por debilidad, anorexia, vómitos, conjuntivitis, temperatura de 39.5 a 40.5°C, posteriormente depresión pronunciada y mucha sed e ictericia de intensidad variable. Hay dolor a la palpación en la región lumbar o en la región anterior del abdomen. Lesiones en la mucosa oral, signos de gastroenteritis hemorrágica, nefritis crónica, pigmentos biliares en orina, temblores musculares, hipotermia y muerte entre 5 y 10 días luego de iniciados los síntomas (26).
Con el incremento de la población humana en zonas de asentamientos hacia la periferia de Tunja, la probabilidad de exposición a vectores y reservorios de leptospirosis es cada vez más alta, lamentablemente esto se da en las zonas de mayor vulnerabilidad social, en donde los recursos disponibles para salud son muy limitados.
Los datos obtenidos de esta investigación contribuirán a futuro, a fortalecer programas que brinden un adecuado y oportuno servicio de información sobre esta enfermedad a la comunidad en general. Además, se pretende que mediante la generación de alertas, se dinamizará la participación de entidades oficiales con la creación de verdaderas herramientas que contribuyan a proteger la salud y calidad de vida en sectores desprotegidos.
Materiales y métodos
Área de estudio. La investigación se realizó en el municipio de Tunja, capital del departamento de Boyacá; se encuentra a los 5º, 32", 7’ de latitud norte y 73º, 22" y 04 de longitud oeste. Límita por el norte con Motavita, Cómbita y Oicatá; al oriente con Oicatá, Chivatá y Soracá; al sur con Boyacá, Ventaquemada y Samacá y por el occidente con Samacá, Sora y Cucaita. La extensión territorial de Tunja es de 118 kilómetros cuadrados, de los cuales el 87% corresponde al área rural y el 13% al área urbana. Su altura sobre el nivel del mar es de 2.775 metros. Su altura máxima es de 3.200 metros en límites con Cucaita y su altura mínima es de 2.400 metros sobre el nivel del mar, en límites con el municipio de Boyacá. Es una zona de clima frío. Durante el estudio, se muestrearon 3 barrios de zonas marginales de Tunja (El dorado, Patriotas y Esmeralda).
Población de estudio. La conformaron 61 caninos, tomando aquellos animales que presentaron características de importancia epidemiológica como la edad, el género, los hábitos de alimentación y desplazamiento, la presencia de ratas en el barrio y el contacto de estas con los perros, entre otros.
Se muestrearon un total de 3 barrios, tomando suero de 24 machos caninos y 37 hembras caninas de zonas marginales. También fueron muestreados 17 hombres y 29 mujeres, con una edad comprendida entre 25 y 55 años, todos, propietarios de mascotas caninas.
Tipo de estudio. Esta investigación correspondió a un estudio epidemiológico descriptivo, observacional, longitudinal aleatorio simple. El análisis de los datos se realizó por medio de un paquete estadístico (Epiinfo2005). Posteriormente, se realizó el análisis de la prevalencia de leptospirosis en cada zona o barrio. Se trabajó con un límite de confianza del 95% y un margen de error del 5%.
Muestreo de campo y procedimientos de laboratorio. La recolección de los sueros caninos se realizó durante diferentes jornadas de trabajo. Se llegó a los barrios marginales y a la comunidad gracias a líderes y miembros de acción comunal que permitieron establecer lazos de comunicación eficientes durante los procesos de perifoneo.
Previo a la toma de muestras, se aplicó una encuesta a los dueños de los caninos para obtener información correspondiente sobre el género, edad, comportamiento, sintomatología concordante con la enfermedad, o si son asintomáticos, vacunas recientes, barrio en el cual vive (estrato 1) entre otros. Posteriormente, se obtuvo por venopunción de la vena cefálica con jeringa, obteniendo 5 ml de sangre de diferentes caninos y luego depositándola en tubos sin anticoagulante identificados adecuadamente. Luego se llevaron estos tubos a centrifugar con el fin de obtener los sueros, los cuales fueron conservados a 20ºC para luego realizar el análisis respectivo con la técnica de MAT. Se muestrearon igualmente los dueños de perros provenientes de zonas marginales, obteniendo una muestra de sangre de 5 ml de la vena cubital, la cual se centrifugó para la obtención del suero y su posterior utilización en el laboratorio para el procesamiento con la técnica de migroaglutinación lisis (MAT). La técnica MAT se empleó para seis serotipos de Leptospira, los cuales fueron L. icterohemorrhagiae, L. pomona, L. harjo, L. canicola, L. sejroe, L. automnalis.
Técnica MAT. Los sueros se llevaron a una dilución de 1:100, agregando 50 µl de cada antígeno y 50 µl del suero diluido en 1:50 de PBS, estas mediciones se realizaron con una pipeta automática; luego se dispensaron en pozos separados de la placa de microtítulo. Las placas fueron cubiertas e incubadas por 2 horas a 28 - 30°C. Posteriormente, cada una de las placas se examinó directamente bajo un microscopio de campo obscuro para observar la presencia de aglutinación. Los sueros que mostraron una aglutinación del 50% con uno o más serovares se les fueron realizadas más diluciones. Se consideraron negativos, los títulos menores a 1:100 y positivos, los títulos mayores a 1:100.
Resultados
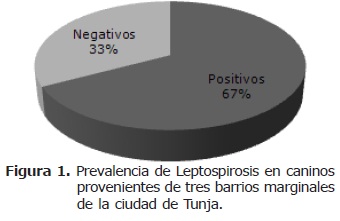
La prevalencia mostrada en este estudio para los diferentes serovares de leptospira arrojó los siguientes resultados: 67.2% de positivad total de caninos frente a los diferentes serovares de leptospira (Figura 1).
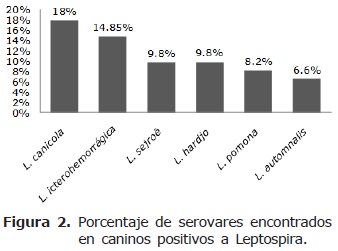
L. canicola presentó 11 anímales positivos para un total de 18.0%, L. icterohaemorrhagiae presentó 9 animales positivos para un total del 14.85%, L. sejroë con 6 animales positivos para un total de 9.8%, L. hardjo presentó 6 anímales positivos para un total de 9.80, L. pomona presentó 5 animales positivos para un total de 8.2% y L. automnalis presentó 4 animales positivos para un 6.6% de positividad (Figura 2).
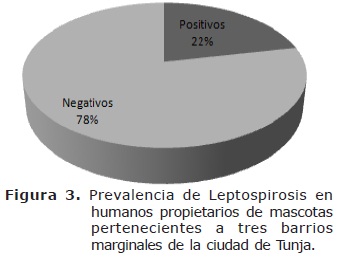
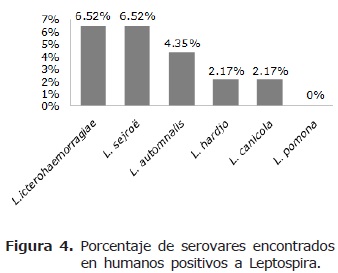
En humanos, la prevalencia fue del 21.7% (Figura 3) y se distribuyó en los diferentes serovares de Leptospira así: L. icterohaemorrhagiae 6.52%, L. sejroë tiene 6.52%, L. automnalis tiene 4.35%, L. hardjo 2.17%, L. canicola 2.17% y L. pomona fue negativa (Figura 4).
Discusión
La seropositividad de 67.2% en la población canina es alta si se compara con un estudio realizado en Tunja, que reportó un 29% (27). En ese mismo estudio, el resultado para humanos fue del 11%, mientras que el del presente estudio fue de 21.7%, considerado igualmente alto. Los serovares más diseminados dentro de las poblaciones estudiadas fueron icterohaemorrhagiae y canicola, seguidos por sejroë, hardjo, automnalis y pomona.
La explicación de las prevalencias más altas para el serovar icterohaemorrhagiae, se puede presumir por el hecho de que se ha reportado para Tunja una prevalencia de 94% de casos positivos en una prevalencia de leptospira en ratas para dicho el serovar (28), en donde se conoce que estos roedores actúan como hospedador de mantenimiento (25).
Por su lado, la explicación a las altas tasas de prevalencia del serovar canicola puede inferirse debido a que este utiliza al perro como su principal hospedador de mantenimiento (25,29). A pesar de ello, el serovar canicola mostró una prevalencia alta en perros y en humanos solamente se reportó un caso de seropositividad. En el serovar canicola se obtuvo una significancia estadística (p<0.004) con una oportunidad relativa de contagio de perros sobre humanos de 9.9 veces más. Esto reafirma que esta especie es el huésped natural de este serovar.
A pesar que no se obtuvo una significancia estadística, la oportunidad relativa de contagio del serovar hardjo en caninos sobre humanos es 4.9 veces más grande. Esto se podría explicar debido a que en los barrios marginales, incluso en barrios centrales de la ciudad de Tunja; es costumbre mantener ganado en pastoreo; daño oportunidad a que los perros entren en contacto con los bovinos y sus secreciones, contaminándose con el serovar hardjo; del cual los bovinos son hospedadores de mantenimiento (30).
La oportunidad relativa de contagio a los serovares icterohaemorrhagiae (2.48 veces más); sejroë (1.56 veces más) y automnalis (1.54 veces más), a pesar de que no se obtuvo significancia estadística; puede interpretarse como el contacto que pueden mantener los perros con secreciones de ratas, especialmente en los barrios marginales donde aún se pueden observar aguas empozadas y algunas veces sistemas de alcantarillado y acueducto deficientes; además de desecho inadecuado de basuras. Hay que sumarle la posibilidad de que algunas de estas mascotas complementen su dieta cazando ratas.
Es importante observar que no existe una homogeneidad en la distribución de los serovares entre los grupos caninos y humanos, lo cual hace que la positividad en humanos no pueda ser atribuida ni exclusivamente ni principalmente a los caninos. En los humanos la prevalencia del serovar canicola es baja, caso contrario a los caninos en los cuales este serovar presentó la mayor prevalencia. De esta forma la alta incidencia de L. icterohaemorrhagiae en humanos podría ser atribuida a la presencia de otros vectores tales como los roedores.
En conclusión, es evidente la problemática que se presenta en en la zona de estudio, pues al comparar los resultados del presente estudio con otros previamente realizados en la ciudad de Tunja, se observa una creciente y elevada positividad, así como una rápida diseminación. Esto puede estar dado al estrecho contacto entre los diferentes vectores, como lo son roedores, caninos y humanos. La importancia de la leptospirosis como enfermedad reemergente la convierte en una amenaza para la salud pública, lo cual complica el entendimiento de la epidemiología y el diagnóstico de la enfermedad, además de poder desarrollar programas preventivos adecuados, como vacunación a partir de cepas existentes en el entorno.
A pesar de que es bien sabido que la leptospirosis se ha reconocido históricamente como una enfermedad relacionada con riesgo ocupacional al trabajar con animales y agricultura, su tradicional estatus de enfermedad esporádica y de ambientes rurales se ha venido desvirtuando con estudios como estos y a raíz de la aparición de brotes importantes en diferentes partes del mundo, relacionados con falta de planeación del crecimiento urbano donde se presentan malas prácticas sanitarias, principalmente. Debe considerarse que la dinámica de las leptospiras en el medio ambiente de Tunja, está muy poco estudiada; y que es peligroso el hecho de desconocerla como una enfermedad potencialmente lesiva contra la salud pública (zoonosis-antropozoonosis) y contra la misma economía. Por tanto, se debe poner atención, pues puede resultar endémica por condiciones multifactoriales, como lo es la presencia de múltiples hospedadores de mantenimiento de diferentes serovares patógenos.
Agradecimientos
A la Secretaria de Salud del Departamento de Boyacá, Universidad Pedagógica y Tecnológica de Colombia, Dirección de Investigaciones DIN de la UPTC y al Programa de Colciencias Jóvenes Investigadores e Innovadores “Virginia Gutiérrez de Pineda”.
Referencias
1. Céspedes Z, Manuel. Leptospirosis: Enfermedad Zoonótica Emergente. Rev Perú Med Exp Salud pública 2005; 22(4):290-307. [ Links ]
2. Department of Agricultural Resources, Bureau of Animal Health. Hoja informativa de Salud Publica: Leptospirosis en perros y seres humanos. Massachusetts: Department of Public Health; 2004. [en linea][acceso mayo 2 de 2007]. URL disponible en: http://www.mass.gov/Eeohhs2/docs/dph/cdc/factsheets/leptospirosis_sp.pdf. [ Links ]
3. Weil A. Ueber eine eigentumliche, mit Milztumor, Icterus und Nephritis einhergehende akute Infektionskrankheit. Dtsche Arch Klin Med 1886; 39:209-232. [ Links ]
4. Everard JD. Leptospirosis. En: F. E. G. Cox (eds.). The Wellcome Trust illustrated history of tropical diseases. London: The Wellcome Trust; 1996. [ Links ]
5. Giraldo de León G, Orrego Uribe A, Betancurth M. Los roedores como reservorios de Leptospiras en planteles porcinos de la zona central cafetera de Colombia. Arch Med Vet 2002; 34(1):69-78. [ Links ]
6. Sandow K, Ramírez W. Leptospirosis. REDVET 2005; 6(6). [en linea]. URL disponible en: http://www.veterinaria.org/revistas/redvet/n060605/060501.pdf. [ Links ]
7. Johnson RC, Faine S. Leptospira. En NR. Krieg and JG. Holt. Bergey's. Manual of systematic bacteriology. Baltimore, EEUU: Williams & Wilkins; 1984. [ Links ]
8. Levett P. Leptospirosis. Clin Microbiol Rev 2001; 14(2):296-326. [ Links ]
9. Klarenbeek A, Schuffner WAP. Het voorkomen van een afwijkend leptospira-ras in Nederland. Ned Tijdschr Geneeskd 1933; 77:4271-4276. [ Links ]
10. Faine S. Leptospira and leptospirosis. Florida: Press Inc; 1994. [ Links ]
11. Haake, DA. Spirochaetal lipoproteins and pathogenesis. Microbiology 2000; 146:1491-1504. [ Links ]
12. Vinh T, Adler B, Faine S. Ultrastructure and chemical composition of lipopolysaccharide extracted from Leptospira interrogans serovar copenhageni. J Gen Microbiol 1986; 132:103-109. [ Links ]
13. Smibert RM. The Spirochaetales. En: A. I. Laskin and H. A. Lechavelier. CRC handbook of microbiology. 2nd ed. Ohio, EEUU: CRC Press; 1977. [ Links ]
14. Jiménez LM. Revisión actualizada sobre métodos de identificación y diagnostico de Leptospirosis en Bovinos. [en línea]. Bogotá: Pontificia Universidad Javeriana; 2006. URL disponible en: http://www.javeriana.edu.co/biblos/tesis/ciencias/tesis245.pdf. [ Links ]
15. Ido Y, Hoki R, Ito H, Wani H. The rat as a carrier of Spirochaeta icterohaemorrhagiae, the causative agent of Weil's disease (spirochaetosis icterohaemorrhagica). J Exp Med 1917; 26:341-353. [ Links ]
16. Gollop JH, Katz AR, Rudoy RC, Sasaki DM. Rat-bite leptospirosis. West J Med 1993; 159:76-77. [ Links ]
17. Luzzi GA, Milne LM, Waitkins SA. Rat-bite acquired leptospirosis. J Infect 1987; 15:57-60. [ Links ]
18. Silverstein CM. Pulmonary manifestations of leptospirosis. Radiology 1953; 61:327-334. [ Links ]
19. Bal AE, et al. Detection of leptospires in urine by PCR for early diagnosis of leptospirosis. J Clin Microbiol 1994; 32:1894-1898. [ Links ]
20. Johnson DW. The Australian leptospiroses. Med J Aust 1950; 2:724-731. [ Links ]
21. Doeleman FPJ. Ziekte van Weil, rechstreeks overgebracht van mensch op mensch. Ned Tijdschr Geneeskd 1932; 76:5057. [ Links ]
22. Harrison NA, Fitzgerald WR. Leptospirosis-can it be a sexually transmitted disease? Postgrad Med J 1988; 64:163-164. [ Links ]
23. Babudieri, B. Animal reservoirs of leptospirosis. Ann NY Acad Sci 1958; 70:393-413. [ Links ]
24. Bolin C. Leptospirosis. En: C. Brown and C. Bolin. Emerging diseases of animals. Washington: ASM Press; 2000. [ Links ]
25. Andre-Fontaine G. Canine leptospirosis-Do we have a problem? Vet Microbiol 2006; 117:19-24p. [ Links ]
26. Alfaro C, Aranguren Y, Clavijo A. Epidemiología y diagnóstico de la leptospirosis como fundamentos para el diseño de estrategias de control. CENIAP HOY [en linea] 2004 [Fecha de acceso 6 de septiembre de 2009]. 6:14. URL disponible en: http://sian.inia.gob.ve/repositorio/revistas_tec/ceniaphoy/articulos/n6/arti/alfaro_c/arti/alfaro_c.htm. [ Links ]
27. Tello V, Hernández L. Seroprevalencia de leptospirosis en población humana en riesgo ocupacional y caninos callejeros en la ciudad de Tunja durante el primer semestre del año 2006. [Tesis de grado]. Tunja: Universidad de Boyacá; 2006. [ Links ]
28. Vanegas J, Lozada M. Seroprevalencia de leptospirosis en roedores presentes en barrios marginados de la ciudad de Tunja en el segundo semestre del año 2006. [Tesis de grado]. Tunja: Universidad de Boyacá; 2006. [ Links ]
29. Weekes CC, Everard COR, Levett PN. Seroepidemiology of canine leptospirosis on the island of Barbados. Vet Microbiol 1997; 51:215-222. [ Links ]
30. Ellis WA, O'Brien JJ, Cassells J. Role of cattle in the maintenance of Leptospira interrogans serovar hardjo infection in Northern Ireland. Vet Rec 2000; 108:555-557. [ Links ]