Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Acessos
Acessos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares em
SciELO
Similares em
SciELO -
 Similares em Google
Similares em Google
Compartilhar
Revista MVZ Córdoba
versão impressa ISSN 0122-0268versão On-line ISSN 1909-0544
Rev.MVZ Cordoba v.16 n.2 Córdoba maio/ago. 2011
ORIGINAL
Efectos de la concentración de glucosa sobre la activación de la movilidad espermática en bocachico Prochilodus magdalenae (Pisces, Characiformes)
Effect of glucose concentration on sperm motility activation in bocachico Prochilodus magdalenae (Pisces, Characiformes)
Gregorio Martínez,1 M.Sc, Víctor Atencio G,2 M.Sc, Sandra Pardo C,1* Ph.D.
1Universidad Nacional de Colombia, FCA/DPA, Grupo de Investigación en Biodiversidad y Genética Molecular - BIOGEM, Sede Medellín, Calle 59A No. 63-020, Medellín, Colombia.
2Universidad de Córdoba, FMVZ/DCA, Centro de Investigación Piscícola - CINPIC, Carrera 6 No. 76-103, Montería, Colombia.
*Correspondencia: scpardoc@unal.edu.co.
Recibido: Mayo de 2010; Aceptado: Enero de 2011.
Resumen
Objetivo. Determinar la concentración de glucosa no activadora de la movilidad espermática como componente de futuros diluyentes para la crioconservación de semen de Prochilodus magdalenae. Materiales y métodos. Se analizó semen inactivo de tres machos obtenido por inducción hormonal. Una submuestra de 0.25 µL de semen de cada macho fue depositada sobre una cámara de Makler y evaluada usando diferentes concentraciones de glucosa (0, 1, 2, 3, 4, 5, 6, 7, 8, 9 y 10%) mediante la adición de 75 µL de cada solución sobre el semen (n=3). De cada solución se determinó la osmolaridad, siendo de 0, 62, 124, 186, 250, 310, 360, 410, 472, 536 y 620 mOsm/kg, respectivamente, así como la del plasma seminal (∼250-300 mOsm/kg). Mediante el software Sperm Class Analyzer (SCA) se determinó la velocidad curvilínea (VCL) y recta (VSL) (µm/seg), movilidad rápida (%), media (%) y lenta (%) y el porcentaje de espermatozoides inmóviles. El tiempo de activación de la movilidad (segundos) se obtuvo por cronometraje y visualización bajo microscopio de campo claro. Resultados. Concentraciones de 0 a 5% de glucosa produjeron activación de la movilidad espermática, no obstante, a partir de glucosa al 6% no fue detectada activación visual; sin embargo, SCA detectó movilidad total (7.2%), VCL (5.1 µm/seg) y VSL (1.7 µm/seg). A partir de glucosa al 7% el SCA detectó 100% de inmovilidad, no adquirida posteriormente con agua destilada. Conclusiones. La concentración de glucosa tiene efecto determinante en la viabilidad y activación de semen fresco. Una concentración de 6% de glucosa puede ser utilizada como solución no activadora de la movilidad espermática en futuros diluyentes para la crioconservación de semen de esta especie.
Palabras clave: Concentración, conservación del semen, glucosa, motilidad espermática, peces, tolerancia a la glucosa. (Fuentes: AIMS, CAB, DeCS).
Abstract
Objective. To determine the concentration of non-activating glucose on sperm motility as a component of future extender for cryopreservation of Prochilodus magdalenae semen. Materials and methods. Inactive semen obtained by hormonal induction from 3 males was analyzed. From each male, 0.25 µL of semen was deposited on Makler's chamber, and then a fixed amount of 75 µl of glucose solution was added to each drop given a final concentration of, 0, 1, 2, 3, 4, 5, 6, 7, 8, 9 and 10%. Each male was checked 3 times (n=3). Osmolarity was determined in each seminal sample (∼250-300 mOsm/Kg) and into each solution, (0, 62, 124, 186, 250, 310, 360, 410, 472, 536 y 620 mOsm/kg, respectively. The software Sperm Class Analyzer (SCA) was used to determine the curvilinear (VCL µm/sec) and straight (VSL, µm/sec) velocity (VSL, µm/sec), likewise, the rate of sperm motility (rapid, medium, and slow) was determined. Rate of immotile sperm was also determined. The activation time of motility (seconds) was obtained under light-field microscope. Results. Glucose Concentrations of 0 and 5% caused activation of sperm motility. Sperm activation was not visually detected in samples with glucose concentrations of 6% or higher. However, the SCA detected a total sperm motility of 7.2%, a VCL of 5.1 µm/sec and a VSL of 1.7 µm/sec. The SCA detected 100% non motile sperm in samples with 7% glucose solution and the motility was not subsequently acquired when distilled water was added. Conclusions. Glucose concentration has a determining effect on viability and activation of fresh sperm. Concentration of 6% glucose solution can be use as a non-activating solution for sperm motility in extenders for sperm cryopreservation in this specie.
Key words: Concentration, fishes, glucose, glucose tolerance, sperm motility, semen preservation. (Sources: AIMS, CAB, DeCS).
Introducción
El bocachico, Prochilodus magdalenae, es un pez suramericano perteneciente a los Characiformes. En Colombia se encuentra distribuido en los ríos Magdalena, Cesar, San Jorge, Cauca, Ranchería y Sinú (1), convirtiéndose en uno de los peces de mayor importancia económica en el país. No obstante, en Colombia, de acuerdo con el INPA (2), en el periodo comprendido desde 1986 a 1995, su captura por pesca extractiva disminuyó de 28501 a 5690 toneladas respectivamente para cada año, presentándose una declinación cercana al 80%, por lo que el desarrollo de tecnologías biotecnológicas como la crioconservación espermática podrían aportar a la conservación de la especie.
Dado que el semen fresco de bocachico, al igual que en la mayoría de peces de agua dulce, activa su movilidad al contacto con soluciones hipotónicas, es necesario antes y durante la crioconservación garantizar un medio que mantenga dicha inactivación de la movilidad, lo que podría mejorar la sobrevivencia espermática posdescongelación y mejorar así el éxito de la fecundación. Para ello, la modificación del ambiente celular (osmolaridad) a través del uso de azúcares (3) y soluciones salinas (4) ha sido exitosa para algunas especies de peces de agua dulce.
La osmolaridad se define como la concentración de solutos totales en una solución, con la propiedad de ejercer presión dentro de dicha disolución. Esta propiedad de los solutos está estrechamente relacionada con lo que se denomina presión osmótica, la cual está involucrada en la regulación del flujo de agua a través de una membrana, fenómeno llamado ósmosis. De este modo, cuando la concentración de solutos (mOsm/kg de agua) es menor en el medio donde se encuentra inmersa una célula que en su propio citosol (hiposmótica), esta tiende a aumentar su volumen, introduciendo agua del medio; mas, cuando la célula se encuentra inmersa en una solución concentrada (hiperosmótica), sufre reducción del tamaño y arrugamiento de la membrana por la salida de agua (5). En ambos casos, el flujo o eflujo de agua celular se da hasta regular la osmolaridad. En cuanto a la deshidratación de células espermáticas, si ésta es excesiva, la osmolaridad intracelular podría llegar a ser muy alta, intoxicando la célula, o la deshidratación podría impedir a la membrana plasmática recuperar su forma en el proceso de descongelación, lo cual impediría el desarrollo de las señales transduccionales mediadas por canales iónicos ubicados en la membrana y que dan lugar a la activación espermática (6). Por el contrario, la falta de la pérdida de agua para alcanzar el potencial de equilibrio por parte de la célula, desencadenaría el congelamiento intracelular (7) que finalmente puede provocar daños mecánicos a la ultraestructura, proteoma, genoma o a su conjunto.
Pegg (8) menciona que los eventos osmóticos que dan lugar a la pérdida de agua durante la congelación son muy importantes para el éxito de la crioconservación. Las investigaciones en semen relacionadas con la evaluación de niveles de osmolaridad extracelular del diluyente como factor de hidratación o deshidratación celular para preparar al espermatozoide para la congelación, no han sido reportadas ampliamente en la literatura nacional o internacional, y en los experimentos de crioconservación de semen en peces de agua dulce se hace necesaria la regulación de la osmolaridad externa de la célula, medio en el que permanecerán congeladas las células espermáticas; esto es para muchos autores, garantizar un medio isotónico (9) que impida la activación (movilidad) espermática por choque hiposmótico con el medio extracelular (10).
Así, la falta de la regulación de la osmolaridad extracelular, impediría la crioconservación y la garantía de viabilidad fecundante del espermatozoide al final del proceso de congelación; pues una vez activado, la movilidad durará poco tiempo (10). Al observar la teoría de Pegg (8), donde destaca la importancia de la pérdida de agua intracelular, surge el interrogante de qué puede ser más favorable para la célula espermática para lograr una eficiente deshidratación, ¿Que la presión osmótica extracelular sea hipotónica o hipertónica?. La utilización de diluyentes que faciliten la deshidratación celular (ligeramente hipertónicos) o que la impidan o controlen (ligeramente hipotónicos), son herramientas que permitirían el manejo de la formación de cristales intracelularmente, con el fin de garantizar el mejoramiento de algunas variables de viabilidad espermáticas afectadas negativamente por el criodaño. El objetivo del presente estudio fue determinar la concentración de glucosa inhibitoria de la activación de la movilidad espermática, como base protocolaria para la preparación de futuros diluyentes aptos para la crioconservación de semen de Prochilodus magdalenae.
Materiales y métodos
Especímenes. Fueron utilizados 3 machos adultos de bocachico P. magdalenae (uno por cada réplica de tratamiento, peso corporal 195±7.5g), para el experimento de inhibición de la movilidad espermática con glucosa. Todos los especímenes hicieron parte de un grupo de reproductores adaptados y mantenidos bajo condiciones de cautiverio en estanques del CINPIC (Centro de Investigación Piscícola de la Universidad de Córdoba, Colombia). Los ejemplares seleccionados fueron capturados y trasladados a recintos circulares de manejo (6 m3), donde permanecieron durante 24 horas, con el propósito de habituarlos a las condiciones experimentales, reducir la intensidad del estrés generado por la manipulación y cambio de ambiente.
Maduración de gónadas. La maduración final de las gónadas y la espermiación se obtuvo con una inyección intramuscular de Extracto Pituitario de Carpa (EPC), equivalente a 4.5 mg/kg.
Manejo de reproductores y extracción de semen. El semen se obtuvo entre 6 y 7 horas después de la inyección de EPC. Para la extracción los reproductores fueron previamente tranquilizados por inmersión en una solución de 2-fenoxietanol (300 ppm, Sigma Chemical Co., St. Louis, MO, USA) hasta evidenciar la pérdida del eje de nado.
El semen fue obtenido mediante masaje abdominal en sentido cráneo-caudal, colectándolo directamente en un tubo plástico tipo Eppendorf de 1.5 mL, aforado, estéril y seco, evitando la contaminación con restos de agua, orina o heces.
Evaluación seminal. Inmediatamente después se realizó la primera evaluación seminal, con el fin de conocer la calidad espermática, teniendo como criterio la movilidad total (%) y la movilidad rápida (%), con valores superiores a 80% y 75%, respectivamente. Simultáneamente, se tomó una muestra de 400 µL de semen de cada uno de los machos en forma separada, las cuales fueron centrifugadas en tubo tipo Eppendorf de 1.5 mL a 14000 gravedades durante 5 minutos para la obtención del plasma y posterior determinación de su osmolaridad en mOsm/kg, mediante osmómetro (Precision, Osmometer III, USA).
Determinación del efecto de la glucosa. Para determinar el efecto de cada una de las concentraciones de glucosa sobre la inhibición de la activación de la movilidad espermática de P. magdalenae, muestras de semen fresco de cada uno de tres machos (n=3) fueron utilizadas para este fin. El semen de cada macho fue diluido una sola vez con diferentes soluciones de glucosa en agua desionizada (0 mOsm/kg) a concentraciones de 0, 1, 2, 3, 4, 5, 6, 7, 8, 9 y 10%, determinándose simultáneamente las diferentes características de movilidad espermática con el fin de establecer el grado de inactivación del mismo, para obtenerse al final tres análisis de la movilidad espermática en respuesta a cada concentración de glucosa. La osmolaridad de cada solución de glucosa fue determinada previamente al inicio del experimento. Para esto, muestras individuales de 100 µL fueron analizadas en osmómetro (Precision, Osmometer III, USA).
Caracteristicas seminales. Se estimaron características de movilidad espermática como: porcentaje de espermatozoides rápidos, medios y lentos, movilidad total (%), porcentaje de espermatozoides inmóviles, velocidad curvilínea (VCL) y lineal (VSL), además del tiempo de activación de la movilidad, Ti-Ac, (seg.), las cuales fueron utilizadas como variables respuesta para determinar el efecto de la concentración de glucosa sobre la movilidad espermática en semen fresco.
Movilidad espermática. En todos los casos, para la estimación de la movilidad espermática, 0.25 µL de semen fresco fueron depositados sobre una cámara de conteo Makler (Sefi, Medical Instruments Ltd., Israel), posteriormente, la movilidad fue activada con 75 µL de agua destilada para obtenerse una relación final 1:301 (procedimiento previamente estandarizado con el software para capturar entre 300 y 400 espermatozoides por campo), procediéndose a analizar la muestra a través de microscopio óptico de contraste de fase (Nikkon, E50i, Japón) adaptado al sistema de análisis seminal asistido por computador Sperm Class Analyzer (SCA, VET 01, Microptic SL, España), obteniéndose un dato promedio por muestra, producto de dos análisis por campo, registrados dentro de los 4 segundos posteriores a la activación de la movilidad espermática.
Tiempo de activación. Para la determinación del tiempo de activación de la movilidad espermática (Ti-Ac) fueron tomados 2 µL de semen (n=3) y ubicados sobre portaobjeto (25.4 mm x 76.2 mm). La muestra seminal fue activada con 10 µL de agua destilada e inmediatamente después evaluado el tiempo de activación por cronometraje del mismo hasta que aproximadamente el 90% de los espermatozoides en la muestra cesaran su movilidad. El tiempo de activación fue estimado en segundos (seg), utilizando microscopio de luz (Carl Zeiss, Axiostar, Alemania) a una magnificación de 10x, el cual poseía una cámara adaptada (Canon Power Shot G5, Japón) que permitía la captura y exportación de video hacia un monitor en tiempo real, para mejorar la visualización de la movilidad y por tanto la estimación del tiempo de activación.
Análisis estadistico. Todos los datos fueron expresados como promedio ± desviación estándar. Los análisis estadísticos fueron realizados utilizando SAS versión 9.0 (SAS Institute Inc., Cary, NC, USA). Todas las características de movilidad espermática fueron probadas con el test de Brown y Forsythe (homogeneidad de la varianza) y su normal distribución fue probada usando el test de Kolmogorv-Smirnov. En caso de no tener una distribución normal, se transformaron con arco seno. Las diferencias significativas fueron probadas mediante ANOVA, seguido de la prueba de comparación múltiple de Tukey (p< 0.05).
Resultados
El semen recién obtenido de los machos utilizados en el experimento (n=3) presentó las siguientes características: volumen seminal 0.64 ± 0.15 mL, movilidad total 99.98 ± 0.03%, movilidad rápida de 79.6 ± 3.1% y osmolaridad del plasma seminal de 278.67±21.06 mOsm/kg (∼250 - ∼300 mOsm/kg).
Las osmolaridades correspondientes a las distintas soluciones de glucosa, respectivamente desde 0% hasta 10%, fueron: 0, 62, 124,186, 250, 310, 360, 410, 472, 536 y 620 mOsm/kg.
La movilidad espermática en P. magdalenae se vio activada casi completamente con la adición de glucosa 0% hasta 4% (0 - 250 mOsm/kg), donde la movilidad total se mantuvo entre 99.5 ± 0.5% y 100±0.0% (Figura 1a), el tiempo de activación de la movilidad (Ti-Ac) entre 31.99±3.25 seg. y 37.16±1.53 seg. (p>0.05) (Figura 1b) y el porcentaje de espermatozoides inmóviles (Figura 1c) estuvo cercano a 0% (0.1±0.03%) (p>0.05). Asimismo, se observó un descenso de casi 7% en la movilidad total cuando la concentración de glucosa alcanzó el 5% (93.2±5.8%) sin ser estadísticamente diferente de los anteriores tratamientos (p>0.05). No obstante, al alcanzarse la concentración de glucosa 6% (360 mOsm/kg), la disminución de la movilidad total fue significativa (p<0.05), llegando a valores de 7.23±2.52%. Concentraciones de glucosa superiores (7, 8, 9 y 10%), inhibieron la activación de la movilidad espermática hasta en un 100%, sin embargo, cabe señalar que la reactivación de la movilidad seminal mediante la adición de agua destilada, posterior a la inhibición de la activación con glucosa 7%-10% (410-620 mOsm/kg), fue nula a pesar de la adición excesiva de ésta, pero la reactivación sí fue posible para semen del tratamiento de glucosa 6%.
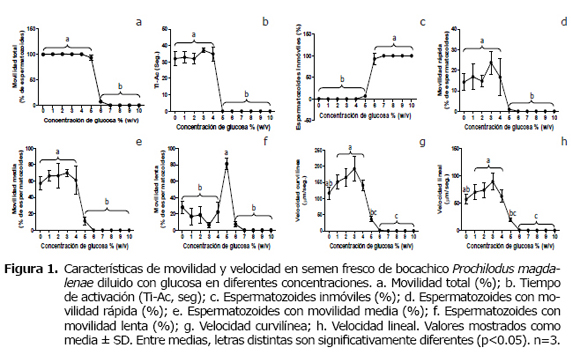
Aunque la movilidad total no varió significativamente entre concentraciones de glucosa desde 0% hasta 5%, sí se afectó el tipo de movilidad, tiempo de activación de la movilidad y velocidad con que estos se desplazaban. Así, la movilidad rápida (Figura 1d) registrada en el tratamiento de glucosa al 5%, disminuyó significativamente (p<0.05) con respecto al grupo de tratamientos de 0-4%, llegando a valores de 0.97±0.6%, movilidad media de 11.3±5.1% (Figura 1b) y una movilidad lenta de 81.13±7.09% (Figura 1e), indicando claramente que en este tratamiento se inicia una lentificación significativa (p<0.05) de la movilidad espermática sin anularla totalmente, siendo el tratamiento glucosa 6% el que se constituye nuevamente en inhibidor de la movilidad, al generar una caída final del tiempo de activación de la movilidad (0 seg), de la movilidad rápida (0%), movilidad media (0%) y de la movilidad lenta (7.23±3.52%), este último valor que a la postre se convierte en el único índice de movilidad total en este tratamiento (Figura 1f).
Por su parte, la velocidad espermática también confirma que la movilidad para P. magdalenae se redujo significativamente a partir del contacto con glucosa 5% (VCL=35.9±8.35 µm/seg, VSL=18.7±3.2 µm/seg), alcanzando éstas variables, sus menores valores en glucosa 6% (VCL=1.83±0.17 µm/seg, VSL=0.7±0.21 µm/seg). Siendo anulada la velocidad en su totalidad en el intervalo de glucosa 7% - 10% (0 µm/seg) (Figuras 1g y 1h).
Discusión
La activación de la movilidad espermática en peces de fertilización externa ocurre por los cambios iónicos y de osmolaridad que suceden cuando los espermatozoides entran en contacto con el agua una vez liberados en el proceso de reproducción (11). Asimismo, se ha encontrado que el inicio de esta puede depender de la presencia extracelular de iones como Na+, Ca2+ o K+ (6, 10, 12), y en algunos casos, sólo de la variación de la osmolaridad extracelular originada o no por iones (13).
En el presente trabajo se observó que la activación espermática de P. magdalenae se genera, incluso, sin la presencia de iones en el medio (0 mOsm/kg = 0% glucosa), por lo que pudiera afirmarse que en este caso la activación depende solamente del choque hiposmótico no iónico, por simple disminución de la osmolaridad, tal como se reporta para peces ciprínidos (12), sin ser estrictamente necesario algún tipo específico de ión para inducir la transducción de la señal activadora de la movilidad, tal como se requiere en el caso de los salmónidos, donde la presencia de K+ extracelular es fundamental para la señal que resulta en la hiperpolarización membranal, la cual da inicio a la activación de la movilidad espermática (14).
Una vez la movilidad espermática inicia, su duración es corta, frecuentemente menor a un minuto, terminando generalmente con una hidratación asociada a la hipotonicidad del medio de activación, que puede generar eventualmente daño celular (15). No obstante, este evento de daño no ocurre para células de P. magdalenae, a pesar que el semen fue activado en un medio extremadamente hipotónico, como lo fue el tratamiento de glucosa 0% (solo agua desionizada = 0 mOsm/kg). Contrario a ello, esta osmolaridad mantuvo siempre la movilidad espermática a niveles estadísticamente iguales al resto de tratamientos con osmolaridades superiores (glucosa 1,2,3 y 4%) y que generaron algún tipo de movilidad y velocidad, sin generar incluso muerte celular, considerando que la inmovilidad espermática también en esta osmolaridad alcanzó un valor promedio de tan sólo 0.5%. Este mismo comportamiento fue evidente durante la activación de la movilidad espermática de piabanha Brycon insignis, donde ésta se mantuvo constante (100%) desde osmolaridades de 0 hasta 274 mOsm/kg (16). Es posible que este tipo de células posean una membrana con funciones fisiológicas y evolutivamente adaptadas para responder a un rango amplio de osmolaridades, incluyendo 0 mOsm/kg, sin que esto pueda afectar en gran medida la viabilidad espermática por daños como la ruptura de membrana. Esto puede evidenciarse cuando se observa la variación extrema en la constitución físico-química de sistemas lóticos colombianos (17), lo que pudiera sugerir dicha adaptación, sistemas naturales donde se llevan a cabo eventos reproductivos de diferentes especies de peces caraciformes.
A pesar de no atribuírsele daño celular a una gran hipotonicidad del medio de activación, el tiempo de activación de la movilidad sí fue inferior a 1 minuto (31.99 seg. - 37.16 seg) mientras se observó activo (0%-4%), y es generalmente lo estimado para peces de agua dulce, especialmente atribuible al descenso rápido en los contenidos de ATP (18).
Aunque el tiempo de activación en peces como Rhamdia quelem inicia a osmolaridades de 0 mOsm/kg (0% NaCl), su duración es estadísticamente igual a espermatozoides inmóviles (8‰ NaCl, 0 seg) y estadísticamente inferior a tratamientos que alcanzaron altas movilidades (2 y 6% NaCl) (19), lo que es contrario a lo acontecido con P. magdalenae, donde 0 mOsm/kg produjo un tiempo de activación de la movilidad espermática estadísticamente superior a los inmóviles (7%-10%) e igual al resto de tratamientos que generaron alta movilidad (1%-4%).
Por otra parte, en este estudio se encontró que la declinación significativa de variables como el porcentaje de movilidad y la velocidad, inició, en forma general, cuando la concentración de glucosa fue del 5% (310 mOsm/kg), cayendo casi definitivamente cuando la glucosa asciende a 6% (360 mOsm/kg). Asimismo, considerando que la osmolaridad del plasma seminal de la especie se determinó en ∼250-300 mOsm/kg, puede afirmarse que el inicio de la inmovilidad sólo puede alcanzarse cuando el medio de activación supera entre ∼10-60 mOsm/kg al plasma seminal, sin bastar incluso con que el mismo medio fuese siquiera isosmótico (glucosa 4%=∼250 mOsm/kg), el cual activó también la movilidad espermática.
Esto concuerda con estudios realizados en peces teleósteos de agua dulce como piabanha Brycon insignis (16) y el barbo Barbus barbus (Cyprinidae) (20) donde la disminución de la movilidad y la velocidad también iniciaron cuando la osmolaridad del medio de activación alcanzó valores de 342 y 350 mOsm/kg respectivamente, es decir, ∼56 y ∼70 mOsm/kg por encima de la osmolaridad del plasma seminal respectivamente de cada especie. Estas mismas investigaciones demuestran que las mayores velocidades y porcentajes de movilidad se alcanzan con osmolaridades menores y muy próximas a las del plasma seminal.
En P. magdalenae, en el presente estudio, la movilidad rápida, media o las velocidades, muestran siempre que el valor óptimo se alcanza con glucosa 3%=∼186 mOsm/kg, el tratamiento más próximo y menor a la osmolaridad del plasma en el experimento, esto último, considerando que el tratamiento glucosa 4% poseía una osmolaridad de ∼250 mOsm/kg, igual a la del plasma. Es posible que siendo un pez de agua dulce y aunque su activación no depende de iones extracelulares, puede que el mecanismo de activación de la movilidad para esta especie, al igual que para Perca (21), tenga sus bases en el hecho que la entrada de agua al interior celular, luego del shock hiposmótico, genere la dilución de un ión específico, no necesariamente K+, como en el caso de zebrafish, cuya disminución en su concentración al interior de la célula, sea la señal que de inicio a la activación de la movilidad, pero que su punto de activación óptimo responde a una concentración también óptima del mismo ión.
Sin embargo, esta osmolaridad óptima de activación puede no ser igual para todas las especies de peces de agua dulce. Así por ejemplo, el mayor porcentaje de movilidad espermática para B. barbus se determinó entre 215-235 mOsm/kg (20), entre 125-235 mOsm/kg para el lucio Esox lucius (22), en Perca Perca fluviatilis entre 100-150 mOsm/kg (21), 100-300 mOsm/kg en tilapia Sarotherodon melanotheron (23) y entre 0-150 mOsm/kg para barbo rosado Puntius conchonius (24), debido entre otros, a la misma naturaleza de factores composicionales del plasma (iones y osmolaridad) (24).
Al parecer la inhibición total de la movilidad espermática en algunos caraciformes neotropicales inicia bajo un mismo nivel de osmolaridad. Esto es que en P. magdalenae, en este estudio, se encontró que a partir de 410 mOsm/kg eran inhibidos en su totalidad todos los índices de movilidad, el mismo nivel que el hallado para B. insignis, en cuyo caso la movilidad total a partir de allí y hasta 547 mOsm/kg (la máxima) registró 0% (16).
De otro modo, cabe señalar también que aunque valores en la concentración de glucosa iguales o superiores a 7% (410 mOsm/kg-620 mOsm/kg) lograron mantener la inmovilización espermática en P. magdalenae, éstas no permiten la reactivación de la movilidad posteriormente con agua destilada sin importar la dilución que se haga de dicha concentración de glucosa (dato no mostrado).
Es posible que este rango de osmolaridad esté por fuera del rango máximo de tolerancia que pueden resistir las células espermáticas de esta especie, dada su adaptación a sistemas de agua dulce hipotónicos y no a sistemas de altas osmolaridades como en el caso de los peces marinos, cuya movilidad inicia con shocks hipertónicos que alcanzan valores alrededor de 1200 mOsm/kg (25), por lo cual, más que una inhibición de la activación de la movilidad espermática, estas osmolaridades pudieran estar generando una elevada deshidratación celular al punto de intoxicar a la célula por concentración de sus solutos citosólicos o debido a daños generados por cambios bruscos en las propiedades de la membrana, la cual se ha demostrado por varios estudios, es de vital importancia durante la activación, considerando que factores ambientales como los iones y la osmolaridad interactúan con ella para el inicio de la movilidad a través de cambios en su potencial osmótico y su conductividad iónica (6).
En conclusión, podría sugerirse que concentraciones iguales o superiores al 6% permiten mantener la inactivación de la movilidad espermática de P. magdalenae, sin embargo, concentraciones de 7% a 10% no permiten activar después la movilidad con agua destilada a pesar de la adición abundante de ésta al medio seminal. No obstante, son necesarios estudios más profundos sobre los mecanismos iónicos que sustentan la movilidad espermática de la especie, de modo que puedan ser optimizados sus protocolos de inmovilización y activación, para procesos de biotecnología o reproducción.
Referencias
1. Mojica I. Lista preliminar de las especies de peces dulceacuícolas de Colombia. Rev Acad Col Cienc Exac Fís y Nat 1999; 23:547-566. [ Links ]
2. INPA: Instituto Nacional de Pesca y Acuicultura. Boletín estadístico pesquero colombiano de 1995 (ed. by INPA). Publicaciones INPA-MADR, Santa fe de Bogotá. 1995. [ Links ]
3. Horváth A, Miskolczi E, Urbány B. Cryopreservation of common carp sperm. Aquat Living Resour 2003; 16(5):457-460. [ Links ]
4. Yang H, Hazlewood L, Walter RB, Tiersch TR. Effect of osmotic inmobilization on refrigerated storage and cryopreservation of sperm from a viviparous fish, the green swordtail Xiphosphorus helleri. Cryobiology 2006; 52(2):209-218. [ Links ]
5. Bolsover RS, Hyams JS, Shephard EA, White HA, Wiedemann CG. Cell Biology. 2a ed. USA: John Wiley & Sons, Inc. 2004. [ Links ]
6. Krasznai Z, Marian T, Izumi H, Damjanovich S, Balkay L, Tron L, Morisawa M. Membrane hyperpolarization removes inactivation of Ca2+ channels, leading to Ca2+ influx and subsequent initialization of sperm motility in the common carp. Proc Natl Acad Sci USA 2000; 97:2052-2057. [ Links ]
7. Viveiros ATM, Lock EJ, Woelders H, Komen J. Influence of cooling rates and plunging temperatures in an interrupted slow-freezing procedure for semen of the African catfish, Clarias gariepinus. Cryobiology 2001; 43:276-287. [ Links ]
8. Pegg D. Principles of cryopreservation. En: Day JG, Stacy GN, editors. Cryopreservation and Freeze-Drying Protocols. Totowa NJ: Human Press Inc; 2007. [ Links ]
9. Jiang Z, Li Q, Li W, Hu J, Zhao H, Zhang S. Effect of low density lipoprotein on DNA integrity of freezing-thawing boar sperm by neutral comet assay. Anim Reprod Sci 2007; 99:401-407. [ Links ]
10. Tabares CJ, Tarazona A, Olivera A. Fisiología de la activación del espermatozoide en peces de agua dulce. Rev Col Cienc Pec 2005; 18: 149-161. [ Links ]
11. Linhart O, Cosson J, Mims SD, Shelton WI, Rodina M. Effects of ions on the motility of fresh and demembranated paddlefish (Polyodon spathula) spermatozoa. Reproduction 2002; 124:713-719. [ Links ]
12. Alavi SMH, Cosson J. Sperm motility in fishes: (II) Effects of ions and osmotic pressure. Cell Biol Int 2006; 30:1-14. [ Links ]
13. Ciereszko A, Glogowski J, Dabrowski K. Biochemical characteristics of seminal plasma and spermatozoa of freshwater fishes. En: Tiersch TR and Mazik PM, editores. Cryopreservation in Aquaculture Species. Baton Roue, Louisiana: World Aquaculture Society; 2000. [ Links ]
14. Inaba K. Molecular architecture of sperm flagella: molecules for motility and signaling. Zool Sci 2003; 20:1043-1056. [ Links ]
15. Ingermann RL. Energy metabolism and respiration in fish spermatozoa. En: Alavi SMH, Cosson JJ, Coward K y Raffie C, editors. Fish spermatology. Oxford, UK: Alpha Science International Ltda.; 2008. [ Links ]
16. Shimoda E, de Andrade DR, Vásquez-Vidal M, Shigueky-Yasui G, Straggiotti-Sliva JF, Pereira-Godinho H, Souza G. Efeitos da osmolaridade sobre a motilidade espermática na Piabanha Brycon insignis. Revista Ceres 2007; 54 (315):430-433. [ Links ]
17. Ortiz-Muñoz V, Álvarez-León R. Caracterización de la tolerancia ambiental de las comunidades ícticas en subsidiarios de los ríos Cauca y Magdalena, Colombia. Memoria de la Fundación La Salle de Ciencias Naturales. 2008; 68:7-20. [ Links ]
18. Cosson J. The ionic and osmotic factors controlling motility of fish spermatozoa. Aquaculture 2004; 12:69-85. [ Links ]
19. Martins GB, Piedras SRN, Pouey JLOF, Robaldo RB. Qualidade espermática de jundiá sob salinidades reduzidas. XVIII Congreso de iniciación científica, XI Encuentro de pos-graduacao y I Mostra científica. Brazil: Universidade Federal de Pelotas; 2009. URL Disponible en: http://www.ufpel.tche.br/cic/2009/cd/biologicas.html. [ Links ]
20. Alavi SMH, Rodina H, Policar T, Linhart O. Relationship between semen characteristics and body size in Barbus barbus L. (Teleostei: Cyprinidae) and effects of ions and osmolality on sperm motility. Comp Biochem Physiol A Mol Integr Physiol 2009a; 153:430-437. [ Links ]
21. Alavi SMH, Rodina M, Policar T, Kozak P, Psenicka M, Linhart O. Semen of Perca fluviatilis L: sperm volume and density, seminal plasma indices and effects of dilution ratio, ions and osmolality on sperm motility. Theriogenology 2007; 68:276-283. [ Links ]
22. Alavi SMH, Rodina M, Viveiros ATM, Cosson J, Gela D, Boryshpolets S, Linhart O. Effects of osmolality on sperm morphology, motility and flagellar wave parameters in Northern pike (Esox lucius L.). Theriogenology 2009b; 72:32-43. [ Links ]
23. Legendre M, Cosson J, Alavi SMH, Linhart O. Sperm motility activation in the euryhaline tilapia Sarotherodon melanotheron heudelotii (Dumeril, 1859) acclimatized to fresh, sea or hypersaline waters. Cybium 2008; 32(2):181-182. [ Links ]
24. Hu J, Zhang Y, Zhou R, Zhang Y. Changes in extracellular osmolality initiate sperm motility in freshwater teleost rosy barb Puntius conchonius. Theriogenology 1995; 72:704-710. [ Links ]
25. Thorogood J, Blackshaw A. Factors affecting the activation, motility and cryopreservation of the spermatozoa of the yellowfin bream, Acanthopagrus australis (Günter). Aquacult Res 2008; 23:377-344. [ Links ]














