Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista MVZ Córdoba
Print version ISSN 0122-0268
Rev.MVZ Cordoba vol.17 no.2 Córdoba May/Aug. 2012
COMUNICACIÓN BREVE
Uso de la inmunohistoquímica como herramienta epidemiológica para el diagnóstico de rabia bovina a partir de casos no conclusivos
Use of immunohistochemistry as an epidemiological tool for the diagnosis of bovine rabies using inconclusive cases
Gloria Jurado G,1 MVZ, Luis Montoya-Flórez,1,3 M.Sc, Cesar Betancur H,2 M.Sc., Francisco Pedraza-Ordoñez,1,3* Ph.D.
1Grupo de Investigación en Patología Veterinaria, Departamento de Salud Animal, Universidad de Caldas, Manizales-Colombia.
2Universidad de Córdoba, Facultad de Medicina Veterinaria y Zootecnia, Departamento de Ciencias Pecuarias. Grubiodeq. Montería, Córdoba - Colombia.
3Laboratorio de Patologia Comparativa, Universidade Estadual Paulista (FMVZ-UNESP), Sao Paulo, Brasil.
*Correspondencia: fpedraza@ucaldas.edu.co
Recibido: Diciembre de 2010; Aceptado: Agosto de 2011.
RESUMEN
Objetivo. Identificar el virus de la rabia en casos de encefalitis bovina a partir de muestras archivadas en el laboratorio sin diagnóstico conclusivo. Materiales y métodos. Doce muestras de cerebro bovino sospechosas de rabia, fueron procesadas por la técnica de inmunoperoxidasa indirecta, usando anticuerpos policlonales contra el agente viral. Resultados. Se demostró la presencia de antígenos virales en tres casos en forma de agregados pequeños en el citoplasma de las neuronas, con un patrón de forma redonda u oval y un número variable de corpúsculos de inclusión viral. Se discute sobre la importancia de los resultados en Colombia, la utilidad de la técnica en las difíciles condiciones de envío de muestras al laboratorio, además la posible relación de los casos negativos con herpesvirus bovino 5. Conclusiones. La utilización de la técnica de inmunohistoquímica para demostrar antígenos del virus rábico en encéfalos bovinos fijados en formol, puede ayudar en el perfeccionamiento del mapa epidemiológico de la enfermedad de la rabia en Colombia y puede disminuir el alto subdiagnóstico de otras enfermedades que afectan el sistema nervioso de los bovinos.
Palabras clave: Encefalitis, infecciones, virus de la rabia (Fuente:CAB).
ABSTRACT
Objective. Identify the rabies virus in cases of nervous disease archived in the laboratory with diagnosis of nonspecific encephalitis. Materials and methods. Twelve samples of bovine brain suspected of rabies, were processed by indirect immunoperoxidase technique using polyclonal antibodies against the viral agent. Results. Was demonstrated the presence of viral antigens in three cases in the form of small aggregates in the cytoplasm of neurons, with a pattern of round or oval and a variable number of viral inclusion bodies. We discussed the importance of the results in Colombia, the usefulness of the technique in the difficult conditions for sending samples to the laboratory, plus the possible relationship of the negative cases with bovine herpesvirus 5. Conclusions. The use of immunohistochemical technique to demonstrate rabies virus antigens in formalin fixed bovines tissues can help in the construction of an epidemiological map of rabies disease in Colombia and may reduce the high under-diagnosis of diseases of the nervous system of cattle, reported in some regions.
Key words: Encephalitis, infections, rabies virus (Source:CAB).
INTRODUCCIÓN
El diagnóstico del virus de la rabia en el laboratorio es esencial para direccionar los programas de control de la enfermedad, el establecimiento de la vigilancia epidemiológica, monitoreo efectivo de áreas geográficas y orientación de medidas profilácticas (1). Se estima que la encefalitis rábica genera pérdidas anuales de 50 millones de dólares en todo el mundo y aproximadamente de 30 millones de dólares en Latinoamérica (2). En Colombia, aun no existe un dato estimado de las pérdidas que este virus ocasiona en las ganaderías, pero se puede inferir que son altas si se tiene en cuenta que en el último reporte sobre sanidad animal emitido por el Instituto Colombiano Agropecuario, el total de notificaciones de síndrome neurológico en bovinos fue de 310 y en 91 (30%) de los casos, se confirmó la presencia del virus rábico por laboratorio (3). La enfermedad de la rabia es producida por un virus RNA del género Lyssavirus, Familia Rhabdoviridae, que produce encefalomielitis no supurativa de curso mortal; la enfermedad se presenta de forma esporádica en bovinos y otros mamíferos en todo el mundo y es una zoonosis (4,5). El diagnóstico del virus puede ser hecho en tejido nervioso fresco, a través de las técnicas de inmunofluorescencia directa (IFD) inoculación intracerebral en ratones, detección de ácidos nucleicos por RT-PCR, crecimiento en células de neuroblastoma o por pruebas histológicas que demuestren la presencia de corpúsculos de Negri (1).
La principal prueba para el diagnóstico del virus es la IFD debido a la rapidez con la que se obtienen sus resultados y a su alta sensibilidad y especificidad, siendo necesario el envío de muestras frescas, congeladas o preservadas en glicerina (1,6,7); esta condición de preservación se dificulta si se tiene en cuenta que, en todo el mundo, se usa formol en la rutina de fijación de tejidos para proceso histopatológico, incluyendo los casos donde no hay sospecha clínica de rabia o en regiones donde hay deficiencias para la refrigeración y para el transporte de las muestras hasta el laboratorio (1,7,8). La fijación en formaldehido de tejidos positivos a rabia inactiva rápidamente al virus e imposibilita el diagnóstico a través de la IFD; igualmente, altera la reactividad de antígenos y ocasiona el enmascaramiento de determinantes antigénicos por las reacciones de unión cruzadas que se producen entre proteínas o entre proteínas y ácidos nucleícos además de los cambios moleculares que genera en carbohidratos y fosfolipidos (8,9). Cuando no se puede realizar IFD para el diagnóstico del virus rabia se favorece el subdiagnóstico de enfermedades del sistema nervioso, por lo tanto, se requiere el uso de técnicas complementarias en el diagnóstico de este agente, como es el caso de la inmunohistoquímica (IHQ), que además de utilizarse en tejidos fijados en formol, es altamente sensible y especifica, comparable con la IFD (1,10,11). El objetivo de esta investigación fue utilizar la técnica de inmunohistoquímica, con el fin de identificar el virus de la rabia en casos de enfermedad nerviosa que no pudieron ser procesados por IFD y quedaron archivados en el laboratorio con diagnóstico de encefalitis inespecífica.
MATERIALES Y MÉTODOS
Tipo de estudio y muestras. La presente investigación correspondió a un estudio descriptivo retrospectivo en el que se utilizaron muestras de cerebro bovino conservado en bloques de parafina, correspondientes a casos de encefalitis natural, ocurridos entre los años 2002 y 2004 en varias regiones de Colombia. Se colectaron un total de doce casos, ocho de los cuales fueron procedentes del laboratorio del Instituto Colombiano Agropecuario ICA-CEISA en Bogotá donde se encontraban con diagnóstico de encefalitis inespecíficas; las otras cuatro, procedían del laboratorio del ICA en Montería, donde el diagnóstico fue similar en dos casos, siendo las otras dos presuntivas de la enfermedad de la rabia. Todos los animales presentaron síntomas característicos de enfermedad neurológica y finalmente murieron. Los cerebros fueron fijados en formalina ácida al 10% lo que impidió en algunos casos realizar la prueba biológica y de anticuerpos fluorescentes exigida para el diagnóstico del virus de la rabia, además, estuvieron en este fijador por periodos de tiempo superior a los dos meses.
Prueba de inmunohistoquímica. La realización de la prueba de inmunohistoquímica (inmunoperoxidasa indirecta) se hizo en el laboratorio de Patología Veterinaria de la Universidad de Caldas en Manizales, modificando los protocolos estandarizados por Machado et al (1), en la Universidad Estadual Paulista (UNESP), Sao Paulo, Brasil y del Instituto Nacional de Salud en Bogotá Colombia. Para el proceso, cortes tisulares de 5 µm fueron inicialmente colocados en láminas de vidrio cargadas (Slidetech Plus Novocastra ® Newcastle UK), desparafinizados en xilol e hidratados por pasaje en concentraciones crecientes de alcohol.
El bloqueo de la peroxidasa endógena se logró con un reactivo para tal fin (Dako Ref S2001® Carpintería EU) y la recuperacion antigénica se hizo combinando dos sistemas (digestión enzimática y calor). En la primera, los cortes fueron sometidos a tripsina durante 30 minutos a 37°C en cámara húmeda, y en la segunda a cocción durante 10 minutos en tampón citrato (pH 6.0), usando un horno microondas (200W de potencia). El bloqueo de los sitios de ligación inespecífica se realizó con leche en polvo sin grasa mediante una solución al 3% en tampón de fosfato (pH 7.4) durante 30 minutos. Posteriormente se realizaron tres incubaciones, inicialmente con el anticuerpo primario: Rabies policlonal DFA Chemicon® a una dilución de 1:200 durante dos horas en cámara húmeda en refrigeración, luego con el anticuerpo secundario biotinilado (Universal DAKO K0690® Carpintería EU) durante 45 minutos en cámara húmeda a temperatura ambiente y finalmente, con el Complejo Streptoavidina Peroxidasa del mismo kit (DAKO K0690® Carpintería EU) por 45 minutos en cámara húmeda a temperatura ambiente.
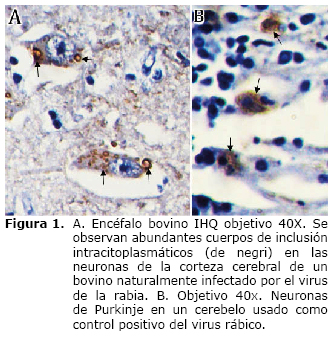
La reacción de la peroxidasa fue revelada con Diaminobenzidina (DAB DAKO K3468 New Castle UK) diluyendo 1 gota por 1500 µL del sustrato y los tejidos fueron expuestos a esta dilución durante 3 minutos. Los tejidos fueron contracoloreados con Hematoxilina de Harris durante 5 minutos, lavados con agua corriente, sumergidos en una solución de agua amoniacal al 5% por 3 segundos y montados con laminillas de vidrio para su observación en el microscopio. Como control positivo se utilizó un fragmento de cerebelo obtenido en el Instituto Nacional de Salud en Bogotá el cual fue confirmado por inmunofluorescencia indirecta y prueba biológica. Dos controles negativos fueron incluidos, uno de cerebro bovino normal y otro por adición de PBS en substitución del anticuerpo primario en los mismos tejidos analizados.
RESULTADOS
La prueba de inmunohistoquímica permitió demostrar la presencia de antígenos en agregados pequeños en el citoplasma de las neuronas con un patrón de forma redonda u oval y un número variable de corpúsculos de inclusión viral. La detección de antígenos del virus de la rabia pudo demostrarse en tres (25%) de los doce casos analizados. Los casos positivos correspondieron a las muestras con diagnóstico de encefalitis inespecífica procedentes del laboratorio ICA-CEISA en Bogotá (dos de ellas remitidas desde el Departamento del Cesar y otra desde Montería) (Figura 1).
DISCUSIÓN
La técnica de inmunohistoquímica (que se basa en el uso de anticuerpos para demostrar antígenos en cortes tisulares) permite la realización de estudios retrospectivos para recuperar diagnósticos de enfermedad de interés epidemiológico con altos niveles de sensibilidad y especificidad, proximos al 100% similar al lo registrado para la IFD (6,7) En el presente estudio, la técnica permitió la identificación del virus de la rabia en casos de enfermedad neurológica de bovinos que habían sido archivados con diagnóstico de encefalitis inespecífica y en los que se pudo demostrar la existencia de antígenos virales citoplasmáticos en agregados pequeños dentro de las neuronas, de forma similar a las citadas por otros autores (7).
Respecto de los casos que no presentaron inmunomarcación, se debe considerar en primera instancia, que efectivamente correspondan a casos negativos (teniendo en cuenta la alta especificidad de la prueba), sin embargo, existen varias características de los tejidos analizados que no pudieron ser controlados en la investigación y eventualmente podrían haber generado resultados falsos negativos, como por ejemplo, la porción del órgano escogido para la muestra (en la mayoría de casos no hubo un patrón definido sobre el tejido enviado para análisis al laboratorio) que según Binghem y Merwe (12), es importante debido a que la cantidad de antígeno puede variar de acuerdo a la porción de cerebro analizado y recomiendan el envío de fragmentos del tronco cerebral, hipocampo y cerebelo.
Otro aspecto importante que explica el resultado de casos falsos negativos fue el prolongado tiempo que permanecieron los tejidos en formol ya que este fijador produce enlaces cruzados con los grupos amino reactivos sin carga que hay en el tejido y con el paso del tiempo, provoca una pérdida progresiva de los antígenos tisulares (8), en este sentido, algunos autores recomiendan, para inmunohistoquímica no superar las 6 horas de fijación (11), mientras que otros sugieren que 6 a 24 horas para piezas pequeñas de tejido, brindan una preservación morfológica óptima (13); sin embargo, modificaciones de la técnica de inmunohistoquímica han sido hechas para intentar recuperar material diagnóstico y se ha comprobado la eficiencia de una doble recuperación antigénica (similar a la utilizada en esta investigación) en tejidos preservados en formol por más de cinco años (1). Por otro lado, debido al uso de fuentes secundarias de información, los datos epidemiológicos de los casos fueron escasos y practicamente nunca se supo sobre la evolución, ni la fase en la que se encontraba la enfermedad, hecho importante si te tiene en cuenta que en los casos de infección natural la cantidad de virus existente en el momento de la muerte del animal no es tan alta como ocurre en los casos de infección experimental (6).
Respecto a los diagnósticos diferenciales en los casos negativos y con base en alteraciones histopatológicas observadas en la coloración de rutina Hematoxilina-Eosina (H&E) de los tejidos evaluados, se consideró en algunos casos, compatibilidad con la meningoencefalitis causada por el Herpes Virus Bovino 5 (BoHV-5), agente recientemente descrito en Colombia (14), siendo que estos casos mostraron, gliosis, manguitos perivasculares, malacia y células gitter, considerados característicos de este tipo de infección (15). Es importante no dejar de lado otras causas de meningitis inespecíficas, como las de origen bacterial (por Listeria spp), envenenamiento por consumo de plantas tóxicas, intoxicación por plomo, polioencefalomalacia por deficiencia de tiamina y botulismo entre otros (16,17). Hallazgos histopatológicos como los cuerpos de inclusión virales, son característicos de la infección con estos microorganismos y pueden definir (cuando se observan) el diagnóstico de enfermedades como la rabia y la meningoencefalitis herpética (16). Los corpúsculos de Negri, como se conoce a las inclusiones del virus rábico pueden pasar desapercibidos en el 30% de los tejidos de animales afectados con esta enfermedad (18), en la presente investigación, de los tres casos positivos al virus de la rabia por IHQ, solo en uno fue observado los corpúsculos de Negri empleando la coloración de H&E.
La utilización de la técnica de inmunohistoquímica para demostrar antígenos del virus rábico en tejidos bovinos fijados en formol, puede ayudar en la construcción del mapa epidemiológico de la enfermedad de la rabia en Colombia y puede disminuir el subdiagnóstico de enfermedades del sistema nervioso de los bovinos, reportado en algunas regiones del país (19,20) facilitando el envío de muestras al laboratorio ya que el formol es muy utilizado por veterinarios y ganaderos debido su bajo costo, fácil adquisición y genera una óptima preservación de las características histopatológicas de los tejidos permitiendo el diagnóstico diferencial de múltiples agentes.
En Colombia, el diagnóstico oficial para la enfermedad de la rabia está centralizado en la capital de la República, mientras que, algunas zonas ganaderas están alejadas de los centros de recepción de muestras o presentan difíciles condiciones de acceso, siendo este uno de los motivos para no enviar muestras al laboratorio. En algunas oportunidades, aunque se toman muestras de los animales afectados, se envían de forma errónea al laboratorio, impidiendo la conclusión de un diagnóstico, generando incertidumbre sobre las causas del problema de salud que esta afectando la explotación en ese momento. En un estudio realizado en Brasil, de 1432 diagnósticos en animales muertos con síntomas nerviosos, el 37.1% de las muestras fue mal remitida al laboratorio y no apta para el diagnóstico, mientras que, del total de diagnósticos establecidos, solo el 20% correspondió a la enfermedad de la rabia, siendo el 80% restante representado por diversas entidades como el botulismo, la polioencefalomalacia y la meningoencefalitis no supurativa (compatible con meningoencefalitis herpética) entre otras (21).
En conclusión, desde el punto de vista práctico, la técnica de IHQ puede usarse para demostrar antígenos del virus de la rabia en cortes histopatológicos de encéfalos sospechosos de la enfermedad, en casos inconclusos o que presenten características atípicas de encefalitis no supurativa y en general cuando se necesite la identificación viral en muestras que no permitan la aplicación de la técnica de inmunofluorescencia como ocurre cuando se usa formol como fijador.
Se recomiendan futuras investigaciones en este mismo sentido utilizando muestras de otras regiones del país, de la misma forma, se recomienda la búsqueda de otros agentes asociados a la enfermedad neurológica en bovinos para contribuir con un adecuado trazado de los mapas epidemiológicos en Colombia.
Agradecimientos
Al personal del Instituto Colombiano Agropecuario (ICA) en Bogotá y Montería, por facilitar las muestras para esta investigación. A la Dra. Gisele Fabrino Machado de la Universidade Estadual Paulista en Araçatuba, Sao Paulo (Brasil), por el entrenamiento al primer autor en el diagnóstico del virus rábico y al personal del Instituto Nacional de Salud por la asesoría brindada para la prueba de IHQ.
REFERENCIAS
1. Machado FG, Queiroz LH, Maroni NC. Detection of rabies virus antigen in dog encephalo kept in formalin for a long time. Rev Port Ciênc Vet 2004; 99 (550):89-92. [ Links ]
2. Franco M. Raiva mata mais bovinos e eqüinos e preocupa. DBO Rural, Goiânia 1998; 17(214):84-88. [ Links ]
3. Instituto Colombiano Agropecuario (ICA). Colombia Sanidad animal 2005, Informe técnico. Bogotá, Colombia: ICA; 2007. [ Links ]
4. Lima EF, Riet-Correa F, Castro RS, Gomes AB, Lima FS. Sinais clínicos, distribuição das lesões no sistema nervoso e epidemiologia da raiva em herbívoros na região Nordeste do Brasil. Pesq Vet Bras 2005; 25(4):250-264. [ Links ]
5. Dodet Betty. An important date in rabies history. Meeting report. Vaccine 2007; 25: 8647-8650. [ Links ]
6. World Organization for Animal Health OIE 2011. Rabies. In: Manual of Diagnostic Tests and Vaccines for Terrestrial Animals 2011. [ Links ]
7. Pedroso POM, Colodel E, Pescador CA, Arruda LP, Driemeier D. Aspectos clínicos e patológicos em bovinos afetados por raiva com especial referência ao mapeamento do antígeno rábico por imunohistoquímica. Pesq Vet Bras 2009; 29(11):899-904. [ Links ]
8. Ramos VJ. Technical Aspects of Immunohistochemistry. Vet Pathol 2005; 42:405-426. [ Links ]
9. D'Amico F, Skarmoutsou E, Stivala F. State of the art in antigen retrieval for immunohistochemistry. J Immunol Meth 2009; 341:1-18. [ Links ]
10. Center for Disease Control and Prevention. Immunohistochemistry diagnoses of rabies. [consultada en 2/10/2010]. URL Disponible en: http://www.cdc.gov/rabies/diagnosis/immunohistochemistry.html. [ Links ]
11. Dagleish MP, Benavides J, Chianini F. Immunohistochemical diagnosis of infectious diseases of sheep. Small Ruminant Res 2010; 92:19-35. [ Links ]
12. Binghem J and Merwe M. Distribution of rabies in infected brain material: determining the reliability of different regions of the brain for the rabies fluorescent antibody test. J Virol Meth 2002; 101:85-94. [ Links ]
13. Farmilo AJ, Stead R. Fixation in inmunocytochemistry. In: Sally J. Naish. Inmunochemical staining methods. Carpinteria, California, USA: DAKO Corporation; 2002; [ Links ]
14. Pedraza FJ, Alessi AC, Barbosa-Stancioli EF. Detection of bovine herpesvirus 5 (BoHV-5) in formalin-fixed, paraffin-embedded bovine brain by nested PCR in colombian cattle. Rev Col Cienc Pec 2010; 23:292-298. [ Links ]
15. Rissi DR, Oliveira FN, Rech RR, Pierezan F, Lemos RAA & Barros CSL. Epidemiologia, sinais clínicos e distribuição das lesões encefálicas em bovinos afetados por meningoencefalite por bovino-5. Pesq Vet Bras 2006; 26:123-132. [ Links ]
16. Riet-Correa, Schild AL, Lemos RA, Renato J, Borges J. Doenças de ruminantes y eqüídeos, 3 ed, Santa Maria, Brasil: Pallotti; 2007. [ Links ]
17. Sant'Ana F, Barros CSL. Polioencephalomalacia in ruminants in Brazil. Braz J Vet Pathol 2010; 3(1):70-79. [ Links ]
18. Rech RR. Alterações no encéfalo de bovinos submetidos à vigilância das encefalopatias espongiformes transmissíveis. [Tese de Doutorado em Medicina Veterinária]. Santa Maria, Brasil: Universidade Federal de Santa Maria; 2007. [ Links ]
19. Montoya LM, Pedraza FJ. Revisión histopatológica de las enfermedades del sistema nervioso en bovinos de la región del Magdalena Medio Colombiano. Rev Col Cienc Pec 2009; 22(3):427. [ Links ]
20. Piedrahita LE, Montoya LM, Pedraza FJ. Herpes Virus Bovino tipo 1 (BoHV-1) como posible causa de encefalitis en bovinos de la región del Magdalena Medio Colombiano. Estudio serológico y análisis epidemiológico. Rev Col Cienc Pec 2010; 23:191-198. [ Links ]
21. Lemos RA. Enfermidades do sistema nervoso de bovinos de corte das regiões centro-oeste e sudeste do Brasil. [Tese de Doutorado] Jaboticabal, São Pablo, Brasil: Universidade Estadual Paulista "Julio de Mesquita Filho". Faculdade de Ciências Agrárias e Veterinárias; 2005. [ Links ]