Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista MVZ Córdoba
Print version ISSN 0122-0268
Rev.MVZ Cordoba vol.17 no.3 Córdoba Sept./Dec. 2012
ORIGINAL
Efecto nutracéutico del Anacardium occidentale en dietas de pollitas ponedoras de reemplazo
Nutraceutical effect of Anacardium occidentale in diets of replacement laying pullets
Yordan Martínez A,1 Ph.D, Orlando Martínez Y,1 Ph.D, Edwin Olmos S,2 MVZ, Sandra Siza I,2 MVZ, César Betancur H,3* M.Sc.
1Universidad de Granma, Bayamo, Granma. Cuba.
2Universidad Técnica de Cotopaxi. Cotopaxi, Ecuador.
3Universidad de Córdoba, Facultad de Medicina Veterinaria y Zootecnia. Departamento de Ciencias Pecuarias. Montería, Colombia.
*Corresponding: betanci@yahoo.com
Recibido: Marzo de 2011; Aceptado: Abril de 2012.
RESUMEN
Objetivo. Evaluar el efecto nutracéutico del polvo de hojas y retoños de Anacardium occidentale (AO) en dietas de pollitas ponedoras de remplazo. Materiales y métodos. Se utilizaron 240 pollitas White Leghorn (L-33) de un día de edad, que se ubicaron durante 35 días, según diseño completamente aleatorizado, con niveles de adición de 0, 0.5, 1.5 y 2.5% de polvo de hojas y retoños de Anacardium occidentale en las dietas. Se determinaron en las pollitas, los indicadores productivos, peso absoluto y relativo de los órganos inmunes, vísceras, accesorios e intestinos, la hipersensibilidad intestinal y la glucosa sérica. Resultados. El peso vivo final, consumo de alimento, peso del timo, bolsa de Fabricio y colon + recto en las aves con el tracto gastrointestinal vacío y lleno, fue favorable con la adición de 0.5% de polvo AO, con diferencias significativas (p≤0.05). El consumo acumulado, el consumo de polvo AO y taninos se incrementaron en las aves con la adición de 1.5 y 2.5% de polvo AO con respecto al control; no obstante los indicadores productivos para estos animales se deprimieron. La adición del polvo de AO, no deterioró el peso relativo de las vísceras (corazón, hígado y riñón) en las aves, además redujo la hipersensibilidad intestinal y la glucosa sérica. Conclusiones. La adición de 0.5% de polvo de hojas y retoños de AO como nutracéutico en las dietas de pollitas ponedoras de remplazo, mejoró los indicadores productivos y el peso de los órganos inmunes; además, la adición del polvo AO en las dietas disminuyó la hipersensibilidad intestinal y la glucosa sérica.
Palabras clave: Inmunidad aviar, marañón, promotor de crecimiento (Fuentes: DeCS, AIMS).
ABSTRACT
Objective. To assess the nutraceutical effect of powder from leaves and shoots of Anacardium occidentale (AO) in the diets of replacement laying pullets. Materials and methods. 240 day-old White Leghorn chicks (L-33), were placed for 35 days, according to a completely randomized design with addition levels of 0, 0.5, 1.5 and 2.5% of leaves and shoots powder of AO, in their diets. In the case of chicks, production indicators, absolute and relative weight of immune organs, viscera, innards and intestines, intestinal hypersensitivity and serum glucose were determined. Results. The final body weight, the cumulative feed intake, the weight of thymus, bursa of Fabricio, and colon + rectum with empty and full gastrointestinal tract in the birds, were favorable with the addition of 0.5 % of AO powder with significant difference between (p≤0.05). Cumulative intake, consumption of AO powder and tannins were increased in birds with 1.5 and 2.5% of AO powder compared to the control group; however, the production indicators for these animals were reduced. The addition of AO powder did not impair the relative weight of the viscera (heart, liver and kidney) in birds; also, the intestinal hypersensitivity and serum glucose were reduced. Conclusions. The addition of 0.5% of powder from leaves and shoots of AO as nutraceutical in diets for replacement pullets and laying hens, improved the productive indicators and weight of immune organs, plus the addition of three levels of dust in the diets, decreased intestinal hypersensitivity and serum glucose.
Keywords: Avian immunity, cashew nuts, promoter of growth (Sources: DeCS, AIMS).
INTRODUCCIÓN
En los últimos años, la comunidad científica internacional ha manifestado una alarmante preocupación por el uso indiscriminado de los antibióticos como promotores de crecimiento en las aves, aunque muchos países restringen su utilización, países en vías de desarrollo lo utilizan con gran frecuencia (1).
Los antibióticos se emplean en los primeros días de vida de las aves con el objetivo de aumentar la exclusión competitiva sobre la microflora del tracto gastrointestinal (TGI), controlando procesos entéricos de naturaleza subclínica frecuentes en la producción intensiva, lo que incrementa entre 1 y 5% las ganancias de peso y el índice de conversión. No obstante, los antibióticos pueden aumentar el número de cepas resistentes, así como transferir resistencias cruzadas a otros microorganismos; la premisa futura de los investigadores es obtener alternativas naturales para contrarrestar el uso indiscriminado de los antibióticos como preventivos en las aves (2).
En la industria avícola se han investigado muchos alimentos funcionales o nutracéuticos como promotores de crecimiento tales como: prebióticos, probióticos, fortalecidos, enriquecidos y extractos de plantas; con el objetivo de mejorar el estado de salud, disminuir los microorganismos patógenos y modular una mejor respuesta inmunitaria. Los aditivos de plantas son considerados como una alternativa para sustituir los antibióticos, desde el punto de vista técnico, económico y biológico por la seguridad de su inclusión y su nula residualidad (1).
El Anacardium occidentale (AO) es un árbol originario de Brasil, localizado en todo el mundo, con muchas propiedades medicinales como hipoglicemiante y antihipertensivo en ratas, moluscicida contra babosas (Biomphalaria glabrata) con actividad bactericida, antihelmíntico y antiinflamatorio (3, 4); específicamente el polvo de las hojas y retoños de AO se utilizó con efectividad para contrarrestar el síndrome diarreico en aves, cerdos, cobayos, ovinos, conejos, bovinos y humanos en la República de Cuba, ya que con sólo dos dosis fue positivo para mejorar el estado físico y metabólico del paciente (5).
Por todos estos beneficios medicinales, el polvo de las hojas y retoños del AO pudiera emplearse como nutracéutico (producto natural) en los primeros días de las aves, teniendo en cuenta la susceptibilidad y presencia de microorganismos patógenos latentes y la premura de la edad al primer huevo. El objetivo fue evaluar el efecto nutracéutico del polvo de retoños y hojas de Anacardium occidentale en las dietas de pollitas ponedoras de reemplazo White Leghorn L-33.
MATERIALES Y MÉTODOS
Sitio de estudio. La experimentación con pollitas ponedoras de reemplazo se desarrolló en el área de producción “Horacio Rodríguez” perteneciente a la Empresa Provincial Avícola Granma, Cuba.
Condiciones geo-climáticas. La humedad relativa media fue 78%, la temperatura mínima promedio de 23.30°C y la temperatura máxima promedio de 30.60°C.
Toma de muestra. Se tomaron hojas y retoños del árbol de Anacardium occidentale Linneo, de 10 años de edad aproximadamente en la zona de Peralejo Bayamo-Granma, Cuba, caracterizado por una topografía llana y suelo ferralítico. Se tuvo en cuenta en la recolección la diversidad del tamaño y estructura de las hojas.
Las muestras fueron deshidratadas a 60 a 65°C durante 16 horas, luego se trituró 1 mm en molino eléctrico de cuchillas paralelas, las muestras se conservaron a temperatura ambiente en almacenes de alimento durante 90 días (5).
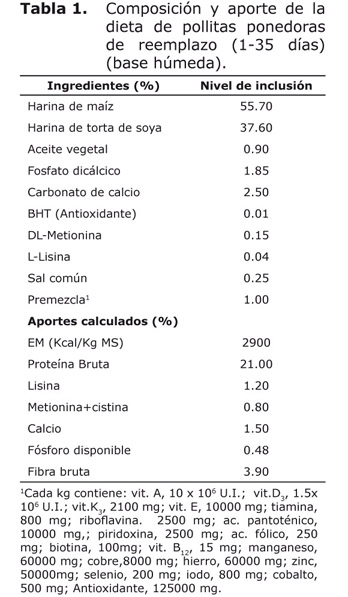
Animales, diseño experimental y tratamientos. Un total de 240 pollitas ponedoras de reemplazo White Leghorn (Híbrido L-33) de un día de edad se ubicaron durante 35 días según diseño completamente aleatorizado con cuatro tratamientos y cuatro repeticiones. Los tratamientos consistieron en adiciones de 0, 0.5, 1.5 y 2.5% de polvo AO como aditivo nutracéutico. Las dietas se formularon según lo recomendado por la UECAN (6) (Tabla 1). Se tomaron en cuenta los resultados del polvo AO como terapéutico para seleccionar los niveles de adición como nutracéutico (5).
Condiciones experimentales. Cada repetición estuvo constituida por un cuartón con cama profunda de cascarilla de arroz y 18 aves/m². El alimento y el agua se ofertaron ad libitum en comederos tipo tolva y bebederos de niple, respectivamente. La nave se desinfectó según las normas de calidad medioambientales (6). Se empleó calefacción alternativa mediante carbón hasta los 14 días de edad, se utilizó un sistema de iluminación de 24 horas luz. No se utilizaron medicamentos, ni atención veterinaria terapéutica durante toda la etapa experimental. Las aves fueron vacunadas contra el Marek, Viruela (primer día), Gumboro (12 días) y Newcastle (14 días).
Indicadores productivos. La viabilidad de las pollitas ponedoras de reemplazo se determinó por los animales muertos entre los existentes al inicio del experimento. Se calculó la conversión alimenticia como la cantidad de alimento ingerido, para una ganancia de 1 g de peso vivo (PV). Se determinó el tamaño del tarso mediante un pie de rey Stanley. El peso inicial y el final se midió de forma individual al primer día y a los 35 de edad, además se determinó el peso semanal, con una muestra del 20% de la masa total, en una balanza digital SARTORIUS modelo BL 1500 con precisión ± 0.1 g, respectivamente. El consumo de alimento acumulado (CA), consumo acumulado de polvo AO (CA de polvo AO) y taninos (CA de taninos) se calcularon diariamente mediante el método de oferta y rechazo. Se tuvo en cuenta la concentración de taninos totales en el polvo AO (22.73 mg/g) y en la torta de soya (10 mg/g) (5).
Peso absoluto y relativo de los órganos digestivos, inmunes y vísceras. A los 35 días de edad las aves se sacrificaron por el método desangrado en la vena yugular 10 aves/tratamiento en ayunas por 4 horas y 10 aves/tratamiento consumiendo alimento ad libitum, seguido se pesaron las vísceras (hígado, corazón y riñón), órganos inmunes (timo, bazo y bolsa de Fabricio), accesorios (proventrículo y molleja) y los intestinos (delgado y grueso).
pH, necropsia de los intestinos y glucosa sérica. Seguido del sacrificio se determinó el pH del intestino delgado y ciegos de 10 aves/tratamiento en ayunas, mediante un potenciómetro digital Bantex modelo 300 A, calibrado con soluciones tampón de pH 7 y 10. Además se realizaron necropsias a los intestinos (delgado y grueso) para evaluar la estructura fisiológica y se determinó la glucosa sérica a 10 aves/tratamiento en ayunas, empleando un espectrofotómetro ultravioleta, marca Humalyzer, con Kits enzimáticos comercializados por SPINREACT. SA.
Análisis estadísticos. Los datos se procesaron mediante análisis de varianza (ANOVA) de clasificación simple en un diseño totalmente aleatorizado, antes de realizar el análisis de varianza se procedió a verificar la normalidad de los datos por la prueba de Kolmogorov Smirnov (7) y para la uniformidad de la varianza, la prueba de Bartlett (8), en los casos necesarios se empleó la Dócima de Duncan (9) para determinar las diferencias entre medias, según el software estadístico SPSS versión 17.1
RESULTADOS
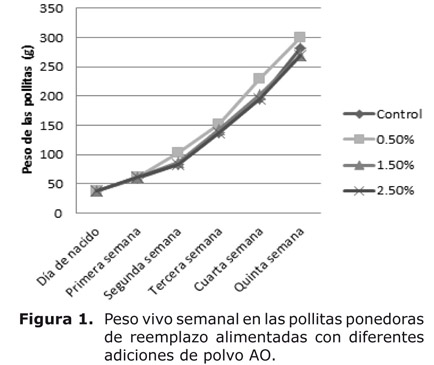
La figura 1 muestra el incremento del peso vivo a partir de la segunda semana de vida en las pollitas ponedoras de reemplazo alimentadas con la adición de 0.5% de polvo AO, en comparación con el tratamiento control, 1.5 y 2.5% de polvo AO.
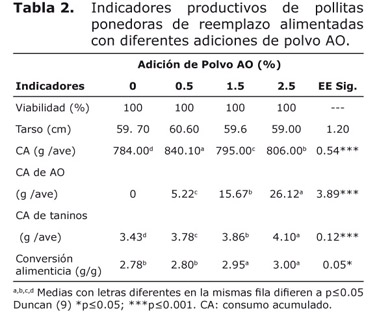
En la tabla 2 se observa que la viabilidad y el tamaño del tarso, no mostraron diferencias significativas entre tratamientos (p≥0.05). El consumo acumulado fue mayoritario para el tratamiento con 0.5% de polvo AO, así como el consumo de polvo AO y taninos fue progresivo con el nivel de adición de polvo AO.
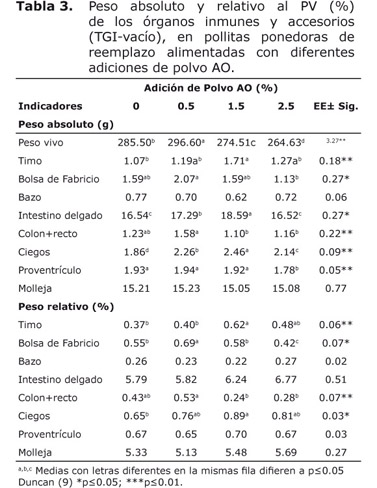
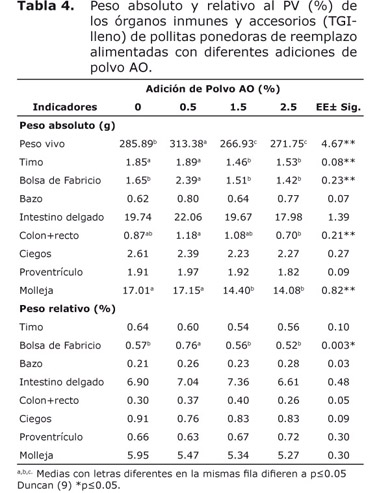
La tabla 3 mostró que el peso absoluto y relativo del bazo, molleja y el relativo del intestino delgado y proventrículo, no mostraron diferencias significativas entre tratamientos (p≥0.05). La adición de 0.5% de polvo AO fue favorable para el peso absoluto y relativo de la bolsa de Fabricio y colon+recto. El peso del timo, intestino delgado y ciegos fueron mayoritarios con 1.5% de polvo AO, con relación a los demás tratamientos.
En las pollitas que consumieron alimento, el peso absoluto del bazo, intestino delgado, ciegos y molleja no mostraron diferencias entre tratamientos (p≥0.05); no obstante, la adición de 0.5% favoreció el peso absoluto y relativo de la bolsa de Fabricio (Tabla 4), los otros órganos y accesorios no mostraron diferencias estadísticas en los pesos relativos (p≥0.05).
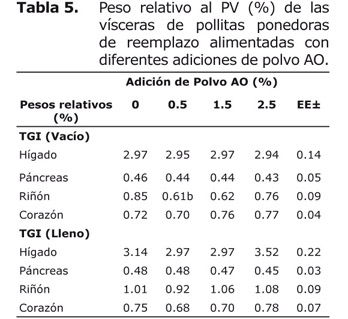
El peso relativo de las vísceras observado en la tabla 5 no mostró diferencias estadísticas (p≥0.05), tanto para el TGI lleno y vacío en las pollitas.
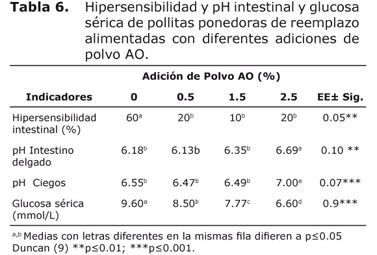
En la tabla 6 se muestra la hipersensibilidad intestinal para el tratamiento control, con respecto a los tratamientos con polvo AO.
El pH del intestino delgado y ciegos se incrementó con 2.5% de polvo con respecto a los otros tratamientos. Mientras la glucosa sérica disminuyó proporcionalmente con el nivel de adición de polvo AO, con diferencias estadísticas (p≤0.001).
DISCUSIÓN
El incremento de peso vivo en las pollitas en 19.5, 14.5, 34.0 y 18.77 g desde la segunda hasta la quinta semana de vida, con 0.5% de adición de polvo AO con respecto al control, mostró los beneficios de esta planta integral en pequeñas proporciones como nutracéutico y promotor de crecimiento natural, además la alta viabilidad demostró la inocuidad del polvo en las dietas para aves, teniendo en cuenta la mortalidad de las aves en los primeros días de vida por la baja actividad inmunológica (10).
El crecimiento compensatorio de las aves con 0.5%, pudo deberse a los compuestos químicos presentes en el polvo AO. Martínez et al (5) habían referido metabolitos secundarios, principalmente polifenoles totales, triterpenos, flavonoides y taninos totales, además reportes recientes de Sousa de Brito et al (11) muestran concentraciones elevadas de antocianidinas.
En este sentido, los taninos aunque son considerados factores anti-nutricionales, pequeñas proporciones en las dietas pueden ser eficientes bactericidas, fungicidas, antioxidantes y astringentes; además, al precipitar las proteínas, los sobrenadantes son trasferidos hasta los ciegos pudiendo mejorar el valor biológico de estas (12).
También, la presencia de flavonoides en el AO y en las dietas de las aves, incrementa la digestibilidad de los nutrientes y el funcionamiento orgánico del cuerpo, así como activa la capacidad antioxidante (atrapadora de los radicales libres RH*) y modificación de la síntesis de eicosanoides (con respuestas anti-prostanoide y anti-inflamatoria) (13).
Además, las antocianidinas detectadas en el AO, ejercen efectos positivos en estados inflamatorios relacionados con su capacidad antioxidante, estimulan el sistema inmune, incrementan la proliferación de linfocitos y la secreción de citocinas (interleucina II), (14). Por estas características benéficas se puede afirmar que hay un efecto directo de los metabolitos secundarios del polvo AO en las aves, teniendo en cuenta, que los animales y en especial las aves no los sintetizan.
A pesar de las características químicas del AO, la adición de 1.5 y 2.5% de polvo AO disminuyeron los resultados productivos comparado con 0.5% de polvo AO y el tratamiento control. Según Savón et al (12) los taninos en altas concentraciones son factores anti-nutricionales, impiden la absorción de los aminoácidos azufrados y de los minerales, especialmente el hierro (15), un mayor consumo de polvo AO y taninos con la adición de 1.5 y 2.5% (Tabla 2 ) pudo provocar alteraciones metabólicas y disminuir los indicadores productivos.
El consumo de alimento fue superior para las aves con la adición de 0.5% de polvo AO, por una mayor capacidad digestiva; no obstante, las aves con 1.5 y 2.5% de polvo AO, consumieron más alimento que el tratamiento control. Savón et al (12), refieren que un exceso de anti-nutricionales puede provocar pérdidas de energía digestible y nutrientes, sobre todo de aminoácidos y ácidos grasos, regulando el consumo voluntario de las aves.
El mayor peso del timo en pollitas con 1.5% de polvo AO (TGI-vacío) está determinado por la activación del sistema inmune, el timo produce las células T destruyendo de forma conjunta los macrófagos (15). No obstante, el timo en las pollitas con el TGI-lleno no mostró diferencias entre tratamientos, al parecer el vaciamiento digestivo activa en mayor medida la actividad de este órgano inmune por menores reservas nutricionales y defensa.
En este sentido, la bolsa de Fabricio mostró un mayor peso con la adición de 0.5% de polvo AO tanto para el TGI vacío como lleno. Esta bolsa de Fabricio estimula la inmunidad humoral y produce anticuerpos de memoria con gran especificidad, el aumento del tamaño de este órgano significa más actividad inmunológica, teniendo en cuenta que involuciona partir de los 50 días de vida.
No obstante, el bazo como otro órgano inmune de las aves, no se incrementó con la adición de polvo AO, al parecer la mayor actividad se concentra en los órganos que producen la mayor cantidad de anticuerpos (células B y T) (16).
Esta actividad inmunológica está respaldada por un aumento de la exclusión competitiva en el TGI de las aves, teniendo en cuenta la propiedad bactericida del polvo AO comprobado por la concentración mínima inhibitoria frente a cepas de bacterias patógenas (5). Es conocido que las aves nacen con bacterias patógenas latentes, que pueden modular la respuesta inmunológica, específicamente durante los primeros 21 días de vida (10).
El mayor peso del intestino delgado y ciegos con 1.5% pudo estar asociado a astringencias provocadas por los taninos del AO. Kubena et al (17), obtuvieron resultados similares en el peso del ciego al incluir altos niveles de taninos en las dietas, con un incremento de la producción de ácidos grasos volátiles, especialmente de propiónico, pudiendo disminuir las colonias de bacterias patógenas.
La adición de polvo AO en las dietas de pollitas no afectó las vísceras, esto demuestra la efectividad del AO, teniendo en cuenta que estos órganos controlan las funciones orgánicas y enzimáticas de las aves, no obstante, Marzo et al (18) refieren un aumento del peso del hígado al incluir 2.5% de taninos en las dietas para aves.
Por las propiedades medicinales comprobadas en el AO; su adición en las dietas de las aves, disminuyó la hipersensibilidad intestinal, significando mayor salud intestinal; sin embargo, no se encontró una acidificación intestinal, justificado por el valor del pH (intestinos delgado y ciegos). Esto pudo deberse a la proliferación tardía de las bacterias benéficas (a partir de los 11 días) que producen ácidos grasos volátiles (AGV) y disminuyen el pH intestinal en las aves (10).
La reducción de la glucosa en 1.1, 1.9 y 3.0 mmol/L con la adición de 0.5, 1.5 y 2.5% de polvo AO en las pollitas, demuestra que las hojas y retoños del AO también son hipoglicemiantes, comprobado con la fruta del AO en ratas (4). El efecto astringente del polvo AO, provoca una lenta liberación intestinal y mantención de la glucosa dietética, necesitando menor concentración de insulina en sangre (19), una reducción de la glucosa en las aves puede favorecer a la disminución de la circulación sanguínea de los lípidos perjudiciales (2).
En conclusión, la adición de 0.5% de polvo de hojas y retoños de Anacardium occidentale como nutracéutico en las dietas de pollitas ponedoras de reemplazo, incrementó el peso vivo semanal, consumo de alimento y peso de los órganos inmunes, con respecto a los demás tratamientos. Además, la adición de tres niveles de polvo AO disminuyó la hipersensibilidad intestinal y la glucosa sérica en pollitas ponedoras de reemplazo.
Agradecimientos
A los directivos y técnicos de la granja de ponedoras de reemplazo “Horacio Rodríguez”, Empresa Provincial Avícola Granma, Cuba, por su colaboración en el desarrollo de esta investigación.
REFERENCIAS
1. Santomá M, Pontes M. Nutrición, Sanidad y Patología en pollos y porcinos. Curso de especialización FEDNA. 2da ed. Madrid. España 2005; 1-36. [ Links ]
2. Martínez Y, Córdova J, Valdivié M, Cosió R, Estarrón M. Influencia de la semilla de calabaza como promotor de crecimiento natural en los pollos de ceba. Rev Cub Cienc Avíc 2010; 34: 19-28. [ Links ]
3. Akinpelu DA. Antimicrobial activity of Anacardium occidentale bark. Fitoterapia 2001; 72: 286-287. [ Links ]
4. Sokeng DS, Kamtchouing P, Watcho P, Jatsa BH, Moundipa FP, Lontsi D et al. Hypoglycemic activity of Anacardium occidentale L. aqueous extract in normal and streptozotocin-induced diabetic rats. Diabetes Res 2001; 36:1-9. [ Links ]
5. Martínez O, Montejo CE, Duverger RJ, Berlanga AJ. Tratamiento de la diarrea de los terneros con Polvo Anacardium occidentale. Rev Inf Vet 2001; 6: 7-16. [ Links ]
6. Unión de Empresas del Centro Avícola Nacional (UECAN). Aportes de los piensos avícolas. Cuba. Ed. por Ministerio de la Agricultura. 2007: p, 1-12. [ Links ]
7. Massey FJ. The Kolmogorov-Smirnov test for goodness of fit. J Am Statist Ass 1951; 46: 68-78. [ Links ]
8. Bartlett, M. Properties of sufficiency and statistical tests. Proc R Soc A 1937; 160:268-282. [ Links ]
9. Duncan, B. Multiple ranges and multiple F test. Biometric 1955; 11:1-42. [ Links ]
10. Santomá G. Estimuladores de la inmunidad. Curso de especialización FEDNA. 1ra ed. Madrid. España 2008; 1-28. [ Links ]
11. Sousa de Brito D, Pessanha de Arau MC. Determination of the flavonoid components of cashew apple (Anacardium occidentale) by LC-DAD-ESI/MS. Food Chem 2007; 105:1112-1118. [ Links ]
12. Savón L, Scull I, Martínez M. Integral foliage meal for poultry feeding. Chemical composition, physical properties and phytochemical screening. Cuban J Agri Sci 2007; 41:359-361. [ Links ]
13. Yang K, Lamprecht SA, Liu Y. Chemo prevention studies of the flavonoids quercetin and rutin in normal and azoxymethane-treated mouse colon. Carcinogenesis 2000; 21:1655-1660. [ Links ]
14. Bub A, Watzl B, Blockhaus M, Briviba K, Liegibel U, Muller H, et al. Fruit juice consumption modulates antioxidative status, immune status and DNA damage. J Nutr Biochem 2003; 14: 90-98. [ Links ]
15. Peña YF. Obtención de ovoanticuerpos policlonales de gallinas inmunizadas con peroxidasa. [Tesis de Maestría]. Cuba: Universidad de Granma, Facultad de Medicina Veterinaria y Zootecnia, Departamento de Sanidad Animal; 2010. [ Links ]
16. Hedlund GB, Hau J. Oral immunisation of chickens using cholera toxin B subunit and Softigenas adjuvants results in high antibody titre in the egg yolk. In Vivo 2001; 15: 381-384. [ Links ]
17. Kubena JA, Byrd CR, Young D, Corrier R. Effects of tannic acid on cecal volatile fatty acids and susceptibility to Salmonella Typhimurium colonization in broiler chicks. Poult Sci 2001; 80: 1293-1298. [ Links ]
18. Marzo F, Urdaneta E, Santidrian S. Liver proteolytic activity in tannic acid-fed birds. Poult Sci 2002; 81: 92-94. [ Links ]
19. Awad WA, Aschenbach JR, Setyabud SC, Razzazi-Fazeli E, Bohm J, Zentek, J. In Vitro effects of deoxynivalenol on small intestinal D-glucose uptake and absorption of deoxynivalenol across the isolated jejunal epithelium of laying hens. Poult Sci 2007; 86:15-20. [ Links ]