Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista MVZ Córdoba
Print version ISSN 0122-0268
Rev.MVZ Cordoba vol.18 no.2 Córdoba May/Aug. 2013
ORIGINAL
Estudio anatomopatológico de aislados de Leptospira spp., provenientes de Nicaragua en Mesocricetus auratus como biomodelo
Anatomopathologic study of Leptospira spp., isolated in Nicaragua in Mesocricetus auratus as biomodel
Luis Rosario F,1 M.Sc, Daniel Arencibia A,2* M.Sc, Niurka Batista S,2 M.Sc, Willian Jirón T,3 M.Sc, Juan Infante B,2 Ph.D.
1Instituto de Farmacia y Alimentos (IFAL, U.H), Habana, Cuba.
2Instituto Finlay, Vicepresidencia de Investigaciones, Habana, Cuba.
3Escuela de Veterinaria (UNAN), León, Nicaragua.
*Correspondencia: darrebola@finlay.edu.cu
Recibido: Marzo de 2012; Aceptado: Diciembre de 2012.
RESUMEN
Objetivo. El objetivo de este trabajo fue caracterizar en el biomodelo Mesocricetus auratus la sintomatología y lesiones anatomopatológicas que provocan 5 aislados clínicos de Leptospira spp., provenientes de Nicaragua. Materiales y métodos. Con este fin se inocularon 50 hámster por vía i.p con 1mL del cultivo de cada una de las cepas en fase exponencial teniendo una concentración celular de 7.5 x 106 leptospira/mL (10 animales por cepa), evaluándose signos de la enfermedad, mortalidad durante 14 días, lesiones anatomopatológicas macroscópicas y microscópicas mediante tinción con hematoxilina-eosina y tinción de Warthyn Starryn. Resultados. Todas las cepas presentaron alta mortalidad, mostrando un cuadro tanto clínico, como lesional característico de la infección experimental. Además, causaron la muerte al 100% de los animales entre el tercer y décimo día postinfección. En el estudio anatomopatológico la cepa del serogrupo Ballum y la del serogrupo Pomona produjeron focos de hemorragias específicamente en el riñón y pulmones. De forma similar ocurrió una congestión hepática y renal, mientras que la hemorragia renal fue observada con mayor frecuencia en la cepa del serogrupo Pomona, diferenciándose del resto de las cepas que mostraron esta lesión con menos frecuencia. Conclusiones. Este trabajo permitió una mayor caracterización de estas cepas siendo utilizadas como futuras candidatas vacunales frente a una nueva epidemia de Leptospirosis en Nicaragua.
Palabras clave: Hámster Sirio, Leptospira, lesiones anatomopatológicas, síntomas (Fuente:AIMS).
ABSTRACT
Objective. The aim of this study was to characterize the symptomatology and anatomopathological lesions caused by 5 clinical isolated Leptospira spp. from Nicaragua in a Mesocricetus auratus biomodel. Materials and methods. 50 hamsters were inoculated via i.p with 1mL of the culture of each strain in exponential phase having a cellular concentration of 7.5 x 106 leptospira/mL, (10 animals per strain). Signs of the disease, mortality during 14 days, and macroscopic and microscopic anatomopathological lesions by haematoxylin-eosin and Warthyn Starryn stain technique were evaluated. Results. All the strains presented high mortality, showing clinical lesions of the experimental infection. Death to 100% of the animals was caused between the third and tenth day post-infection. In the anatomopathologic study, the strains of the Ballum and Pomona serogroup produced haemorrhaging specifically in the kidney and lungs. The animals manifested hepatic and renal congestion, while the renal haemorrhage was observed with more frequency in the strain of the Pomona serogroup, differing from the other strains, which presented this lesion less frequently. Conclusions. This work allowed a better characterization of these strains in order to use them as future vaccine candidates for future Leptospirosis epidemics in Nicaragua.
Key words: Anatomopathological lesions, Leptospira, symptoms, Syrian hamster (Source:AIMS).INTRODUCCIÓN
La leptospirosis, es una de las zoonosis bacterianas más difundidas en el mundo (1,2). El agente causal de esta enfermedad es una bacteria delgada y helicoidal con una activa motilidad, las cuales se agrupan en cuatro especies saprófitas y 12 patógenas, que incluyen alrededor de 250 serovares (3). Debido a las afecciones que produce en el hombre y los animales, así como por su repercusión económica en los países desarrollados y en vías de desarrollo, constituye una importante y permanente preocupación para la medicina humana y veterinaria (4).
En Cuba existe un programa de lucha contra la leptospirosis que incluye la vacunación profiláctica para humanos y animales con los productos vacunales vax-SPIRAL® y Polivalente-Leptospira. Estas vacunas son de células enteras inactivadas, con o sin adyuvante, que incluyen en sus formulaciones a los serovares de mayor circulación en el país (2). Estos productos biofarmacéuticos cuentan entre sus principales desventajas la falta de inmunoprotección cruzada contra los serovares no incluidos en la formulación (5).
En algunos países de la región como la República de Nicaragua se han producido epidemias importantes asociadas fundamentalmente con eventos climatológicos severos. Durante los meses de octubre-noviembre del 2007, este país sufrió severas inundaciones provocadas por el huracán Félix, que condujeron al desarrollo de una epidemia con brotes de leptospirosis fundamentalmente en los departamentos de León y Chinandega. De este brote fueron aisladas 8 cepas de leptospira de pacientes con evidencia epidemiológica y sintomatológica característica de leptospirosis (6).
Para la República de Nicaragua la leptospirosis es una enfermedad endémica, en especial de algunas regiones, con una alta presentación de casos clínicos asociados a eventos climatológicos extremos como las lluvias intensas y con una prevalencia mediana con tendencia a alta (6-8). Además, es sostenida en el tiempo y en cualquier condición por la existencia de factores de riesgo que lo favorecen (roedores, problemas de higiene, baja percepción de riesgos, prácticas agrícolas y de crianza de animales inadecuadas) (6-8). Pese a ser un problema, no existen prácticas de reducción de riesgos en humanos; incluida la vacunación que permita la reducción de la vulnerabilidad de la población humana y animal a la enfermedad.
Este hecho constituye un constante desafío para los productores y comercializadores, así como para la evaluación de la eficacia de las mismas en nuevos mercados. La principal estrategia en este sentido es la determinación de la sobrevivencia de biomodelos relevantes inmunizados y luego retados con cepas altamente virulentas pertenecientes a serovares y serogrupos distintos a los presentes en la vacuna aislada del nuevo contexto epidemiológico. Igualmente, una estrategia viable para estos grupos de productores constituye la generación de formulaciones confeccionadas con cepas procedentes de la región de los nuevos clientes (2,6).
En todos los casos se recomienda inicialmente una adecuada caracterización sintomatológica y anatomopatológica en biomodelos experimentales a partir de aislamientos procedentes de estudios epidemiológicos (3,9).
El objetivo de este trabajo fue realizar un estudio anatomopatológico de aislamientos de Leptospira spp., provenientes de Nicaragua utilizando el Mesocricetus auratus (hámster Sirio) como biomodelo.
MATERIALES Y MÉTODOS
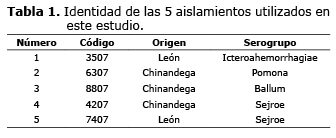
Cepas. Se utilizaron en el estudio 5 cepas provenientes de pacientes con evidencias clínicas y epidemiológicas de la enfermedad leptospirosis del brote ocurrido en los departamentos de León y Chinandega, la parte más noroccidental de la República de Nicaragua (Tabla 1). Todas las cepas fueron cultivados en medio líquido Ellinghausen-McCullough-Johnson-Harris (EMJH) (10) a 28°C; siendo conservadas en medio semisólido Fletcher a una temperatura entre 28-30°C. Se mantuvieron mediante cultivos semanales en el medio proteico EMJH, bajo condiciones estáticas a 28-30°C (9).
Animales de experimentación. En este trabajo se utilizó el biomodelo Mesocricetus auratus (Hámster Sirio) y se emplearon animales de sexo hembras, con peso entre 45-50 g, procedentes del Centro para la Producción de Animales de Laboratorio (CENPALAB, La Habana, Cuba) recepcionados con sus correspondientes certificados de calidad higiénico-sanitaria y genética.
Los animales permanecieron bajo condiciones controladas de temperatura (21-24°C), humedad relativa (50-60%), ciclo alternado de luz/oscuridad de 12 h, recibieron alimentación y agua acidulada con HCl a un pH 2.5 ad libitum. El alimento fue suministrado por CENPALAB y consistió en pienso concentrado para roedores, el cual fue adquirido con sus correspondientes certificados de calidad bromatológica e higiénico-sanitaria.
Para todos los experimentos, los animales se distribuyeron de forma aleatoria en cajas modelo T3 (Macrolón, TECNIPLASTIC, Tecniplast International, Italia). Se ubicaron en grupos individuales de 5 a 6 animales por caja, utilizando como encamado el bagazo de caña de azúcar desmeollado con previa esterilización en autoclave a 121°C y 1.5 atm de presión durante 25 minutos; el cual se cambió dos veces por semana. Todas las operaciones de esta investigación se realizaron siguiendo las Buenas Prácticas de Laboratorio (BPL) (11), establecidas en los Procedimientos Normalizados de Operaciones (PNO), teniendo en cuenta las normas y regulaciones bioéticas vigentes tanto nacionales como internacionales (12).
El protocolo de esta investigación fue revisado y aprobado por el comité de ética institucional. (Comité de Ética, Instituto Finlay, Cuba).
Evaluación de la sintomatología clínica y mortalidad en el biomodelo Mesocricetus auratus (Hámster Sirio). Para realizar este estudio se inocularon 10 animales/cepa utilizando la vía intraperitoneal (i.p). Se utilizó un inoculo de 1 mL del cultivo en fase exponencial teniendo una concentración celular de 7.5 x 106 leptospira/mL. Se evaluaron las variables signos de la enfermedad y mortalidad durante 14 días. Se consideró como criterio de aceptación que las cepas desarrollaran la infección leptospirósica y/o lograran el 100% de mortalidad en ese período (13). La observación clínica se realizó diariamente durante 14 días post-inoculación para evaluar la aparición de signos clínicos como pilo erección, excitabilidad, ictero de piel y mucosas, hemorragias a través de los orificios naturales, postración y muerte. La mortalidad fue expresada en porciento según la siguiente fórmula:
Mortalidad(%)= #de animales muertos*100/Total de animales inoculados.
Estudio anatomopatológico de las cepas seleccionadas en el biomodelo Mesocricetus auratus. En todos los experimentos se realizaron estudios anatomopatológicos por métodos convencionales (3,9,14), realizando la observación macroscópica de los órganos “In situ” y se tomaron muestras para los estudios histopatológicos de los tejidos que se consideraron (3,9,14). En todos los casos se tomaron muestras del área afectada, del área sana y del área limítrofe. Una vez realizada la necropsia, observarse y describirse las lesiones desde el punto de vista macroscópico, las muestras tomadas fueron fijados en formol neutro al 10% durante 72 horas. Luego se realizó una tinción con Hematoxilina-Eosina y Warthyn Starry (14). Tanto los signos clínicos como las alteraciones macroscópicas y descripciones microscópicas fueron recogidos en protocolos establecidos al efecto.
Análisis estadístico. Las variables categóricas (frecuencia de animales con determinados síntomas clínicos) representadas por la comparación de proporciones fueron analizadas con Chi Cuadrado (χ2) prefijando una p≤0.01. El análisis se realizó empleando el Statsoft para Windows STATISTICA (15).
RESULTADOS
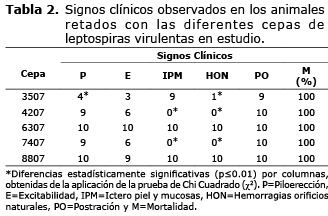
Todas los aislamientos generaron una alta mortalidad, mostrando un cuadro clínico característico de la infección experimental (pilo erección, excitabilidad, signos nerviosos, hemorragias por los orificios nasales, postración) (Tabla 2).
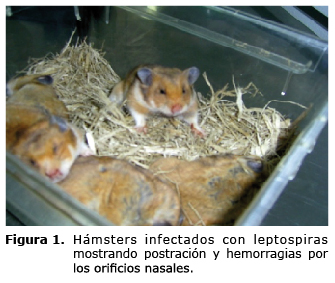
En la figura 1 se puede observar animales con presencia de hemorragias por los orificios nasales y postración. De igual forma se destacó el cuadro lesional caracterizado por ictero, grave congestión en todos los órganos, hemorragias pulmonares focales, entre otros), (Figura 2). Además, causaron la muerte del 100 % de los animales entre el tercer y décimo día postinfección (9, 16-20).
Desde el punto de vista anatomopatológico macroscópico se constataron evidencias inequívocas del establecimiento de la enfermedad, con daños graves en órganos. Las cepas 8807 (serogrupo Ballum) y 6307 (serogrupo Pomona) produjeron focos de hemorragias específicamente en el riñón y pulmones. De forma similar ocurrió una congestión hepática y renal, mientras que la hemorragia renal fue observada con mayor frecuencia en la cepa 6307 (serogrupo Pomona) diferenciándose del resto de las cepas las cuales mostraron esta lesión con menos frecuencia.
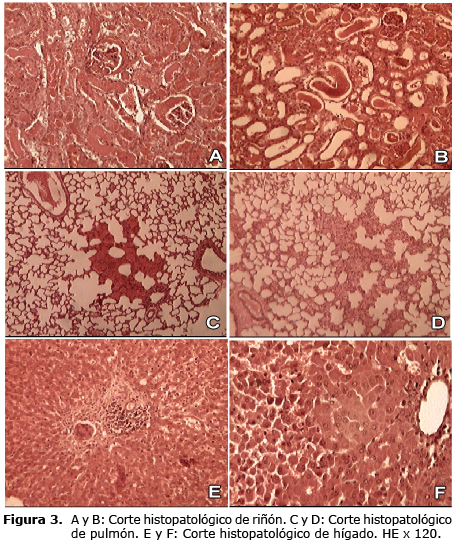
Histológicamente el hígado, los riñones y los pulmones resultaron ser los órganos más afectados. El hígado mostró congestión grave y desorganización de los cordones de hepatocitos con focos hemorrágicos y necróticos en los estados más avanzados (Figura 3 E y F). Además, se observó necrosis centrolobulillar (Figura 3E) e infiltración linfocitaria en el espacio porta (9,18,19), Se destaca la presencia de linfocitos dada por su morfología celular no granulada y núcleo redondo en este tipo de infección (21). Además, en la figura 3 F se observa la presencia de neutrófilos disgregados por todo el tejido (9,17,18).
En los riñones se encontró una degeneración grave del epitelio tubular, hemorragias, infiltración de leucocitos y cilindros hialinos (Figura 3 A y B) (9,18,19). Los pulmones se caracterizaron por la presencia de enfisemas con alvéolos dilatados y destruidos (Figura 3 C y D), graves congestiones y hemorragias (Figura 3 C), unido a la presencia de polimorfonucleares neutrófilos en los septos alveolares (9,17,18). Se constató la presencia de neutrófilos; caracterizados por su morfología celular que permite distinguirlos de otros leucocitos por contener un núcleo con varios lóbulos (21). Además, esta infiltración es típica en la infección experimental de la Leptospirosis (3,9).
DISCUSIÓN
Se pudo observar que la frecuencia de aparición de los signos estudiados fue variable entre las diferentes cepas evaluadas (Tabla 2). La piloerección fue un signo clínico generalizado en la mayoría de las cepas, exceptuando la cepa 3507 (Serogrupo Icterohaemorrhagiae) la cual difirió (p≤0.01) del resto de las cepas que presentaron una menor frecuencia de aparición. Este signo está asociado al establecimiento de la fase leptospirémica de la enfermedad y a los picos de fiebre bifásicos (9,22,23). Igualmente la excitabilidad es un signo que por lo general se manifiesta cuando aparecen estos picos de fiebre y comienza los daños a nivel de Sistema Nervioso Central (SNC), (9,22-24).
La leptospirosis puede presentarse de forma ictérica o anictérica, lo cual está dado entre otros factores por las características propias de cada cepa (Figura 2), (9,16-18). En este estudio sólo el serogrupo Sejroe (cepas 4207 y 7407) se comportó de forma anictérica en el biomodelo animal.
A pesar de que en la etiopatogenia de la leptospirosis se describe y es conocido que provoca ruptura del endotelio vascular (9,16-18), no se encontraron, en todos los casos, evidencias en la ocurrencia de hemorragias a través de los orificios naturales. Manifestándose sólo para las cepas 3507, 4207 y 7407 (p≤0.01) indicando que posiblemente cuando la enfermedad transcurre de forma muy aguda, de 3 a 5 días, es más visible este evento que cuando transcurren más de 7 días.
Los focos de hemorragias específicamente en el riñón y pulmones producidos por las cepas 8807 (serogrupo Ballum) y 6307 (serogrupo Pomona), así como la congestión hepática y renal, están en correspondencia con los obtenidos comúnmente para cepas de Leptospira altamente virulentas (6,19).
La hemorragia renal fue observada con mayor frecuencia en la cepa 6307 (serogrupo Pomona) diferenciándose del resto de las cepas las cuales mostraron esta lesión con menos frecuencia (25).
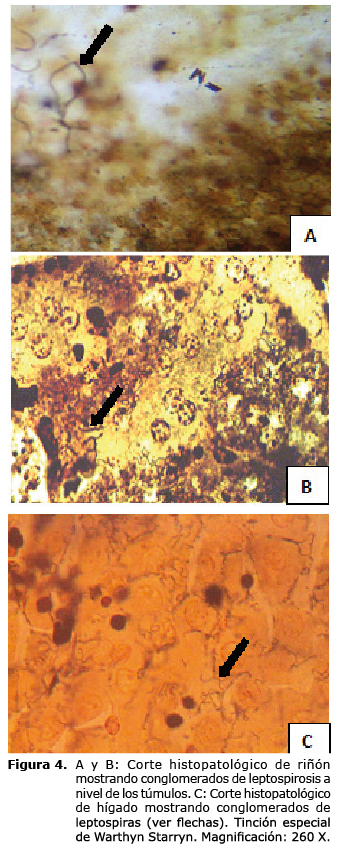
La presencia de leptospiras identificadas en la totalidad de los órganos investigados por la técnica argéntica de Warthyn Starryn resultó ser una evidencia inequívoca de la circulación e invasividad de las espiroquetas en los animales infectados, siendo observados en la figura 4 A y B en un corte histopatológico de riñón y en la figura 4 C en un corte histopatológico de hígado. Los cuadros lesionales con mayor número de leptospiras demostradas con esta técnica correspondieron a los serogrupos Ballum y Pomona; no obstante, en todos los animales infectados pudieron observarse las lesiones y los gérmenes en diferentes órganos. Otros órganos que presentaron lesiones fueron el corazón, con graves hemorragias e infartos agudos, y el sistema nervioso central que se observó congestivo a nivel de los vasos meníngeos. Por otra parte, en el bazo se destacó la congestión de los cordones y depósito de hemosiderina libre y fagocitada lo cual concuerda con lo descrito por Adler et al (9).
Puede plantearse que desde el punto de vista anatomopatológico macroscópico, predominó la presencia de cuadros congestivos y hemorrágicos en todos los órganos y sistemas, la presencia de ictero tanto en piel como en mucosas se evidenció en la mayoría de las cepas, con excepción del serogrupo Sejroe al comportarse de forma anictérica. El análisis microscópico corroboró el hallazgo general y constante de procesos congestivos y hemorrágicos junto a lesiones propias de caquexia (degeneraciones mucoides renales, cardiacas y agotamiento esplénico). Todo lo cual coincide con las lesiones más comunes descritas en las especies animales infectadas natural o experimentalmente por este germen (9,16-18). Los hallazgos histológicos encontrados en hígado, riñón y los pulmones son similares a los encontrados en animales y el hombre (9,20,23,25-27) y coincide además con los encontrados en las personas contagiadas con leptospirosis en diferentes brotes epidemiológicos en la República de Nicaragua (6,8,28), donde fueron aisladas numerosas cepas dentro de las cuales se encuentra las utilizadas en esta investigación.
Contar con aislamientos de cepas pertenecientes a diferentes serogrupos y serovares como candidatos vacunales, caracterizados por una alta virulencia, representativos de los serogrupos que estén circulando en una región determinada, simplificaría gradualmente la confección de una vacuna antileptospirósica hecha a la medida (6,8,13,29,30). Por tanto una evaluación más completa de la capacidad de candidatos vacunales para inducir una respuesta inmunoprotectora. Esto requiere un panel bien caracterizado de cepas virulentas que representen los serovares de importancia tanto desde el punto de vista clínico y epidemiológico (6,8,13,29,30).
El término de alta virulencia y sobre todo que a nivel experimental se logró mimetizar el proceso tanto agudo como crónico de la enfermedad leptospirósica mediante biomodelos, constituyen los parámetros evaluativos más importantes a llevar a cabo durante la investigación preclínica de vacunas humanas y/o veterinarias (31). Esto es importante para la elaboración de candidatos vacunales eficientes y la evaluación de pruebas de potencia de vacunas ya existentes en el mercado (31).
En conclusión se realizó una mayor caracterización de las cinco cepas estudiadas lo que permitirá su utilización como futuros canditatos vacunales frente a una nueva epidemia de Leptospirosis en Nicaragua.
REFERENCIAS
1. OPS. Las enfermedades desatendidas en las poblaciones postergadas, con énfasis en las zoonosis. MMWR. [en línea] 2005 (acceso enero 4 de 2009). URL disponible en: http://www.paho.org/spanish/ad/dpc/vp/rimsa14-18-s.pdf. [ Links ]
2. OPS. Enfermedades desatendidas “Enfermedades de la pobreza”. MMWR [en línea] 2009 (acceso 4 de enero de 2009). URL disponible en: http://www.paho.org/Spanish/AD/DPC/CD/psit-nd-poster.htm.
3. Adler B, de la Peña M. Leptospira and Leptospirosis. Vet Microbiol 2009; 2:4382-4392. [ Links ]
4. Levett P, Morey R, Galloway R, Steigerwalt A. Leptospira broomii sp. nov, isolated from humans with leptospirosis. Int J Syst Evol Microbiol 2006; 56:671-673. [ Links ]
5. McBride A, Athanazio D, Reis M, Ko A. Leptospirosis. Curr Opin Infect Dis 2005; 18:376-386. [ Links ]
6. Rosario LA, Batista N, Arencibia DF, Valdés BY, Jirón W, Duttman CH. Efficacy of Leptospiral vaccine (vax-SPIRAL®) against challenge with strains isolated from leptospirosis epidemic in Nicaragua using the hamster as biomodel. Vet World 2012; 5(1):5-12.
7. NTON. Norma Técnica Obligatoria Nicaragüense de Prevención y Control de la Leptospirosis Humana. NTON 24 001-05. La Gaceta 2006; 27(2):1-53. [ Links ]
8. Batista N, Arencibia DF, Rosario LA, Jirón W, Duttman CH. Perfil antigénico celular de cepas aisladas de Leptospira en León y Chinandega, Nicaragua. ARS Pharmaceutica 2011; 52(4):12-17. [ Links ]
9. Adler B, De La Peña M. Pathogenesis of Bacterial Infections in Animals. En: Gyles CL, Prescott JF, Songer G, Thoen CO. Leptospira. Fourth Edition. USA: Published by Wiley-Blackwell; 2010. [ Links ]
10. Trueba G, Zapata S, Madrid K, Cullen P, Haake D. Cell aggregation: a mechanism of pathogenic Leptospira to survive in fresh water. Intern Microbiol 2004; 7:35-40. [ Links ]
11. NCB (Nuffield Council on Bioethics). The ethics of research involving animals. Estover Road, Plymouth: Latimer Trend & Company Ltd, NCB; 2005. [ Links ]
12. NAS (National Academy of Sciences). Guide for the Care and Use of Laboratory Animals. Eighth Edition. Washington, DC: The National Academic Press and National Research Council of the National Academies; 2011. [ Links ]
13. Nunez JF, Fajardo EM, Perez E, Ontivero I, Silva D, Munoz P. Evaluation of two different potency tests for leptospirosis vaccine vax-spiral. Rev Cub Med Trop 2005; 57(1):67-68. [ Links ]
14. Delgado F, Brihuega B, Venzano A, Funes D, Blanco F, Auteri C et al. Adaptación de un protocolo de histoquímica para la detección de Leptospira pp. en muestras de tejido fijado en formaldehído. Rev Cub Med Trop 2007; 59(1):14-18. [ Links ]
15. SFW (Statsoft for Windows). STATISTICA data analysis software system. MMWR (on line). Versión 6.0. Washington, DC (USA): StatSoft, Inc; 2003. [ Links ]
16. Sandow K, Ramírez W. Leptospirosis. REDVET 2005; 6:26-29. [ Links ]
17. Li L, Ojcius DM, Yan J. Comparison of invasion of ï¬broblasts and macrophages by high- and low-virulence Leptospira strains: colonization of the host-cell nucleus and induction of necrosis by the virulent strain. Arch Microbiol 2007; 188:591-598. [ Links ]
18. Xue F, Yan J, Picardeau M. Evolution and pathogenesis of Leptospira spp.: lessons learned from the genomes. Microb Infect 2009; 11:328-333. [ Links ]
19. Chamizo E. Médula Ósea y Sangre “Leptospirosis”. En: Chamizo E. Patología orgánica y enfermedades de los animales domésticos. Segunda Edición (Primera Reimpresión). La Habana (Cuba): Editorial Félix Varela; 2009.
20. López S, Koval A. Evaluación de la cepa vacunal AKRFB de Leptospira interrogans serovar Pomona frente a 3 cepas virulentas aisladas de bovinos en Argentina. Rev Vet Arg 2011; 28(278):36-47. [ Links ]
21. Frank S. Background “Vertebrate Immunity”. En: Frank S. Immunology and Evolution of Infectious Disease. First Edition. Princeton and Oxford (UK): Princeton University Press; 2002.
22. Musacchio HM, Dorigo C, Volpato V, Hernán M. Características clínicas y epidemiológicas de leptospirosis: 10 años de experiencia en Santa Fe, Argentina. Rev Panam Infectol 2010; 12(1):43-46. [ Links ]
23. Gallegos A, Sandí V. Leptospirosis. Rev Med Costa Rica Centroam 2010; 592:115-121. [ Links ]
24. Malajov Y, Panin A, Sovoliova G. Patogénesis de la Leptospirosis. En: Malajov Y. Leptospirosis de los animales. Tercera Edición. La Habana (Cuba): Editorial Ciencias Médicas; 2007. [ Links ]
25. Marotto P, Ko A, Murta C, Seguro F, Prado R, Barbosa M, et al. Early identiï¬cation of leptospirosis-associated pulmonary hemorrhage syndrome by use of a validated prediction model. J Infec 2010; 60:218-223. [ Links ]
26. Verdasquera D, Alpízar D, Vázquez A, Romero A, Galí B, Abad Y, et al. Evaluación del nivel de conocimientos sobre leptospirosis humana en pediatras del hospital “William Soler”, 2009. Rev Enferm Infec Ped 2011; 24(95):95-104.
27. Alcoforado D, Rodrígues S, Bonel J, Clair A, Vasconcellos F, A Grassman. Highly virulent Leptospira borgpetersenii strain characterized in the Hamster model. Am J Trop Med Hyg 2011; 85(2):271-274. [ Links ]
28. MSN. Ministerio de Salud de Nicaragua. Situación de la Leptospirosis en Nicaragua. Bol Epidemiol 2004; 30(7):22-27. [ Links ]
29. Obregón AM, Fernández C, Rodríguez I, Rodríguez J, Zamora Y. Avances de laboratorio en el diagnóstico serológico y la investigación de la leptospirosis humana en Cuba. Rev Cub Med Trop 2007; 59(1):63-67. [ Links ]
30. Suepaul SM, Carringtonb CV, Campbell M, Bordea G, Adesiyuna AA. Study on the efficacy of Leptospira vaccines developed from serovars isolated from Trinidad and comparison with commercial vaccines using a hamster model. Vaccine 2010; 28:5421-5426. [ Links ]
31. Arencibia DF. Caracterización de nuevos aislados de Leptospira spp provenientes de Nicaragua como base para formular preparados vacunales antileptospirósicos. [Tesis de Maestría]. UNAH-CENSA, Mayabeque, Cuba: EDICENSA; 2012. [ Links ]