Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista MVZ Córdoba
Print version ISSN 0122-0268
Rev.MVZ Cordoba vol.18 no.2 Córdoba May/Aug. 2013
ORIGINAL
Lesiones en órganos de cerdos posdestete, inducidas por el lipopolisacárido de E. coli
Injuries in post-weaning pig organs, induced by the E. coli lipopolysaccharide
Cristian Gutiérrez V,1 Zoot, Albeiro López H,2 Ph.D, Jaime Parra S,2* Ph.D.
1Universidad Nacional de Colombia, Sede Medellín, Facultad de Ciencias Agropecuarias, Departamento de Producción Animal, AA 1779, Colombia.
2Universidad Nacional de Colombia, Facultad de Ciencias Agropecuarias, Departamento de Producción Animal, Grupo BIOGEM, Sede Medellín, Colombia.
*Correspondencia: jeparrasu@unal.edu.co
Recibido: Mayo de 2012; Aceptado: Diciembre de 2012.
RESUMEN
Objetivo. Evaluar el efecto de la ingestión de varios niveles de Lipopolisacárido (LPS) de E. coli sobre las manifestaciones clínicas y lesiones en órganos de cerdos recién destetados. Materiales y métodos. El trabajo de campo se realizó en el Centro San Pablo, perteneciente a la Universidad Nacional de Colombia. El estudio se realizó con 52 cerdos destetados (6.5±0.5 kg) a los 21 días de edad. Los animales fueron alimentados durante 10 días con una dieta basal compuesta de leche y algunos de sus derivados, adicionada con cuatro niveles de LPS (0, 0.3, 0.5 y 1.0 µg/ml de alimento). Los cerdos se sacrificaron escalonadamente los días 1, 5, 7 y 10 posdestete y se tomaron muestras de intestino delgado, estómago, hígado, páncreas, corazón, pulmón, riñón y bazo. El monitoreo clínico y paraclínico se realizó diariamente durante la investigación. Para determinar la ganancia de peso, los animales fueron pesados el día del destete y el día del sacrificio. Resultados. Hubo diferencia (p<0.01) en las variables peso de los órganos y ganancia de peso, donde los animales que consumieron el mayor nivel de LPS presentaron los menores valores, llegando a su mínimo nivel el día 10 posdestete. Las variables presentación de: lesiones macroscópicas, diarreas, y temperatura rectal, aumentaron con el nivel de inclusión de LPS en la dieta, llegando a su máximo nivel el día 10 posdestete (p<0.01). Conclusiones. El LPS de E. coli provoca la inhibición del crecimiento corporal y de los órganos en estudio y una alta incidencia de diarreas.
Palabras clave: Destete, diarreas, fiebre, lechón (Fuente: MesH).
ABSTRACT
Objective. To evaluate the effects of the intake of several levels of lipopolysaccharides (LPS) from E. coli on clinical manifestations and injuries in organs of newly weaned pigs. Materials and methods. The experiment was conducted at the San Pablo Production Center of the Universidad Nacional de Colombia. 52 weaned pigs at 21 days of age were used. The animals were fed a basal diet composed of milk and some of its derivatives, and an addition of four LPS levels (0, 0.3, 0.5 and 1.0 µg / mg of feed) during 10 days. The pigs were sequentially sacrificed on days 1, 5, 7, and 10 after weaning, and samples of the small intestine, stomach, liver, pancreas, heart, lungs, kidney and spleen were extracted. Clinical and laboratory monitoring was performed daily during the investigation. To determine weight gain, the animals were weighed on weaning day, and on slaughter day. Results: There were statistical differences (p<0.01) in organ weights and weight gain, where animals that consumed the highest levels of LPS showed the lowest values, reaching the lowest level on day 10 post-weaning. The variables: macroscopic lesions, diarrhea, and rectal temperature increased with the increase in LPS levels in the diet, reaching their peaks on day 10 post-weaning (p<0.01). Conclusions: E. coli LPS causes inhibition of the studied body and organ growth parameters, and a high incidence of post-weaning diarrhea.
Key words: Diarrheas, fever, piglet, weaning (Fuente: MesH).
INTRODUCCIÓN
La pared intestinal actúa como una barrera física que previene la entrada de compuestos tóxicos y patógenos a la mucosa intestinal y a la circulación sistémica (1). Por tanto, las células epiteliales del intestino actúan como receptores para el sistema inmune (2) y pueden activar la respuesta inmune innata y adquirida a través de la producción de citoquinas, las cuales son pequeños péptidos cruciales en el reclutamiento y activación de neutrófilos, macrófagos, células T y B, y células dendríticas (3). Estas características hacen de estas moléculas agentes importantes en la defensa contra infecciones bacterianas (4), y en las manifestaciones clínicas de la enfermedad (5).
Tras el destete, y en particular si este se realiza bruscamente, se presenta un período breve de ayuno y de adaptación a una nueva dieta sólida, induciendo la mortalidad de lactobacilos y estreptococos, debido a la disminución en la disponibilidad del sustrato específico (lactosa) en todos los segmentos del tracto digestivo (6). Debido a lo anterior, el destete favorece la desaparición de la población microbiana de lactobacilos (Gram positivas) predominante en estómago e intestino, y el aumento de la población de bacterias Gram negativas (principalmente E. coli), la cual libera desde sus paredes productos proinflamatorios como el lipopolisacárido (LPS) (7).
El LPS es una molécula inductora de sepsis y reconocido por cualquier hospedero mamífero como una entidad patogénica importante que activa varias rutas de señalización celular, cuyas cascadas de transducción favorecen la producción de citoquinas proinflamatorias. Una vez que se inicia la cascada de reacciones que conducen a un estado séptico, sobreviene una respuesta sistémica no regulada que puede progresar a fallo orgánico múltiple (8).
La administración de LPS de E. coli es uno de los modelos más empleados en estudios de procesos infecciosos agudos, ya que tiene acciones altamente reproducibles y carece de los efectos secundarios asociados a las infecciones crónicas. Debido a que el conocimiento sobre la relación entre la respuesta inmune y el desarrollo de enfermedades infecciosas en los animales domésticos es escaso, se desea implementar un modelo experimental que permita evaluar los efectos de la ingestión de diferentes niveles de LPS de E. coli sobre órganos de importancia sistémica durante el período posdestete de cerdos.
MATERIALES Y MÉTODOS
Localización. El trabajo de campo se realizó en el Centro San Pablo, perteneciente a la Universidad Nacional de Colombia, Sede Medellín, ubicado en el municipio de Rionegro, paraje “El Tablacito”, localizado a 2100 msnm, con una temperatura entre 12 y 18°C, correspondiendo a una zona de vida bosque muy húmedo Montano bajo.
Animales. Se utilizaron 52 cerdos resultado de un cruce alterno Duroc x Landrace, destetados a los 21 días de edad, con un peso de 6.5±0.5 k. Estos cerdos fueron alojados en jaulas provistas de comida y agua a voluntad y la temperatura estuvo controlada a 26±3°C. Durante la lactancia no se suministró alimento sólido a los lechones.
Dietas. En este experimento se evaluaron cuatro dietas experimentales, una dieta control (basal), y otras tres conteniendo LPS de E. coli, serotipo 0111:B4 (Sigma-Aldrich, Sigma-Aldrich, St Louis, MO, USA) así:
Dieta Basal (DB): Sin adición de LPS de E. coli.
Dieta 1 (D1): DB mas la adición de 0.3 µg de LPS de E. coli /mg de alimento.
Dieta 2 (D2): DB mas la adición de 0.5 µg de LPS de E. coli /mg de alimento.
Dieta 3 (D3): DB mas la adición de 1.0 µg de LPS de E. coli /mg de alimento.
La dieta basal ofrecida a los animales tuvo como componentes leche y algunos de sus derivados; además, fue enriquecida con vitaminas, minerales, y lisina HCL. Las dietas se balancearon para cumplir con todos los mínimos nutricionales requeridos y propuestos por el NRC (9) (Tablas 1 y 2). La cantidad de alimento ofrecido por jaula fue de 300 g/día; sin embargo, se suministró alimento adicional cuando los animales lo requirieron. Las dietas experimentales se proporcionaron desde el día 1 al 10 posdestete.
Evaluación de las manifestaciones clínicas. El monitoreo clínico y paraclínico de los animales se realizó antes de iniciar el experimento para no incluir animales previamente enfermos, o con presencia de diarreas. Adicionalmente, dicho monitoreo se realizó diariamente (tres veces al día) durante toda la investigación. A lo largo del experimento se llevó un registro de las alteraciones que presentaron los animales. La temperatura rectal se midió diariamente en las primeras horas de la mañana (08:00 h) con un termómetro rectal de mercurio, el cual era introducido durante 60 segundos y se tuvo como temperatura de referencia 38°C. La consistencia de las heces se evaluó diariamente por observación a los animales durante la toma de temperatura y se clasificó en tres tipos: normales (N), blandas (B) y diarrea (D).
Estimación de la ganancia de peso. Los 52 cerdos utilizados en el experimento fueron pesados el día del destete (día1), y el día final del experimento. La variación del peso fue expresada como un porcentaje del peso inicial.
Extracción de órganos. Durante la fase de sacrificios escalonados se sacrificaron 52 lechones de la siguiente manera: el día inicial, o día 1 (día del destete), se sacrificaron cuatro lechones, que representaron el grupo de referencia para verificar el estado general de salud y la evaluación macroscópica del estado de los órganos de los animales antes de suministrar las diferentes dietas experimentales. Los órganos evaluados fueron estómago, intestinos delgado y grueso, hígado, páncreas, corazón, pulmones, riñones y bazo. Los días cinco, siete y 10 post-destete se sacrificaron cuatro cerdos de cada nivel de inclusión de LPS (0, 0.3, 0.5, y 1.0 µg/mg de alimento). Todos los cerdos fueron sacrificados 2.5 horas después de su última comida. Los animales se sedaron por inhalación de dióxido de carbono durante 3 minutos, y fueron sacrificados por exanguinación, mediante sección de la vena yugular.
El procedimiento de necropsia (10) realizado consistió en los siguientes pasos: Después del sacrificio, los cerdos se colocaron en posición de decúbito dorsal. Para la apertura de las cavidades, se realizó una incisión hasta la entrada del tórax, donde con el mismo instrumento de corte, se seccionó la zona cartilaginosa de las costillas dejando al descubierto la caja torácica. Siguiendo el corte, también se procedió a la apertura de la cavidad abdominal hasta el pubis. Con la finalidad de extraer correctamente el intestino se hicieron ligaduras dobles en tres puntos (se realizó el corte entre los dos nudos): a nivel del ligamento duodenocólico (punto de terminación de la cola del páncreas); a nivel del íleon (entre su desembocadura y el ciego); y a nivel del recto. La extracción de las asas intestinales se realizó cortando primero el mesenterio y estirando las asas mientras se continuó cortando el mesenterio. Una vez realizado este procedimiento, se cortaron las puntas de las ligaduras antes mencionadas y se expuso la mucosa para valorar el contenido de cada tramo.
A continuación, se realizó una ligadura a nivel del cardias y se extrajeron el hígado, el estómago y el intestino. Posteriormente se separaron el estómago y el intestino del hígado. Para extraer el aparato urogenital se separaron los riñones de la grasa perirrenal, seccionando la vena y la arteria renal. Se retiró el riñón hacia la pelvis unido al uréter correspondiente. Se extrajeron los riñones conjuntamente con la vejiga urinaria y el aparato genital. Se procedió a la apertura longitudinal de los riñones por el borde medial. Se separó la cápsula conjuntiva de los riñones.
Para el estudio de los órganos torácicos se extrajeron conjuntamente pulmones y corazón. El corazón se separó de los pulmones y se abrió el pericardio teniendo en cuenta la presencia de líquidos anormales o adherencias de las hojas pericárdicas. La apertura del corazón se realizó siguiendo la dirección del flujo de la sangre. Posteriormente todos los órganos extraídos fueron lavados con solución salina fría (11).
Procesamiento histotécnico. Las muestras obtenidas de los diferentes órganos fueron procesadas y analizadas en el Laboratorio de Patología Animal de la Universidad de Antioquia. Las muestras conservadas fueron incluidas en parafina, cortadas a 4 µm de espesor y coloreados con Hematoxilina-Eosina de acuerdo con el método reportado por Nabuurs et al (12). En cada lámina se montaron tres cortes transversales.
Evaluación microscópica de lesiones en órganos. Las lesiones determinadas en cada corte histológico fueron congestión, edema, y hemorragia; y se les asignó valor teniendo en cuenta el grado de presentación, así: ausente (0), leve (1), leve a moderada (2), moderada a severa (3), severa (4). Posteriormente, se calculó el porcentaje de presentación de lesiones totales en cada órgano.
Diseño estadístico. El experimento se realizó según un diseño de bloques al azar en un arreglo factorial de 4X4 (4 dietas experimentales por 4 períodos posdestete) (13). Para la conformación de los bloques se tomó en consideración el peso inicial de los animales. A cada animal le fue asignado uno de los 16 tratamientos y cada tratamiento tuvo un total de 4 repeticiones. El análisis estadístico de los datos obtenidos fue desarrollado utilizando el procedimiento de Modelos Lineales Generales (GLM) del SAS (14). Para realizar la comparación de los promedios entre tratamientos se utilizó una prueba de Duncan (p<0.05).
Consideraciones éticas. Todos los procedimientos experimentales fueron llevados a cabo de acuerdo a las guías propuestas por “The International Guiding Principles for Biomedical Research Involving Animals” (15). Esta investigación fue avalada por El Comité de Ética en la Experimentación Animal de la Universidad Nacional de Colombia, Sede Medellín (CEMED 001del 26 de Enero de 2009).
RESULTADOS
Los cerdos que consumieron la dieta basal presentaron un buen estado de salud, mientras que los animales que recibieron LPS en la dieta basal mostraron incrementos en la temperatura rectal por encima de 38°C durante todo el experimento. No obstante, estos cerdos no presentaron síntoma alguno de enfermedad que causara su retiro y/o sacrificio inmediato. Además, al nivel en que se fijó el suministro diario de alimento no hubo sobrantes.
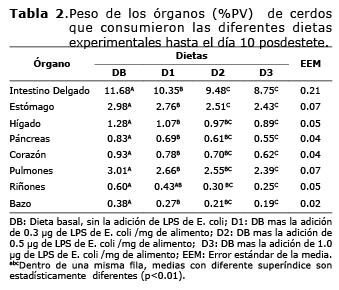
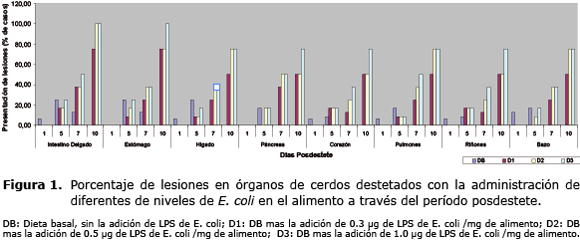
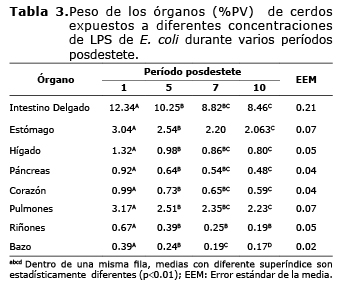
El porcentaje de lesiones en los órganos de los animales que consumieron los niveles de LPS en el alimento a través del período posdestete se pueden observar en la figura 1. Hay un incremento marcado en las lesiones en órganos de los cerdos que consumieron D3, donde los días más críticos fueron a partir del día cinco posdestete, llegando al máximo nivel el día 10. Los órganos mayormente afectados fueron estómago e intestino delgado. Las lesiones más comunes en estos dos órganos fueron hiperqueratosis (en las mucosas de intestino delgado y estómago), congestiones y hemorragias (en los demás órganos en estudio).
En este experimento, no se encontró interacción estadística entre las diferentes concentraciones de LPS y los períodos posdestete en que fueron sacrificados los cerdos para ninguna de las variables en estudio, por lo que fue necesario analizar y desglosar dichos factores de manera independiente. Se presentaron disminuciones (p<0.01) en el peso de todos los órganos entre dietas (Tabla 2), donde los animales que fueron sometidos a D3 presentaron los menores valores. No obstante, es de gran importancia mencionar que los órganos no presentaron diferencias (p>0.05) entre los mayores niveles de suministro de LPS (D2 y D3).
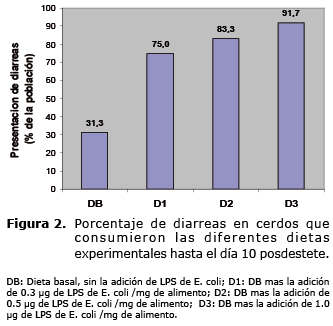
Como puede observarse en la figura 2, la aparición de diarreas ocasionadas por los diferentes tratamientos fueron notables, ya que hay un incremento marcado entre los cerdos que consumieron DB (31.3%) y D3 (91.7%).
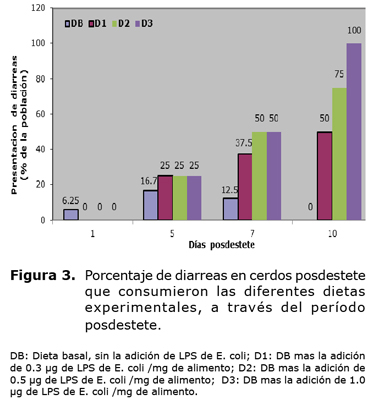
En la figura 3 puede observarse que con el tiempo de exposición a los diferentes niveles de LPS en el alimento, los cerdos presentaron un aumento marcado en la presentación de diarreas, donde los días más críticos fueron a partir del día cinco hasta el día siete posdestete, llegando a su máximo nivel el día 10, momento a partir del cual no se aprecia la recuperación de las alteraciones en la consistencia de las heces observadas en los animales que consumieron DB. A partir del día uno posdestete, los animales que consumieron DB presentaron un incremento en la presentación de diarreas hasta el día cinco posdestete, sin embargo, a partir de este día, la aparición de diarreas disminuye, llegando a su nivel mínimo el día 10 posdestete.
Para todos los órganos se presentó una disminución (p<0.01) en el peso en cada uno de los períodos posdestete (Tabla 3), donde el día uno posdestete presentó los mayores valores, y el día 10 posdestete los pesos mínimos.
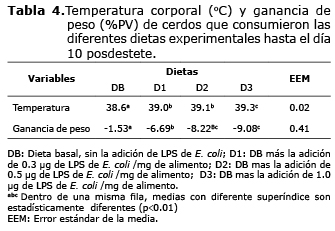
Como se observa en la tabla 4, para la variable temperatura corporal, se presentaron diferencias (p<0.01), donde los animales que consumieron DB presentaron las menores temperaturas, considerándose por tanto, que dicha temperatura es estable y normal. Sin embargo, entre los cerdos pertenecientes a D1 y D2 no se presentó diferencia (p>0.05). No obstante, al ser comparadas con los animales en D3 se presenta diferencia (p>0.01) en el incremento de la temperatura corporal. Debido a lo anterior, a partir del nivel de inclusión de LPS ofrecido en D1, se produjo fiebre en los animales utilizados en este trabajo.
Con respecto a la variable GDP (Tabla 4), se presentaron diferencias (p<0.01) entre las diferentes dietas experimentales, donde los animales en DB presentaron la menor pérdida de peso (-1.53 de GDP; como porcentaje de peso vivo), mientras los animales en D3 presentaron la mayor pérdida de peso (-9.08% de GDP).
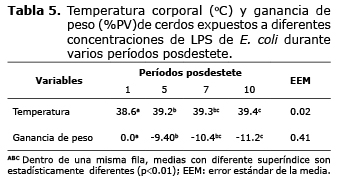
Con respecto al período de exposición de los animales a las diferentes dietas, la variable temperatura (Tabla 5) presentó diferencia significativa (p<0.01), donde en el día 10 los animales presentaron la mayor temperatura (39.4oC) con respecto a la observada el día uno (38.6oC).
Para la variable GDP, se puede observar que hubo diferencia significativa entre los días posdestete (p<0.01), donde los animales en el día 10 posdestete presentaron las menores GDP (-11.2). El valor numérico negativo indica que los cerdos perdieron peso en el transcurso de la experimentación.
DISCUSIÓN
En este trabajo se constató que la aparición de lesiones y diarreas en los animales que consumieron los diferentes niveles de LPS, se debe a que el LPS favorece la inflamación temprana, caracterizada por la atrofia severa, el desequilibrio de la función inmune, y la liberación de mediadores inflamatorios como el TNF-α (16,17).
El aumento en la presentación de diarreas posdestete en los animales que consumieron los diferentes niveles de LPS de E. coli, podría deberse al incremento en la expresión del TNF-α. El TNF-α está implicado en la estimulación de cloro (Cl-) en íleon y colon (18). El incremento en la secreción de Cl- a nivel de criptas y la disminución en la absorción de Sodio (Na+) por las vellosidades intestinales favorecen la pérdida de fluidos en intestino delgado. Ambos procesos son dependientes de la bomba Na+/K+-ATPasa localizada en la membrana basolateral (3), y cuya actividad funcional es afectada por el TNF-α. El incremento en la secreción de Cl- a nivel intestinal está altamente relacionado con la aparición de diarreas (19).
La aparición de lesiones en estomago, hígado, intestino delgado, intestino grueso, riñones, bazo y pulmones en este trabajo, fue causado por la adición y posterior consumo de las diferentes concentraciones de LPS de E. coli en la dieta basal, ya que el LPS provoca una gran variedad de alteraciones morfológicas en el tracto gastrointestinal como edema, hemorragias y por último necrosis (20). Además, el LPS en altas concentraciones causa lesión tisular, coagulación vascular diseminada y shock séptico, llevando incluso a la muerte (21). Debido a lo anterior, sobreviene una respuesta sistémica no regulada que puede progresar a fallo orgánico múltiple, el cual está asociado a una alta mortalidad y se caracteriza por disfunción pulmonar, cardiovascular, renal y gastrointestinal (22).
En este trabajo, la disminución del peso de los órganos de los cerdos que consumieron las diferentes dietas experimentales fue causado por la adición de LPS a la dieta, ya que se ha demostrado que esta endotoxina potencializa la producción de TNF-α (23). El TNF-α tiene la capacidad de activar una gran variedad de rutas de señalización que afectan el recambio y crecimiento celular por estimulación de la apoptosis (24,25). Además, TNF-α provoca las alteraciones inflamatorias sistémicas en diferentes órganos (1).
Los animales que fueron sometidos a las dietas 1,2, y 3 disminuyeron severamente en la variable ganancia de peso (%PV) durante todo el experimento. Estos cambios pueden estar mediados por algunas citoquinas inflamatorias, que amplifican la respuesta inmune celular e inhiben el crecimiento (26,27). Se ha demostrado que la administración intravenosa de LPS produce inhibición en la absorción intestinal de algunos nutrientes, específicamente aminoácidos, siendo esta acción mediada por la citoquina TNF-α, la cual ha sido involucrada en la disfunción mucosal intestinal inducida por el LPS (28).
Además, el LPS favorece la permeabilidad a bacterias y compuestos que podrían potenciar la infección e inflamación, a través de su efecto sobre la estructura de las uniones apretadas de las células epiteliales (29). Esta acción se vería representada en la disminución de ganancia diaria de peso por parte del animal, debido a que durante infecciones agudas, el aumento de la temperatura corporal estimula la actividad inmune, y a su vez, los requerimientos para la producción de neutrófilos, células NK y linfocitos, provocando la disminución de ganancia diaria de peso por parte del animal (30).
En relación a la aparición de episodios febriles en el experimento, podría atribuirse este efecto a los diferentes niveles de LPS y los factores inmunológicos que los componen. Estos factores pueden estar involucrados en los procesos de desarrollo de un estado séptico. Algunos de los síntomas de infección aguda bacteriana causados por LPS son anorexia, hipersomnia y fiebre. Debido a lo anterior, los animales que consumieron cualquiera de las diferentes concentraciones de LPS presentaron los mayores aumentos en la temperatura corporal, lo que concuerda con los observado por Liu et al (20). Según Jiang et al (17) el aumento en la temperatura inducida por LPS, podría estar asociado a la producción de citoquinas proinflamatorias, específicamente TNF-α. El TNF-α posee propiedades endotoxicas, las cuales producen fiebre, hipotensión y shock (22).
Según los datos obtenidos en este trabajo, se puede concluir que el LPS favorece la respuesta inflamatoria temprana, como reacción inmediata frente a agentes patógenos. El LPS de E. coli induce la aparición de episodios febriles y una alta incidencia de diarreas durante la etapa posdestete. Además, el LPS tiene un efecto sobre los parámetros morfológicos de los órganos evaluados, afectando el peso y funcionamiento adecuado de estos. Todo lo anterior conlleva a la inhibición del crecimiento y la disminución en la eficiencia productiva de los cerdos.
Debido a que son pocos los trabajos en los que se hayan evaluado las metodologías utilizadas en este experimento, se considera necesario realizar otras investigaciones sobre la relación entre la respuesta inmunológica intestinal, la patología estructural y funcional de los órganos, y la producción animal para de esta forma mejorar la comprensión de los mecanismos causantes de problemas infecciosos, y sus posibles esquemas de prevención y estrategias terapéuticas durante el período posdestete.
REFERENCIAS
1. Pitman RS, Blumberg RS. First line of defense: the role of the intestinal epithelium as an active component of the mucosal immune system. J Gastroenterol 2000; 35:805-814. [ Links ]
2. Eckmann L, Kagnoff MF, Fierer J. Intestinal epithelial cells as watchdogs for the natural immune system. Trends Microbiol 1995; 3:118-120. [ Links ]
3. Pié S, Lallès SP, Blazy F, Laffitte J, Sève B, Oswald IP. Weaning is associated with an upregulation of expression of inflammatory cytokines in the intestine of piglets. J Nutr 2004; 134:641-647. [ Links ]
4. Stadnyk AW. Intestinal epithelial cells as a source of inflammatory cytokines and chemokines. Can J Gastroenterol 2002; 16:241-246. [ Links ]
5. Gopal R, Birdsell D, Monroy FP. Regulation of toll-like receptors in intestinal epithelial cells by stress and Toxoplasma gondii infection. Parasite Immunol 2008; 30:563-576. [ Links ]
6. García-Herrera J, Navarro MA, Marca MC, Osada J, Rodríguez-Yoldi MJ. The effect of tumor necrosis factor-α on D-fructose intestinal transport in rabbits. Cytokine 2004; 25:21-30.
7. Amador P, Garcia-Herrera J, Marca MC, de la Osada J, Acin S, Navarro MA, Salvador MT, Lostao MP, Rodriguez-Yoldi MJ. Intestinal D-galactose transport in an endotoxemia model in the rabbit. J Membr Biol 2007; 215:125-133. [ Links ]
8. Garcia-Herrera J, Marca MC, Brot-Laroche E, Guillen N, Acin S, Navarro MA et al. Protein kinases, TNF-α and proteasome contribute in the inhibition of fructose intestinal transport by sepsis in vivo. Am J Physiol Gastrointest Liver Physiol 2008, 294:G155-G164.
9. NRC (National Research Council). Nutrient Requirements of Swine (10th Ed), Washington DC: National Academy Press: 1998. [ Links ]
10. Segalés J, Domingo M. 2003. La necropsia en el ganado porcino, diagnóstico anatomopatológico y toma de muestras, Madrid (España): Boehringer Ingelheim; 2003. [ Links ]
11. Reis de Souza TC, Guerrero CMJ, Aguilera BA, Mariscal LG. Efecto de diferentes cereales sobre la morfología intestinal de lechones recién destetados. Téc Pecu Mex 2005; 43:309-321. [ Links ]
12. Nabuurs MJ, Hoogendoorn A, Van der Molen EJ, Van Osta LM. Villus height and crypt depth in weanead and unweanead pigs, reared under various circumstances in the Netherlands. Res Vet Sci 1993; 55:78-84. [ Links ]
13. Steel RG, Torrie JH. Principles and Procedures of Statistics: a biometrical approach (2a Ed), New York (USA): McGraw-Hill Book Co; 1985. [ Links ]
14. SAS®. SAS/STAT User's Guide. Institute Inc. Statistical Analysis Systems Institute. Version 9.1th Ed. Cary, NC: SAS Institute Inc. 2006.
15. CIOMS (Council for International Organizations of Medical Sciences). Geneva: International Guiding Principles for Biomedical Research Involving Animals; 1985. [ Links ]
16. Wang J, Chen L, Li P, Li X, Zhou H, Wang F et al. Gene expression is altered in piglet small intestine by weaning and dietary glutamine supplementation. J Nutr 2008; 138:1025-1032. [ Links ]
17. Jiang Y, Sun LH, Lin YC, Ma XY, Zheng CT, Zhou GL et al. Effects of dietary glycyl-glutamine on growth performance, small intestinal integrity, and immune responses of weaning piglets challenged with lipopolysaccharide. J Anim Sci 2009; 87:4050-4056. [ Links ]
18. Bertelsen LS, Eckmann L, Barrett KE. Prolonged interferon-g exposure decreases ion transport, NKCC1, and Na+-K+-ATPase expression in human intestinal xenografts in vivo. Am J Physiol Gastrointest Liver Physiol 2004; 286:G157-G165. [ Links ]
19. Yu LC, Perdue MH. Immunologically mediated transport of ions and macromolecules. Ann NY Acad Sci 2000; 915:247-259. [ Links ]
20. Liu Y, Huang J, Hou Y, Zhu H, Zhao S, Ding B et al. Dietary arginine supplementation alleviates intestinal mucosal disruption induced by Escherichia coli lipopolysaccharide in weaned pigs. Br J Nutr 2008; 100:552-560. [ Links ]
21. González RND, Alvarez MA, Juaristi JA, Cardoso L, Brandan N. Lipopolisacáridos (LPS) inducen apoptosis y necrosis en macrófagos murinos. Universidad Nacional del Nordeste. Comunicaciones Científicas y Tecnológicas. 2005. http://www.unne.edu.ar/Web/cyt/com2005/3-Medicina/M-060.pdf. [ Links ]
22. Hewett JA, Roth RA. Hepatic and extrahepatic pathobiology of bacterial lipopolysaccharides. Pharmacol Rev 1993; 45:382-411. [ Links ]
23. Ulevitch RJ, Mathison JC, Schumann RR, Tobias PS. A new model of macrophage stimulation by bacterial lipopolysaccharide. J Trauma 1990; 30:189s-192s. [ Links ]
24. Amador P, Garcia-Herrera J, Marca MC, de la Osada J, Acin S, Navarro MA et al. Inhibitory effect of TNF-α on the intestinal absorption of galactose. J Cell Biochem 2007; 101:99-111.
25. Berkes J, Viswanathan VK, Savkovic SD, Hecht G. Intestinal epithelial responses to enteric pathogens: effects on tight junction barrier, ion transport, and inflammation. Gut 2003; 52:439-451. [ Links ]
26. Liu YL, Li DF, Gong LM, Yi GF, Gaines AM, Carroll JA. Effects of fish oil supplementation on the performance and the immunological, adrenal, and somatotropic responses of weaned pigs after an Escherichia coli lipopolysaccharide challenge. J Anim Sci 2003; 81:2758-2765. [ Links ]
27. Johnson IR, Ball RO, Baracos VE, Catherine JF. Glutamine supplementation influences immune development in the newly weaned piglet. Dev Comp Immunol 2006; 30:1191-1202. [ Links ]
28. Abad B, Mesoreno JE, Salvador MT, García-Herrera J, Rodríguez-Yoldi MJ. Tumor necrosis factor-α mediates inhibitory effect of lipopolysaccharide on L-leucine intestinal uptake. Dig Dis Sci 2002; 47:1316-1322.
29. Wang F, Graham WV, Wang Y, Witkowski ED, Schwarz BT, Turner J. Interferon-γ and tumor necrosis factor-α synergize to induce intestinal epithelial barrier dysfunction by up-regulating myosin light chain kinase expression. Am J Pathol 2005; 166(2):409-419.
30. Rugeles MT, Patiño PJ. Inmunología: Una Ciencia activa, Tomo I (1era Ed), Medellín, Colombia: Biogénesis; 2004. [ Links ]