INTRODUCCIÓN
La biologia y ecologia de los peces en grandes ríos tropicales está relacionada con los regímenes hidrológicos en el canal principal y en las áreas de inundación 1. El ciclo hidrológico en estos ríos es principalmente determinado por las fluctuaciones de la precipitación, la cual cambia el nivel de agua resultando en periodos de sequía y lluvias 2. La variación del nivel de agua produce numerosos cambios en el ambiente, modificando los hábitats y la disponibilidad de alimentos de forma estacional e influenciando la reproducción, migración, crecimiento, ecología y la pesca a nivel regional 3. En los peces dulceacuícolas tropicales, las respuestas reproductivas están relacionadas con los regímenes de inundación y de caudal 1,2,4. En respuesta a demandas antropogénicas - especialmente de energía-los regímenes naturales de inundación de los ríos han sufrido modificaciones debido a la construcción de hidroeléctricas. Estas alteraciones podrían afectar la reproducción de los peces, específicamente por los cambios en la amplitud y duración de las inundaciones naturales de los ríos, creando barreras físicas para las migraciones 5,6,7 y afectando el comportamiento de los organismos acuáticos 5,8. A nivel de población, la transformación a ríos regulados involucra alteraciones en la disponibilidad y en las características físicas y químicas del hábitat acuático, pudiendo interferir en las señales ambientales para la reproducción que influencia la maduración, desove y migraciones 9.
La reproducción es un proceso multifactorial que involucra interacciones entre componentes ambientales, sociales, neurales, hormonales y nutricionales 10. En los peces, la reproducción comienza por la sincronización de acciones de eje Hipotálamo-Pituitaria-Gónadas 11, el cual responde a las señales ambientales activando la producción de hormonas especificas relacionadas con estados reproductivos definidos 12. Los estímulos que influencian la producción de hormonas están asociados con la maduración gonadal durante las temporadas de lluvias 7,13,14,15, y estas hormonas son sintetizadas en la adenohipófisis por los gonadotropos, células de la pituitaria que se desarrollan en respuesta a factores ambientales 14. La hormona foliculoestimulante (FSH) contribuye a la espermatogénesis y ovogénesis temprana, mientras que la hormona luteinizante (LH) está relacionada con el crecimiento gonadal, producción de esteroides sexuales, de esperma, y la ovulación de las hembras durante el desove 11,12. Las concentraciones y proporciones de estas hormonas en los organismos de los peces depende del estado reproductivo (la concentración de FSH es mayor en los estados inmaduros y la LH se incrementa durante la madurez), lo cual en peces dulceacuícolas tropicales está determinado por el régimen hidrológico 7,13,14,15.
En el área de la biología reproductiva, herramientas de la endocrinología han comenzado a ser utilizadas para entender cómo la reproducción es controlada y coordinada por el medio ambiente. Debido a la existencia de más de 30,000 especies de peces 16- cada una con diferentes estrategias reproductivas- la mayoría de los estudios se hacen en pocas especies seleccionadas como el salmón o la carpa dorada, las cuales tienen características representativas que han sido usadas como modelo para estudios hormonales de peces de otras especies 12.
El cambio en la respuesta reproductiva de peces tropicales como resultado de centrales hidroeléctricas está bien documentado, aunque las conclusiones se basan principalmente en la forma y tamano del tejido gonadal de los adultos 7,17. Existen múltiples metodologías que pueden ser utilizadas para entender mejor los efectos de los ríos regulados en peces dulceacuícolas a nivel celular. La endocrinología, por ejemplo, brinda una serie de herramientas que pueden ser utilizadas para soportar interpretaciones ecológicas relacionadas con la reproducción, como el uso de antisueros específicos como el FSHp and LHp para la detección inmunoquímica de gonadotrofinas FSH y LH en peces como Odontesthes bonariensis y Oreochromis niloticus12. Este enfoque podría ser compatible con los prochilodontidos para soportar explicaciones sobre como los peces responden frente a los cambios en el régimen hidrológico ocasionado por barreras como las represas. Hasta ahora, cambios en la respuesta hormonal asociada con el desove de peces dulceacuícolas migratorios y los cambios en las señales ambientales asociadas a la modificación del curso del río no han sido confirmados. Este estudio probó la hipótesis que lo cambios en el pulso del caudal debidos a la actividad de una central hidroeléctrica afectan negativamente la producción de hormonas y la reproducción de individuos de Prochilodus magdalenae (Steindachner, 1879) en la cuenca del río Magdalena.
MATERIALES Y MÉTODOS
Descripción del área de estudio. El río Magdalena (Colombia, Figura 1) es un río de sexto orden que fluye hacia el noroeste, entre la cordillera central y occidental de los Andes (3° y 11° N). Tiene 1,540 km de longitud, descarga 7.500 m3. s-1 en el mar Caribe 18 y es considerado un eje focal del desarrollo económico de Colombia.
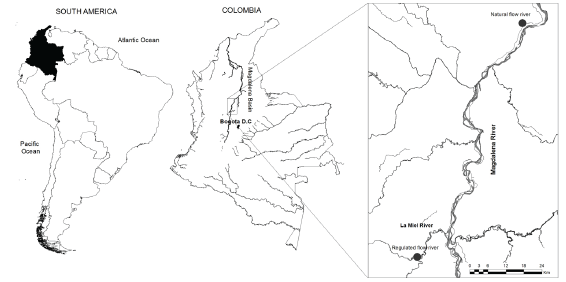
Figura 1 Ubicación del área de estudio y sitios de muestreo sobre el río Magdalena (río con caudal natural) y sitios de muestreo en el río La Miel (río con caudal regulado). El río Magdalena fluye de sur a norte.
El pulso hidrológico anual del río Magdalena es bimodal (dos periodos de aguas altas y dos de aguas altas). Debido a la geomorfología, muchos de sus tributarios han sido intervenidos para la generación hidroeléctrica, con una capacidad instalada de alrededor de 9.7 GW, siendo la fuente de generación hidroeléctrica más importante de Colombia 19. Uno de los tributarios del río Magdalena es el río La Miel, el cual fue represado para la generación hidroeléctrica en 2002. El caudal medio es de 84.3 m3. s-1, pero debido a la generación hidroeléctrica, el régimen hidrológico ha sido modificado y el pulso de caudal ocurre aguas debajo de la central hidroeléctrica (Figura 2).
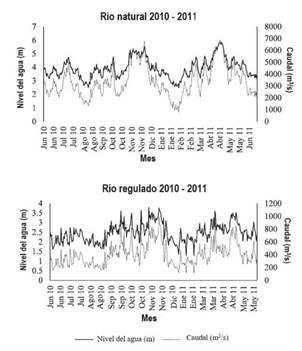
Figura 2 Nivel del río (m) y caudal (m3/s) de junio 2010 a junio de 2011 en un río natural y uno regulado de la Cuenca del Magdalena.
Para evaluar el efecto del pulso de nivel en la producción hormonal, fueron colectados peces potamódromos bajo condiciones de cambios repentinos de caudal (río La Miel) y bajo condiciones de caudal natural (río Magdalena). Individuos de P. magdalenae fueron capturados en estos sitios cada mes. Aunque el río Magdalena tiene algunos trechos represados (por ejemplo la represa de Betania (2°41'06" N, 75°26'24" W) y El Quimbo (1°30'0"N, 76°34' 59.88"W)), las contribuciones de otros tributarios amortiguan los efectos de las centrales hidroeléctricas localizadas sobre el río (Figura 2). Los niveles del agua (m) y el caudal (m3/s) del río natural fueron obtenidos de la base de datos nacional de hidrología (Instituto de Hidrología, Meteorología y Estudios Ambientales -IDEAM), y la companía hidroeléctrica ISAGEN S.A. E.S.P suministró la información del río regulado. Estos datos hidrológicos fueron colectados diariamente en puntos fijos en cada uno de los puntos de colecta de especímenes (la distancia entre los puntos de medida del nivel de los ríos es de 145 km aprox.). Para el análisis, fue usado el promedio diario de nivel de río (m) y de caudal (m3/s). A lo largo del periodo de muestreo un ciclo ENSO se desarrolló: El Niño estuvo presente durante los últimos seis meses del 2010 y durante los primeros seis meses del 2011 ocurrió La Niña (Figura 2).
Individuos de P. magdalenae del río natural y regulado fueron comprados mensualmente a pescadores. Cincuenta especímenes fueron obtenidos cada mes, en la misma semana, de junio de 2010 a junio de 2011 de cada sitio de muestreo (la distancia aproximada entre los sitios de muestreo es de 150 Km). Después de la captura, los peces fueron fijados in situ en formalina al 10% y transportados a laboratorio de Ictiología de la Universidad de Antioquia, Colombia.
De cada ejemplar fue registrada longitud estándar (L S , mm), peso total (W T , g), peso eviscerado (WE, g), peso de gónadas (GW, g), y sexo (macho o hembra).
Fueron hechas observaciones macroscópicas en los ovarios para determinar el estado de madurez sexual de las hembras, observándose características como color y vascularización o presencia de ovocitos en los ovarios. Para los machos, se observó el tamaño de los testículos, el color y la vascularización. Los estados de madurez de las hembras y machos fueron definidos siguiendo la escala de Vazzoler 20, la cual clasifica estado A: inmaduro, B: madurando, C: maduro, D: desovado, y E: reposo.
Fue calculado el índice gonadosomático (GI) a partir de la proporción del peso de la gónada con respecto al peso total del pez, en un tiempo o estado reproductivo especifico:
Donde W T es el peso total del cuerpo y GW es el peso de la gónada. Para probar si este índice era diferente entre los sitios de muestreo, se usó un test no-paramétrico en el programa GraphPad Prism 7.
Para estimar la relación entre los picos de nivel, el índice gonadosomático, y la densidad de células de FSH y LH se utilizó una correlación de Spearman.
Análisis hormonal. En cada sitio de muestreo (río natural y regulado), fueron seleccionadas una glándula pituitaria por cada estado macroscópico de madurez colectado (una para estado A, otra para B, otra para C, otra para D y otra para E), de machos y hembras, cada mes (12 meses en cada sitio). Cada glándula pituitaria fue sumergida en parafina y seccionada en, al menos, 10 cortes (de entre tres y cinco um de grosor) con um micrótomo en el sector del par proximal distalis, donde la densidad celular es mayor comparada con otros sectores de la pituitaria y tratando de realizar los cortes en la misma profundidad para todas las glándulas pituitarias analizadas. La variable respuesta fue el número de celulas inmunoteñidas por mm2.
El antisuero utilizado en este estudio fue el FSHp y LHp de salmón, ver referencias 21 y 22. Se empleó una dilución 1/5000 para los anticuerpos anti-GTH-Iβ (FSH) y anti-GTH-IIβ (LH).
Mensualmente, las glándulas pituitarias fueron extraídas, fijadas en formalina al 10% para la preservación y sumergidas en parafina, cortadas y colocadas en placas cargadas para microscopio. Se utilizó el kit UltraVision Quanto Detection System HRP DAB (Thermo Scientific) y se siguió el protocolo descrito por Shi et al 23 para cada muestra. Las fotografías fueron tomadas con una cámara digital (Nikon D500) instalada en un microscopio binocular (Zeiss) y fue contado el número de células tenidas por mm2.
Para determinar si había diferencias en la producción de hormonas entre los diferentes estados de madurez, se evaluaron diferencias significativas en el número de células inmunoteñidas por cada estado de desarrollo gonadal por medio de una Anova de una vía para cada tipo de célula: células FSH y células LH.
Teniendo en cuenta que la estación lluviosa es conocida por influenciar la producción de hormonas y la maduración gonadal, se usó una correlación de Spearman para evaluar la relación entre el tipo y la variación de la producción hormonal (FSH y LH) con la modificación en el nivel del río y de caudal para individuos de río natural y del regulado.
Aspectos éticos. Los peces fueron sacrificados sin sufrir crueldad o prolongación de la agonía, de acuerdo con la ley 84 de 1989 (Colombia).
RESULTADOS
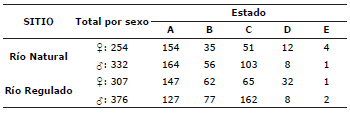
Se analizaron 1271 individuos, de los cuales 588 (332 machos y 256 hembras) provinieron del río natural y 683 (376 machos y 307 hembras) del río regulado. Individuos de todos los estados de madurez fueron colectados en ambos sitios de colecta y la mayoría pertenecían a los estados de madurez A, B y C en ambos ríos (Tabla 1).
Table 1 Número de individuos de Prochilodus magdalenae por estado de madurez (de acuerdo con la clasificación propuesta por Vazzoler), por sexo y por sitios de muestreo (río natural o regulado), colectados entre junio de 2010 y junio de 2011 en la cuenca del Magdalena.
El índice gonadosomático (GI) en los machos cambió a través del tiempo en ambos sitios de muestreo. En el río natural, las diferencias fueron encontradas en el Gi a lo largo de los meses (H= 187.824, DF= 11, p<0.005), donde junio, julio, agosto y octubre presentaron los mayores valores. Individuos del río regulado también mostraron diferencias entre meses (H= 208.509, DF=12, p<0.005), donde los mayores valores del GI fueron de junio a agosto de 2010, octubre 2010 y marzo y abril de 2011. No hubo diferencia significativa en los valores de GI en machos del río natural M= 0.309, SD= 0.298) y del regulado (M= 0.481, SD= 0.377) (t (23) =-1.259, p>0.005).
En las hembras, se encontraron diferencias en los valores de GI a través del tiempo en ambos sitios. En el río natural, se observaron diferencias entre meses (H = 124.260, DF= 11, p<0.005), donde los mayores valores de GI fueron en junio y agosto de 2010. Se encontraron diferencias entre los meses para hembras del río regulado (H = 151.490, DF= 12, p<0.005), con los valores más altos de GI de agosto a octubre de 2010. No hubo diferencia significativa en los valores de GI en hembras del río natural (M= 12) y regulado (M = 13) (U = 55, p >0.005) (Figura 3). En ambos ríos el menor valor en el Gi fue en el primer semestre de 2011.
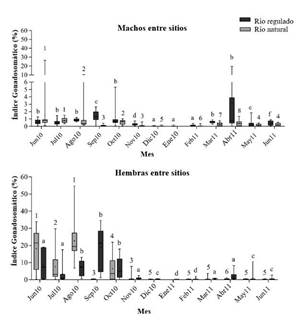
Figura 3 Valor medio y desviación estándar del índice gonadosomático por sitios de muestreo, mes y sexo para Prochilodus magdalenae de un río natural y regulado en la cuenca del Magdalena. Letras iguales significan igual valor de la media.
Un total de 113 glándulas pituitarias fueron analizadas. El número de células LH inmunoteñidas fue diferente entre estadios de madurez en machos del río natural (F(2,21) = 5.49, p<0.005), así como para los individuos de río regulado (F(3,27) = 26.652, p<0.005). No hubo diferencia significativa en el número de células LH inmunoteñidas entre machos del río natural y del regulado (t(7) = -0.889, p>0.005). En las hembras analizadas, el número de células LH inmunoteñidas fue diferente entre los estados de madurez en individuos del río natural (F(2,17) =10.684, p<0.005), así como para individuos del río regulado (F(3,27) =24.401, p<0.005).
No hubo diferencia significativa en el número de células LH inmunoteñidas entre hembras del río natural y del río regulado (t(7) =0.415, p>0.005).
Para el número de células FSH inmunoteñidas, se encontraron diferencia entre los estado de madurez en machos del río natural (F(2,21)=8.945, p<0.005), así como para aquellos del río regulado (F(3,27) =9.46 2, p<0.005). No hubo diferencia significativa en el número de células FSH inmunoteñidas entre machos del río natural comparado con los del río regulado (t(7)=1.874, p>0.005). En las hembras, el número de células FSH inmunoteñidas fue diferente entre los estados de madurez en individuos del río natural (F(3,18)=4.318, p<0.005), y del río regulado (F(3,27) = 13.59 2,' p<0.005). No hubo diferencia significativa en el número de células FSH inmunoteñidas entre hembras del río natural y del regulado (t(6) =0.763, p>0.005).
Se encontró que las hembras inmaduras y madurando (estados de madurez A y B) tuvieron un mayor número de células FSH inmunoteñidas, mientras que individuos en estados avanzados de madurez (estado C) presentaron un mayor número de células LH inmunoteñidas (ver Figura 4 para un ejemplo de células de la pituitaria inmunoteñidas). Esta situación no aplicó para machos del río natural (Figura 5).
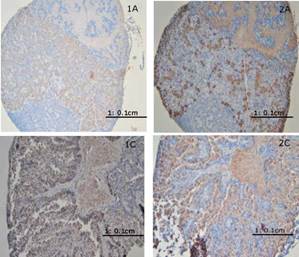
Figura 4 Secciones de glándulas pituitarias de hembras de Prochilodus magdalenae, teñidas con anticuerpos anti-GTH Iβ y anti-GTH Iiβ mostrando inmunoreactividad (color café oscuro) en el citoplasma de los gonadotropos. Las imágenes 1A y 2A corresponden a individuos inmaduros (estado A), presentando mínima inmunoreactividad a los anticuerpos anti-GTH Iβ comparado con los anti-GTH IIβ. Las imágenes 1C y 2C corresponden a individuos maduros (estado C), presentando una mayor inmunoreactividad a los anticuerpos anti-GTH Iβ comparado con los de anti-GTH Iiβ.
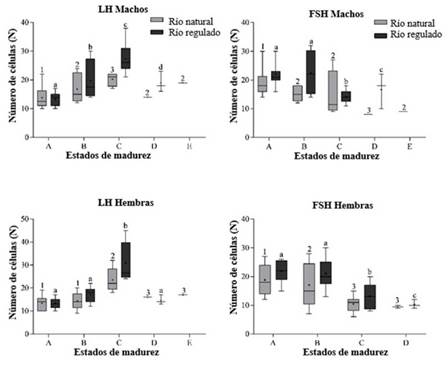
Figura 5 Relación entre la madurez gonadal y el número de células de LH y FSH inmunoteñidas para Prochilodus magdalenae por río y sexo. Mismas letras significan igual valor de la media.
En el río natural, se encontró una relación negativa y significativa entre el caudal (m3/s) y el índice gonadosomático (r = -0.168, p<0.05), entre el índice gonadosomático y la densidad de células FSH inmunoteñidas (r=-0.324, p<0.05), y una relación positiva y significante entre el índice gonadosomático y la densidad de células LH inmunoteñidas (r=0.404, p<0.05), mostrando un comportamiento esperado entre las variaciones de caudal y la respuesta gonadal, al igual que una asociación entre la respuesta hormonal y los estados reproductivos.
Por otra parte, en el río regulado se encontró una relación positiva y significativa entre el caudal (m3/s) y el índice gonadosomático (r=0.195, p<0.05), y una relación negativa y significante entre la densidad de células FSH inmunoteñidas y el nivel del agua (r=-0.090, p<0.05). No hubo una relación significativa entre la densidad de células LH inmunoteñidas y el nivel del agua (r=-0.004, p<0.05), sugiriendo que en este río no existe una correlación entre la reproducción y la respuesta hormonal.
DISCUSIÓN
Los resultados mostraron que el patrón del caudal influenció la producción de hormonas en peces potamódromos de la cuenca del río Magdalena, alterando la respuesta de las hormonas de peces migratorios correlacionas con el caudal, posiblemente generando una falta de sincronía entre la respuesta de las hormonas de la reproducción y el nivel del agua. Sugerimos que los pulsos de nivel alterados producto de la generación hidroeléctrica podrían ser considerados como un posible factor responsable de la alteración de las hormonas reproductivas P. magdalenae.
Debido a que el pulso de nivel ha mostrado ser la principal señal para iniciar la mayoría de los procesos biológicos de la biota acuática, el desove y la migración de peces potamódromos en el río Magdalena también ha sido relacionada con los cambios en el nivel del agua, y con eventos climáticos regionales como los ciclos ENSO (24) y variables fisicoquímicas (pH, temperatura, sólidos disueltos) (4). El pulso de un río regulado por la generación hidroeléctrica (como el río La Miel) genera cambios que alteran el comportamiento histórico del clima y los patrones de caudal que los peces usan como estímulos ambientales, siendo un posible factor que influencia los cambios hormonales de P. magdalenae. Sugerimos que la falta de sincronía entre el comportamiento hormonal y el índice gonadosomático es una respuesta a los picos de nivel inusuales, los cuales modifican la información ambiental percibida por los peces (25). Esto puede influenciar el comportamiento de desove, y con ello el posterior reclutamiento, modificando la estructura de la comunidad (3).
Los resultados del presente estudio son similares a los obtenidos por Santos et al (26), donde los niveles de FSH en trucha arcoíris decrecían antes del comienzo de la madurez sexual e incrementaban después de la ovulación. Esto es porque la hormona FSH contribuye con la espermatogénesis temprana y crecimiento folicular, mientras que la hormona LH promueve la maduración de gametos y está relacionada con la producción de esperma y la ovulación (12). Por consiguiente, altos niveles de FSH fueron encontrados en individuos inmaduros y en reposo, hidroeléctrica en Prochilodus magdalenae y bajos niveles en individuos maduros y en recuperación. Este patrón fue encontrado en individuos de la familia Salmonidae y otras especies con sincronización del desarrollo gonadal, donde los niveles de FSH aumentan durante el comienzo del crecimiento gonadal y decrecen durante el desove (15).
Los periodos para la madurez gonadal pueden presentar cambios asociados con las condiciones ambientales relacionadas a los eventos ENSO. En la cuenca del río Magdalena (río natural), individuos maduros migrantes fueron reportados en las estaciones lluviosas (abril a mayo y de octubre a diciembre) (4). De forma similar, individuos maduros fueron reportados en el río La Miel (río regulado) de enero a junio y entre septiembre y octubre de 2010. En este estudio, los peces del río natural y del río regulado se comportaron de acuerdo a lo reportado previamente, sin embargo, en los primeros seis meses del 2011, los valores del GI de las hembras fueron menores posiblemente por la actividad de La Niña durante esos meses, reduciendo la percepción de los estímulos conocidos (por ejemplo, bajo caudal) para la maduración de las gónadas.
Cambios en los periodos de tiempo para la maduración gonadal podrían ser explicados parcialmente por la sucesión de eventos ENSO que ocurrieron durante el periodo de estudio en la cuenca del río Magdalena: "La Niña" 2007/2009, "El Niño" 2009/2010 y de nuevo "La Niña" 2010/2011, donde este último evento de "La Niña" terminó alrededor de junio 2011. Esto, una transición de La Niña a El Niño en el medio de 2009, y subsecuentemente un cambio a La Niña en el medio de 2010, se reflejaron en el desempeno de los individuos en las migraciones de 2010, especialmente en la "subienda" (primera migración reproductiva del año). Estos peces podrían haber pertenecido a las cohortes del 2008 y 2009, que crecieron bajo las condiciones de "La Niña", como abundancia de áreas de cría, disponibilidad de alimentos (24). Simultáneamente, también se reportó el incremento en la disponibilidad de alimento y el rápido crecimiento de adultos y juveniles (3,27). Un incremento en las áreas de protección, disponibilidad de alimentos y áreas de desove resulta en una cohorte de P. magdalenae más fuerte, mostrando un tamano, peso y densidad mayor (24), estimulando la maduración gonadal y generando periodos más amplios de desove en respuesta a estas señales ambientales atípicas, explicando los patrones poblacionales de P. magdalenae durante 2011.
Los cambios en el pulso del río modifican la respuesta hormonal reproductiva en individuos de P. magdalenae independientemente del flujo del río, o sea, el índice gonadosomático fue mayor cuando los peces se encontraban maduros, de junio a septiembre de 2010 en el río natural, y de mayo a octubre de 2010 y de febrero a abril de 2011 en el río regulado. El índice gonadosomático y la madurez sexual son variables muy relacionadas, involucrando el uso de la energía obtenido por la alimentación y la acumulación en forma de grasa (17). Esta relación es controlada por una serie de señales que preceden el comienzo de los eventos reproductivos, incluyendo las migraciones de los peces (17). En ríos tropicales, el desove ocurre durante la creciente (2). En la cuenca del río Magdalena, dos periodos de reproducción han sido reportados: el primero comienza en marzo y termina en mayo, y el segundo empieza en octubre y termina en octubre (4,24,28). Los grandes ríos del norte de Sur América muestran una estacionalidad marcada en la hidrografía; muchos de ellos muestran un patrón de descarga unimodal, pero el Magdalena presenta un padrón más complejo que incluye dos periodos de aguas bajas (enero y agosto) (24). Con un incremento en el nivel del agua debido al incremento de la precipitación regional que ocurre dos veces por año, todas las condiciones bióticas y abióticas para el proceso reproductivo tienen lugar dos veces al año, haciendo posible que P. magdalenae tenga dos eventos reproductivos.
La generación hidroeléctrica genera un cambio diario de nivel por aguas abajo de la represa, causando una alteración permanente en el pulso del río que puede cambiar las señales para el ciclo reproductivo. En ríos regulados, la presencia de individuos maduros durante casi todos los meses muestreados, y el comportamiento hormonal sin relación con el nivel del río, sugiere que cambios continuos en los niveles de agua, como resultado de la actividad de la hidroeléctrica sumada a los efectos del ENSO, producen señales reproductivas poco claras para individuos de P. magdalenae, interfiriendo en la percepción de los cambios de nivel del agua, afectado de este modo el éxito reproductivo de los individuos que habitan estos tributarios.
Se encontró que cambios mínimos en el régimen del río, bien sea como resultado de la producción hidroeléctrica o/y por los efectos del ENSO, son suficientemente fuertes para causar una respuesta en la glándula pituitaria de los P. magdalenae, creando una respuesta hormonal reproductiva, en algunos casos desincronizada con otros factores ambientales (como la conductividad o la disponibilidad de alimentos) necesaria para el éxito reproductivo. En ríos tropicales, cuando el nivel del agua-principal estimulo ambiental en esta región que estimula la producción hormonal para el proceso reproductivo- es constantemente alterado, se afecta la relación entre las señales ambientales y las respuestas gonadales y hormonales, lo que es esencial para el bienestar y perpetuación de especies como P. magdalenae. En este sentido, más estudios son necesarios para explorar específicamente los efectos de la alteración del nivel del agua sobre el comportamiento hormonal de los peces bajo influencia de hidroeléctricas.











 texto en
texto en 



