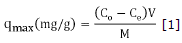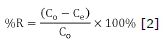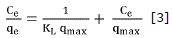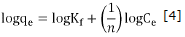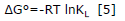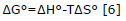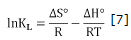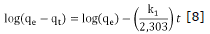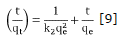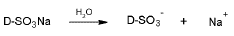INTRODUCCIÓN
Las industrias como la textil, cuero, imprenta, cosmética, productos farmacéuticos, plásticos y alimentos utilizan diferentes tipos de colorantes que también aparecen en las aguas residuales descargadas por algunas de estas industrias 1-3. La presencia de color en los cuerpos de agua incide sobre la diversidad acuática porque impide la penetración de la luz solar afectando la fotosíntesis considerablemente 1,4, además, se conoce que estos compuestos contienen aminas aromáticas, bencidina y otros compuestos aromáticos tóxicos, carcinógenos y mutagénicos para los seres humanos 3,5,6.
Los colorantes azoicos representan la clase más grande y versátil de los colorantes sintéticos. Contienen uno o más enlaces azo (-N = N-) como grupo cromóforo en asociación con estructuras complejas que contienen otros grupos funcionales tales como -NH2, -SO3, -OH 3,7,8. Además, estos colorantes pueden formar fuertes compuestos de coordinación con iones de metales de transición, como Ni (II), Cr (III), Co (II) y Cu (II) entre otros, formando quelatos azo-metal estables que no pueden metabolizarse ni degradarse 2,9.
Existen varias técnicas para la eliminación de colorantes de las aguas residuales. Por los resultados obtenidos y su versatilidad en la remoción de diferentes tipos de colorantes, se considera que la adsorción es una de las mejores 10,11. La mayoría de los sistemas comerciales actualmente utiliza carbón activado como adsorbente para eliminar colorantes debido a su alta área superficial y volumen de poro 12, excelente capacidad de adsorción, rápida y fácil regeneración 13. Quizás uno de los principales inconvenientes de su empleo es el uso de precursores no renovables como el carbón mineral y la madera, relativamente costosos. En este sentido, las investigaciones se han enfocado hacia la producción de carbón activado usando precursores no convencionales, materiales renovables, abundantes y de bajo costo, como la biomasa proveniente de desechos agrícolas e industriales 14-16.
Bajo este contexto, en esta investigación se preparó carbón activado por activación química con H3PO4 empleando cáscara de yuca como precursor. Se evaluaron sus características fisicoquímicas, su capacidad de adsorción, termodinámica y cinética en la remoción del colorante azul directo 86 (DB-86) y, además, se comparó con otro de marca comercial. Los datos experimentales fueron ajustados a modelos matemáticos de isotermas de adsorción y cinéticos.
MATERIALES Y MÉTODOS
Preparación del carbón activado. La cáscara de yuca se lavó con abundante agua para retirar la tierra y material no deseable, se secó durante 3 días al sol y después por 24 h a 105°C 17 en un horno de convección forzada marca Esco Isotherm® OFA 32TN-9. Una vez seca la cáscara, se trituró en un molino marca MACSA 300 monitor 525V con impulsión 4 kW, hasta alcanzar el tamano de partícula entre 1 y 4 mm (granulometría de 5x18, U. S. Standard Sieve). El material molido se lavó con agua desionizada y se secó en un horno por 24 h a 105°C. La activación química de este precursor consistió en adicionar 1 mL de disolución de H3PO4 al 85% 18 por cada gramo de cáscara molida y seca, esta mezcla se mantuvo en contacto por 24 h a 25°C. Luego se calcinó en una mufla durante 30 min a 530°C. Por último, el carbón activado obtenido se dejó enfriar y se lavó con HCl concentrado durante 6 h en agitación continua, para eliminar fosfatos y otras impurezas. Pasado este tiempo se lavó con agua desionizada hasta conseguir un pH cercano a 7, empleando un medidor de pH marca Orion StarTM A221, se secó por 1 h a 105°C y se tamizó hasta conseguir un tamano de partícula entre 0.500 a 1.680 mm (granulometría de 12x35, U. S. Standard Sieve). Para el caso del carbón activado comercial marca Merck, este solo se lavó con suficiente agua desionizada y se secó en un horno a 105°C durante 24 h.
Caracterización de los carbones activados. Es de vital importancia evaluar ciertas propiedades físicas y químicas del carbón activado, de esta manera, se puede lograr una mejor interpretación de los mecanismos que se involucran durante los procesos que puedan darse. Para ello, se realizó el análisis próximo de los diferentes adsorbentes, el cual incluye contenido de humedad, cenizas y material volátil, siguiendo las normas ASTM D-2867-70, ASTM D2866 y ASTM D2866-94 respectivamente. El tamano de poros se determinó por dos métodos: por medio del índice de yodo siguiendo la norma ASTM D4607-94 y, por adsorción con azul de metileno aplicando el método Chemviron Carbon Company, el cual consistió en adicionar una cantidad de carbón activado a un volumen de disolución estándar de azul de metileno. La capacidad máxima (qmax) se calculó a partir de la ecuación 1.
Donde Co y Ce son las concentraciones iniciales y en el equilibrio del colorante en mg/L, V es el volumen de disolución en litros y M es la masa de carbón activado empleada en gramos. El punto de carga cero (PCC) se determinó colocando en varios frascos 0.5 g de adsorbente en 50 mL de agua desionizada, luego se ajustó el pH entre 3 y 12 unidades con soluciones de HCl 0.1 M y NaOH 0.1 M. Transcurridas 48 h se midió el pH final. Por último, se realizó el método de Boehm para cuantificar los grupos funcionales ácidos y básicos orgánicos presentes 19,20. Esta prueba consistió en adicionar 1 g de carbón activado a 100 mL de disolución de NaOH 0.1 M, Na2CO3 0.1 M, NaHCO3 0.1 M y HCl 0.1 M por 24 h, cada una por separado. Por último, se tomó una alícuota y se tituló con disoluciones estándar de NaOH y HCl según el caso. Todos los reactivos químicos usados fueron grado analítico marca Merck®.
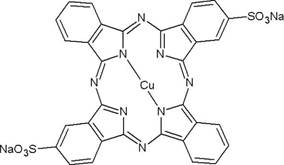
Estudio por lote, termodinámico y cinético. Inicialmente, se preparó una disolución "stock" de 1000 mg/L del colorante azul directo 86, colorante tipo ftalocianina de cobre, de fórmula molecular C32H14CuN8Na2O6S2 (Figura 1), a partir de esta disolución se prepararon varias diluciones de 20, 40, 60, 80 y 100 mg/L. A 50 mL de cada una de las anteriores diluciones se le adicionó 1 g de carbón activado, se ajustó el pH a 2 con HCl diluido (seleccionado del estudio de efecto del pH) y se colocaron en un agitador horizontal a 120 rpm por 12 h. Por último, se filtró, se tomó una alícuota y se le determinó la concentración en un espectrofotómetro UV-vis marca Spectronic Genesys 20, a una longitud de onda de 615 nm, previamente determinada por barrido. Cada uno de los anteriores experimentos se realizó por triplicado y a diferentes temperaturas (25, 30 y 40°C). La capacidad de adsorción y el porcentaje de remoción se calcularon a partir de las ecuaciones 1 y 2. Para el estudio cinético se seleccionaron las condiciones de concentración inicial de colorante de 100 mg/L y pH 2 y, a diferencia del procedimiento anterior se tomaron alícuotas entre los 60 y 720 min.
Para evaluar el efecto del pH sobre la capacidad de adsorción se realizó un procedimiento muy similar al mencionado anteriormente. Este consistió en preparar una dilución de 100 mg/L, ajustándole el pH con HCl y NaOH diluido hasta lograr valores de 2, 4, 8 10 ± 0.1, a la temperatura del laboratorio (25°C).
RESULTADOS
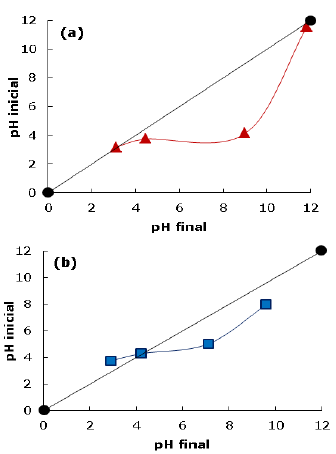
Caracterización fisicoquímica. La curva experimental de cada uno de los adsorbentes para la determinación del potencial de carga cero (PCC) se muestran en la Figura 2. Los valores de PCC para el carbón activado obtenido a partir de la cáscara de yuca y para el carbón comercial, son respectivamente 3.1 y 4.2. Esto implica que aquellos adsorbentes con valores de pH mayores que el PCC tienen una superfície con predominio de cargas negativas, mientras que, un pH menor que el PCC se tendrá una superfície con predominio de cargas positivas.
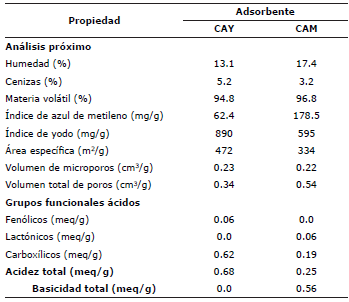
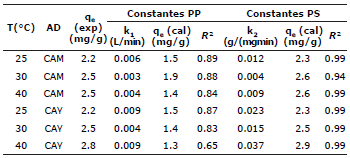
En la tabla 1 se muestra comparativamente las características fisicoquímicas de los carbones activados CAY y CAM. Del análisis próximo se observa que el porcentaje de humedad y de materia volátil es menor en el carbón activado preparado con cáscara de yuca, en comparación con el carbón comercial. Por otro lado, el porcentaje de cenizas, aunque bajo para ambos carbones activados, presenta un ligero aumento en el CAY. Se sugiere que el mayor contenido de humedad en el carbón activado CAM (17.4%), se debe principalmente a las condiciones ambientales y de almacenamiento del mismo, al tratarse de un sólido poroso adsorbente retiene la humedad del aire en su superfície. Con respecto a las propiedades de textura: área específica, volumen de microporos y volumen total de poros, estos se calcularon a partir del índice de yodo e índice de azul de metileno. El índice de yodo es una medida de la adsorción de yodo en una solución acuosa, es una medida de microporos y se utiliza como una estimación de la superfície total.
Adsorbentes con alto índice de yodo tiene un mejor rendimiento en la eliminación de contaminantes de tamaño pequeno, en tanto que, el índice de azul de metileno muestra tamaños mayores de poro desarrollados durante la activación. Es importante resaltar que para el cálculo del valor del índice de yodo, se tomaron muestras de 1.2 g de CAY y 1.8 g de CAM, para que el factor de corrección tabulado del índice de yodo se ajustara a cada muestra de carbón analizada. En la tabla 1 se observa que el carbón activado CAY logró desarrollar mayor área específica (472 m2/g) con predominio de microporos que favorecen el proceso de adsorción. Con respecto a la estimación de poros de mayor tamano, el resultado del índice de azul de metileno muestra que el carbón CAM, con una capacidad de adsorción de 178.5 mg/g es el que posee más estructuras macro y mesoporosas.
Asumiendo que el NaOH neutraliza a los grupos carboxílicos, lactónicos y fenólicos; el Na2CO3 a los grupos carboxílicos y lactónicos, el NaHCO3 solo a los grupos carboxílicos y el HCl a los grupos básicos, se realizaron los cálculos correspondientes para determinar la cantidad en meq/g de estos grupos funcionales para los dos carbones activados. En la tabla 1se resumen los resultados.
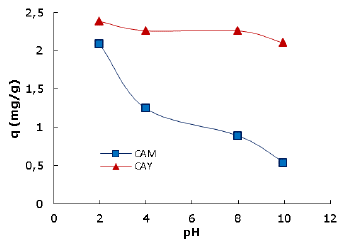
Estudio por lote, termodinámico y cinético. La figura 3 muestra como disminuye la capacidad de adsorción de los carbones activados evaluados cuando se aumenta el pH de la solución a 25°C. A valores bajos de pH (2 a 4) la concentración de iones hidronio (H+) aumenta, cargándose positivamente la superfície del carbón activado, situación que favorece las atracciones electrostáticas con las moléculas del colorante DB-86 de naturaleza aniónica. La capacidad máxima de adsorción para ambos carbones activados se alcanzó a pH 2, razón por la cual, se seleccionó este pH.
Del estudio por lote se obtuvieron las isotermas de adsorción, estas indican cómo las moléculas del adsorbente se distribuyen entre las fases líquida y sólida cuando el proceso alcanza el estado de equilibrio. Los datos obtenidos se ajustaron a los modelos de isotermas Langmuir y Freundlich. Las ecuaciones linealizadas de ambos modelos se representan mediante las ecuaciones 3 y 4 respectivamente.
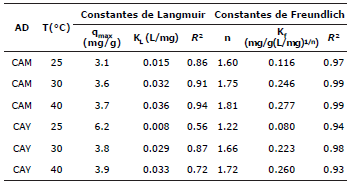
Donde qe (mg/g) es la capacidad máxima de adsorción del adsorbente, (dm3/mg) KL es la constante de Langmuir y está relacionada con el calor de adsorción, Kf (mg/g (dm3/mg)1/n) es la constante de Freundlich, n es una constante que indica la intensidad de la adsorción y Ce (mg/dm3) es la concentración en el equilibrio. Estos parámetros proporcionan información importante sobre los mecanismos de adsorción, las propiedades de superfície y afinidades del adsorbente. En la tabla 2 se registran los valores obtenidos por regresión lineal.
Tabla 2 Parámetros de adsorción para las isotermas de Langmuir y Freundlich.
AD=Adsorbente; T=Temperatura;
Las propiedades termodinámicas como el cambio de energía de Gibbs (ΔG°), de entalpía (ΔH°) y de entropía (ΔS°) se estimaron con el fin de comprender la viabilidad y la naturaleza del proceso de adsorción 21. A partir de la constante aparente de equilibrio definida en la ecuación 3 del modelo de isoterma de Langmuir, se calculó el cambio en la energía de Gibbs, ΔG° (kJ/mol), para cada una de las temperaturas evaluadas T (K), empleando la ecuación 5, donde R es la constante universal de los gases (8.314 J/molK).
El cambio en la energía de Gibbs indica el grado de espontaneidad del proceso, valores negativos reflejan una mayor favorabilidad de la adsorción y su variación puede expresarse en función del cambio en la entalpia ΔH°(kJ/mol), en la entropía ΔS°(J/molK) y la temperatura, como lo indica la ecuación 6.
Al remplazar la ecuación 5 en la 6 resulta la siguiente expresión:
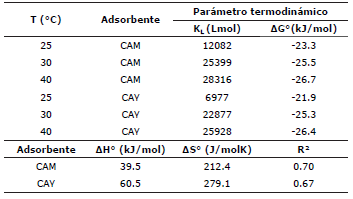
La figura 4 muestra la representación de ln(KL) en función de 1/T, donde la pendiente y el intercepto resultante de la gráfica son utilizados para determinar ΔH° y ΔS° respectivamente. Los valores de las propiedades termodinámicas se muestran en la tabla 3.
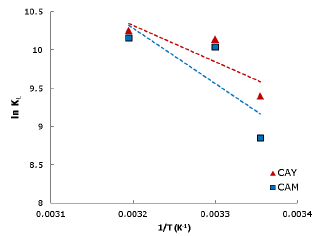
Figura 4 Termodinámica de la adsorción del colorante DB-86 sobre los carbones activados CAY y CAM a pH 2.
Con respecto a la cinética de adsorción los resultados experimentales fueron ajustados a los modelos cinéticos de pseudo primer orden y pseudo segundo orden. Las ecuaciones 8 y 9 muestran sus expresiones matemáticas linealizadas.
Donde qe y qt (mg/g) son la capacidad de adsorción en el equilibrio y en un tiempo t respectivamente y, k1(min-1) y k2(g/mgmin) son las constantes de velocidad para cada modelo 4,22. Los valores de qe y k1 fueron calculados de las gráficas lineales del log(qe-qt) versus t como se muestra en la figura 5. De igual manera, Los valores de k2 y q e se calcularon a partir de la pendiente e intercepto de la línea recta que resulta de graficar graficar t/qt contra t (Figura 6). Los valores de todas las constantes a diferentes temperaturas para los carbones CAY y CAM se muestran en la tabla 4.
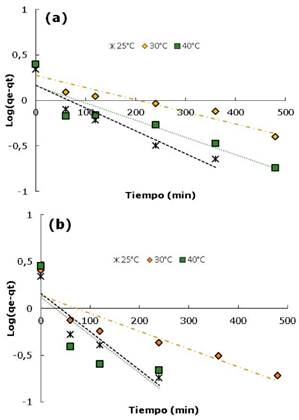
Figura 5 Modelo cinético pseudo primer orden para la adsorción del colorante DB-86 a diferentes temperaturas: a) CAM y b) CAY.
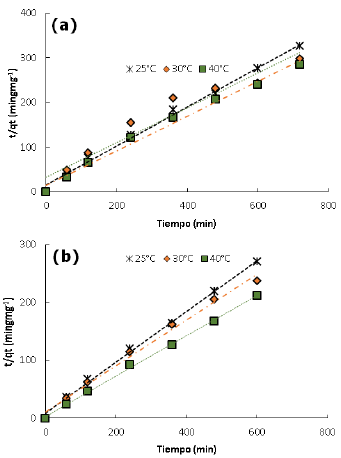
Figura 6 Modelo cinético pseudo segundo orden para la adsorción del colorante DB-86 a diferentes temperaturas: a) CAM y b) CAY.
DISCUSIÓN
La aplicación del carbón activado como material adsorbente está asociado a procesos de superfície: propiedades de textura y naturaleza química. Estos parámetros son intrínsecos del material de carbón, es decir, dependen de su origen y tratamientos encaminados a modificar su estructura porosa como también su química de superfície. En el caso de esta investigación el tratamiento de la cáscara de yuca con H3PO4 modificó ambas características; con respecto al área específica estimada a partir de los resultados del índice de yodo para ambos carbones activados, puede decirse que es baja con relación a las características genéricas de este tipo de adsorbentes, en consecuencia, la química de superfície desempena un papel importante y quizás relevante. Factores como la presencia de heteroátomos principalmente aquellos grupos funcionales orgánicos tales como ácidos carboxílicos (también en la forma de su anhídrido cíclico), lactonas y grupos hidroxílicos de carácter fenólico (Tabla 1), son los responsables de las propiedades ácidas del carbón activado 23-25 y, la presencia de grupos pirona y cromero que le imprimen densidad electrónica sobre las capas grafénicas, especialmente de los electrones n deslocalizados, son los responsables del carácter básico.
El carbón activado preparado a partir de cáscara de yuca presenta mayor contenido de grupos ácidos (0.68 meq/g), razón por la cual, su valor de pH en el punto de carga cero sea 3.1, característica que se esperaba porque fue activado con ácido fosfórico. Por otro lado, aunque no se conozca cómo fue activado el carbón comercial el hecho que tenga mayor desarrollo de meso y macroporosidad (0.32 cm3/g) hace que su acidez disminuya 26.
Uno de los factores más importantes que afecta la capacidad de adsorbentes en el tratamiento de aguas residuales es el pH. La Figura 3 muestra el efecto del pH en la remoción del colorante DB-86 en los dos carbones estudiados. El comportamiento es muy similar: la capacidad máxima de adsorción disminuye en la medida que aumenta el pH. Estos cambios pueden atribuirse a (i) las interacciones entre los grupos funcionales superficiales del adsorbente y los grupos funcionales de las moléculas del colorante (grupos sulfonatos) variando la concentración de H+ y OH- y, (ii) las interacciones del adsorbente con otros grupos funcionales (enlaces de hidrógeno y grupos solubles en agua) 10.
En la explicación del posible efecto del pH, la determinación del potencial de carga cero (PCC) juega un papel importante. Tomando como ejemplo el PCC del carbón activado CAY, para valores de pH por encima de 3.1 predominan las cargas negativas en la superfície del carbón. A valores de pH por debajo del PCC, la superficie presenta principalmente cargas positivas.
En el caso del colorante DB-86 al mezclarse en agua se disuelve instantáneamente disociándose los grupos sulfonatos como sigue:
A pH 2 por debajo del PCC la superfície del carbón activado CAY se encuentra cargada positivamente:
Como resultado, el proceso de adsorción procede ampliamente a través de atracciones electrostáticas entre los dos contraiones:
Al incrementarse el pH de la solución (pH>3.1) la superfície del carbón activado se carga negativamente:
Como el colorante DB-86 sigue cargado negativamente por los grupos sulfonatos, las interacciones disminuyen, por lo tanto, baja su adsorción. El hecho que el carbón activado CAY siga removiendo aún a pH básicos se debe a fuerzas tipo van der Waals y enlaces de hidrógeno.
Los datos experimentales del estudio por lote se ajustaron a dos modelos de isotermas de adsorción: (i) el modelo de Langmuir se eligió para estimar la capacidad máxima de adsorción, los resultados del ajuste muestran que el carbón CAY obtuvo la mayor capacidad con 6.2 mg/g a 25°C. Los coeficientes de correlación lineal considerablemente menores a 1 para todas las temperaturas estudiadas (Tabla 2), sugiere que el proceso de adsorción no ocurre en sitios activos idénticos localizados sobre la superfície de los diferentes carbones activados, en consecuencia, el proceso de adsorción no se restringe al cubrimiento en monocapas y, (ii) el modelo de Freundlich que consiste en una ecuación empírica que se puede usar para la adsorción no ideal sobre una superfície heterogénea; el parámetro n del modelo es una medida de la desviación de la linealidad de la adsorción. Si n es igual a la unidad, la adsorción es lineal. Si n es inferior a la unidad, esto implica que el proceso de adsorción es químico, pero un valor de n superior a la unidad, la adsorción es favorable para un proceso físico, según las consideraciones de este modelo 27. En la tabla 2 se observa que los valores de n son superiores a 1; esto sugiere que predomina la adsorción física.
Comparando los coeficientes de correlación de ambos modelos (Tabla 2), se observa que el modelo de isoterma de Freundlich es el que mejor representa el equilibrio de adsorción (R2>0.93) a todas las temperaturas evaluadas. Esto sugiere que el proceso de adsorción se lleva a cabo sobre una superfície heterogénea con crecimiento en multicapas.
Los valores negativos de ΔG° para ambos carbones activados demuestra que el proceso de adsorción del colorante DB-86 fue espontáneo. Resultados similares que muestran la espontaneidad del proceso de adsorción de colorantes han sido reportados por otros investigadores: Aljeboree et al 4, utilizaron la cáscara de coco como precursor en la preparación de carbón activado y su empleo en la remoción de colorantes textiles como el amarillo directo (DY12) y el azul maxilon (GRL); de la cáscara del fruto del pino brasileno, Calvete et al 28, prepararon carbón activado, que luego emplearon en la remoción del colorante reactivo naranja 16 (RO-16); Leechart et al 29, usaron las cenizas del desecho del corte de la madera como material precursor en la preparación de carbón activado, para posteriormente evaluarlo en la remoción del colorante rojo reactivo 141 (RR141); entre otras investigaciones.
El cambio de entalpía positivo indica que la adsorción del colorante BD-86 es endotérmico. Cuando la atracción entre el colorante y el adsorbente tiene lugar, el cambio en la entalpía estándar ocurre por la presencia de fuerzas que incluyen van der Waals, enlaces de hidrógeno, intercambio de ligandos, interacciones dipolo-dipolo y enlaces químicos 30,31). De acuerdo con la magnitud de la suma de las diferentes fuerzas la naturaleza de la adsorción puede ser física o química. Generalmente, la magnitud del cambio de entalpía estándar para la adsorción física está cercana a los 20 kJ/mol, mientras que la quimiadsorción está en el rango de los 80-200 kJ/mol 32. En este estudio las entalpías calculadas corresponden a 39.5 y 60.5 kJ/mol para los carbones activados CAM y CAY respectivamente, estos valores sugieren una tendencia hacia la fisiadsorción, debido a que el cambio entálpico está por debajo de lo requerido para que se presente quimiadsorción. Con respecto al cambio positivo en la entropía estándar se confirma la preferencia del colorante DB-86 sobre la superfície de los carbones activados evaluados.
Con respecto al ajuste de los datos experimentales a los modelos cinéticos, la ecuación de pseudo segundo orden muestra un excelente ajuste con un coeficiente de correlación lineal R2>0.94 para todas las condiciones de temperaturas estudiadas. De igual manera, los valores de qe calculados a partir del modelo cinético son muy similares a los obtenidos experimentalmente.
En conclusión, tanto el carbón activado obtenido a partir de la cáscara de yuca como el comercial tienen distinta composición química promovida muy seguramente por el uso de precursores diferentes, como en su método de activación. La diferencia entre los puntos de carga cero, propiedades de textura y la presencia de grupos funcionales orgánicos oxigenados, entre otras propiedades fisicoquímicas, así lo evidencian. El ajuste de los datos experimentales a los modelos de isotermas de Langmuir y Freundlich permitió establecer que el carbón activado CAY fue el que mayor capacidad de remoción mostró (6.2 mg/g). El modelo cinético que mejor se ajusta es el de pseudo segundo orden y los resultados termodinámicos demuestran la espontaneidad de la adsorción del colorante DB-86 sobre los dos carbones activados. El desarrollo de una buena área superficial unida a su naturaleza ácida permite que el carbón activado obtenido a partir de la cáscara de yuca pueda emplearse en la remoción del colorante DB-86.











 texto en
texto en